Сетчатка (от лат. rete 'сеть'; мн. ч. retinae или retinas ) — самый внутренний светочувствительный слой ткани глаза большинства позвоночных и некоторых моллюсков . Оптика глаза создает сфокусированное двухмерное изображение видимого мира на сетчатке, которая затем обрабатывает это изображение внутри сетчатки и посылает нервные импульсы по зрительному нерву в зрительную кору для создания зрительного восприятия . Сетчатка выполняет функцию , которая во многом аналогична функции пленки или датчика изображения в камере .
Нейронная сетчатка состоит из нескольких слоев нейронов , соединенных синапсами , и поддерживается внешним слоем пигментированных эпителиальных клеток. Основными светочувствительными клетками сетчатки являются фоторецепторные клетки , которые бывают двух типов: палочки и колбочки . Палочки функционируют в основном при тусклом свете и обеспечивают монохроматическое зрение. Колбочки функционируют в условиях хорошей освещенности и отвечают за восприятие цвета с помощью ряда опсинов , а также за остроту зрения, используемую для таких задач, как чтение. Третий тип светочувствительных клеток, светочувствительные ганглиозные клетки , важны для усвоения циркадных ритмов и рефлекторных реакций, таких как зрачковый световой рефлекс .
Свет, попадающий на сетчатку, запускает каскад химических и электрических событий, которые в конечном итоге запускают нервные импульсы, посылаемые в различные зрительные центры мозга через волокна зрительного нерва . Нейронные сигналы от палочек и колбочек подвергаются обработке другими нейронами, чей выход принимает форму потенциалов действия в ганглиозных клетках сетчатки , аксоны которых образуют зрительный нерв. [1]
В эмбриональном развитии позвоночных сетчатка и зрительный нерв возникают как выросты развивающегося мозга, в частности эмбрионального промежуточного мозга ; таким образом, сетчатка считается частью центральной нервной системы (ЦНС) и фактически является мозговой тканью. [2] [3] Это единственная часть ЦНС, которую можно визуализировать неинвазивно . Как и большая часть мозга, сетчатка изолирована от сосудистой системы гематоэнцефалическим барьером . Сетчатка является частью тела с наибольшей постоянной потребностью в энергии. [4]
Сетчатка позвоночных инвертирована в том смысле, что светочувствительные клетки находятся в задней части сетчатки, так что свет должен пройти через слои нейронов и капилляров, прежде чем он достигнет светочувствительных участков палочек и колбочек. [5] Ганглиозные клетки, аксоны которых образуют зрительный нерв, находятся в передней части сетчатки; поэтому зрительный нерв должен пересекать сетчатку на пути к мозгу. В этой области нет фоторецепторов, что приводит к образованию слепого пятна . [6] Напротив, в сетчатке головоногих моллюсков фоторецепторы находятся спереди, а обрабатывающие нейроны и капилляры — позади них. Из-за этого у головоногих моллюсков нет слепого пятна.
Хотя вышележащая нервная ткань частично прозрачна, а сопутствующие глиальные клетки , как было показано, действуют как волоконно-оптические каналы для транспортировки фотонов непосредственно к фоторецепторам, [7] [8] рассеивание света все же происходит. [9] У некоторых позвоночных, включая людей, есть область центральной сетчатки, адаптированная для острого зрения. Эта область, называемая центральной ямкой , является бессосудистой (не имеет кровеносных сосудов) и имеет минимальную нервную ткань перед фоторецепторами, тем самым минимизируя рассеивание света. [9]
У головоногих моллюсков неинвертированная сетчатка, которая по разрешающей способности сопоставима с глазами многих позвоночных. У глаз кальмаров нет аналога пигментного эпителия сетчатки позвоночных (RPE). Хотя их фоторецепторы содержат белок ретинохром, который перерабатывает ретиналь и воспроизводит одну из функций RPE позвоночных, фоторецепторы головоногих моллюсков, вероятно, не поддерживаются так же хорошо, как у позвоночных, и в результате полезный срок службы фоторецепторов у беспозвоночных намного короче, чем у позвоночных. [10] Легко заменяемые стебельчатые глаза (некоторые омары) или сетчатки (некоторые пауки, такие как Deinopis [11] ) встречаются редко.
Сетчатка головоногих моллюсков не возникает как вырост мозга, как у позвоночных. Это различие предполагает, что глаза позвоночных и головоногих моллюсков не гомологичны , а эволюционировали отдельно. С эволюционной точки зрения более сложная структура, такая как инвертированная сетчатка, может, как правило, возникнуть в результате двух альтернативных процессов — выгодного «хорошего» компромисса между конкурирующими функциональными ограничениями или как исторический неадаптивный реликт извилистого пути эволюции и трансформации органов. Зрение является важной адаптацией у высших позвоночных.
Третий взгляд на «перевернутый» глаз позвоночных заключается в том, что он сочетает в себе два преимущества — сохранение фоторецепторов, упомянутых выше, и снижение интенсивности света, необходимое для предотвращения ослепления фоторецепторов, что основано на чрезвычайно чувствительных глазах предков современных миксин (рыб, которые живут в очень глубокой, темной воде). [12]
Недавнее исследование эволюционного назначения инвертированной структуры сетчатки, проведенное APS (Американским физическим обществом) [13], гласит, что «направленность глиальных клеток помогает повысить четкость человеческого зрения. Но мы также заметили нечто довольно любопытное: цвета, которые лучше всего проходили через глиальные клетки, были от зеленого до красного, которые больше всего нужны глазу для дневного зрения. Глаз обычно получает слишком много синего цвета и, следовательно, имеет меньше колбочек, чувствительных к синему цвету.
Дальнейшее компьютерное моделирование показало, что зеленый и красный концентрируются в глиальных клетках в пять-десять раз больше, чем синий свет, и в их соответствующих колбочках. Вместо этого избыток синего света рассеивается на окружающих палочках. Эта оптимизация такова, что цветное зрение в течение дня улучшается, в то время как ночное зрение страдает очень мало".
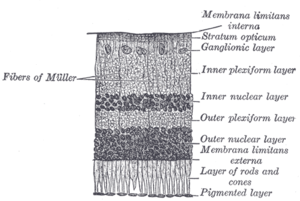



Сетчатка позвоночных имеет 10 отдельных слоев. [15] От ближайшего к самому дальнему от стекловидного тела:
Эти слои можно сгруппировать в четыре основные стадии обработки — фоторецепция; передача на биполярные клетки ; передача на ганглиозные клетки , которые также содержат фоторецепторы, светочувствительные ганглиозные клетки ; и передача по зрительному нерву. На каждой синаптической стадии горизонтальные и амакриновые клетки также соединены латерально.
Зрительный нерв — это центральный тракт множества аксонов ганглиозных клеток, соединяющихся в первую очередь с латеральным коленчатым телом , зрительной ретрансляционной станцией в промежуточном мозге (задняя часть переднего мозга). Он также проецируется в верхний холмик , супрахиазматическое ядро и ядро зрительного тракта. Он проходит через другие слои, создавая у приматов диск зрительного нерва . [21]
Дополнительные структуры, не связанные напрямую со зрением, обнаруживаются как выросты сетчатки у некоторых групп позвоночных. У птиц гребень представляет собой сосудистую структуру сложной формы, которая выступает из сетчатки в стекловидное тело ; он снабжает глаз кислородом и питательными веществами, а также может помогать зрению. У рептилий структура похожая, но гораздо более простая. [22]
У взрослых людей вся сетчатка составляет около 72% сферы диаметром около 22 мм. Вся сетчатка содержит около 7 миллионов колбочек и от 75 до 150 миллионов палочек. Диск зрительного нерва, часть сетчатки, иногда называемая «слепым пятном», поскольку в ней отсутствуют фоторецепторы, расположен в зрительном сосочке , где волокна зрительного нерва покидают глаз. Он выглядит как овальная белая область площадью 3 мм2 . Височно (в направлении висков) от этого диска находится макула , в центре которой находится фовеа , ямка, которая отвечает за острое центральное зрение, но на самом деле менее чувствительна к свету из-за отсутствия палочек. У людей и нечеловеческих приматов есть одна ямка, в отличие от некоторых видов птиц, таких как ястребы, которые двулистные, и собак и кошек, у которых нет ямки, но есть центральная полоса, известная как зрительная полоса. [ необходима цитата ] Вокруг фовеа простирается центральная сетчатка примерно на 6 мм, а затем периферическая сетчатка. Самый дальний край сетчатки определяется ora serrata . Расстояние от одной ora до другой (или macula), наиболее чувствительной области вдоль горизонтального меридиана , составляет около 32 мм. [ необходима уточнение ]
В разрезе сетчатка имеет толщину не более 0,5 мм. Она состоит из трех слоев нервных клеток и двух синапсов , включая уникальный ленточный синапс . Зрительный нерв переносит аксоны ганглиозных клеток в мозг и кровеносные сосуды, которые снабжают сетчатку. Ганглиозные клетки лежат в глубине глаза, в то время как фоторецепторные клетки находятся за его пределами. Из-за этого нелогичного расположения свет должен сначала пройти через ганглиозные клетки и вокруг них, а также через толщу сетчатки (включая ее капиллярные сосуды, не показаны), прежде чем достичь палочек и колбочек. Свет поглощается ретинальным пигментным эпителием или сосудистой оболочкой (оба непрозрачны).
Белые кровяные клетки в капиллярах перед фоторецепторами могут восприниматься как крошечные яркие движущиеся точки при взгляде на синий свет. Это известно как энтоптический феномен синего поля (или феномен Ширера).
Между слоем ганглиозных клеток и палочками и колбочками находятся два слоя нейропилей , где осуществляются синаптические контакты. Слои нейропилей — это внешний плексиформный слой и внутренний плексиформный слой . Во внешнем слое нейропиля палочки и колбочки соединяются с вертикально идущими биполярными клетками , а горизонтально ориентированные горизонтальные клетки соединяются с ганглиозными клетками.
Центральная сетчатка преимущественно содержит колбочки, в то время как периферическая сетчатка преимущественно содержит палочки. Всего в сетчатке около семи миллионов колбочек и ста миллионов палочек. В центре макулы находится фовеолярная ямка, где колбочки узкие и длинные, и расположены в гексагональной мозаике , наиболее плотной, в отличие от гораздо более толстых колбочек, расположенных более периферически в сетчатке. [23] В фовеолярной ямке другие слои сетчатки смещаются, прежде чем нарастить вдоль фовеолярного склона, пока не будет достигнут ободок фовеа, или парафовеа , который является самой толстой частью сетчатки. Макула имеет желтую пигментацию из-за экранирующих пигментов и известна как желтое пятно. Область, непосредственно окружающая фовеа, имеет самую высокую плотность палочек, сходящихся на отдельных биполярных клетках. Поскольку ее колбочки имеют гораздо меньшую конвергенцию сигналов, фовеа обеспечивает самое острое зрение, которое может достичь глаз. [2]
Хотя палочки и колбочки представляют собой своего рода мозаику , передача от рецепторов к биполярам и ганглиозным клеткам не является прямой. Поскольку существует около 150 миллионов рецепторов и только 1 миллион волокон зрительного нерва, должна происходить конвергенция и, таким образом, смешивание сигналов. Более того, горизонтальное действие горизонтальных и амакриновых клеток может позволить одной области сетчатки контролировать другую (например, один стимул подавляет другой). Это ингибирование является ключом к уменьшению суммы сообщений, отправляемых в высшие области мозга. У некоторых низших позвоночных (например, голубя ) контроль сообщений является «центробежным» — то есть один слой может контролировать другой, или высшие области мозга могут управлять нервными клетками сетчатки, но у приматов этого не происходит. [2]
Используя оптическую когерентную томографию (ОКТ), можно идентифицировать 18 слоев сетчатки. Слои и анатомическое соотношение следующие: [24] [25] [26]



С помощью ОКТ можно распознать следующие слои (от самых внутренних до самых внешних):
Развитие сетчатки начинается с формирования полей зрения, опосредованного белками SHH и SIX3 , с последующим развитием глазных пузырьков, регулируемых белками PAX6 и LHX2 . [33] Роль Pax6 в развитии глаз была элегантно продемонстрирована Вальтером Герингом и коллегами, которые показали, что эктопическая экспрессия Pax6 может привести к формированию глаз на антеннах, крыльях и ногах Drosophila . [34] Глазной пузырек дает начало трем структурам: нейральной сетчатке, пигментированному эпителию сетчатки и зрительному стеблю. Нейральная сетчатка содержит клетки-предшественники сетчатки (RPC), которые дают начало семи типам клеток сетчатки. Дифференциация начинается с ганглиозных клеток сетчатки и завершается образованием мюллеровой глии. [35] Хотя каждый тип клеток дифференцируется из RPC в последовательном порядке, существует значительное совпадение во времени дифференциации отдельных типов клеток. [33] Сигналы, определяющие судьбу дочерних клеток RPC, кодируются несколькими семействами факторов транскрипции, включая факторы bHLH и гомеодомен . [36] [37]
В дополнение к руководству определением судьбы клеток, в сетчатке существуют сигналы для определения дорсально-вентральной (DV) и носо-височной (NT) осей. Ось DV устанавливается вентрально-дорсальным градиентом VAX2 , тогда как ось NT координируется экспрессией факторов транскрипции forkhead FOXD1 и FOXG1 . Дополнительные градиенты формируются в сетчатке. [37] Это пространственное распределение может помочь в правильном нацеливании аксонов RGC, которые функционируют для установления ретинотопической карты. [33]

Сетчатка разделена на отдельные слои, каждый из которых содержит определенные типы клеток или клеточные отсеки [38] , имеющие метаболизм с различными потребностями в питании. [39] Чтобы удовлетворить эти потребности, глазная артерия разветвляется и снабжает сетчатку через две отдельные сосудистые сети: хориоидальную сеть, которая снабжает хориоидею и наружную сетчатку, и ретинальную сеть, которая снабжает внутренний слой сетчатки. [40]
Хотя инвертированная сетчатка позвоночных кажется нелогичной, она необходима для правильного функционирования сетчатки. Фоторецепторный слой должен быть встроен в ретинальный пигментный эпителий (RPE), который выполняет по крайней мере семь жизненно важных функций, [41] одна из наиболее очевидных — поставлять кислород и другие необходимые питательные вещества, необходимые для функционирования фоторецепторов.
Потребности сетчатки в энергии даже больше, чем у мозга. [4] Это связано с дополнительной энергией, необходимой для постоянного обновления внешних сегментов фоторецепторов, из которых 10% теряется ежедневно. [4] Потребности в энергии самые большие во время темновой адаптации, когда ее чувствительность максимально повышена. [42] Хориоидея поставляет около 75% этих питательных веществ в сетчатку, а сосудистая сеть сетчатки — только 25%. [5]
Когда свет попадает на 11-цис-ретиналь (в дисках палочек и колбочек), 11-цис-ретиналь изменяется на полностью транс-ретиналь, который затем запускает изменения в опсинах. Теперь внешние сегменты не регенерируют ретиналь обратно в цис-форму после того, как он был изменен светом. Вместо этого ретиналь выкачивается в окружающий RPE, где он регенерируется и транспортируется обратно во внешние сегменты фоторецепторов. Эта функция рециркуляции RPE защищает фоторецепторы от фотоокислительного повреждения [43] [44] и позволяет клеткам фоторецепторов иметь десятилетия полезной жизни.
Сетчатка птиц лишена кровеносных сосудов, возможно, для того, чтобы обеспечить беспрепятственный проход света для формирования изображений, тем самым обеспечивая лучшее разрешение. Поэтому считается, что сетчатка птиц зависит от питания и снабжения кислородом специализированного органа, называемого «пектеном» или pecten oculi , расположенного на слепом пятне или зрительном диске. Этот орган чрезвычайно богат кровеносными сосудами и, как полагают, поставляет питание и кислород сетчатке птиц путем диффузии через стекловидное тело. Пектен очень богат щелочной фосфатазной активностью и поляризованными клетками в своей мостовой части — и то, и другое соответствует его секреторной роли. [45] Клетки гребня заполнены темными гранулами меланина, которые, как предполагается, поддерживают этот орган в тепле за счет поглощения рассеянного света, падающего на пектены. Считается, что это повышает скорость метаболизма пектена, тем самым экспортируя больше питательных молекул для удовлетворения жестких энергетических потребностей сетчатки в течение длительных периодов воздействия света. [46]
Известно, что бифуркации и другие физические характеристики внутренней сосудистой сети сетчатки различаются у разных людей [47] , и эти индивидуальные различия использовались для биометрической идентификации и раннего выявления начала заболевания. Картирование сосудистых бифуркаций является одним из основных шагов в биометрической идентификации. [48] Результаты такого анализа структуры кровеносных сосудов сетчатки можно оценить по данным наземной проверки [49] сосудистых бифуркаций изображений глазного дна сетчатки, полученных из набора данных DRIVE. [50] Кроме того, были также определены классы сосудов набора данных DRIVE [51] , и также доступен автоматизированный метод для точного извлечения этих бифуркаций. [52] Изменения в кровообращении сетчатки наблюдаются с возрастом [53] и воздействием загрязнения воздуха [54] и могут указывать на сердечно-сосудистые заболевания, такие как гипертония и атеросклероз. [55] [56] [57] Определение эквивалентной ширины артериол и венул вблизи диска зрительного нерва также является широко используемым методом выявления сердечно-сосудистых рисков. [58]
Сетчатка преобразует оптическое изображение в нервные импульсы, начиная с шаблонного возбуждения цветочувствительных пигментов ее палочек и колбочек, фоторецепторных клеток сетчатки . Возбуждение обрабатывается нервной системой и различными частями мозга, работающими параллельно, чтобы сформировать представление внешней среды в мозге. [ необходима цитата ]
Колбочки реагируют на яркий свет и обеспечивают цветовое зрение с высоким разрешением при дневном освещении (также называемое фотопическим зрением ). Реакции палочек насыщаются при дневном освещении и не способствуют зрению образов. Однако палочки реагируют на тусклый свет и обеспечивают монохроматическое зрение с более низким разрешением при очень низких уровнях освещенности (называемое скотопическим зрением ). Освещенность в большинстве офисных помещений находится между этими двумя уровнями и называется мезопическим зрением . При мезопических уровнях освещенности как палочки, так и колбочки активно вносят информацию об образах. Какой вклад информация палочек вносит в зрение образов при этих обстоятельствах, неясно.
Реакция колбочек на различные длины волн света называется их спектральной чувствительностью. При нормальном человеческом зрении спектральная чувствительность колбочки делится на один из трех подтипов, часто называемых синим, зеленым и красным, но более точно известных как подтипы колбочек, чувствительные к коротким, средним и длинным волнам. Отсутствие одного или нескольких подтипов колбочек приводит к тому, что у людей возникают недостатки цветового зрения или различные виды дальтонизма . Эти люди не слепы к объектам определенного цвета, но не способны различать цвета, которые могут различать люди с нормальным зрением. У людей есть это трихроматическое зрение , в то время как у большинства других млекопитающих отсутствуют колбочки с пигментом, чувствительным к красному, и поэтому они имеют более слабое дихроматическое цветовое зрение. Однако у некоторых животных есть четыре спектральных подтипа, например, форель добавляет ультрафиолетовую подгруппу к коротким, средним и длинным подтипам, которые похожи на человеческие. Некоторые рыбы также чувствительны к поляризации света.
В фоторецепторах воздействие света гиперполяризует мембрану в серии градуированных сдвигов. Внешний сегмент клетки содержит фотопигмент . Внутри клетки нормальные уровни циклического гуанозинмонофосфата (цГМФ) поддерживают Na+-канал открытым, и, таким образом, в состоянии покоя клетка деполяризована. Фотон заставляет ретиналь , связанный с рецепторным белком, изомеризоваться в транс-ретиналь . Это заставляет рецептор активировать несколько G-белков . Это, в свою очередь, заставляет Ga-субъединицу белка активировать фосфодиэстеразу (PDE6), которая разрушает цГМФ, что приводит к закрытию Na+ -циклических нуклеотид-зависимых ионных каналов (CNG). Таким образом, клетка гиперполяризуется. Количество высвобождаемого нейротрансмиттера уменьшается при ярком свете и увеличивается по мере снижения уровня освещенности. Сам фотопигмент обесцвечивается при ярком свете и восстанавливается только в результате химического процесса, поэтому при переходе от яркого света к темноте глазу может потребоваться до тридцати минут, чтобы достичь полной чувствительности.
При таком возбуждении светом фоторецептор посылает пропорциональный ответ синаптически биполярным клеткам , которые в свою очередь сигнализируют ганглиозным клеткам сетчатки . Фоторецепторы также перекрестно связаны горизонтальными клетками и амакриновыми клетками , которые изменяют синаптический сигнал до того, как он достигнет ганглиозных клеток, причем нейронные сигналы смешиваются и объединяются. Из нервных клеток сетчатки только ганглиозные клетки сетчатки и несколько амакриновых клеток создают потенциалы действия .
В ганглиозных клетках сетчатки существует два типа реакции в зависимости от рецептивного поля клетки. Рецептивные поля ганглиозных клеток сетчатки включают центральную, приблизительно круглую область, где свет оказывает одно влияние на активацию клетки, и кольцевое окружение, где свет оказывает противоположное влияние. В клетках ON увеличение интенсивности света в центре рецептивного поля приводит к увеличению частоты активации. В клетках OFF оно ее уменьшает. В линейной модели этот профиль реакции хорошо описывается разницей гауссианов и является основой для алгоритмов обнаружения краев . Помимо этого простого различия, ганглиозные клетки также различаются по хроматической чувствительности и типу пространственной суммации. Клетки, демонстрирующие линейную пространственную суммацию, называются X-клетками (также называемыми парвоцеллюлярными, P-клетками или карликовыми ганглиозными клетками), а те, которые демонстрируют нелинейную суммацию, называются Y-клетками (также называемыми магноцеллюлярными, M-клетками или ганглиозными клетками сетчатки парасоля), хотя соответствие между X- и Y-клетками (в сетчатке кошки) и P- и M-клетками (в сетчатке примата) не такое простое, как когда-то казалось.
При передаче зрительных сигналов в мозг, зрительный путь , сетчатка вертикально делится на две половины, височную (ближе к виску) и носовую (ближе к носу) половину. Аксоны из носовой половины пересекают мозг в зрительном перекресте, чтобы соединиться с аксонами из височной половины другого глаза, прежде чем перейти в латеральное коленчатое тело .
Хотя существует более 130 миллионов ретинальных рецепторов, в зрительном нерве находится всего около 1,2 миллиона волокон (аксонов). Таким образом, большой объем предварительной обработки выполняется внутри сетчатки. Фовеа производит самую точную информацию. Несмотря на то, что она занимает около 0,01% поля зрения (менее 2° угла зрения ), около 10% аксонов в зрительном нерве посвящены фовеа. Предел разрешения фовеа был определен как около 10 000 точек. Информационная емкость оценивается в 500 000 бит в секунду (для получения дополнительной информации о битах см. теорию информации ) без цвета или около 600 000 бит в секунду, включая цвет. [59]

Когда сетчатка посылает нервные импульсы, представляющие изображение, в мозг, она пространственно кодирует (сжимает) эти импульсы, чтобы соответствовать ограниченной емкости зрительного нерва. Сжатие необходимо, поскольку фоторецепторных клеток в 100 раз больше, чем ганглиозных . Это делается с помощью « декорреляции », которая осуществляется «структурами центр-окружение», которые реализуются биполярными и ганглиозными клетками.
В сетчатке есть два типа структур центр-окружение — on-центры и off-центры. On-центры имеют положительно взвешенный центр и отрицательно взвешенное окружение. Off-центры — полная противоположность. Положительное взвешивание более известно как возбуждающее , а отрицательное взвешивание — как ингибирующее .
Эти структуры центр-окружение не являются физически очевидными, в том смысле, что их нельзя увидеть, окрашивая образцы ткани и исследуя анатомию сетчатки. Структуры центр-окружение являются логическими (т.е. математически абстрактными) в том смысле, что они зависят от прочности связей между биполярными и ганглиозными клетками. Считается, что прочность связей между клетками обусловлена количеством и типами ионных каналов, встроенных в синапсах между биполярными и ганглиозными клетками.
Структуры «центр-окружение» математически эквивалентны алгоритмам обнаружения краев , используемым программистами для извлечения или улучшения краев на цифровой фотографии. Таким образом, сетчатка выполняет операции над импульсами, представляющими изображение, для улучшения краев объектов в поле ее зрения. Например, на изображении собаки, кошки и автомобиля именно края этих объектов содержат наибольшую информацию. Для того чтобы высшие функции мозга (или компьютера, если на то пошло) извлекали и классифицировали такие объекты, как собака и кошка, сетчатка является первым шагом к разделению различных объектов в пределах сцены.
В качестве примера, следующая матрица лежит в основе компьютерного алгоритма , реализующего обнаружение краев. Эта матрица является компьютерным эквивалентом структуры центр-окружение. В этом примере каждый блок (элемент) в этой матрице будет подключен к одному фоторецептору. Фоторецептор в центре является текущим обрабатываемым рецептором. Центральный фоторецептор умножается на весовой коэффициент +1. Окружающие фоторецепторы являются «ближайшими соседями» к центру и умножаются на значение −1/8. В конечном итоге вычисляется сумма всех девяти этих элементов. Это суммирование повторяется для каждого фоторецептора на изображении путем сдвига влево к концу строки, а затем вниз к следующей строке.
Общая сумма этой матрицы равна нулю, если все входы от девяти фоторецепторов имеют одинаковое значение. Нулевой результат указывает на то, что изображение было однородным (неизменным) в пределах этого небольшого участка. Отрицательные или положительные суммы означают, что изображение варьировалось (изменялось) в пределах этого небольшого участка из девяти фоторецепторов.
Вышеприведенная матрица является лишь приближением того, что действительно происходит внутри сетчатки. Различия таковы:
Вот пример входного изображения и того, как обнаружение краев может его изменить.
После того, как изображение пространственно закодировано структурами центр-окружение, сигнал посылается по зрительному нерву (через аксоны ганглиозных клеток) через зрительный перекрест в LGN ( латеральное коленчатое тело ). Точная функция LGN в настоящее время неизвестна. Затем выход LGN отправляется в заднюю часть мозга. В частности, выход LGN «излучается» в первичную зрительную кору V1 .
Упрощенный поток сигналов: Фоторецепторы → Биполяры → Ганглий → Хиазма → ЛГН → Кора V1
Существует множество наследственных и приобретенных заболеваний или расстройств, которые могут повлиять на сетчатку. Некоторые из них включают:
Кроме того, сетчатку называют «окном» в мозг и тело, поскольку отклонения, обнаруженные при обследовании сетчатки, могут быть признаком как неврологических, так и системных заболеваний. [61]
Для диагностики заболеваний и расстройств сетчатки доступен ряд различных инструментов. Офтальмоскопия и фотография глазного дна уже давно используются для исследования сетчатки. Недавно адаптивная оптика использовалась для визуализации отдельных палочек и колбочек в сетчатке живого человека, а компания, базирующаяся в Шотландии, разработала технологию, которая позволяет врачам наблюдать всю сетчатку без какого-либо дискомфорта для пациентов. [62]
Электроретинограмма используется для неинвазивного измерения электрической активности сетчатки, на которую влияют некоторые заболевания. Относительно новой технологией, которая в настоящее время становится широко доступной, является оптическая когерентная томография (ОКТ). Этот неинвазивный метод позволяет получить трехмерную объемную или высокоразрешающую поперечную томограмму тонких структур сетчатки с гистологическим качеством. Анализ сосудов сетчатки — это неинвазивный метод исследования мелких артерий и вен сетчатки, который позволяет делать выводы о морфологии и функции мелких сосудов в других частях тела человека. Он был установлен как предиктор сердечно-сосудистых заболеваний [63] и, по-видимому, имеет потенциал для раннего выявления болезни Альцгеймера, согласно исследованию, опубликованному в 2019 году. [64]
Лечение зависит от характера заболевания или расстройства.
Ниже приведены общепринятые методы лечения заболеваний сетчатки:
Генная терапия сетчатки
Генная терапия обещает быть потенциальным средством лечения широкого спектра заболеваний сетчатки. Это предполагает использование неинфекционного вируса для переноса гена в часть сетчатки. Векторы рекомбинантного аденоассоциированного вируса (rAAV) обладают рядом особенностей, которые делают их идеально подходящими для генной терапии сетчатки, включая отсутствие патогенности, минимальную иммуногенность и способность трансдуцировать постмитотические клетки стабильным и эффективным образом. [65] Векторы rAAV все чаще используются из-за их способности опосредовать эффективную трансдукцию ретинального пигментного эпителия (RPE), фоторецепторных клеток и ретинальных ганглиозных клеток . Каждый тип клеток может быть специально нацелен путем выбора подходящей комбинации серотипа AAV , промотора и места внутриглазной инъекции.
Несколько клинических испытаний уже сообщили о положительных результатах использования rAAV для лечения врожденного амавроза Лебера , показывая, что терапия была как безопасной, так и эффективной. [66] [67] Не было никаких серьезных побочных эффектов, и пациенты во всех трех исследованиях показали улучшение своей зрительной функции, измеренной несколькими методами. Методы, используемые в трех испытаниях, различались, но включали как функциональные методы, такие как острота зрения [67] [68] [69] и функциональная подвижность [68] [69] [70], так и объективные меры, которые менее подвержены предвзятости, такие как способность зрачка реагировать на свет [66] [71] и улучшения на функциональной МРТ. [72] Улучшения сохранялись в течение длительного времени, и пациенты продолжали чувствовать себя хорошо спустя более 1,5 лет. [66] [67]
Уникальная архитектура сетчатки и ее относительно иммунно-привилегированная среда помогают этому процессу. [73] Плотные соединения , которые образуют гематоретинальный барьер , отделяют субретинальное пространство от кровоснабжения, тем самым защищая его от микробов и большинства иммуноопосредованных повреждений и повышая его потенциал реагировать на векторно-опосредованную терапию. Высококомпартментализированная анатомия глаза облегчает точную доставку терапевтических векторных суспензий в определенные ткани под прямой визуализацией с использованием микрохирургических методов. [74] В защищенной среде сетчатки векторы AAV способны поддерживать высокие уровни экспрессии трансгена в ретинальном пигментном эпителии (RPE), фоторецепторах или ганглиозных клетках в течение длительных периодов времени после однократного лечения. Кроме того, глаз и зрительная система могут регулярно и легко контролироваться на предмет зрительной функции и структурных изменений сетчатки после инъекций с помощью неинвазивных передовых технологий, таких как острота зрения, контрастная чувствительность , аутофлуоресценция глазного дна (ФАФ), адаптированные к темноте зрительные пороги, диаметры сосудов, пупиллометрия, электроретинография (ЭРГ), мультифокальная ЭРГ и оптическая когерентная томография (ОКТ). [75]
Эта стратегия эффективна против ряда изученных заболеваний сетчатки, включая неоваскулярные заболевания, которые являются признаками возрастной макулярной дегенерации , диабетической ретинопатии и ретинопатии недоношенных . Поскольку регуляция васкуляризации в зрелой сетчатке включает баланс между эндогенными положительными факторами роста , такими как фактор роста эндотелия сосудов (VEGF), и ингибиторами ангиогенеза , такими как фактор, полученный из пигментного эпителия ( PEDF ), было показано, что опосредованная rAAV экспрессия PEDF, ангиостатина и растворимого рецептора VEGF sFlt-1, которые являются антиангиогенными белками, снижает аберрантное образование сосудов в моделях на животных. [76] Поскольку специфическая генная терапия не может быть легко использована для лечения значительной части пациентов с дистрофией сетчатки, существует большой интерес в разработке более общеприменимой терапии факторов выживания. Нейротрофические факторы обладают способностью модулировать рост нейронов во время развития, чтобы поддерживать существующие клетки и обеспечивать восстановление поврежденных популяций нейронов в глазу. AAV, кодирующие нейротрофические факторы, такие как члены семейства факторов роста фибробластов (FGF) и GDNF, либо защищали фоторецепторы от апоптоза, либо замедляли гибель клеток. [76]
Трансплантация органов Трансплантация сетчатки была предпринята, но без особого успеха. В Массачусетском технологическом институте , Университете Южной Калифорнии, Рейнско-Вестфальском техническом университете Ахена и Университете Нового Южного Уэльса разрабатывается «искусственная сетчатка»: имплантат, который будет обходить фоторецепторы сетчатки и стимулировать прикрепленные нервные клетки напрямую с помощью сигналов с цифровой камеры.
Около 300 г. до н. э . Герофил идентифицировал сетчатку, препарируя глаза трупов. Он назвал ее паутинной оболочкой, из-за ее сходства с паутиной, и сетчатой , из-за ее сходства с литейной сетью. Термин паутинная оболочка стал обозначать слой вокруг мозга; термин сетчатая оболочка стал обозначать сетчатку . [ 77]
Между 1011 и 1021 годами н. э. Ибн аль-Хайтам опубликовал многочисленные эксперименты, демонстрирующие, что зрение возникает из света, отражающегося от объектов в глаз. Это согласуется с теорией интромиссии и противоречит теории эмиссии , теории, согласно которой зрение возникает из лучей, испускаемых глазами. Однако Ибн аль-Хайтам решил, что сетчатка не может быть ответственна за начало зрения, поскольку изображение, сформированное на ней, было перевернутым. Вместо этого он решил, что оно должно начинаться на поверхности хрусталика. [78]
В 1604 году Иоганн Кеплер разработал оптику глаза и решил, что сетчатка должна быть тем местом, где начинается зрение. Он предоставил другим ученым возможность примирить перевернутое изображение на сетчатке с нашим восприятием мира как вертикального. [79]
В 1894 году Сантьяго Рамон-и-Кахаль опубликовал первую крупную характеристику нейронов сетчатки в своей работе Retina der Wirbelthiere ( Сетчатка позвоночных ). [80]
Джордж Уолд , Хэлдан Кеффер Хартлайн и Рагнар Гранит получили Нобелевскую премию по физиологии и медицине 1967 года за свои научные исследования сетчатки. [81]
Недавнее исследование Пенсильванского университета подсчитало, что приблизительная пропускная способность сетчатки человека составляет 8,75 мегабит в секунду, тогда как скорость передачи данных сетчатки морской свинки составляет 875 килобит в секунду. [82]
В 2006 году Макларен и Пирсон, а также коллеги из Лондонского университетского колледжа и глазной больницы Мурфилдс в Лондоне показали, что фоторецепторные клетки можно успешно трансплантировать в сетчатку мыши, если донорские клетки находятся на критической стадии развития. [83] Недавно Адер и коллеги в Дублине с помощью электронного микроскопа показали, что трансплантированные фоторецепторы образуют синаптические связи. [84]
В 2012 году Себастьян Сын и его лаборатория в Массачусетском технологическом институте запустили EyeWire , онлайн- игру для граждан , в которой игроки отслеживают нейроны в сетчатке. [85] Целью проекта EyeWire является выявление конкретных типов клеток в пределах известных широких классов клеток сетчатки и картирование связей между нейронами в сетчатке, что поможет определить, как работает зрение. [86] [87]
{{cite news}}: CS1 maint: несколько имен: список авторов ( ссылка ){{cite journal}}: CS1 maint: DOI неактивен по состоянию на июнь 2024 г. ( ссылка )