
Общий анестетик (или анестетик ) — это препарат , который вызывает обратимую потерю сознания . [2] Эти препараты обычно вводятся анестезиологом/ анестезиологом для индукции или поддержания общей анестезии с целью облегчения хирургического вмешательства .
Общие анестетики широко используются в хирургии с 1842 года, когда Кроуфорд Лонг впервые ввел пациенту диэтиловый эфир и провел безболезненную операцию. Долгое время считалось, что общие анестетики оказывают свое действие (анальгезию, потерю сознания, неподвижность) [3] через мембранно-опосредованный механизм или путем прямой модуляции активности мембранных белков в нейрональной мембране. В целом, различные анестетики проявляют различные механизмы действия, так что на всех уровнях интеграции в центральной нервной системе существует множество неисключающих молекулярных мишеней . [4] Однако для некоторых внутривенных анестетиков, таких как пропофол и этомидат , основной молекулярной мишенью считается рецептор ГАМК А , при этом решающую роль играют определенные субъединицы β. [5] [6] [7]
Концепция специфических взаимодействий между рецепторами и лекарственными средствами, впервые введенная Полом Эрлихом в 1897 году [8], гласит, что лекарственные средства действуют только тогда, когда они связаны со своими мишенями (рецепторами). [1] Идентификация конкретных молекулярных мишеней для общих анестетиков стала возможной только с современным развитием методов молекулярной биологии для мутаций отдельных аминокислот в белках генетически модифицированных мышей . [1] [5] [6] [7]

Неспецифический механизм действия общей анестезии был впервые предложен Эмилем Харлессом и Эрнстом фон Биброй в 1847 году. [9] Они предположили, что общие анестетики могут действовать, растворяясь в жировой фракции клеток мозга и удаляя из них жировые компоненты, тем самым изменяя активность клеток мозга и вызывая анестезию. В 1899 году Ганс Хорст Мейер опубликовал первые экспериментальные доказательства того факта, что эффективность анестезии связана с растворимостью липидов. [10] [11] Два года спустя похожая теория была независимо опубликована Чарльзом Эрнестом Овертоном . [12]
Мейер сравнил силу многих агентов, определяемую как обратную величину молярной концентрации , необходимой для индукции анестезии у головастиков, с их коэффициентом распределения оливковое масло/вода . Он обнаружил почти линейную зависимость между силой и коэффициентом распределения для многих типов молекул анестетиков, таких как спирты , альдегиды , кетоны , эфиры и сложные эфиры . Концентрация анестетика, необходимая для индукции анестезии у 50 % популяции животных (EC50 ) , не зависела от способа доставки анестетика, т. е. газовой или водной фазы. [10] [11] [13]
Мейер и Овертон обнаружили поразительную корреляцию между физическими свойствами молекул общих анестетиков и их эффективностью: чем больше липидная растворимость соединения в оливковом масле, тем больше его анестезирующая эффективность. [13] Эта корреляция верна для широкого спектра анестетиков с липидной растворимостью, варьирующейся более чем на 4-5 порядков, если в качестве масляной фазы используется оливковое масло. Эта корреляция может быть значительно улучшена с точки зрения как качества корреляции, так и увеличенного диапазона анестетиков, если в качестве «масляной» фазы используется объемный октанол [14] или полностью гидратированный жидкий липидный бислой [15] [16] [17] [18] . Было также отмечено, что летучие анестетики аддитивны в своих эффектах. (Смесь половинной дозы двух различных летучих анестетиков дала тот же анестезирующий эффект, что и полная доза любого препарата по отдельности.)
Наиболее охарактеризованный сайт анестезии, отвечающий за корреляцию Мейера-Овертона, находится в упорядоченных липидных доменах. Анестетики неспецифически прилипают к поверхности специфического сайта связывания пальмитата внутри липидной мембраны, вытесняя пальмитат из упорядоченных липидов GM1. Этот процесс приводит к возникновению компонента мембранно-опосредованной анестезии . [19] Похожий механизм был показан для люциферазы. [20] Анестетики неспецифически связывались с гидрофобной поверхностью и превзошли специфическое связывание люциферина. Однако люцифераза не имеет физиологического значения для позвоночных, поскольку она не экспрессируется эндогенно у позвоночных.

Из корреляции между растворимостью липидов и анестезирующей силой и Мейер, и Овертон предположили единый механизм общей анестезии. Они предположили, что солюбилизация липофильного общего анестетика в липидном бислое нейрона вызывает его нарушение и анестезирующий эффект при достижении критической концентрации анестетика. Позже, в 1973 году, Миллер и Смит предложили гипотезу критического объема, также называемую гипотезой расширения липидного бислоя. [21] Они предположили, что объемные и гидрофобные молекулы анестетика накапливаются внутри гидрофобных (или липофильных) областей нейрональной липидной мембраны, вызывая ее искажение и расширение (утолщение) из-за смещения объема. Накопление критических количеств анестетика вызывает утолщение мембраны, достаточное для обратимого изменения функции ионных каналов мембраны, тем самым обеспечивая анестезирующий эффект. Фактическая химическая структура анестезирующего агента сама по себе не важна, но его молекулярный объем играет главную роль: чем больше места внутри мембраны занимает анестетик, тем сильнее анестезирующий эффект. Основываясь на этой теории, в 1954 году Маллинз предположил, что корреляция Мейера-Овертона с эффективностью может быть улучшена, если принять во внимание молекулярные объемы молекул анестетика. [22] Эта теория существовала более 60 лет и была подкреплена экспериментальным фактом, что увеличение атмосферного давления обращает анестезирующий эффект ( эффект реверсии давления ). [21] [23] [24]
Затем появились другие физико-химические теории анестезирующего действия, которые учитывали разнообразную химическую природу общих анестетиков и предполагали, что анестезирующий эффект осуществляется посредством некоторого возмущения липидного бислоя. [25] Было предложено несколько типов возмущений бислоя, вызывающих анестезирующий эффект, включая (1) изменения в разделении фаз, (2) изменения в толщине бислоя, (3) изменения в параметрах порядка или (4) изменения в эластичности кривизны. [26] [27] [28]
Согласно теории латерального фазового разделения [28], анестетики оказывают свое действие, разжижая мембраны нервов до точки, когда фазовые разделения в критических липидных областях исчезают. Эта вызванная анестезией разжижение делает мембраны менее способными облегчать конформационные изменения в белках, которые могут быть основой для таких мембранных событий, как ионное запирание, высвобождение синаптического трансмиттера и связывание трансмиттера с рецепторами. Более поздние методы с визуализацией сверхвысокого разрешения показывают, что анестетики не преодолевают фазовое разделение — фазовое разделение сохраняется. Довольно насыщенные липиды в фазовом разделении могут претерпевать переход из упорядоченного в неупорядоченное состояние, на которое сильно влияют анестетики. Тем не менее, концепция белков, перемещающихся между фазово-разделенными липидами в ответ на анестетик, теперь оказалась верной. [29]
Считалось, что все эти ранние теории липидов страдают от четырех недостатков [1] (полное описание с опровержениями см. в разделах ниже):
Корреляция между растворимостью липидов и эффективностью общих анестетиков считалась необходимым, но недостаточным условием для вывода липидного целевого участка. Общие анестетики могли бы также связываться с гидрофобными целевыми участками на белках в мозге, но, учитывая химическое разнообразие анестетиков, это, вероятно, должно было бы включать более одного участка, и эти участки не исключали бы по своей сути участок в мембране. Для белков одной из причин, по которой более полярные общие анестетики могут быть менее эффективными, является то, что им необходимо пересечь гематоэнцефалический барьер , чтобы оказать свое воздействие на нейроны в мозге.

Существуют две современные липидные гипотезы, которые не исключают прямого связывания с белком. Самая последняя гипотеза постулирует, что упорядоченные липиды в плазматической мембране содержат структурированный сайт связывания для липидного пальмитата . Это сайт связывания липида в липидной структуре, а не в белковой структуре. Белки, которые содержат ковалентно присоединенный пальмитат ( пальмитоилирование ), нацелены на упорядоченные липиды через специфическое липид-липидное взаимодействие. Связывание пальмитата с липидным доменом зависит от холестерина, и клетка регулирует белок с помощью наноскопической локализации.
Анестетики работают, неспецифически связываясь с сайтом связывания пальмитата, что нарушает способность холестерина связываться с белком и изолировать его в неактивном состоянии. Этот мембранно-опосредованный механизм был экспериментально продемонстрирован Павлом и его коллегами в 2020 году. Они показали, что фермент фосфолипаза D2 (PLD2) чувствителен к анестетикам и активирует калиевый канал TREK-1 через мембранно-опосредованный механизм . Анестетики вытесняют PLD2 из упорядоченных липидных доменов, позволяя ферменту активироваться путем презентации субстрата и активировать канал. [29] [30]
Вторая липидная гипотеза утверждает, что анестезирующий эффект возникает, если растворение общего анестетика в бислое вызывает перераспределение латеральных давлений мембраны. [31] [32]
Каждая двухслойная мембрана имеет отчетливый профиль распределения латерального давления внутри нее. Большинство мембранных белков (особенно ионных каналов) чувствительны к изменениям в этом профиле распределения латерального давления. Эти латеральные напряжения довольно велики и изменяются в зависимости от глубины внутри мембраны. Согласно современной липидной гипотезе, изменение в профиле латерального давления мембраны смещает конформационное равновесие определенных мембранных белков, которые, как известно, подвержены влиянию клинических концентраций анестетиков, таких как лиганд-управляемые ионные каналы. Этот механизм также неспецифичен, поскольку эффективность анестетика определяется не его фактической химической структурой, а позиционным и ориентационным распределением его сегментов и связей внутри бислоя.
В 1997 году Кантор предложил подробный механизм общей анестезии, основанный на статистической термодинамике решетки. [32] Было высказано предположение, что включение амфифильных и других активных на границе раздела растворенных веществ (например, общих анестетиков) в бислой селективно увеличивает боковое давление вблизи водных интерфейсов, что компенсируется уменьшением бокового давления по направлению к центру бислоя. Расчеты показали, что общая анестезия, вероятно, включает в себя ингибирование открытия ионного канала в постсинаптическом лиганд-зависимом мембранном белке [32] по следующему механизму:
Это первая гипотеза, которая предоставила не только корреляцию эффективности со структурными или термодинамическими свойствами, но и детальное механистическое и термодинамическое понимание анестезии.

Таким образом, согласно современной липидной гипотезе, анестетики не действуют напрямую на свои мембранные белки-мишени, а скорее возмущают специализированные липидные матрицы на интерфейсе белок-липид, которые действуют как медиаторы. Это новый тип механизма трансдукции, отличающийся от обычного взаимодействия лиганда и рецептора по принципу «ключ-замок», где анестетик (лиганд) влияет на функцию мембранных белков, связываясь с определенным участком на белке. Таким образом, предполагается, что некоторые мембранные белки чувствительны к своему липидному окружению.
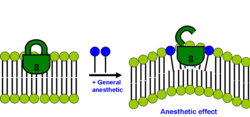
В том же году был предложен немного другой подробный молекулярный механизм того, как возмущение бислоя может влиять на ионный канал. Олеамид (амид жирной кислоты олеиновой кислоты) является эндогенным анестетиком, обнаруженным in vivo (в мозге кошки), и известно, что он усиливает сон и снижает температуру тела, закрывая щелевой контакт канала соединения. [33] Подробный механизм показан на рисунке: хорошо упорядоченное липидное (зеленое)/холестериновое (желтое) кольцо, которое существует вокруг коннексона (пурпурный), становится неупорядоченным при обработке анестетиком (красные треугольники), способствуя закрытию ионного канала коннексона. Это снижает активность мозга и вызывает летаргию и анестезирующий эффект.
Недавно сверхразрешающая визуализация показала прямые экспериментальные доказательства того, что летучие анестетики нарушают упорядоченные липидные домены, как и предсказывалось. [34] В том же исследовании был выявлен связанный механизм, при котором анестетики высвобождают фермент фосфолипазу D (PLD) из липидных доменов, а фермент связывается с каналами TREK-1 и активирует их путем выработки фосфатидной кислоты. Эти результаты экспериментально показали, что мембрана является физиологически значимой целью общих анестетиков.

В начале 1980-х годов Николас П. Фрэнкс и Уильям Р. Либ [35] продемонстрировали, что корреляцию Мейера-Овертона можно воспроизвести с помощью растворимого белка. Они обнаружили, что два класса белков инактивируются клиническими дозами анестетика при полном отсутствии липидов. Это люциферазы , которые используются биолюминесцентными животными и бактериями для получения света, [36] и цитохром P450 , [37] , который представляет собой группу гемовых белков, которые гидроксилируют разнообразную группу соединений, включая жирные кислоты , стероиды и ксенобиотики , такие как фенобарбитал . Примечательно, что ингибирование этих белков общими анестетиками напрямую коррелировало с их анестезирующим потенциалом. Ингибирование люциферазы также демонстрирует отсечку длинноцепочечного спирта, которая связана с размером кармана, связывающего анестетик. [38]
Эти наблюдения были важны, поскольку они продемонстрировали, что общие анестетики оказывают свое действие неспецифически, в том числе при связывании с белками. Это также открыло возможность того, что анестетики могут работать посредством прямого связывания с белками, а не влиять на мембранные белки косвенно через неспецифические взаимодействия с липидным бислоем в качестве медиатора. [14] [39] Было показано, что анестетики изменяют функции многих цитоплазматических сигнальных белков, включая протеинкиназу С. [40] [41 ]
Однако белки, считающиеся наиболее вероятными молекулярными мишенями анестетиков, — это ионные каналы. Согласно этой теории, общие анестетики гораздо более селективны, чем в липидных гипотезах, и они напрямую связываются только с небольшим количеством мишеней в центральной нервной системе, в основном с лиганд-зависимыми ионными каналами в синапсах и рецепторами, сопряженными с G-белком , изменяя их ионный поток. В частности, рецепторы Cys-loop [42] являются вероятными мишенями для общих анестетиков, которые связываются на границе между субъединицами. Суперсемейство рецепторов Cys-loop включает ингибирующие рецепторы ( рецепторы ГАМК A , рецепторы ГАМК C , глициновые рецепторы ) и возбуждающие рецепторы ( никотиновый ацетилхолиновый рецептор и рецептор серотонина 5-HT3 ). Общие анестетики могут ингибировать функции каналов возбуждающих рецепторов или потенцировать функции тормозных рецепторов соответственно.
Расположение неспецифических сайтов связывания в ионных каналах по-прежнему остается важным вопросом в этой области. В частности, как соединение, которое следует закону Овертона-Мейера, напрямую вызывает конформационное изменение белка? Обычно аллостерическая регуляция включает изменение формы белка, которое обеспечивает связывание лиганда. Этот механизм отличается от механизма люциферазы. Второй важный вопрос: как неспецифические сайты связывания белка сохраняются у разных видов и почему они обычно ингибируют возбуждающие рецепторы и потенцируют ингибирующие рецепторы?
Ряд экспериментальных и вычислительных исследований показали, что общие анестетики могут изменять динамику в гибких петлях, которые соединяют α-спирали в пучок и подвергаются воздействию мембранно-водного интерфейса рецепторов Cys-петли. [43] [44] [45] [46] [47] [48] Однако основные связывающие карманы общих анестетиков расположены внутри трансмембранных пучков из четырех α-спиралей рецепторов Cys-петли. [49] [50] [51]

Рецептор ГАМК А (ГАМК А Р) является ионотропным рецептором, активируемым тормозным нейротрансмиттером γ-аминомасляной кислотой (ГАМК). Активация рецептора ГАМК А приводит к притоку ионов хлора , что вызывает гиперполяризацию нейрональных мембран. [52]
Рецептор ГАМК А был идентифицирован как основная цель внутривенных анестетиков, таких как пропофол и этомидат . [4] [5] Место связывания пропофола с рецепторами ГАМК А млекопитающих было идентифицировано с помощью фотомаркировки с использованием производного диазирина . [53] Сильная активация тонической проводимости рецептора ГАМК А клиническими концентрациями пропофола была подтверждена электрофизиологическими записями нейронов гиппокампа CA1 в срезах мозга взрослых крыс . [54]
Рецепторы ГАМК А , содержащие β3-субъединицы, являются основными молекулярными мишенями для анестезирующего действия этомидата , тогда как рецепторы ГАМК А, содержащие β2, участвуют в седативном эффекте, вызываемом этим препаратом. [55] Электрофизиологические эксперименты с амнестическими концентрациями этомидата также показали усиление тонической проводимости ГАМК А пирамидальных нейронов CA1 в срезах гиппокампа. [56]
Мощная активация ингибирования, опосредованного рецептором ГАМК А , с последующим сильным снижением частоты импульсации неокортикальных нейронов также была продемонстрирована для клинических концентраций летучих анестетиков, таких как изофлуран , энфлуран и галотан . [57]
Усиление активности рецептора ГАМК А вряд ли является единственным механизмом, объясняющим широкий спектр поведенческих эффектов общих анестетиков. [1] Накопление экспериментальных данных предполагает, что модуляция двухпоровых доменных калиевых каналов , [58] [59] или потенциалзависимых натриевых каналов [60] также может объяснять некоторые действия летучих анестетиков. Альтернативно, ингибирование глутаматзависимых рецепторов N-метил-D-аспартата кетамином , ксеноном и закисью азота обеспечивает механизм действия в соответствии с преобладающим анальгезирующим профилем. [1]
Стереоизомеры, которые представляют собой зеркальные отражения друг друга, называются энантиомерами или оптическими изомерами (например, изомеры R-(+)- и S-(−)-этомидата). [1] Физико-химические эффекты энантиомеров всегда идентичны в ахиральной среде (например, в липидном бислое). Однако in vivo энантиомеры многих общих анестетиков (например, изофлуран , тиопентал , этомидат ) могут значительно различаться по своей анестезирующей активности, несмотря на схожие коэффициенты распределения масло/газ. [61] [62] Например, R-(+)-изомер этомидата в 10 раз более мощный анестетик, чем его S-(-)-изомер. [1] Это означает, что оптические изомеры одинаково разделяются на липиды, но оказывают различное воздействие на ионные каналы и синаптическую передачу . Это возражение убедительно доказывает, что основной целью анестетиков является не сам ахиральный липидный бислой, а стереоселективные сайты связывания на мембранных белках, которые обеспечивают хиральную среду для специфических взаимодействий стыковки анестетика с белком. [1]
Опровержение возражения: 1) Стереоселективный транспорт анестетика никогда не рассматривался. Анестетики гидрофобны и транспортируются связанными с белками в крови. Любое стереоселективное связывание с транспортным белком изменило бы концентрацию в месте действия. Более того, поглощение белка в мембране могло бы немного лучше связать один из изомеров и снизить эффективную концентрацию, которую испытывает мембрана. Все стереоизомеры являются эффективными анестетиками, они только смещают чувствительность, что предполагает необходимость рассмотрения селективного транспорта и селективных поглощений белка. 2) Липиды хиральны, как и белки. И подобно белкам, липиды имеют упорядоченные и неупорядоченные области. [63] [64] В этой области не удалось исследовать хиральность упорядоченных липидов из-за отсутствия знаний об их существовании.
Все общие анестетики вызывают иммобилизацию (отсутствие движения в ответ на болезненные стимулы) посредством угнетения функций спинного мозга, тогда как их амнестическое действие осуществляется в головном мозге. Согласно корреляции Мейера-Овертона, анестезирующая сила препарата прямо пропорциональна его липидной растворимости, однако существует множество соединений, которые не удовлетворяют этому правилу. Эти препараты поразительно похожи на мощные общие анестетики и, как предполагается, являются мощными анестетиками на основе их липидной растворимости, но они оказывают только один компонент анестезирующего действия (амнезию) и не подавляют движение (т. е. не угнетают функции спинного мозга), как все анестетики. [65] [66] [67] [68] Эти препараты называются неиммобилизаторами. Существование неиммобилизаторов предполагает, что анестетики вызывают различные компоненты анестезирующего эффекта (амнезию и неподвижность), воздействуя на различные молекулярные мишени, а не только на одну мишень (нейронный бислой), как считалось ранее. [69] Хорошим примером неиммобилизаторов являются галогенированные алканы, которые очень гидрофобны, но не подавляют движение в ответ на пагубную стимуляцию при соответствующих концентрациях. См. также: флуротил .
Опровержение возражения: Это логическая ошибка . Гипотеза не требует, чтобы каждая когда-либо протестированная молекула подчинялась гипотезе, чтобы гипотеза была истинной. Существование менее 10-20 родственных соединений, которые, как известно, не подчиняются гипотезе Мейера-Овертона, никоим образом не отрицает сотни, если не тысячи химически разнообразных соединений, которые подчиняются гипотезе Овертона-Мейера. Исключения могут существовать по причинам, не связанным с механизмом, лежащим в основе гипотезы Мейера-Овертона.
Экспериментальные исследования показали, что общие анестетики, включая этанол, являются мощными флюидизаторами естественных и искусственных мембран. Однако изменения плотности и текучести мембран в присутствии клинических концентраций общих анестетиков настолько малы, что относительно небольшое повышение температуры (~1 °C) может имитировать их, не вызывая анестезии. [70] Изменение температуры тела примерно на 1 °C находится в пределах физиологического диапазона и, очевидно, недостаточно, чтобы вызвать потерю сознания как таковую. Таким образом, мембраны флюидизируются только большими количествами анестетиков, но не происходит никаких изменений в текучести мембран, когда концентрации анестетиков малы и ограничены, чтобы быть фармакологически значимыми.
Опровержение возражения: Ранние исследования рассматривали только текучесть основной массы липидной мембраны. Недавние исследования показали, что изменения температуры могут происходить на несколько градусов в упорядоченных наноскопических липидных доменах. [71] Кроме того, текучесть активно регулируется десатуразами жирных кислот . И, наконец, конкуренция анестетиков с пальмитоилированными белками происходит независимо от температуры и несмотря на повышенные упорядоченные липиды. [29]
Согласно корреляции Мейера-Овертона, в гомологическом ряду любого общего анестетика (например, н - спиртов или алканов) увеличение длины цепи увеличивает растворимость липидов и, таким образом, должно вызывать соответствующее увеличение анестезирующей силы. Однако, за пределами определенной длины цепи анестезирующий эффект исчезает. Для н -спиртов эта граница происходит при длине углеродной цепи около 13 [72] , а для н -алканов при длине цепи от 6 до 10, в зависимости от вида. [73]

Если общие анестетики нарушают ионные каналы, разделяясь и нарушая липидный бислой, то можно было бы ожидать, что их растворимость в липидных бислоях также будет демонстрировать эффект отсечки. Однако разделение спиртов в липидных бислоях не показывает отсечки для длинноцепочечных спиртов от н - деканола до н - пентадеканола . График длины цепи против логарифма коэффициента распределения липидный бислой/буфер K является линейным, причем добавление каждой метиленовой группы вызывает изменение свободной энергии Гиббса на -3,63 кДж/моль.
Эффект отсечки был впервые интерпретирован как доказательство того, что анестетики оказывают свое действие не путем глобального воздействия на липиды мембран, а путем прямого связывания с гидрофобными карманами четко определенных объемов в белках. По мере роста алкильной цепи анестетик заполняет большую часть гидрофобного кармана и связывается с большей аффинностью. Когда молекула слишком велика, чтобы полностью разместиться в гидрофобном кармане, аффинность связывания больше не увеличивается с увеличением длины цепи. Таким образом, объем цепи н-алканола на длине отсечки дает оценку объема места связывания. Это возражение легло в основу белковой гипотезы анестезирующего эффекта (см. ниже).

Однако эффект отсечки все еще можно объяснить в рамках липидной гипотезы. [31] [74] В короткоцепочечных алканолах (A) сегменты цепи довольно жесткие (с точки зрения конформационной энтропии) и очень близки к гидроксильной группе, привязанной к водной межфазной области («буй»). Следовательно, эти сегменты эффективно перераспределяют боковые напряжения от внутренней части бислоя к интерфейсу. В длинноцепочечных алканолах (B) сегменты углеводородной цепи расположены дальше от гидроксильной группы и более гибкие, чем в короткоцепочечных алканолах. Эффективность перераспределения давления уменьшается по мере увеличения длины углеводородной цепи до тех пор, пока анестетическая сила не будет потеряна в какой-то момент. Было высказано предположение, что полиалканолы (C) будут иметь анестезирующий эффект, аналогичный короткоцепочечным 1-алканолам, если длина цепи между двумя соседними гидроксильными группами меньше, чем отсечка. [75] Эта идея была подкреплена экспериментальными данными, поскольку полигидроксиалканы 1,6,11,16-гексадекантетраол и 2,7,12,17-октадекантетраол проявили значительную анестезирующую активность, как и предполагалось изначально. [74]
Опровержение возражения: Аргумент предполагает, что все классы анестетиков должны работать одинаково на мембране. Вполне возможно, что один или два класса молекул могут работать через не мембранный опосредованный механизм. Например, было показано, что спирты включаются в липидную мембрану через ферментативную реакцию трансфосфатидилирования. [76] Метаболит этанола связывался с анестезирующим каналом и ингибировал его. И хотя этот механизм может противоречить единому унитарному механизму анестезии, он не исключает мембранно-опосредованный механизм.