Редокс ( / ˈrɛdɒk s / RED -oks , / ˈr iːdɒk s / REE -doks , восстановление–окисление [ 2] или окисление–восстановление [ 3] : 150 ) — тип химической реакции , в которой изменяются степени окисления реагентов . [ 4] Окисление — это потеря электронов или повышение степени окисления, тогда как восстановление — это приобретение электронов или понижение степени окисления. Процессы окисления и восстановления происходят одновременно в химической реакции .
Существует два класса окислительно-восстановительных реакций:
«Redox» — это словосочетание слов «REDuction» и «OXidation». Термин «redox» впервые был использован в 1928 году. [6]
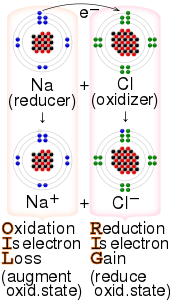
Окисление — это процесс, в котором вещество теряет электроны. Восстановление — это процесс, в котором вещество приобретает электроны.
Процессы окисления и восстановления происходят одновременно и не могут происходить независимо. [5] В окислительно-восстановительных процессах восстановитель передает электроны окислителю. Таким образом, в реакции восстановитель или восстановитель теряет электроны и окисляется, а окислитель или окислитель получает электроны и восстанавливается. Пара окислителя и восстановителя, которая участвует в конкретной реакции, называется окислительно-восстановительной парой. Окислительно-восстановительная пара — это восстанавливающий вид и его соответствующая окислительная форма, [7] например, Fe2+/ Фе3+Окисление и восстановление в отдельности называются полуреакцией, поскольку две полуреакции всегда происходят вместе, образуя целую реакцию. [5]
В электрохимических реакциях процессы окисления и восстановления происходят одновременно, но разделены в пространстве.
Первоначально окисление подразумевало реакцию с кислородом с образованием оксида. Позднее этот термин был расширен, чтобы охватить вещества , которые осуществляют химические реакции, подобные реакциям кислорода. В конечном итоге значение было обобщено, чтобы включить все процессы, связанные с потерей электронов или повышением степени окисления химического вещества. [8] : A49 Вещества, которые обладают способностью окислять другие вещества (заставлять их терять электроны), называются окислительными или окисляющими и известны как окислители , окислители или окислители. Окислитель удаляет электроны из другого вещества и, таким образом, сам восстанавливается. [8] : A50 Поскольку он «принимает» электроны, окислитель также называется акцептором электронов . Окислители обычно являются химическими веществами с элементами в высоких степенях окисления [3] : 159 (например, N2О4, МnО−
4, CrO3, Кр
2О2−
7, ОсО4), или же высоко электроотрицательные элементы (например, O 2 , F 2 , Cl 2 , Br 2 , I 2 ), которые могут получать дополнительные электроны, окисляя другое вещество. [3] : 909
Окислители — это окислители, но этот термин в основном зарезервирован для источников кислорода, особенно в контексте взрывов. Азотная кислота — сильный окислитель. [9]

Вещества, которые обладают способностью восстанавливать другие вещества (заставлять их получать электроны), называются восстанавливающими или восстанавливающими и известны как восстановители , восстановители или восстановители. Восстановитель передает электроны другому веществу и, таким образом, сам окисляется. [3] : 159 Поскольку он отдает электроны, восстановитель также называется донором электронов . Доноры электронов также могут образовывать комплексы переноса заряда с акцепторами электронов. Слово восстановление первоначально относилось к потере веса при нагревании металлической руды, такой как оксид металла, для извлечения металла. Другими словами, руда была «восстановлена» до металла. [10] Антуан Лавуазье продемонстрировал, что эта потеря веса была вызвана потерей кислорода в виде газа. Позже ученые поняли, что атом металла получает электроны в этом процессе. Затем значение восстановления стало обобщенным и включило все процессы, связанные с получением электронов. [10] Восстановительный эквивалент относится к химическим видам , которые передают эквивалент одного электрона в окислительно-восстановительных реакциях. Этот термин распространен в биохимии . [11] Восстановительным эквивалентом может быть электрон или атом водорода в виде гидрид-иона . [12]
Восстановители в химии очень разнообразны. Электроположительные элементарные металлы , такие как литий , натрий , магний , железо , цинк и алюминий , являются хорошими восстановителями. Эти металлы сравнительно легко отдают электроны. [13]
Реагенты переноса гидрида, такие как NaBH 4 и LiAlH 4 , восстанавливают путем переноса атома: они переносят эквивалент гидрида или H − . Эти реагенты широко используются при восстановлении карбонильных соединений до спиртов . [14] [15] Схожий метод восстановления включает использование газообразного водорода (H 2 ) в качестве источника атомов H. [3] : 288
Электрохимик Джон Бокрис предложил термины электронизация и деэлектронизация для описания процессов восстановления и окисления, соответственно, когда они происходят на электродах . [16] Эти слова аналогичны протонизации и депротонизации . [17] Они не получили широкого распространения среди химиков во всем мире, [ необходима ссылка ], хотя ИЮПАК признал термины электронизация [18] и деэлектронизация. [19]
Окислительно-восстановительные реакции могут происходить медленно, как при образовании ржавчины , или быстро, как в случае сжигания топлива . Реакции переноса электронов, как правило, быстрые, происходящие в течение времени смешивания. [20]
Механизмы реакций переноса атомов весьма разнообразны, поскольку могут переноситься многие виды атомов. Такие реакции также могут быть довольно сложными, включающими много этапов. Механизмы реакций переноса электронов происходят двумя различными путями: перенос электронов во внутренней сфере [21] и перенос электронов во внешней сфере . [22]
Анализ энергий связи и энергий ионизации в воде позволяет рассчитать термодинамические аспекты окислительно-восстановительных реакций. [23]
Каждая полуреакция имеет стандартный электродный потенциал ( Eо
ячейка), что равно разности потенциалов или напряжению в равновесии при стандартных условиях электрохимической ячейки , в которой катодной реакцией является рассматриваемая полуреакция , а анодом является стандартный водородный электрод , где водород окисляется: [24]
Электродный потенциал каждой полуреакции также известен как ее восстановительный потенциал ( Eо
красный), или потенциал, когда полуреакция происходит на катоде. Восстановительный потенциал является мерой тенденции окислителя к восстановлению. Его значение равно нулю для H + + e − → 1 ⁄ 2 H 2 по определению, положительно для окислителей сильнее H + (например, +2,866 В для F 2 ) и отрицательно для окислителей слабее H + (например, −0,763 В для Zn 2+ ). [8] : 873
Для окислительно-восстановительной реакции, происходящей в клетке, разность потенциалов равна:
Однако потенциал реакции на аноде иногда выражают как окислительный потенциал :
Окислительный потенциал является мерой тенденции восстановителя к окислению, но не представляет собой физический потенциал на электроде. При таком обозначении уравнение напряжения ячейки записывается со знаком плюс

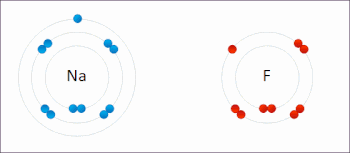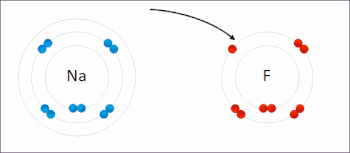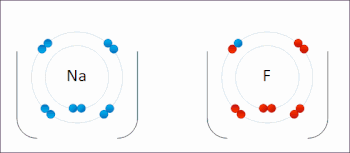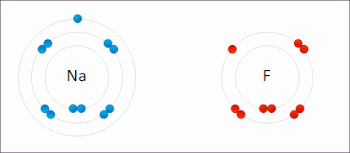
В реакции между водородом и фтором водород окисляется, а фтор восстанавливается:
Эта спонтанная реакция выделяет 542 кДж на 2 г водорода, поскольку связь HF намного сильнее связи FF. Эту реакцию можно проанализировать как две полуреакции . Реакция окисления преобразует водород в протоны :
Реакция восстановления преобразует фтор во фторид-анион:
Полуреакции объединяются таким образом, что электроны взаимно уничтожаются:
Протоны и фторид объединяются, образуя фтористый водород в неокислительно-восстановительной реакции:
Общая реакция:

В этом типе реакции атом металла в соединении или растворе заменяется атомом другого металла. Например, медь осаждается, когда металлический цинк помещается в раствор сульфата меди(II) :
В приведенной выше реакции металлический цинк вытесняет ион меди(II) из раствора сульфата меди, тем самым высвобождая свободную металлическую медь. Реакция протекает спонтанно и выделяет 213 кДж на 65 г цинка.
Ионное уравнение этой реакции:
В результате двух полуреакций видно, что цинк окисляется:
И медь восстанавливается:


Реакция диспропорционирования — это реакция, в которой одно и то же вещество одновременно окисляется и восстанавливается. Например, ион тиосульфата с серой в степени окисления +2 может реагировать в присутствии кислоты с образованием элементарной серы (степень окисления 0) и диоксида серы (степень окисления +4).
Таким образом, один атом серы восстанавливается от +2 до 0, а другой окисляется от +2 до +4. [8] : 176
Катодная защита — это метод, используемый для контроля коррозии металлической поверхности, делая ее катодом электрохимической ячейки . Простой метод защиты соединяет защищенный металл с более легко корродирующим « жертвенным анодом », который действует как анод . Затем корродирует жертвенный металл вместо защищенного металла. Распространенное применение катодной защиты — оцинкованная сталь, в которой жертвенное цинковое покрытие на стальных деталях защищает их от ржавчины. [ требуется цитата ]
Окисление используется в самых разных отраслях промышленности, например, при производстве чистящих средств и окислении аммиака для получения азотной кислоты . [ необходима ссылка ]
Окислительно-восстановительные реакции являются основой электрохимических ячеек, которые могут генерировать электрическую энергию или поддерживать электросинтез . Металлические руды часто содержат металлы в окисленном состоянии, такие как оксиды или сульфиды, из которых чистые металлы извлекаются путем плавки при высоких температурах в присутствии восстановителя. Процесс гальванопокрытия использует окислительно-восстановительные реакции для покрытия объектов тонким слоем материала, как в хромированных автомобильных деталях, посеребренных столовых приборах , гальванизации и позолоченных ювелирных изделиях . [ необходима цитата ]

Многие важные биологические процессы включают окислительно-восстановительные реакции. Перед началом некоторых из этих процессов железо должно быть усвоено из окружающей среды. [25]
Клеточное дыхание , например, представляет собой окисление глюкозы (C 6 H 12 O 6 ) до CO 2 и восстановление кислорода до воды . Суммарное уравнение для клеточного дыхания:
Процесс клеточного дыхания также сильно зависит от восстановления NAD + до NADH и обратной реакции (окисление NADH до NAD + ). Фотосинтез и клеточное дыхание являются взаимодополняющими, но фотосинтез не является обратной реакцией окислительно-восстановительного процесса в клеточном дыхании:
Биологическая энергия часто хранится и высвобождается с помощью окислительно-восстановительных реакций. Фотосинтез включает восстановление углекислого газа до сахаров и окисление воды до молекулярного кислорода. Обратная реакция, дыхание, окисляет сахара до углекислого газа и воды. В качестве промежуточных этапов восстановленные углеродные соединения используются для восстановления никотинамидадениндинуклеотида (НАД + ) до НАДН, который затем способствует созданию протонного градиента , который управляет синтезом аденозинтрифосфата (АТФ) и поддерживается восстановлением кислорода. В клетках животных митохондрии выполняют схожие функции.
Свободнорадикальные реакции — это окислительно-восстановительные реакции, которые происходят как часть гомеостаза и убивают микроорганизмы . В этих реакциях электрон отрывается от молекулы, а затем почти мгновенно присоединяется снова. Свободные радикалы являются частью окислительно-восстановительных молекул и могут стать вредными для организма человека, если они не присоединяются снова к окислительно-восстановительной молекуле или антиоксиданту .
Термин окислительно-восстановительное состояние часто используется для описания баланса GSH/GSSG , NAD + /NADH и NADP + /NADPH в биологической системе, такой как клетка или орган . Окислительно-восстановительное состояние отражается в балансе нескольких наборов метаболитов (например, лактата и пирувата , бета-гидроксибутирата и ацетоацетата ), взаимопревращение которых зависит от этих соотношений. Окислительно-восстановительные механизмы также контролируют некоторые клеточные процессы. Окислительно-восстановительные белки и их гены должны быть расположены совместно для окислительно-восстановительной регуляции в соответствии с гипотезой CoRR для функции ДНК в митохондриях и хлоропластах .
Широкий спектр ароматических соединений ферментативно восстанавливается с образованием свободных радикалов , которые содержат на один электрон больше, чем их исходные соединения. В общем, донором электронов является любой из широкого спектра флавоферментов и их коферментов . После образования эти анионные свободные радикалы восстанавливают молекулярный кислород до супероксида и регенерируют неизмененное исходное соединение. Чистая реакция представляет собой окисление коферментов флавофермента и восстановление молекулярного кислорода с образованием супероксида. Это каталитическое поведение было описано как бесполезный цикл или окислительно-восстановительный цикл.

Минералы, как правило, являются окисленными производными металлов. Железо добывается в виде магнетита (Fe 3 O 4 ). Титан добывается в виде диоксида, обычно в форме рутила (TiO 2 ). Эти оксиды должны быть восстановлены для получения соответствующих металлов, что часто достигается путем нагревания этих оксидов с углеродом или оксидом углерода в качестве восстановителей. Доменные печи представляют собой реакторы, в которых оксиды железа и кокс (форма углерода) объединяются для получения расплавленного железа. Основная химическая реакция, в результате которой получается расплавленное железо, следующая: [26]
Реакции переноса электронов играют центральную роль во множестве процессов и свойств почв, а окислительно-восстановительный потенциал , количественно определяемый как Eh (потенциал платинового электрода ( напряжение ) относительно стандартного водородного электрода) или pe (аналогично pH как -log активности электронов), является основной переменной, наряду с pH, которая контролирует и регулируется химическими реакциями и биологическими процессами. Ранние теоретические исследования с приложениями к затопленным почвам и производству риса-сырца были основополагающими для последующей работы по термодинамическим аспектам окислительно-восстановительного потенциала и роста корней растений в почвах. [27] Более поздняя работа основывалась на этой основе и расширяла ее для понимания окислительно-восстановительных реакций, связанных с изменениями состояния окисления тяжелых металлов, педогенезом и морфологией, деградацией и образованием органических соединений, химией свободных радикалов , разграничением водно-болотных угодий , рекультивацией почв и различными методологическими подходами для характеристики окислительно-восстановительного статуса почв. [28] [29]
Ключевые термины, используемые в окислительно-восстановительной реакции, могут сбивать с толку. [30] [31] Например, реагент, который окисляется, теряет электроны; однако, этот реагент называется восстановителем. Аналогично, реагент, который восстанавливается, получает электроны и называется окислителем. [32] Эти мнемоники обычно используются студентами для запоминания терминологии: [33]
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка )Описанные гомогенные реакции переноса протона аналогичны гомогенным реакциям переноса электрона в том, что общую реакцию переноса электрона можно разложить на одну реакцию электронирования и одну реакцию деэлектронирования.