Хлорид тантала(V) , также известный как пентахлорид тантала , представляет собой неорганическое соединение с формулой TaCl5 . Он имеет форму белого порошка и обычно используется в качестве исходного материала в химии тантала. Он легко гидролизуется с образованием оксихлорида тантала(V) (TaOCl3 ) и в конечном итоге пентаоксида тантала ( Ta2O5 ); для этого его необходимо синтезировать и обрабатывать в безводных условиях с использованием безвоздушных технологий .
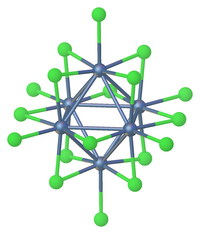
TaCl 5 кристаллизуется в моноклинной пространственной группе C 2/ m . [2] Десять атомов хлора определяют пару октаэдров, которые имеют общее ребро. Атомы тантала занимают центры октаэдров и соединены двумя мостиковыми лигандами хлора . Димерная структура сохраняется в некомплексообразующих растворителях и в значительной степени в расплавленном состоянии. Однако в парообразном состоянии TaCl 5 является мономерным . Этот мономер принимает тригональную бипирамидальную структуру , как и у PCl 5 . [3]
Растворимость пентахлорида тантала несколько увеличивается для следующего ряда ароматических углеводородов :
Это отражается в углублении цвета растворов от бледно-желтого до оранжевого. Пентахлорид тантала менее растворим в циклогексане и четыреххлористом углероде, чем в ароматических углеводородах. Такие растворы пентахлорида тантала также известны как плохие проводники электричества, что указывает на слабую ионизацию. TaCl 5 очищается путем сублимации с получением белых игл.
Пентахлорид тантала может быть получен путем реакции порошкообразного металлического тантала с газообразным хлором при температуре от 170 до 250 °C. Эту реакцию можно также провести с использованием HCl при 400 °C. [4]
Его также можно получить путем реакции между пентаоксидом тантала и тионилхлоридом при температуре 240 °C.
Пентахлорид тантала имеется в продаже, однако образцы могут быть загрязнены оксихлоридом тантала(V) (TaOCl3 ) , образующимся в результате гидролиза.
TaCl 5 является электрофильным и ведет себя как катализатор Фриделя-Крафтса , подобно AlCl 3 . Он образует аддукты с различными основаниями Льюиса . [5]
TaCl 5 образует устойчивые комплексы с эфирами :
TaCl 5 также реагирует с пентахлоридом фосфора и оксихлоридом фосфора , первый выступает в качестве донора хлорида, а второй служит лигандом, связываясь через кислород:
Пентахлорид тантала реагирует с третичными аминами с образованием кристаллических аддуктов.
Пентахлорид тантала реагирует при комнатной температуре с избытком оксида трифенилфосфина с образованием оксихлоридов:
Предполагаемое первоначальное образование аддуктов между TaCl 5 и гидроксильными соединениями, такими как спирты , фенолы и карбоновые кислоты, немедленно сопровождается элиминированием хлористого водорода и образованием связей Ta–O:
В присутствии аммиака в качестве акцептора HCl все пять хлоридных лигандов замещаются с образованием Ta(OEt) 5. Аналогично TaCl 5 реагирует с метоксидом лития в безводном метаноле с образованием соответствующих метоксипроизводных:
Аммиак вытеснит большую часть хлоридных лигандов из TaCl 5 , образуя кластер. Хлорид вытесняется медленнее первичными или вторичными аминами , но замена всех пяти хлоридных центров амидными группами была достигнута с использованием диалкиламидов лития, как показано на примере синтеза пентакис(диметиламидо)тантала :
Со спиртами пентахлорид реагирует с образованием алкоксидов . Как показано для получения этоксида тантала(V) , такие реакции часто проводятся в присутствии основания:
Пентахлорид тантала восстанавливается азотистыми гетероциклами, такими как пиридин .
Восстановление хлорида тантала(V) дает анионные и нейтральные кластеры, включая [Ta 6 Cl 18 ] 4− и [Ta 6 Cl 14 ](H 2 O) 4 . [6]