
Атомная теория — это научная теория, согласно которой материя состоит из частиц, называемых атомами . Определение слова «атом» менялось с годами в ответ на научные открытия. Первоначально оно относилось к гипотетической концепции существования некой фундаментальной частицы материи, слишком маленькой, чтобы ее можно было увидеть невооруженным глазом, и которую нельзя было разделить. Затем определение было уточнено до основных частиц химических элементов, когда химики заметили, что элементы, по-видимому, объединяются друг с другом в соотношениях небольших целых чисел. Затем физики обнаружили, что эти частицы имеют собственную внутреннюю структуру и поэтому, возможно, не заслуживают называться «атомами», но переименование атомов к тому моменту было бы непрактичным.
Атомная теория является одним из важнейших научных достижений в истории, решающим для всех физических наук. В начале Фейнмановских лекций по физике физик и лауреат Нобелевской премии Ричард Фейнман предлагает атомную гипотезу как единственную наиболее плодовитую научную концепцию. [1]
Основная идея о том, что материя состоит из крошечных неделимых частиц, является старой идеей, которая появилась во многих древних культурах. Слово атом происходит от древнегреческого слова atomos , [a], что означает «неразрезаемый». Эта древняя идея основывалась на философских рассуждениях, а не на научных рассуждениях. Современная атомная теория не основана на этих старых концепциях. [2] [3] В начале 19 века ученый Джон Дальтон заметил, что химические вещества, по-видимому, объединяются друг с другом посредством дискретных и постоянных единиц веса, и он решил использовать слово атом для обозначения этих единиц. [4]
Ближе к концу XVIII века в химии появилось несколько важных разработок, не ссылающихся на понятие атомной теории. Первым было переопределение элемента Антуаном Лавуазье как вещества, которое ученые не могли разложить на более простые вещества экспериментальным путем. Это положило конец древней идее о том, что элементами материи являются огонь, земля, воздух и вода, которая не имела экспериментального подтверждения. Лавуазье показал, что воду можно разложить на водород и кислород , которые, в свою очередь, он не мог разложить на что-либо более простое, тем самым доказав, что это элементы. [5] Лавуазье также определил закон сохранения массы , который гласит, что в химической реакции вещество не появляется и не исчезает в воздухе; общая масса остается той же, даже если вовлеченные вещества были преобразованы. Наконец, существовал закон определенных пропорций , установленный французским химиком Жозефом Прустом в 1797 году, который гласит, что если соединение разложить на составляющие его химические элементы, то массы этих компонентов всегда будут иметь те же самые пропорции по весу, независимо от количества или источника исходного соединения. Это определение отличало соединения от смесей. [6]

Джон Дальтон изучал данные, собранные им самим и другими учеными. Он заметил закономерность, которая позже стала известна как закон кратных пропорций : в соединениях, содержащих два определенных элемента, количество элемента A на меру элемента B будет отличаться в этих соединениях на соотношения малых целых чисел. Это предполагало, что каждый элемент соединяется с другими элементами в кратных базовому количеству.
В 1804 году Дальтон объяснил свою атомную теорию своему другу и коллеге-химику Томасу Томсону , который опубликовал объяснение теории Дальтона в своей книге «Система химии» в 1807 году. По словам Томсона, идея Дальтона впервые пришла ему в голову во время экспериментов с «олефиантным газом» ( этиленом ) и «карбюраторным водородным газом» ( метаном ). Дальтон обнаружил, что «карбюраторный водородный газ» содержит в два раза больше водорода на единицу углерода, чем «олефиантный газ», и пришел к выводу, что молекула «олефиантного газа» состоит из одного атома углерода и одного атома водорода, а молекула «карбюраторного водородного газа» состоит из одного атома углерода и двух атомов водорода. [7] В действительности молекула этилена имеет два атома углерода и четыре атома водорода (C 2 H 4 ), а молекула метана имеет один атом углерода и четыре атома водорода (CH 4 ). В этом конкретном случае Дальтон ошибся в формулах этих соединений, и это была не единственная его ошибка. Но в других случаях он правильно понял их формулы. Следующие примеры взяты из собственных книг Дальтона «Новая система химической философии» (в двух томах, 1808 и 1817):
Пример 1 — оксиды олова: Дальтон выделил два типа оксида олова . Один из них — серый порошок, который Дальтон назвал «закисью олова», который состоит из 88,1% олова и 11,9% кислорода. Другой — белый порошок, который Дальтон назвал «дойкоксидом олова», который состоит из 78,7% олова и 21,3% кислорода. Корректируя эти цифры, получаем, что в сером порошке содержится около 13,5 г кислорода на каждые 100 г олова, а в белом порошке — около 27 г кислорода на каждые 100 г олова. 13,5 и 27 образуют соотношение 1:2. Эти соединения сегодня известны как оксид олова (II) (SnO) и оксид олова (IV) (SnO 2 ). В терминологии Дальтона «протоксид» — это молекула, содержащая один атом кислорода, а молекула «дейтоксид» — два. [8] [9] Современными эквивалентами его терминов были бы «монооксид» и «диоксид » , но они не используются для оксидов олова, поскольку они на самом деле являются кристаллами; они не существуют в молекулярной форме.
Пример 2 — оксиды железа: Дальтон выделил два оксида железа. Существует один тип оксида железа, представляющий собой черный порошок, который Дальтон назвал «закисью железа», которая состоит из 78,1% железа и 21,9% кислорода. Другой оксид железа — красный порошок, который Дальтон назвал «промежуточным или красным оксидом железа», который состоит из 70,4% железа и 29,6% кислорода. Корректируя эти цифры, в черном порошке содержится около 28 г кислорода на каждые 100 г железа, а в красном порошке содержится около 42 г кислорода на каждые 100 г железа. 28 и 42 образуют соотношение 2:3. Эти соединения — оксид железа (II) и оксид железа (III) , их формулы — Fe 2 O 2 и Fe 2 O 3 соответственно (формула оксида железа (II) обычно записывается как FeO, но здесь она записывается как Fe 2 O 2, чтобы противопоставить ее другому оксиду). Дальтон описал «промежуточный оксид» как «2 атома закиси и 1 атом кислорода», что в сумме дает два атома железа и три атома кислорода. Это в среднем составляет полтора атома кислорода на каждый атом железа, помещая его посередине между «закисью» и «дейтоксидом». [10] [11]
Пример 3 — оксиды азота: Дальтон знал о трех оксидах азота: «закись азота», «азотистый газ» и «азотная кислота». [12] Эти соединения известны сегодня как закись азота , оксид азота и диоксид азота соответственно. «Закись азота» состоит из 63,3% азота и 36,7% кислорода, что означает, что на каждые 140 г азота приходится 80 г кислорода. «Закись азота» состоит из 44,05% азота и 55,95% кислорода, что означает, что на каждые 140 г азота приходится 160 г кислорода. «Азотная кислота» состоит из 29,5% азота и 70,5% кислорода, что означает, что на каждые 140 г азота приходится 320 г кислорода. 80 г, 160 г и 320 г образуют соотношение 1:2:4. Формулы этих соединений: N 2 O, NO и NO 2 . [13] [14]
Дальтон определил атом как «конечную частицу» химического вещества, и он использовал термин «составной атом» для обозначения «конечных частиц», которые содержат два или более элементов. Это не соответствует современному определению, в котором атом является основной частицей химического элемента, а молекула — агломерацией атомов. Термин «составной атом» сбивал с толку некоторых современников Дальтона, поскольку слово «атом» подразумевает неделимость, но он ответил, что если «атом» диоксида углерода разделить, он перестает быть диоксидом углерода. «Атом» диоксида углерода неделим в том смысле, что его нельзя разделить на более мелкие частицы диоксида углерода. [4] [15]
Дальтон сделал следующие предположения о том, как «элементарные атомы» объединяются, образуя «составные атомы» (то, что мы сегодня называем молекулами ). Когда два элемента могут образовывать только одно соединение, он предполагал, что это один атом каждого, что он назвал «бинарным соединением». Если два элемента могут образовывать два соединения, первое соединение является бинарным соединением, а второе — «тройным соединением», состоящим из одного атома первого элемента и двух второго. Если два элемента могут образовывать три соединения между собой, то третье соединение является «четвертичным» соединением, содержащим один атом первого элемента и три второго. [16] Дальтон считал, что вода является «бинарным соединением», т. е. одним атомом водорода и одним атомом кислорода. Дальтон не знал, что в своем естественном газообразном состоянии элементарные частицы кислорода, азота и водорода существуют парами (O 2 , N 2 и H 2 ). Он также не знал о валентностях. Эти свойства атомов были открыты позже, в 19 веке.
Поскольку атомы были слишком малы, чтобы их можно было напрямую взвесить методами 19-го века, Дальтон вместо этого выразил вес мириадов атомов как кратные весу атома водорода, который, как знал Дальтон, был самым легким элементом. По его измерениям, 7 граммов кислорода соединятся с 1 граммом водорода, чтобы получить 8 граммов воды без остатка, и предположив, что молекула воды состоит из одного атома кислорода и одного атома водорода, он пришел к выводу, что атомный вес кислорода равен 7. На самом деле он равен 16. Помимо грубости измерительных инструментов начала 19-го века, главной причиной этой ошибки было то, что Дальтон не знал, что молекула воды на самом деле имеет два атома водорода, а не один. Если бы он знал, он бы удвоил свою оценку до более точной 14. Эта ошибка была исправлена в 1811 году Амедео Авогадро . Авогадро предположил, что равные объемы любых двух газов при одинаковой температуре и давлении содержат равное количество молекул (другими словами, масса частиц газа не влияет на объем, который он занимает). [17] Гипотеза Авогадро, теперь обычно называемая законом Авогадро , предоставила метод выведения относительного веса молекул газообразных элементов, поскольку, если гипотеза верна, относительная плотность газа напрямую указывает на относительный вес частиц, из которых состоят газы. Такой способ мышления привел непосредственно ко второй гипотезе: частицы некоторых элементарных газов были парами атомов, и при химической реакции эти молекулы часто разделялись надвое. Например, тот факт, что два литра водорода будут реагировать всего с одним литром кислорода, чтобы произвести два литра водяного пара (при постоянном давлении и температуре), предполагал, что одна молекула кислорода разделяется надвое, чтобы образовать две молекулы воды. Формула воды - H2O , а не HO. Авогадро измерил атомный вес кислорода, который составил 15,074. [18]
Атомная теория Дальтона привлекла широкий интерес, но не все ее приняли поначалу. Закон кратных отношений, как было показано, не является универсальным законом, когда дело касается органических веществ, молекулы которых могут быть довольно большими. Например, в олеиновой кислоте на каждые 216 г углерода приходится 34 г водорода, а в метане на каждые 216 г углерода приходится 72 г водорода. 34 и 72 образуют соотношение 17:36, что не является соотношением малых целых чисел. Теперь мы знаем, что вещества на основе углерода могут иметь очень большие молекулы, большие, чем любые другие элементы. Формула олеиновой кислоты — C 18 H 34 O 2 , а метана — CH 4 . [19] Закон кратных отношений сам по себе не был полным доказательством, и атомная теория не была общепринятой до конца 19-го века.
Одной из проблем было отсутствие единой номенклатуры. Слово «атом» подразумевало неделимость, но Дальтон определил атом как конечную частицу любого химического вещества , а не только элементы или даже материю как таковую. Это означало, что «составные атомы», такие как углекислый газ, могут быть разделены, в отличие от «элементарных атомов». Дальтон не любил слово «молекула», считая его «уменьшительным». [4] [20] Амедео Авогадро делал наоборот: он использовал исключительно слово «молекула» в своих трудах, избегая слова «атом», вместо этого используя термин «элементарная молекула». [21] Йенс Якоб Берцелиус использовал термин «органические атомы» для обозначения частиц, содержащих три или более элементов, потому что он считал, что это существует только в органических соединениях. Жан-Батист Дюма использовал термины «физические атомы» и «химические атомы»; «Физический атом» — это частица, которую нельзя разделить физическими средствами, такими как температура и давление, а «химический атом» — это частица, которую нельзя разделить химическими реакциями. [22]
Современные определения атома и молекулы — атом как основная частица элемента, а молекула как скопление атомов — были установлены во второй половине 19 века. Ключевым событием стал Карлсруэский конгресс в Германии в 1860 году. Как первый международный конгресс химиков, его целью было установление некоторых стандартов в сообществе. Главным сторонником современного различия между атомами и молекулами был Станислао Канниццаро .
Различные количества определенного элемента, участвующего в построении различных молекул, являются целыми кратными фундаментальной величины, которая всегда проявляет себя как неделимая сущность и которую следует по праву называть атомом.
- Станислао Канниццаро , 1860 г. [23]
Канниццаро критиковал химиков прошлого, таких как Берцелиус, за то, что они не принимали, что частицы некоторых газообразных элементов на самом деле являются парами атомов, что приводило к ошибкам в их формулировке некоторых соединений. Берцелиус считал, что частицы газообразного водорода и газообразного хлора являются отдельными атомами. Но он заметил, что когда один литр водорода реагирует с одним литром хлора, они образуют два литра хлористого водорода вместо одного. Берцелиус решил, что закон Авогадро не применим к соединениям. Канниццаро проповедовал, что если бы ученые просто признали существование одноэлементных молекул, такие расхождения в их выводах были бы легко разрешены. Но у Берцелиуса даже не было слова для этого. Берцелиус использовал термин «элементарный атом» для газовой частицы, которая содержала только один элемент, и «составной атом» для частиц, которые содержали два или более элементов, но не было ничего, что отличало бы H 2 от H , поскольку Берцелиус не верил в H 2 . Поэтому Канниццаро призвал к переопределению, чтобы ученые могли понять, что молекула водорода может расщепляться на два атома в ходе химической реакции. [24]
Второе возражение против атомной теории было философским. Ученые 19 века не имели возможности непосредственно наблюдать атомы. Они делали вывод о существовании атомов посредством косвенных наблюдений, таких как закон кратных отношений Дальтона. Некоторые ученые, особенно те, кто приписывал себя школе позитивизма , утверждали, что ученые не должны пытаться вывести более глубокую реальность вселенной, а только систематизировать те закономерности, которые они могли наблюдать напрямую. Антиатомисты утверждали, что, хотя атомы могут быть полезной абстракцией для предсказания того, как реагируют элементы, они не отражают конкретную реальность.
Таких ученых иногда называли «эквивалентистами», потому что они предпочитали теорию эквивалентных весов , которая является обобщением закона Пруста о пропорциях. Например, 1 грамм водорода соединится с 8 граммами кислорода, образуя 9 граммов воды, поэтому «эквивалентный вес» кислорода составляет 8 граммов. Эта позиция была в конечном итоге отменена двумя важными достижениями, которые произошли позже в 19 веке: разработкой периодической таблицы и открытием того, что молекулы имеют внутреннюю архитектуру, которая определяет их свойства. [25]
Ученые обнаружили, что некоторые вещества имеют точно такой же химический состав, но разные свойства. Например, в 1827 году Фридрих Вёлер обнаружил, что фульминат серебра и цианат серебра оба состоят из 107 частей серебра, 12 частей углерода, 14 частей азота и 16 частей кислорода (теперь мы знаем их формулы как AgCNO). В 1830 году Йенс Якоб Берцелиус ввел термин изомерия для описания этого явления. В 1860 году Луи Пастер выдвинул гипотезу, что молекулы изомеров могут иметь одинаковый набор атомов, но в разных расположениях. [26]
В 1874 году Якобус Хенрикус ван 'т Хофф предположил, что атом углерода связывается с другими атомами в тетраэдрическом расположении. Работая на основе этого, он объяснил структуры органических молекул таким образом, что мог предсказать, сколько изомеров может иметь соединение. Рассмотрим, например, пентан (C 5 H 12 ). В способе моделирования молекул ван 'т Хоффа существует три возможных конфигурации для пентана, и ученые действительно открыли три и только три изомера пентана. [27] [28]
Изомерию нельзя было полностью объяснить с помощью теорий, альтернативных атомной теории, таких как радикальная теория и теория типов. [29] [30]
Дмитрий Менделеев заметил, что когда он располагал элементы в ряд в соответствии с их атомным весом, в них наблюдалась определенная периодичность. [31] : 117 Например, второй элемент, литий , имел схожие свойства с девятым элементом, натрием , и шестнадцатым элементом, калием — период из семи. Аналогично, бериллий , магний и кальций были схожи и все находились на расстоянии семи мест друг от друга в таблице Менделеева. Используя эти закономерности, Менделеев предсказал существование и свойства новых элементов, которые позже были обнаружены в природе: скандий , галлий и германий . [31] : 118 Более того, периодическая таблица могла предсказать, сколько атомов других элементов может связывать атом — например, германий и углерод находятся в одной группе в таблице , и их атомы оба соединяются с двумя атомами кислорода каждый (GeO 2 и CO 2 ). Менделеев обнаружил, что эти закономерности подтверждают атомную теорию, поскольку она показывала, что элементы можно классифицировать по их атомному весу. Вставка нового элемента в середину периода нарушила бы параллель между этим периодом и следующим, а также нарушила бы закон Дальтона о кратных пропорциях. [32]
В современной периодической таблице периодичность элементов, упомянутых выше, равна восьми, а не семи, поскольку благородные газы не были известны во времена, когда Менделеев составлял свою таблицу. Ряды также теперь имеют разную длину (2, 8, 18 и 32), что соответствует квантовой теории.
Элементы в периодической таблице обычно располагаются в порядке увеличения атомного веса. Однако в ряде мест химики решили поменять местами некоторые соседние элементы, чтобы они оказались в группе с другими элементами со схожими свойствами. Например, теллур расположен перед йодом, хотя теллур тяжелее (127,6 против 126,9), так что йод может находиться в том же столбце, что и другие галогены . В 1913 году Генри Мозли обнаружил, что атомы каждого элемента при возбуждении испускают рентгеновские лучи с частотой, пропорциональной положению элемента в скорректированной периодической таблице, что подтвердило эти корректировки.
Для того чтобы ввести закон идеального газа и статистические формы физики, необходимо было постулировать существование атомов. В 1738 году швейцарский физик и математик Даниил Бернулли постулировал, что давление газов и тепло были вызваны лежащим в основе движением молекул.
В 1860 году Джеймс Клерк Максвелл , ярый сторонник атомизма, первым применил статистическую механику в физике. [33] Людвиг Больцман и Рудольф Клаузиус расширили его работу по газам и законам термодинамики, особенно второму закону, касающемуся энтропии. В 1870-х годах Джозайя Уиллард Гиббс расширил законы энтропии и термодинамики и ввел термин «статистическая механика».
В начале 20-го века Альберт Эйнштейн независимо переосмыслил законы Гиббса, поскольку они были напечатаны только в малоизвестном американском журнале. [34] Позже Эйнштейн заметил, что если бы он знал о работе Гиббса, он бы «вообще не опубликовал эти статьи, а ограничился бы рассмотрением нескольких моментов [которые были отличны]». [35] Вся статистическая механика и законы тепла, газа и энтропии принимали существование атомов как необходимый постулат.
В 1827 году британский ботаник Роберт Браун заметил, что частицы пыли внутри зерен пыльцы, плавающих в воде, постоянно колеблются без видимой причины. В 1905 году Эйнштейн предположил, что это броуновское движение было вызвано молекулами воды, непрерывно толкающими зерна, и разработал математическую модель для его описания. Эта модель была экспериментально подтверждена в 1908 году французским физиком Жаном Перреном , который использовал уравнения Эйнштейна для измерения размера атомов. [36]
Считалось, что атомы являются наименьшей возможной частицей материи до 1897 года, когда Дж. Дж. Томсон в ходе своей работы по катодным лучам открыл электрон .
Трубка Крукса представляет собой герметичный стеклянный контейнер, в котором два электрода разделены вакуумом. Когда напряжение подается на электроды, генерируются катодные лучи, создавая светящееся пятно там, где они ударяются о стекло на противоположном конце трубки. Экспериментируя, Томсон обнаружил, что лучи могут отклоняться электрическими и магнитными полями , что означало, что эти лучи не являются формой света, а состоят из очень легких заряженных частиц, и их заряд отрицателен. Томсон назвал эти частицы «корпускулами». Он измерил их отношение массы к заряду, которое оказалось на несколько порядков меньше, чем у атома водорода, самого маленького атома. Это отношение было одинаковым независимо от того, из чего были сделаны электроды и какой был след газа в трубке. [39]
В отличие от этих корпускул, положительные ионы, созданные электролизом или рентгеновским излучением, имели соотношение массы к заряду, которое варьировалось в зависимости от материала электродов и типа газа в реакционной камере, что указывает на то, что они представляют собой разные виды частиц.
В 1898 году Томсон измерил заряд ионов, который составил примерно 6 × 10 -10 электростатических единиц (2 × 10 -19 Кулонов). [40] : 85 [41] В 1899 году он показал, что отрицательное электричество, создаваемое ультрафиолетовым светом, попадающим на металл (теперь известное как фотоэлектрический эффект ), имеет такое же отношение массы к заряду, как и катодные лучи; затем он применил свой предыдущий метод определения заряда ионов к отрицательным электрическим частицам, создаваемым ультрафиолетовым светом. [40] : 86 С помощью этой комбинации он показал, что масса электрона составляет 0,0014 массы ионов водорода. [42] Эти «корпускулы» были настолько легкими, но при этом несли в себе так много заряда, что Томсон пришел к выводу, что они должны быть основными частицами электричества, и по этой причине другие ученые решили, что эти «корпускулы» следует называть электронами, следуя предложению Джорджа Джонстона Стоуни 1894 года о наименовании основной единицы электрического заряда. [43]
В 1904 году Томсон опубликовал статью, описывающую новую модель атома. [44] Электроны находятся внутри атомов и переходят из одного атома в другой по цепочке под действием электрического тока. Когда электроны не текут, их отрицательный заряд логически должен быть уравновешен каким-то источником положительного заряда внутри атома, чтобы сделать атом электрически нейтральным. Не имея ни малейшего понятия об источнике этого положительного заряда, Томсон предположил, что положительный заряд находится повсюду в атоме, а атом имеет форму сферы — это была математически самая простая модель, соответствующая имеющимся доказательствам (или их отсутствию). [45] Баланс электростатических сил распределил бы электроны по этой сфере более или менее равномерно. Томсон далее объяснил, что ионы — это атомы, которые имеют избыток или недостаток электронов. [46]
Модель Томсона широко известна как модель сливового пудинга , основанная на идее, что электроны распределены по сфере положительного заряда с той же плотностью, что и изюм в сливовом пудинге . Ни Томсон, ни его коллеги никогда не использовали эту аналогию. Похоже, это было тщеславием популярных научных писателей. Аналогия предполагает, что положительная сфера похожа на твердое тело, но Томсон сравнил ее с жидкостью, поскольку он предположил, что электроны движутся в ней по схемам, управляемым электростатическими силами. [47] [48] Положительная электризация в модели Томсона была абстракцией, он не предлагал ничего конкретного, как частица. Модель Томсона была неполной, она не могла предсказать ни одно из известных свойств атома, таких как спектры испускания или валентности.
В 1906 году Роберт А. Милликен и Харви Флетчер провели эксперимент с каплей масла , в котором они измерили заряд электрона, который составил около -1,6 × 10 -19 , значение, которое теперь определяется как -1 e . Поскольку было известно, что ион водорода и электрон неделимы, а атом водорода нейтрален по заряду, отсюда следовало, что положительный заряд водорода равен этому значению, т. е. 1 e .
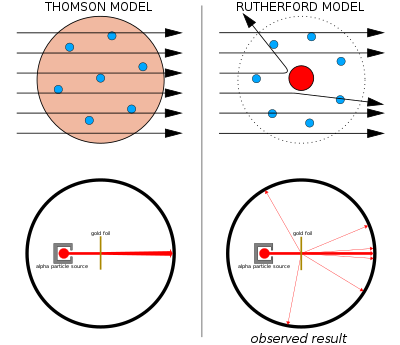
Модель «пудинга с изюмом» Томсона была вытеснена в 1911 году одним из его бывших студентов, Эрнестом Резерфордом , который обнаружил, что положительный заряд и большая часть массы атома сосредоточены в очень малой доле его объема, которую он предположил в самом центре.
Эрнест Резерфорд и его коллеги Ганс Гейгер и Эрнест Марсден усомнились в модели Томсона после того, как столкнулись с трудностями при попытке построить прибор для измерения отношения заряда к массе альфа-частиц (это положительно заряженные частицы, испускаемые некоторыми радиоактивными веществами, такими как радий ). Альфа-частицы рассеивались воздухом в камере обнаружения, что делало измерения ненадежными. Томсон столкнулся с похожей проблемой в своей работе над катодными лучами, которую он решил, создав почти идеальный вакуум в своих приборах. Резерфорд не думал, что столкнется с этой же проблемой, поскольку альфа-частицы намного тяжелее электронов. Согласно модели атома Томсона, положительный заряд в атоме недостаточно сконцентрирован, чтобы создать электрическое поле, достаточно сильное, чтобы отклонить альфа-частицу, а электроны настолько легкие, что они должны были бы легко отталкиваться в сторону гораздо более тяжелыми альфа-частицами. Однако рассеяние имело место, поэтому Резерфорд и его коллеги решили тщательно исследовать это рассеяние. [49]
Между 1908 и 1913 годами Резерфорд и его коллеги провели ряд экспериментов, в которых они бомбардировали тонкие металлические фольги пучком альфа-частиц. Они заметили, что альфа-частицы отклоняются на углы больше 90°. Согласно модели Томсона, все альфа-частицы должны были пройти с незначительным отклонением. Резерфорд пришел к выводу, что положительный заряд атома не распределен по всему объему атома, как считал Томсон, а сосредоточен в крошечном ядре в центре, и что ядро также имеет большую часть массы атома. Только такая интенсивная концентрация заряда, закрепленная его большой массой, могла создать электрическое поле, достаточно сильное, чтобы отклонить альфа-частицы, как это и наблюдалось. [49] Модель Резерфорда иногда называют «планетарной моделью». [50]
Планетарная модель атома имела два существенных недостатка. Первый заключается в том, что, в отличие от планет, вращающихся вокруг солнца, электроны являются заряженными частицами. Известно, что ускоряющийся электрический заряд излучает электромагнитные волны в соответствии с формулой Лармора в классическом электромагнетизме . Орбитальный заряд должен неуклонно терять энергию и двигаться по спирали к ядру, сталкиваясь с ним за малую долю секунды. Вторая проблема заключалась в том, что планетарная модель не могла объяснить сильно пиковые спектры излучения и поглощения атомов, которые наблюдались.

Квантовая теория произвела революцию в физике в начале 20-го века, когда Макс Планк и Альберт Эйнштейн постулировали, что световая энергия излучается или поглощается дискретными количествами, известными как кванты (сингулярный, квантовый ). Это привело к серии квантовых атомных моделей, таких как квантовая модель Артура Эриха Хааса в 1910 году и квантовая атомная модель Джона Уильяма Николсона 1912 года , которая квантовала угловой момент как h /2 π . [51] [52] В 1913 году Нильс Бор включил эту идею в свою модель атома Бора, в которой электрон мог вращаться вокруг ядра только по определенным круговым орбитам с фиксированным угловым моментом и энергией, причем его расстояние от ядра (т. е. их радиусы) было пропорционально его энергии. [53] Согласно этой модели электрон не мог по спирали входить в ядро, поскольку он не мог терять энергию непрерывно; вместо этого он мог совершать только мгновенные « квантовые скачки » между фиксированными уровнями энергии . [53] Когда это происходило, свет испускался или поглощался с частотой, пропорциональной изменению энергии (отсюда поглощение и испускание света в дискретных спектрах). [53]
Модель Бора не была идеальной. Она могла предсказать только спектральные линии водорода, а не многоэлектронных атомов. [54] Хуже того, она не могла даже учесть все особенности спектра водорода: по мере совершенствования спектрографической технологии было обнаружено, что приложение магнитного поля вызывало умножение спектральных линий таким образом, который модель Бора не могла объяснить. В 1916 году Арнольд Зоммерфельд добавил эллиптические орбиты к модели Бора, чтобы объяснить дополнительные линии излучения, но это сделало модель очень сложной в использовании, и она по-прежнему не могла объяснить более сложные атомы. [55] [56]
Экспериментируя с продуктами радиоактивного распада , в 1913 году радиохимик Фредерик Содди обнаружил, что, по-видимому, существует более одной разновидности некоторых элементов. [57] Термин «изотоп» был придуман Маргарет Тодд как подходящее название для этих разновидностей. [58]
В том же году Дж. Дж. Томсон провел эксперимент, в котором он направил поток ионов неона через магнитные и электрические поля, ударяя по фотографической пластине на другом конце. Он наблюдал два светящихся пятна на пластине, что предполагало две различные траектории отклонения. Томсон пришел к выводу, что это было связано с тем, что некоторые ионы неона имели разную массу. [59] Природа этой разной массы позже была объяснена открытием нейтронов в 1932 году: все атомы одного и того же элемента содержат одинаковое количество протонов, в то время как разные изотопы имеют разное количество нейтронов. [60]
Еще в 1815 году Уильям Праут заметил, что атомные веса известных элементов кратны атомному весу водорода, поэтому он выдвинул гипотезу, что все атомы представляют собой скопления водорода, частицы, которую он назвал «протил». Гипотеза Праута была поставлена под сомнение, когда было обнаружено, что некоторые элементы отклоняются от этой закономерности — например, атомы хлора в среднем весят 35,45 дальтон — но когда в 1913 году были открыты изотопы , наблюдение Праута снова привлекло внимание.
В 1898 году Дж. Дж. Томсон обнаружил, что положительный заряд иона водорода равен отрицательному заряду одного электрона. [61]
В статье от апреля 1911 года, посвященной его исследованиям по рассеянию альфа-частиц , Эрнест Резерфорд подсчитал, что заряд атомного ядра, выраженный как множитель ядерного заряда водорода ( qe ), составляет примерно половину атомного веса атома . [62]
В июне 1911 года голландский физик Антониус ван ден Брук заметил, что в периодической таблице каждый последующий химический элемент увеличивал атомный вес в среднем на 2, что, в свою очередь, предполагало, что заряд ядра каждого последующего элемента увеличивался на 1 q e . [63]
В 1913 году Генри Мозли измерил рентгеновское излучение всех элементов периодической таблицы и обнаружил, что частота рентгеновского излучения является математической функцией атомного номера элемента и заряда ядра водорода (см. закон Мозли ).
В 1917 году Резерфорд бомбардировал азотный газ альфа-частицами и наблюдал, как из газа выделяются ионы водорода . Резерфорд пришел к выводу, что альфа-частицы ударяют по ядрам атомов азота, заставляя ионы водорода расщепляться. [64] [65]
Эти наблюдения привели Резерфорда к выводу, что ядро водорода является сингулярной частицей с положительным зарядом, равным отрицательному заряду электрона. Название «протон» было предложено Резерфордом на неформальной встрече коллег-физиков в Кардиффе в 1920 году. [66] Все атомные ядра содержат число протонов, равное атомному номеру соответствующего элемента. До этого момента атомный номер определялся как положение элемента в периодической таблице .
Физики в 1920-х годах считали, что атомное ядро содержит протоны и некоторое количество «ядерных электронов», которые уменьшают общий заряд. Эти «ядерные электроны» отличались от электронов, вращающихся вокруг ядра. Эта неверная гипотеза объяснила бы, почему атомные номера элементов меньше их атомных весов и почему радиоактивные элементы испускают электроны ( бета-излучение ) в процессе ядерного распада. Резерфорд даже выдвинул гипотезу, что протон и электрон могут тесно связываться друг с другом в «нейтральный дублет». Резерфорд писал, что существование таких «нейтральных дублетов», свободно перемещающихся в пространстве, дало бы более правдоподобное объяснение того, как более тяжелые элементы могли образоваться в процессе зарождения Вселенной, учитывая, что одиночному протону трудно слиться с большим атомным ядром из-за отталкивающего электрического поля. [67]
В 1928 году Уолтер Боте заметил, что бериллий испускает высокопроникающее, электрически нейтральное излучение при бомбардировке альфа-частицами. Позже было обнаружено, что это излучение может выбивать атомы водорода из парафинового воска . Первоначально считалось, что это было высокоэнергетическое гамма-излучение , поскольку гамма-излучение оказывало аналогичное воздействие на электроны в металлах, но Джеймс Чедвик обнаружил, что эффект ионизации был слишком сильным, чтобы быть следствием электромагнитного излучения, при условии сохранения энергии и импульса во взаимодействии. В 1932 году Чедвик подверг различные элементы, такие как водород и азот, воздействию таинственного «бериллиевого излучения», и, измеряя энергии отскакивающих заряженных частиц, он пришел к выводу, что излучение на самом деле состояло из электрически нейтральных частиц, которые не могли быть безмассовыми, как гамма-лучи, но вместо этого должны были иметь массу, близкую к массе протона. Чедвик назвал эту новую частицу «нейтроном» и считал, что это протон и электрон, слитые вместе, поскольку нейтрон имеет примерно такую же массу, как и протон, а масса электрона по сравнению с ним пренебрежимо мала. [68] Нейтроны на самом деле не являются слиянием протона и электрона.

В 1924 году Луи де Бройль предположил, что все частицы, особенно субатомные частицы, такие как электроны, имеют связанную волну. Эрвин Шредингер , очарованный этой идеей, разработал уравнение [69] , которое описывает электрон как волновую функцию, а не как точку. Этот подход предсказал многие спектральные явления, которые модель Бора не смогла объяснить, но его было трудно визуализировать, и он столкнулся с оппозицией. [70] Один из его критиков, Макс Борн , предположил вместо этого, что волновая функция Шредингера не описывает физическую протяженность электрона (как распределение заряда в классическом электромагнетизме), а скорее дает вероятность того, что электрон при измерении будет обнаружен в определенной точке. [71] Это примирило идеи волноподобных и корпускулярноподобных электронов: поведение электрона или любой другой субатомной сущности имеет как волноподобные, так и корпускулярноподобные аспекты , и то, наблюдается ли один или другой аспект, зависит от эксперимента. [72]
Следствием описания частиц как волновых форм, а не точек, является то, что математически невозможно точно рассчитать как положение, так и импульс частицы в заданный момент времени. Это стало известно как принцип неопределенности , концепция, впервые введенная Вернером Гейзенбергом в 1927 году.
Волновая модель Шредингера для водорода заменила модель Бора с ее аккуратными, четко определенными круговыми орбитами. Современная модель атома описывает положения электронов в атоме с точки зрения вероятностей. Электрон потенциально может быть обнаружен на любом расстоянии от ядра, но, в зависимости от его уровня энергии и углового момента , существует чаще в определенных областях вокруг ядра, чем в других; эта модель называется его атомной орбиталью . Орбитали имеют различные формы — сфера , гантель , тор и т. д. — с ядром в середине. [73] Формы атомных орбиталей находятся путем решения уравнения Шредингера. [74] Аналитические решения уравнения Шредингера известны для очень немногих относительно простых модельных гамильтонианов, включая атом водорода и молекулярный ион водорода . [75] Начиная с атома гелия , который содержит всего два электрона, для решения уравнения Шредингера используются численные методы. [76]
Качественно форма атомных орбиталей многоэлектронных атомов напоминает состояния атома водорода. Принцип Паули требует распределения этих электронов внутри атомных орбиталей таким образом, чтобы не более двух электронов были назначены на одну орбиталь; это требование глубоко влияет на атомные свойства и, в конечном счете, на связывание атомов в молекулы. [77] : 182
стр. 208: До 1913 года мы использовали фразу «химически неразделимые радиоэлементы», а в то время в гостиной в доме тестя Содди, сэра Джорджа
Бейлби
, было предложено слово «изотоп» .