Токсоплазмоз — паразитарное заболевание, вызываемое Toxoplasma gondii , апикомплексом . [3] Инфекции токсоплазмозом связаны с различными нейропсихиатрическими и поведенческими состояниями. [8] Иногда у людей может быть несколько недель или месяцев легкой, похожей на грипп болезни, такой как мышечные боли и болезненные лимфатические узлы . [1] У небольшого числа людей могут развиться проблемы со зрением. [1] У людей со слабой иммунной системой могут возникнуть серьезные симптомы, такие как судороги и плохая координация. [1] Если человек заражается во время беременности , состояние, известное как врожденный токсоплазмоз, может повлиять на ребенка. [1]
Токсоплазмоз обычно распространяется через употребление плохо приготовленной пищи, содержащей цисты , через контакт с инфицированными кошачьими фекалиями или от инфицированной женщины к ее ребенку во время беременности. [3] В редких случаях болезнь может передаваться через переливание крови или трансплантацию других органов. [3] Иным образом она не передается между людьми. [3] Известно, что паразит размножается половым путем только в семействе кошачьих . [9] Однако он может инфицировать большинство видов теплокровных животных , включая людей. [9] Диагностика обычно проводится путем анализа крови на антитела или анализа амниотической жидкости у беременной пациентки на ДНК паразита . [4]
Профилактика заключается в правильной подготовке и приготовлении пищи. [10] Беременным женщинам также рекомендуется не чистить кошачьи туалеты или, если это необходимо, надевать перчатки и мыть руки после этого. [10] Лечение здоровых людей обычно не требуется. [5] Во время беременности для лечения можно использовать спирамицин или пириметамин / сульфадиазин и фолиновую кислоту . [5]
До половины населения мира инфицировано T. gondii , но не имеет симптомов. [7] В Соединенных Штатах инфицировано около 11% людей, в то время как в некоторых регионах мира этот показатель составляет более 60%. [3] Ежегодно регистрируется около 200 000 случаев врожденного токсоплазмоза. [6] Шарль Николь и Луи Мансо впервые описали этот организм в 1908 году . [11] В 1941 году была подтверждена передача инфекции во время беременности от беременной женщины к ее ребенку. [11] Существуют предварительные доказательства того, что в противном случае бессимптомная инфекция может влиять на поведение людей. [12]
Инфекция имеет три стадии:
Острый токсоплазмоз часто протекает бессимптомно у здоровых взрослых. [13] [14] Однако симптомы могут проявляться и часто похожи на грипп : опухшие лимфатические узлы , головные боли, лихорадка и усталость, [15] или мышечные боли, которые длятся в течение месяца или более. У человека с полностью функционирующей иммунной системой редко развиваются серьезные симптомы после заражения. Люди с ослабленной иммунной системой, вероятно, будут испытывать головную боль, спутанность сознания, плохую координацию, судороги, проблемы с легкими, которые могут напоминать туберкулез или пневмонию Pneumocystis jirovecii (распространенная оппортунистическая инфекция, которая возникает у людей со СПИДом), или хориоретинит, вызванный тяжелым воспалением сетчатки (глазной токсоплазмоз). [15] У маленьких детей и людей с ослабленным иммунитетом , таких как люди с ВИЧ/СПИДом, те, кто принимает определенные виды химиотерапии или те, кто недавно перенес трансплантацию органа , может развиться тяжелый токсоплазмоз. Это может привести к повреждению мозга ( энцефалит ) или глаз ( некротизирующий ретинохороидит ). [16] Младенцы, инфицированные через плаценту, могут родиться с любой из этих проблем или с пороками развития носа, хотя эти осложнения редки у новорожденных. Токсоплазматические трофозоиты, вызывающие острый токсоплазмоз, называются тахизоитами и обычно обнаруживаются в различных тканях и жидкостях организма, но редко в крови или спинномозговой жидкости. [17]
Опухшие лимфатические узлы обычно обнаруживаются на шее или под подбородком, затем в подмышках и паху. Опухоль может возникать в разное время после первоначальной инфекции, сохраняться и рецидивировать в течение разного времени независимо от противопаразитарного лечения. [18] Обычно она обнаруживается в отдельных местах у взрослых, но у детей чаще встречаются множественные места. Увеличенные лимфатические узлы проходят в течение 1–2 месяцев в 60% случаев. Однако четверти пострадавших требуется 2–4 месяца, чтобы вернуться к норме, а 8% — 4–6 месяцев. Значительное число (6%) не возвращается к норме до гораздо более позднего времени. [19]
Из-за отсутствия очевидных симптомов [13] [14] хозяева легко заражаются T. gondii и заболевают токсоплазмозом, не зная об этом. Хотя легкие гриппоподобные симптомы иногда возникают в течение первых нескольких недель после заражения, заражение T. gondii не вызывает легко наблюдаемых симптомов у здоровых взрослых людей. [7] [20] У большинства иммунокомпетентных людей инфекция переходит в латентную фазу, во время которой присутствуют только брадизоиты ( в тканевых цистах ); [21] эти тканевые цисты и даже поражения могут возникать в сетчатке , альвеолярной оболочке легких (где острая инфекция может имитировать инфекцию Pneumocystis jirovecii ), сердце, скелетных мышцах и центральной нервной системе (ЦНС), включая мозг. [22] Цисты образуются в ЦНС ( мозговой ткани ) при заражении T. gondii и сохраняются в течение всей жизни хозяина. [23] У большинства младенцев, инфицированных в утробе матери, при рождении не наблюдается никаких симптомов, но симптомы могут проявиться позже в жизни. [24]
Обзоры серологических исследований показали, что 30–50% населения мира подвергались воздействию и могут быть хронически инфицированы латентным токсоплазмозом, хотя показатели инфицирования значительно различаются в разных странах. [7] [25] [26] Это латентное состояние инфекции в последнее время связывают с многочисленными болезнями , [7] неврологическими изменениями, [23] [25] и тонкими зависимыми от пола изменениями поведения у иммунокомпетентных людей, [27] [28] , а также с повышенным риском дорожно-транспортных происшествий. [29]
Хотя это случается редко, поражения кожи могут возникать при приобретенной форме заболевания, включая розеолу и многоформную эритему , узелки, похожие на пруриго , крапивницу и макулопапулезные поражения . У новорожденных могут быть точечные пятна, экхимозы или поражения в виде «черничного кекса».
Диагностика кожного токсоплазмоза основана на обнаружении тахизоитной формы T. gondii в эпидермисе . [30] Она обнаруживается на всех уровнях эпидермиса, имеет размеры около 6 на 2 мкм и имеет форму дуги, при этом ядро составляет одну треть ее размера. Ее можно идентифицировать с помощью электронной микроскопии или окрашивания тканей по Гимзе, при котором цитоплазма становится синей, а ядро — красным. [31]
В своем жизненном цикле T. gondii принимает несколько форм. [32] Тахизоиты ответственны за острую инфекцию; они быстро делятся и распространяются по тканям организма. Тахизоиты также известны как «тахизойные мерозоиты», описательный термин, который более точно передает паразитологическую природу этой стадии. [33] После пролиферации тахизоиты превращаются в брадизоиты , которые находятся внутри латентных внутриклеточных тканевых цист , которые образуются в основном в мышцах и мозге. Образование цист частично вызвано давлением иммунной системы хозяина. [34] Брадизоиты (также называемые «брадизойными мерозоитами») не реагируют на антибиотики. Брадизоиты, однажды образовавшись, могут оставаться в тканях в течение всей жизни хозяина. У здорового хозяина, если некоторые брадизоиты превращаются обратно в активные тахизоиты, иммунная система быстро их уничтожит. Однако у людей с ослабленным иммунитетом или у плодов, у которых отсутствует развитая иммунная система, тахизоиты могут размножаться в большом количестве и вызывать значительные неврологические повреждения. [32]
Выживание паразита зависит от баланса между выживанием хозяина и размножением паразита. [34] T. gondii достигает этого баланса, манипулируя иммунным ответом хозяина, снижая иммунный ответ хозяина и усиливая репродуктивное преимущество паразита. [34] Как только он заражает нормальную клетку хозяина, он сопротивляется повреждениям, вызванным иммунной системой хозяина, и изменяет иммунные процессы хозяина. [35] Пробираясь в клетку хозяина, паразит образует мембрану паразитофорной вакуоли (ПВ) из мембраны клетки хозяина. [2] [36] ПВ инкапсулирует паразита и одновременно устойчив к активности эндолизосомальной системы и может взять под контроль митохондрии и эндоплазматический ретикулум хозяина . [2] [36]
При первом вторжении в клетку паразит высвобождает белки ROP из луковицы органеллы роптрии . [2] Эти белки перемещаются в ядро и на поверхность мембраны PV, где они могут активировать пути STAT для модуляции экспрессии цитокинов на транскрипционном уровне, связывать и инактивировать разрушающие мембрану PV белки IRG , среди других возможных эффектов. [2] [36] [37] Кроме того, некоторые штаммы T. gondii могут секретировать белок, известный как GRA15, активирующий путь NF-κB , который повышает регуляцию провоспалительного цитокина IL-12 в раннем иммунном ответе, что может привести к латентной фазе паразита. [2] Способность паразита секретировать эти белки зависит от его генотипа и влияет на его вирулентность. [2] [37]
Паразит также влияет на антиапоптотический механизм, позволяя инфицированным клеткам хозяина сохраняться и размножаться. Одним из методов устойчивости к апоптозу является разрушение эффекторных белков проапоптоза, таких как BAX и BAK . [38] Чтобы разрушить эти белки, T. gondii вызывает конформационные изменения белков, которые не позволяют белкам транспортироваться в различные клеточные отсеки, где они инициируют события апоптоза. Однако T. gondii не вызывает снижения активности эффекторных белков проапоптоза. [38]
T. gondii также обладает способностью инициировать аутофагию клеток хозяина. [39] Это приводит к уменьшению количества здоровых, неинфицированных клеток и, следовательно, меньшему количеству клеток хозяина, которые атакуют инфицированные клетки. Исследования Ванга и др. показывают, что инфицированные клетки приводят к более высокому уровню аутофагосом в нормальных и инфицированных клетках. [39] Их исследования показывают, что T. gondii вызывает аутофагию клеток хозяина, используя кальций-зависимый путь. [39] Другое исследование предполагает, что паразит может напрямую влиять на высвобождение кальция из кальциевых хранилищ, которые важны для сигнальных процессов клеток. [38]
Механизмы, описанные выше, позволяют T. gondii сохраняться в хозяине. Некоторые ограничивающие факторы для токсоплазмы заключаются в том, что ее влияние на клетки хозяина сильнее при слабой иммунной системе и зависит от количества, поэтому большое количество T. gondii на клетку хозяина вызывает более серьезный эффект. [40] Эффект на хозяина также зависит от силы иммунной системы хозяина. Иммунокомпетентные люди обычно не проявляют серьезных симптомов или вообще не проявляют их, в то время как у людей с ослабленным иммунитетом могут наступить летальный исход или серьезные осложнения. [40]
Было показано, что T. gondii вырабатывает белок под названием GRA28, высвобождаемый секреторным путем MYR1, который препятствует экспрессии генов в инфицированных клетках и приводит к тому, что клетки ведут себя как дендритные клетки, становясь очень подвижными в организме. [41]
Поскольку паразит может изменять иммунный ответ хозяина, он также может оказывать влияние, положительное или отрицательное, на иммунный ответ на другие патогенные угрозы. [34] Это включает, помимо прочего, ответы на инфекции Helicobacter felis , Leishmania major или других паразитов, таких как Nippostrongylus brasiliensis . [34]
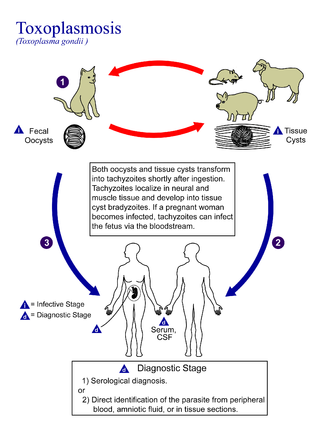
Токсоплазмоз обычно передается через рот, когда ооцисты или тканевые цисты Toxoplasma gondii случайно проглатываются. [42] Также может иметь место врожденная передача от матери к плоду. [43] Передача также может происходить во время процесса трансплантации твердых органов [44] или гематогенной трансплантации стволовых клеток. [45]
Передача инфекции через рот может происходить через:
Кошки выделяют возбудителя с фекалиями в течение нескольких недель после заражения болезнью, как правило, при поедании инфицированного промежуточного хозяина, которым могут быть млекопитающие (например, грызуны) или птицы. Выделение ооцист обычно начинается с третьего дня после приема инфицированных промежуточных хозяев и может продолжаться в течение недель. Ооцисты не являются инфекционными при выделении. Примерно через день ооциста подвергается процессу, называемому споруляцией, и становится потенциально патогенной. [52] Помимо кошек, промежуточными хозяевами паразита и вовлечены в процесс передачи инфекции также являются птицы и млекопитающие, включая людей. Однако патогенность варьируется в зависимости от возраста и вида, вовлеченного в инфекцию, а также способа передачи T. gondii . [53]
Токсоплазмоз также может передаваться через трансплантацию твердых органов. Токсоплазма-серонегативные реципиенты, которым пересаживают органы от недавно инфицированных токсоплазма-серопозитивных доноров, находятся в группе риска. Реципиенты органов, у которых есть латентный токсоплазмоз, находятся в группе риска реактивации заболевания в их системе из-за иммуносупрессии, происходящей во время трансплантации твердых органов. [44] Реципиенты гематогенных трансплантатов стволовых клеток могут подвергаться более высокому риску заражения из-за более длительных периодов иммуносупрессии. [45]
Трансплантация сердца и легких сопряжена с самым высоким риском заражения токсоплазмозом из-за поперечнополосатой мышцы, из которой состоит сердце, [44] которая может содержать кисты, а риски для других органов и тканей сильно различаются. [54] Риск передачи можно снизить путем скрининга доноров и реципиентов перед процедурой трансплантации и предоставления лечения. [54]
Врожденный токсоплазмоз — это особая форма токсоплазмоза, при которой нерожденный плод заражается через плаценту . [55] Врожденный токсоплазмоз связан с гибелью плода и выкидышем, а у младенцев — с гидроцефалией, церебральными кальцификациями и хориоретинитом , что приводит к энцефалопатии и, возможно, слепоте. [6] Если женщина впервые подвергается воздействию T. gondii во время беременности, плод подвергается особому риску. [6] Простой анализ крови при первом посещении врача дородовой помощи может определить, подвергалась ли женщина предыдущему воздействию и, следовательно, подвергается ли она риску. Положительный титр антител указывает на предыдущее воздействие и иммунитет и в значительной степени обеспечивает безопасность нерожденного плода.
Не существует достаточных доказательств относительно влияния обучения до беременности на профилактику врожденного токсоплазмоза. [56] Однако обучение родителей до рождения ребенка считается эффективным, поскольку оно может улучшить пищевую, личную и гигиеническую безопасность домашних животных. [56] Необходимы дополнительные исследования, чтобы выяснить, может ли дородовое обучение снизить врожденный токсоплазмоз. [56]
Для беременных женщин с отрицательными титрами антител, что указывает на отсутствие предшествующего контакта с T. gondii , рекомендуется проводить серологическое тестирование как можно чаще, например, ежемесячно, поскольку лечение во время беременности для тех женщин, которые впервые подверглись воздействию T. gondii, значительно снижает риск передачи паразита плоду. Поскольку иммунная система ребенка не развивается полностью в течение первого года жизни, а устойчивые цисты, которые образуются по всему телу, очень трудно искоренить с помощью антипротозойных средств, инфекция может быть очень серьезной у молодых людей. [ необходима цитата ]
Несмотря на эти риски, беременные женщины не проходят рутинный скрининг на токсоплазмоз в большинстве стран по причинам экономической эффективности и большого количества ложноположительных результатов ; Португалия , [57] Франция , [58] Австрия , [58] Уругвай , [59] и Италия [60] являются заметными исключениями, а некоторые региональные программы скрининга действуют в Германии , Швейцарии и Бельгии . [60] Поскольку инвазивное пренатальное тестирование несет определенный риск для плода (18,5 потерь беременности на один предотвращенный случай токсоплазмоза), [58] предпочтительнее проводить постнатальный или неонатальный скрининг. Исключением являются случаи, когда отмечаются аномалии плода , и, таким образом, скрининг может быть целевым. [58]
Беременным женщинам следует избегать контакта с сырым мясом , пить сырое молоко (особенно козье) и не есть сырое или недоваренное мясо независимо от его типа. [61] Из-за очевидной связи между токсоплазмой и кошками также часто рекомендуется избегать контакта с кошачьими фекалиями и воздерживаться от садоводства (кошачьи фекалии часто встречаются в садовой почве) или, по крайней мере, надевать перчатки, когда этим занимаются. [61] Большинство кошек не выделяют активно ооцисты , поскольку они заражаются в первые шесть месяцев своей жизни, когда они выделяют ооцисты в течение короткого периода времени (1–2 недели). [62] Однако эти ооцисты зарываются в почву, спорулируют и остаются заразными в течение периодов от нескольких месяцев до более года. [61] Многочисленные исследования показали, что проживание в доме с кошкой не является значительным фактором риска заражения T. gondii , [61] [63] [64] хотя проживание с несколькими котятами имеет некоторое значение. [65]
В 2006 году чешская исследовательская группа [66] обнаружила, что женщины с высоким уровнем антител к токсоплазмозу имели значительно больше шансов родить мальчиков, чем девочек. В большинстве популяций рождаемость мальчиков составляет около 51%, но у людей, инфицированных T. gondii, вероятность рождения мальчика составляла до 72%. [67]
Токсоплазмоз у людей диагностируется с помощью биологических, серологических, гистологических или молекулярных методов или с помощью некоторой комбинации вышеперечисленных методов. [62] Токсоплазмоз может быть трудно отличить от первичной лимфомы центральной нервной системы . Его симптомы имитируют несколько других инфекционных заболеваний, поэтому клинические признаки неспецифичны и недостаточно характерны для определенного диагноза. Неудачная попытка антимикробной терапии ( пириметамин , сульфадиазин и фолиновая кислота ( USAN : лейковорин)), делает альтернативный диагноз более вероятным. [ необходима цитата ]
T. gondii также может быть обнаружен в крови , амниотической жидкости или спинномозговой жидкости с помощью полимеразной цепной реакции . [68] T. gondii может существовать в организме хозяина в виде неактивной цисты, которая, вероятно, избежит обнаружения. [ необходима цитата ]
Серологическое тестирование позволяет обнаружить антитела к T. gondii в сыворотке крови, используя такие методы, как реакция окрашивания Сэбина-Фельдмана (DT), реакция непрямой гемагглютинации , реакция непрямой флуоресцентной антитела (IFA) , реакция прямой агглютинации , реакция латексной агглютинации (LAT), иммуноферментный анализ (ELISA) и реакция иммуносорбентной агглютинации (IAAT). [62]
Наиболее часто используемые тесты для измерения антител IgG — это DT, ELISA, IFA и модифицированный прямой тест агглютинации. [69] Антитела IgG обычно появляются в течение недели или двух после заражения, достигают пика в течение одного-двух месяцев, а затем снижаются с различной скоростью. [69] Антитела IgG к токсоплазме обычно сохраняются в течение жизни и, следовательно, могут присутствовать в кровотоке в результате как текущей, так и предыдущей инфекции. [70]
В некоторой степени острые инфекции токсоплазмоза можно дифференцировать от хронических инфекций с помощью теста на авидность IgG , который является разновидностью ИФА. При первой реакции на инфекцию специфический для токсоплазмы IgG имеет низкое сродство к антигену токсоплазмы; в последующие недели и месяцы сродство IgG к антигену увеличивается. На основании теста на авидность IgG, если IgG у инфицированного человека имеет высокое сродство, это означает, что инфекция началась за три-пять месяцев до тестирования. Это особенно полезно при врожденной инфекции, когда статус беременности и гестационный возраст на момент заражения определяют лечение. [71]
В отличие от IgG, антитела IgM могут быть использованы для выявления острой инфекции, но, как правило, не хронической инфекции. [70] Антитела IgM появляются раньше после заражения, чем антитела IgG, и исчезают быстрее, чем антитела IgG, после выздоровления. [62] В большинстве случаев специфические антитела IgM к T. gondii можно впервые обнаружить примерно через неделю после первичного заражения, и они уменьшаются в течение одного-шести месяцев; 25% инфицированных дают отрицательный результат на специфический IgM к T. gondii в течение семи месяцев. [70] Однако IgM можно обнаружить через месяцы или годы после заражения, во время хронической фазы, и возможны ложноположительные результаты при острой инфекции. [69] Наиболее часто используемыми тестами для измерения антител IgM являются двойной сэндвич-тест IgM-ELISA , тест IFA и анализ иммуносорбентной агглютинации (IgM-ISAGA). Коммерческие наборы для тестирования часто имеют низкую специфичность, и сообщаемые результаты часто неверно интерпретируются. [69]
В 2021 году двадцать коммерческих анализов IgG против токсоплазмы были оценены в систематическом обзоре в сравнении с принятым референтным методом. [72] Большинство из них были иммуноферментными анализами, за которыми следовали тесты на агглютинацию, иммунохроматографические тесты и анализ вестерн-блоттинга . Средняя чувствительность анализов IgG варьировалась от 89,7% до 100% для стандартных титров и от 13,4% до 99,2% для низких титров IgG. Несколько исследований указали на способность некоторых методов, особенно WB, обнаруживать IgG на ранних стадиях после первичной инфекции. Специфичность анализов IgG была в целом высокой, в диапазоне от 91,3% до 100%; и выше 99% для большинства анализов ИФА. Положительная прогностическая ценность (ППЦ) не была дискриминантным показателем среди методов, в то время как значительные различия (87,5–100%) были зарегистрированы среди отрицательных прогностических ценностей (ОПЦ), ключевого параметра, оценивающего способность окончательно исключить инфекцию токсоплазмы у пациентов с риском оппортунистических инфекций. [72]

Рекомендации по диагностике врожденного токсоплазмоза включают: пренатальную диагностику на основе тестирования амниотической жидкости и ультразвуковых исследований; неонатальную диагностику на основе молекулярного тестирования плаценты и пуповинной крови и сравнительных серологических тестов матери и ребенка и клинического обследования при рождении; и раннюю детскую диагностику на основе неврологических и офтальмологических обследований и серологического обследования в течение первого года жизни. [55] Во время беременности серологическое тестирование рекомендуется проводить с трехнедельными интервалами. [73]
Несмотря на то, что диагностика токсоплазмоза в значительной степени зависит от серологического обнаружения специфического анти- Toxoplasma иммуноглобулина, серологическое тестирование имеет ограничения. Например, оно может не обнаружить активную фазу инфекции T. gondii , поскольку специфические анти- Toxoplasma IgG или IgM могут не вырабатываться до тех пор, пока не пройдет несколько недель после заражения. В результате беременная женщина может получить отрицательный результат теста во время активной фазы инфекции T. gondii , что приведет к необнаруженному и, следовательно, нелеченному врожденному токсоплазмозу. [74] Кроме того, тест может не обнаружить инфекции T. gondii у пациентов с ослабленным иммунитетом, поскольку титры специфических анти- Toxoplasma IgG или IgM могут не повышаться у этого типа пациентов. [ необходима цитата ]
Многие методы на основе ПЦР были разработаны для диагностики токсоплазмоза с использованием клинических образцов, которые включают амниотическую жидкость, кровь , спинномозговую жидкость и биопсию тканей . Наиболее чувствительным методом на основе ПЦР является вложенная ПЦР , за которой следует гибридизация продуктов ПЦР. [74] Основным недостатком этих методов является то, что они требуют много времени и не дают количественных данных. [74]
ПЦР в реальном времени полезна для обнаружения патогенов, экспрессии и регуляции генов, а также аллельной дискриминации. Эта техника ПЦР использует 5'-нуклеазную активность ДНК-полимеразы Taq для расщепления нерасширяемого, флуоресцентно-меченого гибридизационного зонда во время фазы расширения ПЦР. [74] Второй флуоресцентный краситель, например, 6-карбокси-тетраметил-родамин, гасит флуоресценцию интактного зонда. [74] Расщепление нуклеазой гибридизационного зонда во время ПЦР высвобождает эффект гашения, что приводит к увеличению флуоресценции пропорционально количеству продукта ПЦР, которое можно контролировать с помощью детектора последовательности. [74]
Лимфатические узлы, пораженные токсоплазмой, имеют характерные изменения, включая плохо разграниченные реактивные зародышевые центры , скопления моноцитоидных В-клеток и разбросанные эпителиоидные гистиоциты . [ необходима цитата ]
Классическая триада врожденного токсоплазмоза включает: хориоретинит , гидроцефалию и внутричерепной артериосклероз . [75] Другие последствия включают нейросенсорную глухоту, судороги и умственную отсталость. [76]
Врожденный токсоплазмоз также может повлиять на слух ребенка. До 30% новорожденных имеют некоторую степень нейросенсорной тугоухости. [77] Также могут быть затронуты коммуникативные навыки ребенка. Исследование, опубликованное в 2010 году, рассматривало 106 пациентов, все из которых получили лечение токсоплазмоза до 2,5 месяцев. Из этой группы 26,4% имели речевые расстройства. [78]
Лечение рекомендуется людям с серьезными проблемами со здоровьем, например, людям с ВИЧ , у которых количество CD4 составляет менее 200 клеток/мм 3 . Триметоприм/сульфаметоксазол является препаратом выбора для профилактики токсоплазмоза, но не для лечения активного заболевания. Исследование 2012 года показывает многообещающий новый способ лечения активной и латентной формы этого заболевания с использованием двух эндохинолонов, подобных эндохину . [79]
Лекарства, назначаемые при остром токсоплазмозе, следующие: [ необходима цитата ]
(другие антибиотики, такие как миноциклин , иногда применялись в качестве терапии спасения ).
При заражении во время беременности спирамицин рекомендуется в первом и начале второго триместра, а пириметамин/сульфадиазин и лейковорин — в конце второго и третьем триместре. [81]
У людей с латентным токсоплазмозом цисты невосприимчивы к этим методам лечения, поскольку антибиотики не достигают брадизоитов в достаточной концентрации.
Лекарства, назначаемые при латентном токсоплазмозе:
Когда у беременной женщины диагностирован острый токсоплазмоз, амниоцентез может быть использован для определения того, инфицирован ли плод или нет. Когда у беременной женщины развивается острый токсоплазмоз, тахизоиты имеют приблизительно 30% вероятность проникновения в плацентарную ткань, а оттуда проникнуть и заразить плод. По мере увеличения гестационного возраста на момент заражения, вероятность инфицирования плода также увеличивается. [32]
Если паразит еще не достиг плода, спирамицин может помочь предотвратить плацентарную передачу. Если плод инфицирован, беременную женщину можно лечить пириметамином и сульфадиазином , с фолиновой кислотой , после первого триместра. Их лечат после первого триместра, потому что пириметамин оказывает антифолатное действие, а недостаток фолиевой кислоты может помешать формированию мозга плода и вызвать тромбоцитопению . [84] Инфекция на ранних стадиях беременности коррелирует с более плохими исходами для плода и новорожденного, особенно когда инфекция не лечится. [85]
Новорожденные, прошедшие 12-месячное постнатальное лечение от токсоплазмоза, имеют низкий риск нейросенсорной потери слуха. [86] Для этой группы была создана информация относительно этапов лечения детей с врожденным токсоплазмозом. [87]
Инфекции T. gondii встречаются во всем мире, хотя показатели инфицирования значительно различаются в зависимости от страны. [26] Обзор 99 исследований в 44 странах показал, что для женщин детородного возраста районы с самой высокой распространенностью находятся в Латинской Америке (около 50–80%), некоторых частях Восточной и Центральной Европы (около 20–60%), на Ближнем Востоке (около 30–50%), некоторых частях Юго-Восточной Азии (около 20–60%) и некоторых частях Африки (около 20–55%). [26]
В Соединенных Штатах данные Национального обследования здоровья и питания (NHANES) с 1999 по 2004 год показали, что 9,0% лиц, родившихся в США, в возрасте 12–49 лет были серопозитивны по антителам IgG к T. gondii , что ниже 14,1%, измеренных в NHANES 1988–1994 годов. [88] В исследовании 1999–2004 годов 7,7% родившихся в США и 28,1% родившихся за границей женщин в возрасте 15–44 лет были серопозитивны к T. gondii . [88] Тенденция к снижению серопозитивности была отмечена многочисленными исследованиями в Соединенных Штатах и многих европейских странах. [26] Toxoplasma gondii считается второй по значимости причиной смертей, связанных с пищевыми продуктами , и четвертой по значимости причиной госпитализаций, связанных с пищевыми продуктами, в Соединенных Штатах. [89]
Простейшим, ответственным за токсоплазмоз, является T. gondii . Три основных типа T. gondii ответственны за образцы токсоплазмоза во всем мире, называемые типами I, II и III. Эти три типа T. gondii оказывают различное воздействие на определенных хозяев, в основном мышей и людей, из-за их вариаций в генотипах. [90]
Современные методы серотипирования позволяют отделить только паразитов типа I или III от паразитов типа II. [91]
Поскольку паразит представляет особую угрозу для плода, когда он заражается во время беременности, [92] большая часть глобальных эпидемиологических данных относительно T. gondii исходит из серопозитивных тестов у женщин детородного возраста. Серопозитивные тесты ищут наличие антител против T. gondii в крови, поэтому, хотя серопозитивность гарантирует, что человек подвергся воздействию паразита, она не обязательно гарантирует, что он хронически инфицирован. [93]
Toxoplasma gondii была впервые описана в 1908 году Николь и Мансо в Тунисе и независимо от них Сплендором в Бразилии. [11] Сплендор сообщил о простейшем у кролика, в то время как Николь и Мансо идентифицировали его у североафриканского грызуна, гунди ( Ctenodactylus gundi ). [42] В 1909 году Николь и Мансо дифференцировали простейшего от Leishmania . [11] Николь и Мансо затем назвали его Toxoplasma gondii по изогнутой форме его инфекционной стадии (греческий корень toxon = лук). [11]
Первый зарегистрированный случай врожденного токсоплазмоза был в 1923 году, но он не был идентифицирован как вызванный T. gondii . [42] Янку (1923) подробно описал результаты вскрытия 11-месячного мальчика, который поступил в больницу с гидроцефалией . У мальчика были классические признаки токсоплазмоза, включая хориоретинит (воспаление сосудистой оболочки и сетчатки глаза). [42] Гистология выявила ряд «спороцитов», хотя Янку не идентифицировал их как T. gondii . [42]
Только в 1937 году был проведен первый подробный научный анализ T. gondii с использованием ранее разработанных методов анализа вирусов. [11] В 1937 году Сабин и Олицкий проанализировали T. gondii у лабораторных обезьян и мышей. Сабин и Олицкий показали, что T. gondii является облигатным внутриклеточным паразитом, и что мыши, которых кормили тканью, зараженной T. gondii, также заражались инфекцией. [11] Таким образом, Сабин и Олицкий продемонстрировали, что T. gondii является патогеном, передающимся между животными. [ необходима ссылка ]
T. gondii был впервые описан как патоген для человека в 1939 году в Детской больнице в Нью-Йорке . [11] [94] Вольф, Коуэн и Пейдж выявили инфекцию T. gondii у девочки, рожденной в срок с помощью кесарева сечения. [42] У младенца развились судороги и хориоретинит обоих глаз на третий день. Затем у младенца развился энцефаломиелит, и он умер в возрасте одного месяца. Вольф, Коуэн и Пейдж выделили T. gondii из пораженных тканей мозга. Внутричерепная инъекция образцов головного и спинного мозга мышам, кроликам и крысам вызвала энцефалит у животных. [11] Вольф, Коуэн и Пейдж рассмотрели дополнительные случаи и пришли к выводу, что T. gondii вызывала узнаваемые симптомы и могла передаваться от матери к ребенку. [42]
Первый случай токсоплазмоза у взрослых был зарегистрирован в 1940 году без неврологических признаков. Пинкертон и Вайнман сообщили о наличии токсоплазмы у 22-летнего мужчины из Перу, который умер от последующей бактериальной инфекции и лихорадки. [42]
В 1948 году Сэбин и Фельдман создали серологический тест с красителем, основанный на способности антител пациента изменять окраску токсоплазмы . [11] [95] Тест Сэбина-Фельдмана с красителем в настоящее время является золотым стандартом для определения заражения токсоплазмой . [11]
Передача токсоплазмы через употребление в пищу сырого или недоваренного мяса была продемонстрирована Десмонтом и др. в 1965 году в Париже. [11] Десмонт наблюдал, что терапевтическое употребление сырой говядины или конины в туберкулезной больнице было связано с 50%-ным ежегодным увеличением антител к токсоплазме . [11] Это означает, что больше T. gondii передавалось через сырое мясо.
В 1974 году Десмонт и Куврер показали, что инфицирование в течение первых двух триместров наносит наибольший вред плоду, что передача зависит от того, когда мать была инфицирована во время беременности, что матери с антителами до беременности не передают инфекцию плоду, и что спирамицин снижает передачу плоду. [42]
Токсоплазма привлекла больше внимания в 1970-х годах в связи с ростом иммунодепрессивной терапии после трансплантации органов или костного мозга и эпидемией СПИДа в 1980-х годах. [11] Пациенты с пониженной функцией иммунной системы гораздо более восприимчивы к заболеванию.
«Синдром сумасшедшей кошатницы» — термин, придуманный новостными организациями для описания научных открытий, связывающих паразита Toxoplasma gondii с несколькими психическими расстройствами и поведенческими проблемами. [96] [97] Предполагаемая корреляция между владением кошкой в детстве и последующим развитием шизофрении предполагает, что необходимы дальнейшие исследования для определения фактора риска для детей; [98] однако более позднее исследование показало, что владение кошкой в детстве не является предиктором психотических переживаний в возрасте 13 или 18 лет. [99] Исследователи также обнаружили, что владение кошкой не сильно увеличивает риск заражения T. gondii у беременных женщин. [61] [100]
Термин синдром сумасшедшей кошатницы опирается как на стереотип, так и на популярные культурные ссылки. Он возник, когда случаи вышеупомянутых недугов были отмечены среди населения. Кошатница — это культурный стереотип женщины, которая компульсивно собирает и обожает кошек. Биолог Ярослав Флегр является сторонником теории о том, что токсоплазмоз влияет на поведение человека. [101] [102]


Хотя T. gondii способен заражать практически всех теплокровных животных, восприимчивость и частота заражения сильно различаются между различными родами и видами . [112] [113] Частота заражения в популяциях одного и того же вида также может сильно различаться из-за различий в местоположении, рационе питания и других факторах. [ необходима ссылка ]
Хотя заражение T. gondii было отмечено у нескольких видов азиатских приматов, серопревалентность антител к T. gondii была впервые обнаружена у макак-токе ( Macaca sinica ), которые являются эндемичными для острова Шри-Ланка. [114]
Австралийские сумчатые особенно восприимчивы к токсоплазмозу. [115] Валлаби , коалы , вомбаты , падмелоны и небольшие дасюриды могут быть убиты им, а восточные полосатые бандикуты обычно умирают в течение примерно 3 недель после заражения. [116]
По оценкам, 23% диких свиней во всем мире серопозитивны к T. gondii . [117] Серопораженность варьируется по всему миру, самая высокая серопораженность в Северной Америке (32%) и Европе (26%), а самая низкая в Азии (13%) и Южной Америке (5%). [117] Географические регионы, расположенные в более высоких широтах, и регионы с более теплым, влажным климатом связаны с повышенной серопозитивностью T. gondii среди диких кабанов. [117] Дикие кабаны, инфицированные T. gondii, представляют потенциальный риск для здоровья людей, употребляющих их мясо. [117]
Среди домашнего скота самые высокие показатели хронической инфекции T. gondii наблюдаются у свиней [118] [119] [120] овец [121] и коз. [122] Распространенность T. gondii среди мясных животных сильно различается как внутри стран, так и между ними, [122] и было показано, что показатели заражения существенно зависят от различных методов ведения сельского хозяйства и управления. [14] Например, животные, содержащиеся на открытом воздухе или в условиях свободного выгула, подвержены большему риску заражения, чем животные, выращиваемые в помещениях или в коммерческих помещениях . [14] [47]
Во всем мире процент свиней, являющихся носителями жизнеспособных паразитов, был измерен в 3–71,43% [120] , а в Соединенных Штатах (с помощью биопробы на мышах или кошках) достигал 92,7% и 0% в зависимости от фермы или стада. [47] Исследования серопревалентности ( антитела к T. gondii в крови) более распространены, и такие измерения указывают на высокую относительную серопревалентность у свиней во всем мире. [123] Было обнаружено, что у новорожденных поросят наблюдается весь спектр тяжести, включая прогрессирование до мертворождения . [124] [118] : 95 Это было особенно продемонстрировано в основополагающем исследовании Thiptara et al. 2006, в котором сообщалось о рождении помета из трех мертворожденных и шести выживших в Таиланде. Это наблюдение было актуально не только для этой страны, но и для контроля токсоплазмоза в свиноводстве по всему миру. [125] [118] : 95 [120]
Наряду со свиньями, овцы и козы являются одними из наиболее часто инфицированных животных, имеющих эпидемиологическое значение для заражения человека. [122] Распространенность жизнеспособных T. gondii в тканях овец была измерена (с помощью биопробы) и составила 78% в Соединенных Штатах, [126] а обследование коз, предназначенных для потребления в Соединенных Штатах, в 2011 году выявило серопревалентность 53,4%. [127] В настоящее время доступна единственная живая аттенуированная вакцина, Toxovax, для смягчения негативных последствий врожденного токсоплазмоза в овцеводстве. [128] [129]
Из-за отсутствия контакта с открытым воздухом куры, выращиваемые в крупных закрытых помещениях, обычно не заражаются T. gondii . [14] Куры, находящиеся на свободном выгуле или на заднем дворе, заражаются гораздо чаще. [14] Обследование кур, находящихся на свободном выгуле в Соединенных Штатах, показало, что его распространенность составляет 17–100% в зависимости от фермы. [130] Поскольку куриное мясо обычно тщательно готовят перед употреблением, домашнюю птицу обычно не считают существенным фактором риска заражения человека T. gondii . [131]
Хотя крупный рогатый скот и буйволы могут быть инфицированы T. gondii , паразит обычно уничтожается или снижается до неопределяемого уровня в течение нескольких недель после заражения. [14] Тканевые цисты редко присутствуют в мясе буйволов или говядине, и мясо этих животных считается малорискованным в плане содержания жизнеспособных паразитов. [47] [122] [132]
Лошади считаются устойчивыми к хронической инфекции T. gondii . [14] Однако жизнеспособные клетки были выделены из лошадей в США, забитых на экспорт, а тяжелый токсоплазмоз человека во Франции был эпидемиологически связан с потреблением конины . [47] [133]
В 1942 году был диагностирован и зарегистрирован первый случай токсоплазмоза у домашней кошки в Мидлтауне, штат Нью-Йорк. [134] Исследователи выделили ооцисты из кошачьих фекалий и обнаружили, что ооцисты могут быть заразными в течение 12 месяцев в окружающей среде. [135]
Серопревалентность T. gondii у домашних кошек во всем мире оценивается примерно в 30–40% [136] и демонстрирует значительные географические различия. В Соединенных Штатах официальной национальной оценки не проводилось, но местные исследования показали уровни, варьирующиеся от 16% до 80%. [136] Исследование 2012 года 445 чистокровных домашних кошек и 45 кошек из приютов в Финляндии выявило общую серопревалентность 48,4% [137], в то время как исследование 2010 года одичавших кошек из Гизы, Египет, выявило уровень серопревалентности 97,4%. [138] Другое исследование из Колумбии зафиксировало серопревалентность 89,3% [139] , тогда как китайское ( Гуандун ) исследование выявило распространенность всего 2,1%. [140]
Уровень заражения T. gondii у домашних кошек сильно различается в зависимости от рациона питания и образа жизни кошек. [141] Одичавшие кошки , которые охотятся за своей пищей, имеют больше шансов заразиться, чем домашние кошки, и, естественно, также зависит от распространенности зараженной T. gondii добычи, такой как птицы и мелкие млекопитающие . [142]
Большинство инфицированных кошек выделяют ооцисты с фекалиями только один раз в жизни, обычно в течение 3-10 дней после заражения. Это выделение может высвобождать миллионы ооцист, каждая из которых способна распространяться и выживать в течение месяцев. После заражения большинство кошек вырабатывают антитела к T. gondii и больше не выделяют ооцисты. [143] [136] По оценкам, 1% кошек в любой момент времени активно выделяют ооцисты. [14]
Трудно контролировать популяцию кошек с инфицированными ооцистами из-за отсутствия одобренной вакцины. Это остается проблемой в большинстве случаев, и программы, которые легко доступны, сомнительны по эффективности. [129] [144] [145] Исследования вакцин для кошек от токсоплазмоза продолжаются, и несколько кандидатов показывают положительные результаты в клинических испытаниях. [129] [145]
Современные методы борьбы с T. gondii у кошек обычно основаны на предотвращении их охоты (где они могут подхватить паразита), недопущении употребления кошачьими сырого мяса и поддержании хорошей гигиены вокруг туалетных лотков для минимизации загрязнения окружающей среды ооцистами. [146] [143]
Было показано, что заражение T. gondii изменяет поведение мышей и крыс способами, которые, как считается, увеличивают шансы грызунов стать добычей кошек. [147] [148] [149] У инфицированных грызунов снижается врожденное отвращение к запахам кошек; в то время как неинфицированные мыши и крысы, как правило, избегают областей, отмеченных кошачьей мочой или запахом кошачьего тела, у инфицированных животных это избегание снижается или устраняется. [147] [149] [150] Более того, некоторые данные свидетельствуют о том, что эта потеря отвращения может быть специфична для кошачьих запахов: когда им дают выбор между двумя запахами хищников (кошки или норки ), инфицированные грызуны демонстрируют значительно более сильное предпочтение запахам кошек, чем неинфицированные контрольные животные . [151] [152]
У грызунов поведенческие изменения, вызванные T. gondii, происходят посредством эпигенетического ремоделирования в нейронах, связанных с наблюдаемым поведением; [153] [154] например, он изменяет эпигенетическое метилирование , чтобы вызвать гипометилирование генов, связанных с аргинин-вазопрессином в медиальной миндалине, что значительно снижает отвращение к хищникам. [153] [154] Аналогичные эпигенетически вызванные поведенческие изменения также наблюдались в мышиных моделях зависимости, где изменения в экспрессии ферментов, модифицирующих гистоны , посредством нокаута гена или ингибирования фермента в определенных нейронах вызывали изменения в поведении, связанном с наркотиками. [155] [156] [157] Широко распространенное ацетилирование гистона-лизина в кортикальных астроцитах , по-видимому, является еще одним эпигенетическим механизмом, используемым T. gondii . [158] [159]
Грызуны, инфицированные T. gondii, демонстрируют ряд поведенческих изменений, выходящих за рамки измененных реакций на запахи кошек. Крысы, инфицированные паразитом, демонстрируют повышенный уровень активности и сниженное неофобное поведение. [160] Аналогичным образом, инфицированные мыши демонстрируют изменения в моделях локомоции и исследовательского поведения во время экспериментальных тестов. Эти модели включают перемещение на большие расстояния, движение с более высокой скоростью, ускорение в течение более длительных периодов времени и демонстрацию сокращенного времени паузы при помещении на новые арены. [161] Также было показано, что инфицированные грызуны имеют более низкую тревожность , используя традиционные модели, такие как приподнятые крестообразные лабиринты , арены на открытом поле и тесты на социальное взаимодействие. [161] [162]
Исследование, проведенное Калифорнийским университетом в Дэвисе на мертвых морских выдрах, собранных с 1998 по 2004 год, показало, что токсоплазмоз был причиной смерти 13% животных. [163] Близость к пресноводным стокам в океан была основным фактором риска. Проглатывание ооцист из кошачьих фекалий считается наиболее вероятным конечным источником. [164] Поверхностные стоки , содержащие фекалии диких кошек, и мусор домашних кошек, смываемый в туалеты, являются возможными источниками ооцист. [165] [166] Эти же источники могли также занести инфекцию токсоплазмоза находящемуся под угрозой исчезновения гавайскому тюленю-монаху . [167] Заражение паразитом способствовало гибели по меньшей мере четырех гавайских тюленей-монахов. [167] Заражение гавайского тюленя-монаха T. gondii было впервые отмечено в 2004 году. [168] Распространение паразита угрожает восстановлению этого находящегося под угрозой исчезновения ластоногого. Паразиты были обнаружены у дельфинов и китов. [169] [170] Исследователи Блэк и Мэсси полагают, что анчоусы, которые перемещаются из эстуариев в открытый океан, могут способствовать распространению болезни. [171]
Toxoplasma gondii была зарегистрирована как причина смерти гигантской панды, содержавшейся в зоопарке в Китае, которая умерла в 2014 году от острого гастроэнтерита и респираторного заболевания . [111] Хотя этот отчет, казалось бы, анекдотичен , он подчеркивает, что все теплокровные виды, вероятно, инфицированы T. gondii , включая находящиеся под угрозой исчезновения виды, такие как гигантская панда. [ требуется ссылка ]

Хроническая инфекция T. gondii традиционно считалась бессимптомной у людей с нормальной иммунной функцией. [172] Некоторые данные свидетельствуют о том, что латентная инфекция может тонко влиять на ряд поведенческих реакций и тенденций человека, а инфекция может изменять восприимчивость или интенсивность ряда психиатрических или неврологических расстройств. [173] [172]
В большинстве текущих исследований, где были обнаружены положительные корреляции между титрами антител T. gondii и определенными поведенческими чертами или неврологическими расстройствами, тесты на серопозитивность T. gondii проводятся после начала исследуемого заболевания или поведенческого признака; то есть часто неясно, увеличивает ли заражение паразитом шансы иметь определенный признак или расстройство, или увеличивает ли наличие определенного признака или расстройства шансы заразиться паразитом. [174] Группы людей с определенными поведенческими чертами или неврологическими расстройствами могут разделять определенные поведенческие тенденции, которые увеличивают вероятность воздействия и заражения T. gondii ; в результате трудно подтвердить причинно-следственные связи между инфекциями T. gondii и связанными с ними неврологическими расстройствами или поведенческими чертами. [174]
Некоторые данные связывают T. gondii с шизофренией . [172] Два метаанализа 2012 года показали, что показатели антител к T. gondii у людей с шизофренией были в 2,7 раза выше, чем в контрольной группе. [175] [176] Поэтому позитивность антител к T. gondii считалась промежуточным фактором риска по сравнению с другими известными факторами риска. [175] Отмеченные предостережения включают в себя то, что тесты на антитела не обнаруживают токсоплазмоз напрямую, у большинства людей с шизофренией нет антител к токсоплазмозу, и может существовать предвзятость публикации . [176] Хотя в большинстве этих исследований люди с уже диагностированной шизофренией тестировались на антитела к T. gondii , связь между T. gondii и шизофренией была обнаружена до появления симптомов шизофрении. [147] Различия в возрасте начала шизофрении по половому признаку могут быть частично объяснены вторым пиком заболеваемости инфекцией T. gondii в возрасте 25–30 лет только у женщин. [177] Хотя механизм, подтверждающий связь между шизофренией и инфекцией T. gondii , неясен, исследования изучали молекулярную основу этой корреляции. [177] Антипсихотические препараты, используемые при шизофрении, по-видимому, подавляют репликацию тахизоитов T. gondii в клеточной культуре. [147] Предполагая, что существует причинно-следственная связь между T. gondii и шизофренией, исследованиям еще предстоит определить, почему только у некоторых людей со скрытым токсоплазмозом развивается шизофрения; некоторые правдоподобные объяснения включают различную генетическую восприимчивость, различия в штаммах паразитов и различия в пути приобретенной инфекции T. gondii . [178]
Корреляции также были обнаружены между титрами антител к T. gondii и ОКР , а также самоубийствами среди людей с расстройствами настроения, включая биполярное расстройство . [173] [179] Положительные титры антител к T. gondii , по-видимому, не коррелируют с большой депрессией или дистимией . [180] Хотя существует корреляция между T. gondii и многими психологическими расстройствами, лежащий в основе механизм неясен. Исследование 2016 года 236 человек с высоким уровнем антител к токсоплазмозу показало, что «было мало доказательств того, что T. gondii был связан с повышенным риском психического расстройства, плохим контролем импульсов, личностными аберрациями или нейрокогнитивными нарушениями». [181]
Скрытая инфекция связана с болезнью Паркинсона и болезнью Альцгеймера . [173]
У людей с рассеянным склерозом уровень инфицирования примерно на 15% ниже, чем у населения в целом. [182]
Скрытая инфекция T. gondii у людей связана с более высоким риском автомобильных аварий [183] , что может быть связано с нарушением психомоторной активности или повышенным рискованным профилем личности [173] .
Сообщалось, что изменение климата влияет на возникновение, выживание, распространение и передачу T. gondii . [184] T. gondii был обнаружен в канадской Арктике, месте, которое когда-то было слишком холодным для его выживания. [185] Более высокие температуры увеличивают время выживания T. gondii . [184] Большее таяние снега и осадков может увеличить количество ооцист T. gondii , которые переносятся речным потоком. [184] Изменения в популяциях птиц, грызунов и насекомых и схемах миграции могут повлиять на распространение T. gondii из-за их роли в качестве резервуара и переносчика. [184] Урбанизация и естественная деградация окружающей среды также, как предполагается, влияют на передачу T. gondii и увеличивают риск заражения. [184]
Токсоплазмоз становится глобальной угрозой здоровью, поскольку им заражено 30–50% населения мира.
Накапливающиеся данные свидетельствуют о том, что латентная инфекция Toxoplasma gondii связана с различными нейропсихиатрическими и поведенческими состояниями.
При острой инфекции тахизоиты обнаруживаются во всех органах, особенно в мышцах, включая сердце, а также в печени, селезенке, лимфатических узлах и ЦНС.
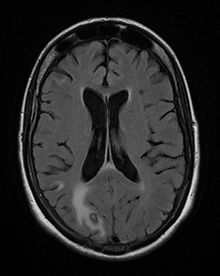
Серопревалентность T. gondii у людей колеблется от 10 до 70% во всем мире в зависимости от региона и значительно увеличивается с возрастом. После заражения паразиты сохраняются в виде внутринейрональных цист в центральной нервной системе (ЦНС) в течение всей жизни хозяина (1, Рисунок 1). До недавнего времени персистенция паразита у здоровых людей считалась клинически бессимптомной. Однако в последнее десятилетие появилось несколько сообщений, указывающих на то, что хронический церебральный токсоплазмоз может влиять на поведение хозяина (2).
Зоонозный патоген
Toxoplasma gondii
заражает более 30% человеческой популяции. Внутриклеточный паразит может сохраняться в ЦНС в нейронах на протяжении всей жизни, изменяя их функцию и структуру, что приводит к специфическим поведенческим изменениям хозяина. ... Более того, исследования человеческой популяции сопоставили серопозитивность
Toxoplasma
с изменениями неврологических функций; однако сложные основные механизмы едва заметного поведенческого изменения до сих пор полностью не изучены. Паразиты способны вызывать прямые изменения в инфицированных клетках, например, изменяя метаболизм дофамина, функционально подавляя нейроны, а также препятствуя апоптозу.
Девять из одиннадцати исследований с использованием опросника самоотчета Кеттелла из 16 личностных факторов показали значимые и последовательные результаты для обоих полов. Серопозитивные мужчины в целом меньше уважали правила и были более бдительными (подозрительными, ревнивыми, жесткими/негибкими), чем серонегативные мужчины. Напротив, серопозитивные женщины больше уважали правила и были более сердечными, чем серонегативные женщины. Оба серопозитивных пола были более тревожными, чем соответствующие здоровые субъекты сравнения. ... Поведенческие наблюдения и интервью были завершены, чтобы выяснить, были ли гендерные различия, обнаруженные в показателях самоотчета, воспроизведены объективными показателями. Серопозитивные мужчины набрали значительно меньше баллов, чем серонегативные мужчины по самоконтролю, опрятности одежды и отношениям. Различия были менее впечатляющими для серопозитивных женщин, с тенденцией к более высоким баллам по самоконтролю и опрятности одежды по сравнению с серонегативными женщинами. Авторы рассматривают результаты исследования как объективное подтверждение того, что присутствие
T. gondii
может изменить поведение человека-хозяина.
{{cite journal}}: CS1 maint: DOI inactive as of October 2024 (link)модификации, вызванные наркотиками, играют важную роль в пластичности нейронов и в поведенческих реакциях, вызванных наркотиками. Хотя лишь немногие исследования изучали влияние AMPH на регуляцию генов (таблица 1), текущие данные свидетельствуют о том, что AMPH действует на нескольких уровнях, изменяя взаимодействие гистонов/ДНК и привлекая факторы транскрипции, которые в конечном итоге вызывают репрессию некоторых генов и активацию других генов. Важно отметить, что некоторые исследования также коррелируют эпигенетическую регуляцию, вызванную AMPH, с поведенческими результатами, вызванными этим препаратом, что позволяет предположить, что эпигенетическое ремоделирование лежит в основе поведенческих изменений, вызванных AMPH. Если это подтвердится, то использование специфических препаратов, ингибирующих ацетилирование, метилирование гистонов или метилирование ДНК, может стать важной терапевтической альтернативой для предотвращения и/или устранения зависимости от АМФ и смягчения побочных эффектов, вызываемых АМФ при использовании для лечения СДВГ.
Кратковременное увеличение ацетилирования гистонов обычно способствует поведенческим реакциям на наркотики, в то время как устойчивое увеличение противодействует эффектам кокаина, основываясь на действиях системного или внутри-NAc введения ингибиторов HDAC. ... Генетическая или фармакологическая блокада G9a в NAc потенцирует поведенческие реакции на кокаин и опиаты, тогда как увеличение функции G9a оказывает противоположный эффект (Maze et al., 2010; Sun et al., 2012a). Такое вызванное лекарствами снижение регуляции G9a и H3K9me2 также сенсибилизирует животных к пагубным эффектам последующего хронического стресса (Covington et al., 2011). Снижение регуляции G9a увеличивает дендритное разветвление нейронов NAc и связано с повышенной экспрессией многочисленных белков, вовлеченных в синаптическую функцию, которая напрямую связывает измененный G9a/H3K9me2 в синаптической пластичности, связанной с зависимостью (Maze et al., 2010).
«G9a, по-видимому, является критической контрольной точкой для эпигенетической регуляции в NAc, поскольку, как мы знаем, он функционирует в двух отрицательных обратных петлях. Он противодействует индукции ΔFosB, долгосрочного фактора транскрипции, важного для наркотической зависимости (Robison and Nestler, 2011), в то время как ΔFosB, в свою очередь, подавляет экспрессию G9a (Maze et al., 2010; Sun et al., 2012a). ... Кроме того, G9a индуцируется в NAc при длительном ингибировании HDAC, что объясняет парадоксальное ослабление поведенческих эффектов кокаина, наблюдаемых в этих условиях, как отмечено выше (Kennedy et al., 2013). Гены субъединиц рецептора GABAA входят в число тех, которые контролируются этой обратной петлей. Таким образом, хронический кокаин или длительное ингибирование HDAC индуцируют несколько субъединиц рецептора GABAA в NAc, что связано с повышенной частотой Тормозные постсинаптические токи (IPSC). В разительном контрасте комбинированное воздействие кокаина и ингибирование HDAC, которое запускает индукцию G9a и повышает глобальные уровни H3K9me2, приводит к блокаде рецептора GABAA и регуляции IPSC.