Протеаза (также называемая пептидазой , протеиназой или протеолитическим ферментом ) [1] — это фермент , который катализирует протеолиз , расщепляя белки на более мелкие полипептиды или отдельные аминокислоты и стимулируя образование новых белковых продуктов. [2] Они делают это, расщепляя пептидные связи внутри белков путем гидролиза — реакции, при которой вода разрывает связи . Протеазы участвуют во многих биологических путях, включая переваривание проглоченных белков, катаболизм белков (расщепление старых белков) [3] [4] и передачу сигналов в клетках .
В отсутствие функциональных ускорителей протеолиз будет очень медленным и займет сотни лет . [5] Протеазы можно найти во всех формах жизни и вирусах . Они неоднократно эволюционировали независимо , и разные классы протеаз могут выполнять одну и ту же реакцию с помощью совершенно разных каталитических механизмов .
Протеазы можно разделить на семь широких групп: [6]
Впервые протеазы были сгруппированы в 84 семейства в соответствии с их эволюционным родством в 1993 году и классифицированы по четырем каталитическим типам: сериновые , цистеиновые , аспарагиновые и металлопротеазы . [ 7] Треониновые и глутаминовые протеазы не были описаны до 1995 и 2004 годов соответственно. Механизм, используемый для расщепления пептидной связи , включает в себя превращение аминокислотного остатка, содержащего цистеин и треонин (протеазы) или молекулу воды (аспарагиновая, глутаминовая и металлопротеазы), в нуклеофильный характер, чтобы он мог атаковать карбонильную группу пептида . Одним из способов создания нуклеофила является каталитическая триада , где остаток гистидина используется для активации серина , цистеина или треонина в качестве нуклеофила. Однако это не эволюционная группировка, поскольку типы нуклеофилов эволюционировали конвергентно в разных суперсемействах , а некоторые суперсемейства демонстрируют дивергентную эволюцию с образованием множества разных нуклеофилов. Металлопротеазы, аспарагиновые и глутаминовые протеазы используют остатки своего активного центра для активации молекулы воды, которая затем атакует разрезаемую связь. [8]
Седьмой каталитический тип протеолитических ферментов, аспарагин-пептидлиаза , был описан в 2011 году. Его протеолитический механизм необычен, поскольку вместо гидролиза он осуществляет реакцию элиминирования . [9] Во время этой реакции каталитический аспарагин образует циклическую химическую структуру, которая расщепляется по остаткам аспарагина в белках при правильных условиях. Учитывая его принципиально иной механизм, его включение в качестве пептидазы может быть дискуссионным. [9]
Современная классификация эволюционных суперсемейств протеаз содержится в базе данных MEROPS. [10] В этой базе данных протеазы классифицируются в первую очередь по «кланам» ( суперсемействам ) на основе структуры, механизма и порядка каталитических остатков (например, клан PA , где P указывает на смесь семейств нуклеофилов). Внутри каждого «клана» протеазы классифицируются на семейства на основе сходства последовательностей (например, семейства S1 и C3 в клане PA). Каждое семейство может содержать многие сотни родственных протеаз (например , трипсин , эластаза , тромбин и стрептогризин внутри семейства S1).
В настоящее время известно более 50 кланов, каждый из которых указывает на независимое эволюционное происхождение протеолиза. [10]
Альтернативно, протеазы можно классифицировать по оптимальному pH , при котором они активны:
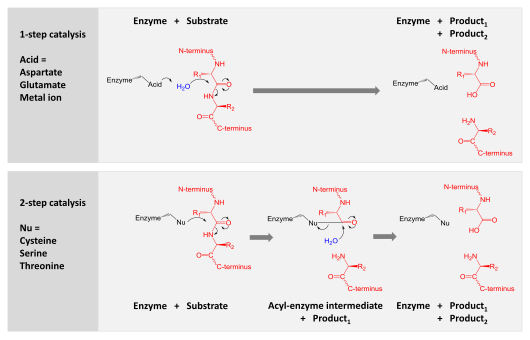
Протеазы участвуют в расщеплении длинных белковых цепей на более короткие фрагменты путем расщепления пептидных связей , связывающих аминокислотные остатки. Некоторые отсоединяют концевые аминокислоты от белковой цепи ( экзопептидазы , такие как аминопептидазы , карбоксипептидаза А ); другие атакуют внутренние пептидные связи белка ( эндопептидазы , такие как трипсин , химотрипсин , пепсин , папаин , эластаза ).
Катализ осуществляется по одному из двух механизмов:
Протеолиз может быть очень беспорядочным , так что гидролизуется широкий спектр белковых субстратов. Это относится к пищеварительным ферментам, таким как трипсин , которые должны быть способны расщеплять массив потребляемых белков на более мелкие пептидные фрагменты. Неразборчивые протеазы обычно связываются с одной аминокислотой на субстрате и поэтому обладают специфичностью только к этому остатку. Например, трипсин специфичен для последовательностей ...K\... или ...R\... ('\'=сайт расщепления). [12]
И наоборот, некоторые протеазы высокоспецифичны и расщепляют субстраты только с определенной последовательностью. Свертывание крови (например, тромбин ) и обработка вирусных полипротеинов (например, протеаза TEV ) требуют такого уровня специфичности для достижения точных событий расщепления. Это достигается за счет протеаз, имеющих длинную связывающую щель или туннель с несколькими карманами, которые связываются с указанными остатками. Например, протеаза TEV специфична для последовательности ...ENLYFQ\S... ('\'=сайт расщепления). [13]
Протеазы, будучи сами белками, расщепляются другими молекулами протеаз, иногда того же типа. Это действует как метод регуляции активности протеазы. Некоторые протеазы менее активны после аутолиза (например, протеаза TEV ), тогда как другие более активны (например, трипсиноген ).
Протеазы встречаются во всех организмах, от прокариот до эукариот и вирусов . Эти ферменты участвуют во множестве физиологических реакций, от простого переваривания пищевых белков до высокорегулируемых каскадов (например, каскада свертывания крови , системы комплемента , путей апоптоза и каскада активации профенолоксидазы у беспозвоночных). Протеазы могут либо разрывать специфические пептидные связи ( ограниченный протеолиз ), в зависимости от аминокислотной последовательности белка, либо полностью расщеплять пептид до аминокислот ( неограниченный протеолиз ). Активность может быть деструктивным изменением (отмена функции белка или расщепление его на основные компоненты), активацией функции или сигналом в сигнальном пути.
Геномы растений кодируют сотни протеаз, функции которых в основном неизвестны. Те, функция которых известна, в значительной степени участвуют в регуляции развития . [14] Растительные протеазы также играют роль в регуляции фотосинтеза . [15]
Протеазы используются в организме для различных метаболических процессов. Кислые протеазы, секретируемые в желудке (например, пепсин ), и сериновые протеазы, присутствующие в двенадцатиперстной кишке ( трипсин и химотрипсин ), позволяют нам переваривать белок пищи. Присутствующие в сыворотке крови протеазы ( тромбин , плазмин , фактор Хагемана и др.) играют важную роль в свертывании крови, а также лизисе тромбов, правильном действии иммунной системы. Другие протеазы присутствуют в лейкоцитах ( эластаза , катепсин G ) и играют несколько различных ролей в метаболическом контроле. Некоторые змеиные яды также являются протеазами, например, гемотоксин гадюки , и мешают каскаду свертывания крови жертвы. Протеазы определяют время жизни других белков, играющих важную физиологическую роль, таких как гормоны, антитела или другие ферменты. Это один из наиболее быстрых «включающихся» и «выключающихся» регуляторных механизмов в физиологии организма.
Благодаря сложному совместному действию протеазы могут катализировать каскадные реакции, которые приводят к быстрому и эффективному усилению ответа организма на физиологический сигнал.
Бактерии секретируют протеазы для гидролиза пептидных связей в белках и, следовательно, расщепления белков на составляющие их аминокислоты . Бактериальные и грибковые протеазы особенно важны для глобальных циклов углерода и азота при переработке белков, и такая активность, как правило, регулируется сигналами питания в этих организмах. [16] Чистое влияние регулирования активности протеаз с помощью питания среди тысяч видов, присутствующих в почве, можно наблюдать на уровне общего микробного сообщества, поскольку белки расщепляются в ответ на ограничение углерода, азота или серы. [17]
Бактерии содержат протеазы, ответственные за общий контроль качества белков (например, протеасома ААА+ ), разрушая развернутые или неправильно свернутые белки .
Секретируемая бактериальная протеаза может также действовать как экзотоксин и быть примером фактора вирулентности в бактериальном патогенезе (например, эксфолиативный токсин ). Бактериальные экзотоксические протеазы разрушают внеклеточные структуры.
Геномы некоторых вирусов кодируют один массивный полипротеин , для расщепления которого на функциональные единицы требуется протеаза (например, вирус гепатита С и пикорнавирусы ). [18] Эти протеазы (например, протеаза TEV ) обладают высокой специфичностью и расщепляют только очень ограниченный набор последовательностей субстрата. Поэтому они являются общей мишенью для ингибиторов протеазы . [19] [20]
Археи используют протеазы для регулирования различных клеточных процессов, включая передачу сигналов клетками , метаболизм , секрецию и контроль качества белка. [21] [22] У архей обнаружены только две АТФ-зависимые протеазы: мембраносвязанная протеаза LonB и растворимый 20S протеосомный комплекс. [21]
Область исследований протеаз огромна. С 2004 года ежегодно публикуется около 8000 статей в этой области. [23] Протеазы используются в промышленности, медицине и в качестве основного инструмента биологических исследований. [24] [25]
Пищеварительные протеазы входят в состав многих стиральных порошков , а также широко используются в хлебной промышленности в качестве улучшителя хлеба . В медицине используются различные протеазы как для их естественной функции (например, контроль свертывания крови), так и для совершенно искусственных функций ( например , для целенаправленной деградации патогенных белков). Высокоспецифичные протеазы, такие как протеаза TEV и тромбин , обычно используются для контролируемого расщепления слитых белков и аффинных меток . Содержащие протеазу растительные растворы, называемые вегетарианским сычужным ферментом, уже сотни лет используются в Европе и на Ближнем Востоке для изготовления кошерных и халяльных сыров . Вегетарианский сычужный фермент Withania coagulans использовался на протяжении тысячелетий в качестве аюрведического средства для улучшения пищеварения и лечения диабета на Индийском субконтиненте. Его также используют для приготовления панира .
Активность протеаз ингибируется ингибиторами протеаз . [26] Одним из примеров ингибиторов протеаз является суперсемейство серпинов . В его состав входят альфа-1-антитрипсин (защищающий организм от чрезмерного воздействия собственных воспалительных протеаз), альфа-1-антихимотрипсин (который действует аналогичным образом), С1-ингибитор (защищающий организм от чрезмерной протеазной активации собственной системы комплемента ). ), антитромбин (который защищает организм от чрезмерной коагуляции ), ингибитор активатора плазминогена-1 (который защищает организм от неадекватной коагуляции путем блокирования фибринолиза , запускаемого протеазой ) и нейросерпина . [27]
Природные ингибиторы протеаз включают семейство белков липокалинов , которые играют роль в регуляции и дифференцировке клеток. Было обнаружено, что липофильные лиганды, прикрепленные к белкам липокалина, обладают свойствами ингибирования опухолевых протеаз. Природные ингибиторы протеазы не следует путать с ингибиторами протеазы , используемыми в антиретровирусной терапии. Некоторые вирусы , в том числе ВИЧ/СПИД , в своем репродуктивном цикле зависят от протеаз. Таким образом, ингибиторы протеаз разрабатываются как противовирусные терапевтические средства.
Другие природные ингибиторы протеаз используются в качестве защитных механизмов. Распространенными примерами являются ингибиторы трипсина, обнаруженные в семенах некоторых растений, наиболее примечательными для людей являются соевые бобы, основная продовольственная культура, где они действуют, отпугивая хищников. Сырые соевые бобы токсичны для многих животных, включая человека, пока содержащиеся в них ингибиторы протеазы не будут денатурированы.
Чтобы оценить относительную эффективность ферментов, катализирующих гидролиз внутренних и С-концевых пептидных связей [...]