Mycoplasma pneumoniae — это вид очень мелких клеточных бактерий , не имеющих клеточной стенки , из класса Mollicutes . M. pneumoniae — это патоген человека, вызывающий заболевание Mycoplasma pneumonia , форму атипичной бактериальной пневмонии, связанной с болезнью холодовой агглютинации . M. pneumoniae характеризуется отсутствием пептидогликановой клеточной стенки и, как следствие, устойчивостью ко многим антибактериальным агентам, активным в клеточной стенке .
Сохранение инфекции M. pneumoniae даже после лечения связано с ее способностью имитировать состав поверхности клетки хозяина .
В 1898 году Нокар и Ру выделили агент, предположительно являющийся причиной пневмонии крупного рогатого скота, и назвали его микробом перипневмонии [1] [2] [3] [4] [5] [6] Микроорганизмы из других источников, имеющие свойства, схожие со свойствами возбудителя плевропневмонии (PPO) крупного рогатого скота, вскоре стали известны как организмы, подобные плевропневмонии (PPLO), но их истинная природа оставалась неизвестной. [1] [2] [3] [4] Позднее было доказано, что многие PPLO являются причиной пневмонии и артрита у нескольких низших животных. [1] [7] [8] [9]
В 1944 году Монро Итон использовал эмбрионированные куриные яйца для культивирования агента, который, как считалось, является причиной первичной атипичной пневмонии человека (PAP), широко известной как «ходячая пневмония». [10] Этот неизвестный организм стал известен как «агент Итона». [11] В то время использование Итоном эмбрионированных яиц, которые затем применялись для культивирования вирусов, подтверждало идею о том, что агент Итона был вирусом. Однако было известно, что PAP поддается лечению антибиотиками широкого спектра действия , что делает вирусную этиологию подозреваемой. [1] [2] [7] [12] [13]
Роберт Чанок , исследователь из NIH , изучавший возбудителя Итона как вирус, посетил Институт Вистара в Филадельфии в 1961 году, чтобы получить клеточную культуру нормального штамма человеческих клеток, разработанного Леонардом Хейфликом . Этот штамм клеток был известен своей исключительной чувствительностью к выделению и выращиванию человеческих вирусов. Чанок рассказал Хейфлику о своих исследованиях возбудителя Итона и о своей вере в то, что его вирусная природа сомнительна. Хотя Хейфлик мало знал о текущих исследованиях этого возбудителя, его докторская диссертация была посвящена болезням животных, вызванным PPLO. Хейфлик знал, что многие низшие животные страдают от пневмоний, вызванных PPLO (позже названными микоплазмами ). Хейфлик рассудил, что возбудитель Итона может быть микоплазмой, а не вирусом. Чанок никогда не слышал о микоплазмах и по просьбе Хейфлика отправил ему яичный желток, содержащий возбудителя Итона. [1] [4] [14] [15] [16] [17]
Используя новую формулу агара и жидкой среды, которую он разработал, [14] Хейфлик выделил уникальную микоплазму из яичного желтка. Вскоре Чанок и Хейфлик доказали, что это возбудитель PAP. [14] [18] [19] [20] Когда это открытие стало известно Эмми Клинебергер-Нобель из Института Листера в Лондоне, ведущему мировому авторитету в области этих организмов, она предложила назвать организм Mycoplasma hayflickiae . [21] Хейфлик возразил в пользу Mycoplasma pneumoniae . [22] [23]
Этот самый маленький свободноживущий микроорганизм был первым, который был выделен и признан причиной заболевания человека. За свое открытие Хейфлик был удостоен Президентской премии Международной организации микоплазмологии. Инвертированный микроскоп, под которым Хейфлик открыл Mycoplasma pneumoniae, хранится в Смитсоновском институте . [20]
Термин микоплазма ( mykes означает грибок, иplasma означает сформированный) происходит от грибоподобного роста некоторых видов микоплазм. [6] Микоплазмы были классифицированы как Mollicutes («mollis», что означает мягкий и «cutis», что означает кожа) в 1960 году из-за их небольшого размера и генома , отсутствия клеточной стенки , низкого содержания G+C и необычных потребностей в питании . [6] [24]
Микоплазмы, которые являются одними из самых маленьких самовоспроизводящихся организмов, являются паразитическими видами, у которых отсутствует клеточная стенка и периплазматическое пространство , которые имеют редуцированные геномы и ограниченную метаболическую активность. [6] [25] [26] M. pneumoniae также был обозначен как вид, не ферментирующий аргинин . [25] Микоплазмы далее классифицируются по составу последовательности 16s рРНК . Все микоплазмы группы pneumoniae обладают схожими вариациями 16s рРНК, уникальными для этой группы, из которых M. pneumoniae имеет 6,3% вариаций в консервативных областях , что предполагает микоплазмы, образованные путем дегенеративной эволюции из грамположительной эубактериальной группы, которая включает бациллы , стрептококки и лактобациллы . [6] [24] [25] M. pneumoniae является членом семейства Mycoplasmataceae и порядка Mycoplasmatales . [6]
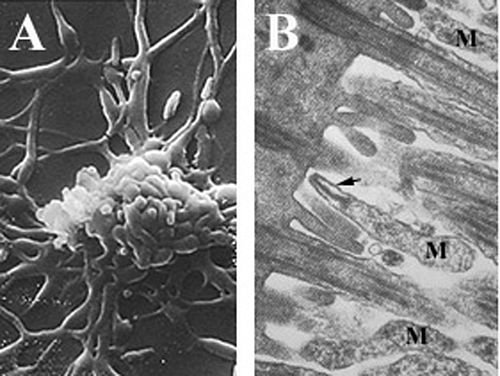
Клетки Mycoplasma pneumoniae имеют удлиненную форму, которая составляет приблизительно 0,1–0,2 мкм (100–200 нм ) в ширину и 1–2 мкм (1000–2000 нм) в длину. Чрезвычайно малый размер клеток означает, что их невозможно исследовать с помощью световой микроскопии ; для просмотра морфологии колоний M. pneumoniae , которые обычно имеют длину менее 100 мкм, требуется стереомикроскоп. [6] Неспособность синтезировать клеточную стенку пептидогликана обусловлена отсутствием генов, кодирующих ее образование, и приводит к повышению важности поддержания осмотической стабильности для предотвращения высыхания . [6] Отсутствие клеточной стенки также требует повышенной поддержки клеточной мембраны (усиленной стеролами), которая включает жесткий цитоскелет, состоящий из сложной белковой сети и, потенциально, внеклеточной капсулы для облегчения прилипания к клетке-хозяину . [6] M. pneumoniae — единственные бактериальные клетки, которые имеют холестерин в своей клеточной мембране (полученный от хозяина) и обладают большим количеством генов, кодирующих вариации мембранных липопротеинов , чем другие микоплазмы, [25], которые, как полагают, связаны с его паразитическим образом жизни. Клетки M. pneumoniae также обладают органеллой прикрепления , которая используется в скользящей подвижности организма неизвестным механизмом. [6]
Секвенирование генома M. pneumoniae в 1996 году показало, что его размер составляет 816 394 п.н. [24] Геном содержит 687 генов, кодирующих белки, из которых около 56,6% кодируют основные метаболические ферменты ; в частности, те, которые участвуют в гликолизе и ферментации органических кислот . [6] [24] [25] [27] Следовательно, M. pneumoniae очень восприимчив к потере ферментативной функции из-за мутаций генов , поскольку единственными буферными системами против функциональной потери из-за точечных мутаций являются поддержание пентозофосфатного пути и метаболизма нуклеотидов . [27] Предполагается, что потеря функции в других путях компенсируется метаболизмом клетки-хозяина. [27] Помимо возможности потери функции пути, в редуцированном геноме M. pneumoniae полностью отсутствуют ряд путей, включая цикл трикарбоновых кислот , дыхательную цепь переноса электронов и пути биосинтеза аминокислот , жирных кислот , холестерина , пуринов и пиримидинов . [6] [25] [27] Эти ограничения делают M. pneumoniae зависимыми от систем импорта для получения основных строительных блоков от хозяина или окружающей среды, которые не могут быть получены через гликолитические пути . [25] [27] Наряду с энергозатратным производством белка и РНК , большая часть энергетического метаболизма расходуется на поддержание протонных градиентов (до 80%) из-за высокого соотношения площади поверхности к объему клеток M. pneumoniae . Только 12–29% энергетического метаболизма направляется на рост клеток , что необычно мало для бактериальных клеток и считается адаптацией к их паразитическому образу жизни. [27]
В отличие от других бактерий, M. pneumoniae использует кодон UGA для кодирования триптофана, а не как стоп-кодон. [6] [24]
Mycoplasma pneumoniae имеет сокращенный метаболом по сравнению с другими видами бактерий . [28] Это означает, что у патогена меньше метаболических реакций по сравнению с другими видами бактерий, такими как B.subtilis и Escherichia coli . [28] [29]

Поскольку Mycoplasma pneumoniae имеет редуцированный геном, у него меньшее количество общих путей и метаболических ферментов, что способствует его более линейному метаболому. [28] Линейный метаболом делает Mycoplasma pneumoniae менее адаптивной к внешним факторам. [28] Кроме того, поскольку Mycoplasma pneumoniae имеет редуцированный геном, большинство его метаболических ферментов являются незаменимыми. [28] Это контрастирует с другим модельным организмом, Escherichia coli , у которого только 15% его метаболических ферментов являются незаменимыми. [28] Подводя итог, можно сказать, что линейная топология метаболома Mycoplasma pneumoniae приводит к снижению эффективности его метаболических реакций, но по-прежнему сохраняет схожие уровни концентраций метаболитов, клеточной энергетики, адаптивности и глобальной экспрессии генов. [28]
В таблице выше показана средняя длина пути для метаболомов M. pneumoniae , E. coli , L. lactis и B. subtilis . [28] Это число описывает, по сути, среднее число реакций, которые происходят в метаболоме. Mycoplasma pneumoniae , в среднем, имеет большое число реакций на путь в пределах своего метаболома по сравнению с другими модельными бактериальными видами. [28]
Одним из эффектов уникального метаболома Mycoplasma pneumoniae является более длительное время его дупликации. [28] В среднем патогену требуется значительно больше времени для дупликации по сравнению с другими модельными организмами-бактериями. [28] Это может быть связано с тем, что метаболом Mycoplasma pneumoniae менее эффективен, чем метаболом Escherichia coli . [28]
Метаболом Mycoplasma pneumoniae также может быть информативным при анализе его патогенеза. [31] Обширное изучение метаболической сети этого организма привело к выявлению биомаркеров , которые потенциально могут выявить наличие обширных осложнений, которые могут вызывать бактерии. [31] Метаболомика все чаще используется как полезный инструмент для проверки биомаркеров инфекционных патогенов. [31]

Mycoplasma pneumoniae паразитирует в эпителии дыхательных путей человека. [6] Считается, что присоединение к клеткам эпителия дыхательных путей происходит через органеллу прикрепления с последующим уклонением от иммунной системы хозяина путем внутриклеточной локализации и корректировки состава клеточной мембраны для имитации мембраны клетки хозяина. [ требуется ссылка ] Mycoplasma pneumoniae растет исключительно путем паразитирования на млекопитающих. Размножение , таким образом, зависит от прикрепления к клетке хозяина. По словам Уэйтса и Токингтона, специализированное размножение происходит путем « бинарного деления , временно связанного с дубликацией ее органеллы прикрепления, которая мигрирует на противоположный полюс клетки во время репликации и до разделения нуклеоида ». [6] Мутации , которые влияют на образование органеллы прикрепления, не только препятствуют подвижности и делению клеток , но и снижают способность клеток M. pneumoniae прикрепляться к клетке хозяина. [25]
Присоединение M. pneumoniae к клетке-хозяину (обычно к клетке дыхательных путей , но иногда к эритроциту или клетке урогенитальной выстилки ) является инициирующим событием для легочного заболевания и связанных с ним симптомов. [6] Специализированная органелла прикрепления представляет собой полярное , электронно-плотное и удлиненное расширение клетки, которое облегчает подвижность и прилипание к клеткам-хозяевам. [6] [25] Она состоит из центральной нити , окруженной внутрицитоплазматическим пространством , а также ряда адгезинов и структурных и вспомогательных белков, локализованных на кончике органеллы. [6] [25] Известно, что различные белки способствуют формированию и функциональности органеллы прикрепления, включая вспомогательные белки HMW1–HMW5, P30, P56 и P90, которые обеспечивают структуру и адгезионную поддержку, а также P1, P30 и P116, которые непосредственно участвуют в прикреплении. [6] [32] [33] Эта сеть белков участвует не только в инициации образования органелл прикрепления и адгезии, но и в подвижности . [33] Адгезин P1 (трипсин-чувствительный белок) представляет собой белок массой 120 кДа , сильно сгруппированный на поверхности кончика органелл прикрепления в вирулентных микоплазмах. [6] [33] [34] Для прикрепления M. pneumoniae к клетке-хозяину требуется как присутствие P1, так и его концентрация на поверхности клетки . Было показано, что клетки M. pneumoniae, обработанные моноклональными антителами, специфичными к иммуногенному С-концу адгезина P1, ингибируют свою способность прикрепляться к поверхности клетки-хозяина примерно на 75%, что позволяет предположить, что P1 является основным компонентом адгезии. [6] [32] [33] Эти антитела также снижают способность клетки быстро скользить , что может способствовать снижению адгезии к хозяину, затрудняя их способность находить клетку-хозяина. [32] Кроме того, мутации в P1 или деградация при обработке трипсином приводят к образованию авирулентных клеток M. pneumoniae . [6] Потеря белков в цитоскелете , участвующих в локализации P1 в структуре кончика, таких как HMW1–HMW3, также вызывает авирулентность.из-за отсутствия кластеризации адгезина. [33] [34] Другим белком, который, как считается, играет важную роль в адгезии, является P30, поскольку клетки M. pneumoniae с мутациями в этом белке или у которых выработались антитела против P30, неспособны прикрепляться к клеткам-хозяевам. [6] [25] P30 не участвует в локализации P1 в структуре кончика, поскольку P1 перемещается в органеллу прикрепления у мутантов P30, но вместо этого он может функционировать как рецептор -связывающий вспомогательный адгезин. [25] [34] Мутанты P30 также демонстрируют отличительные морфологические особенности, такие как множественные доли и округлую форму в отличие от удлиненной, что предполагает, что P30 может взаимодействовать с цитоскелетом во время формирования органеллы прикрепления. [25] Ряд компонентов поверхности эукариотических клеток были вовлечены в адгезию клеток M. pneumoniae к эпителию дыхательных путей . Среди них сиалогликоконъюгаты , сульфатированные гликолипиды , гликопротеины , фибронектин и рецепторы нейраминовой кислоты . [6] [32] [35] Лектины на поверхности бактериальных клеток способны связывать олигосахаридные цепи на гликолипидах и гликопротеинах для облегчения прикрепления, в дополнение к белкам TU и пируватдегидрогеназе E1 β , которые связываются с фибронектином. [6] [32]

Mycoplasma pneumoniae сливается с клетками хозяина и выживает внутриклеточно . Таким образом, он может уклоняться от обнаружения иммунной системой хозяина , противостоять лечению антибиотиками и пересекать слизистые барьеры. [6] [26] В дополнение к тесной физической близости M. pneumoniae и клеток хозяина, отсутствие клеточной стенки и специфических компонентов клеточной мембраны , таких как холестерин , может способствовать слиянию. Внутренняя локализация может вызывать хронические или латентные инфекции, поскольку M. pneumoniae способна сохраняться , синтезировать ДНК и реплицироваться внутри клетки хозяина даже после лечения антибиотиками. [26] Точный механизм внутриклеточной локализации неизвестен, однако потенциальная возможность цитоплазматической секвестрации внутри хозяина объясняет сложность полного устранения инфекций M. pneumoniae у пораженных людей. [6]
Помимо уклонения от иммунной системы хозяина путем внутриклеточной локализации, M. pneumoniae может изменять состав своей клеточной мембраны, чтобы имитировать мембрану клетки хозяина и избегать обнаружения клетками иммунной системы . Клетки M. pneumoniae обладают рядом белковых и гликолипидных антигенов , которые вызывают иммунные ответы , но вариации этих поверхностных антигенов позволят инфекции сохраняться достаточно долго, чтобы клетки M. pneumoniae слились с клетками хозяина и избежали обнаружения. Сходство между составами M. pneumoniae и клеточных мембран человека также может приводить к аутоиммунным реакциям в нескольких органах и тканях. [6]
Основной цитотоксический эффект M. pneumoniae заключается в локальном нарушении структуры тканей и клеток вдоль эпителия дыхательных путей из-за его прикрепления к клеткам хозяина. Прикрепление бактерий к клеткам хозяина может привести к потере ресничек , снижению метаболизма , биосинтеза и импорта макромолекул , и, в конечном итоге, инфицированные клетки могут быть сброшены с эпителиальной выстилки. [6] Локальное повреждение также может быть результатом приобретения лактоферрина и последующего образования гидроксильного радикала , супероксидного аниона и пероксида . [6]
Во-вторых, M. pneumoniae вырабатывает уникальный фактор вирулентности, известный как токсин внебольничного респираторного дистресс-синдрома (CARDS). [36] Токсин CARDS, скорее всего, способствует колонизации и патогенным путям M. pneumoniae, что приводит к воспалению и дисфункции дыхательных путей.
Третьим фактором вирулентности является образование перекиси водорода при инфекциях M. pneumoniae . [6] Когда M. pneumoniae прикрепляется к эритроцитам , перекись водорода диффундирует от бактерий к клетке-хозяину без ее детоксикации каталазой или пероксидазой , тем самым повреждая клетку-хозяина за счет снижения уровня глутатиона , повреждения липидных мембран и вызывая денатурацию белка , т. е . окисление гема и гемолиз . [6] [35]
Совсем недавно было показано, что перекись водорода играет незначительную роль в гемолизе, если вообще играет, но истинным виновником является сероводород . [37]
Цитотоксические эффекты инфекций M. pneumoniae приводят к распространенным симптомам, таким как кашель и раздражение легких , которые могут сохраняться в течение месяцев после того, как инфекция утихла. Местное воспаление и гиперреактивность, вызванная выработкой цитокинов, вызванной инфекцией, связаны с хроническими заболеваниями, такими как бронхиальная астма , а также с прогрессированием симптомов у лиц с муковисцидозом и ХОБЛ . [6]
Инфекции можно лечить пероральными антибиотиками из семейства макролидов , которые действуют путем ингибирования биосинтеза белка микоплазмы . Исторически эритромицин является старейшим препаратом. В качестве первого выбора используются азитромицин или кларитромицин , поскольку они имеют более удобную фармакокинетику, чем эритромицин: их нужно принимать только один или два раза, а не четыре раза в день, и у них меньше побочных эффектов. В качестве альтернативы можно использовать тетрациклины (например, доксициклин) и респираторные фторхинолоны (например, левофлоксацин или моксифлоксацин ); они имеют нежелательный профиль побочных эффектов у детей. Бета-лактамы, такие как пенициллин, совершенно неэффективны, поскольку они нацелены на синтез клеточной стенки.
Устойчивость к макролидам была зарегистрирована еще в 1967 году; Однако устойчивость растет с ростом использования с 2000 года. Устойчивость в 2020-х годах была самой высокой в Азии, достигая 100%, в то время как показатели в Соединенных Штатах варьировались от 3,5% до 13%. Одна базовая мутация в V-области 23S рРНК, например A2063/2064G [38], ответственна за более чем 90% инфекций, устойчивых к макролидам. [39]
Поскольку рутинное культивирование и тестирование на восприимчивость не проводятся, поскольку M. pneumoniae трудно выращивать, врачи выбирают антибиотик на основе оценки местной резистентности, ответа на лечение, т. е. переключают его, если лечение рефрактерно, и других факторов. [38]
В данной статье использован текст из CDC, являющийся общественным достоянием, как указано.