
Хлоропласт ( / ˈ k l ɔːr ə ˌ p l æ s t , - p l ɑː s t / ) [1] [ 2] представляет собой тип связанной с мембраной органеллы, известной как пластида , которая осуществляет фотосинтез в основном в растениях и водорослях . клетки . Фотосинтетический пигмент хлорофилл улавливает энергию солнечного света , преобразует ее и сохраняет в запасающих энергию молекулах АТФ и НАДФН , одновременно высвобождая кислород из воды в клетках. АТФ и НАДФН затем используются для создания органических молекул из углекислого газа в процессе, известном как цикл Кальвина . Хлоропласты выполняют ряд других функций, включая синтез жирных кислот , синтез аминокислот и иммунный ответ у растений. Число хлоропластов на клетку варьируется от одного у одноклеточных водорослей до 100 у таких растений, как арабидопсис и пшеница .
Хлоропласт характеризуется наличием двух мембран и высокой концентрацией хлорофилла . Другие типы пластид , такие как лейкопласты и хромопласты , содержат мало хлорофилла и не осуществляют фотосинтеза.
Хлоропласты очень динамичны — они циркулируют и перемещаются внутри растительных клеток, а иногда и сжимаются пополам для размножения. На их поведение сильно влияют факторы окружающей среды, такие как цвет и интенсивность света. Хлоропласты, как и митохондрии , содержат собственную ДНК , которая, как полагают, унаследована от их предка — фотосинтезирующей цианобактерии , поглощенной ранней эукариотической клеткой . [3] Хлоропласты не могут производиться растительной клеткой и должны быть унаследованы каждой дочерней клеткой во время клеточного деления.
За одним исключением ( амебоидная хроматофора Paulinella ), все хлоропласты, вероятно, можно проследить до одного эндосимбиотического события , когда цианобактерия была поглощена эукариотом. Несмотря на это, хлоропласты можно обнаружить у чрезвычайно широкого круга организмов, некоторые из которых не связаны напрямую друг с другом, что является следствием многих вторичных и даже третичных эндосимбиотических событий .
Слово «хлоропласт» происходит от греческих слов «хлорос » (χλωρός), что означает «зеленый», и « пласт» (πλάστης), что означает «тот, кто образует». [4]
Первое окончательное описание хлоропласта ( Chlorophyllkörnen , «зерно хлорофилла») было дано Гуго фон Молем в 1837 году как дискретных тел внутри зеленой растительной клетки. [5] В 1883 году Андреас Франц Вильгельм Шимпер назвал эти тела «хлоропластидами» ( Chloroplastiden ). [6] В 1884 году Эдуард Страсбургер принял термин «хлоропласты» ( Chloroplasten ). [7] [8] [9]
Хлоропласты — один из многих типов органелл растительной клетки. Считается, что они произошли от эндосимбиотических цианобактерий . Считается, что митохондрии возникли в результате аналогичного события эндосимбиоза , когда был поглощен аэробный прокариот . [10] Такое происхождение хлоропластов было впервые предложено русским биологом Константином Мерешковским в 1905 году [11] после того, как Андреас Франц Вильгельм Шимпер заметил в 1883 году, что хлоропласты очень напоминают цианобактерии . [6] Хлоропласты встречаются только у растений , водорослей , [12] и трех видов амеб – Paulinella chromatophora , P. micropora и морской P. longichromatophora . [13]
Хлоропласты считаются эндосимбиотическими цианобактериями. [14] Цианобактерии иногда называют сине-зелеными водорослями , хотя они и являются прокариотами . Это разнообразный тип грамотрицательных бактерий , способных осуществлять фотосинтез . Цианобактерии также содержат клеточную стенку пептидогликана , которая толще, чем у других грамотрицательных бактерий, и расположена между двумя клеточными мембранами. [15] Как и хлоропласты, они содержат тилакоиды . [16] На мембранах тилакоидов находятся фотосинтетические пигменты , в том числе хлорофилл а . [17] Фикобилины также являются распространенными цианобактериальными пигментами, обычно организованными в полусферические фикобилисомы , прикрепленные к внешней стороне тилакоидных мембран (хотя фикобилины не являются общими для всех хлоропластов). [17] [18]
![Первичный эндосимбиоз Эукариот с митохондриями поглотил цианобактерию в случае серийного первичного эндосимбиоза, создав линию клеток с обеими органеллами. Важно отметить, что цианобактериальный эндосимбионт уже имел двойную мембрану — мембрана, происходящая из фагосомальных вакуолей, была утрачена.[19]](http://upload.wikimedia.org/wikipedia/commons/thumb/b/b8/Chloroplast_endosymbiosis_simple.svg/440px-Chloroplast_endosymbiosis_simple.svg.png)
Где-то между 1 и 2 миллиардами лет назад [20] [21] [22] свободноживущая цианобактерия проникла в раннюю эукариотическую клетку либо в качестве пищи, либо в качестве внутреннего паразита , [10] но сумела выбраться из фагоцитарной вакуоли . содержатся в. [17] Две самые внутренние липидные двухслойные мембраны [23] , окружающие все хлоропласты, соответствуют внешней и внутренней мембранам грамотрицательной клеточной стенки предковой цианобактерии , [19] [24] [25] , а не фагосомальной мембране . от хоста, который, вероятно, был потерян. [19] Новый клеточный житель быстро стал преимуществом, обеспечив эукариотического хозяина пищей, что позволило ему жить внутри него. [10] Со временем цианобактерия ассимилировалась, и многие ее гены были потеряны или перенесены в ядро хозяина . [26] Из геномов, которые, вероятно, изначально содержали более 3000 генов, в хлоропластах современных растений осталось только около 130 генов. [21] Некоторые из его белков затем синтезировались в цитоплазме клетки-хозяина и импортировались обратно в хлоропласты (ранее цианобактерии). [26] [27] Отдельно где-то около 90–140 миллионов лет назад это произошло снова и привело к появлению амебоидной Paulinella chromatophora . [22]
Это событие называется эндосимбиозом , или «клеткой, живущей внутри другой клетки с взаимной выгодой для обеих». Внешнюю клетку обычно называют хозяином, а внутреннюю — эндосимбионтом . [10]
Считается, что хлоропласты возникли после митохондрий , поскольку все эукариоты содержат митохондрии, но не все имеют хлоропласты. [10] [28] Это называется серийным эндосимбиозом — ранний эукариот поглощает предка митохондрии , а некоторые его потомки затем поглощают предка хлоропласта, создавая клетку как с хлоропластами, так и с митохондриями. [10]
Вопрос о том, возникли ли первичные хлоропласты в результате одного эндосимбиотического события или множества независимых поглощений в различных эукариотических линиях, уже давно обсуждается. В настоящее время принято считать, что организмы с первичными хлоропластами имеют одного предка , который принял цианобактерию 600–2000 миллионов лет назад. [20] [22] Было высказано предположение, что ближайшим живым родственником этой бактерии является Gloeomargaritalitophora . [29] [30] [31] Исключением является амебоид Paulinella chromatophora , который происходит от предка, принявшего цианобактерию Prochromococcus 90–500 миллионов лет назад. [32] [31] [22]
Эти хлоропласты, происхождение которых можно проследить непосредственно от цианобактериального предка, известны как первичные пластиды [33] ( « пластид » в этом контексте означает почти то же самое, что и хлоропласт [10] ). Все первичные хлоропласты принадлежат к одной из четырех линий хлоропластов - линии глаукофитных хлоропластов, амебоидной линии Paulinella chromatophora , линии хлоропластов родофитов (красных водорослей) или линии хлоропластиданов (зеленых) хлоропластов. [34] Родофитные и хлоропластидановые линии являются самыми крупными, [ 19] причем хлоропластидан (зеленый) является тем, который содержит наземные растения . [19]
Обычно считается, что событие эндосимбиоза произошло у Archaeplastida , внутри которого Glaucophyta является возможной самой ранней дивергентной линией. [27] [14] Группа хлоропластов глаукофитов является наименьшей из трех основных линий хлоропластов, встречается только у 13 видов, [19] и считается той, которая разветвилась раньше всех. [19] [20] [35] Глаукофиты имеют хлоропласты, которые сохраняют пептидогликановую стенку между своими двойными мембранами, [33] как и их цианобактериальные родители. [15] По этой причине хлоропласты глаукофитов также известны как «муропласты» [33] (помимо «цианопластов» или «цианелл»). Хлоропласты глаукофитов также содержат концентрические несложенные тилакоиды , которые окружают карбоксисому – икосаэдрическую структуру, в которой хлоропласты глаукофитов и цианобактерии удерживают свой фермент фиксации углерода RuBisCO . Синтезируемый ими крахмал собирается вне хлоропласта. [17] Как и цианобактерии, тилакоиды хлоропластов глаукофитов и родофитов усеяны светособирающими структурами, называемыми фикобилисомами . [17] [33] По этим причинам хлоропласты глаукофитов считаются примитивным промежуточным звеном между цианобактериями и более развитыми хлоропластами красных водорослей и растений . [33]
Родофиты , или группа хлоропластов красных водорослей , — еще одна крупная и разнообразная линия хлоропластов. [19] Родофитные хлоропласты также называют родопластами , [33] буквально «красные хлоропласты». [37]
Родопласты имеют двойную мембрану с межмембранным пространством и пигменты фикобилина , организованные в фикобилисомы на тилакоидных мембранах, что предотвращает штабелирование их тилакоидов. [17] Некоторые содержат пиреноиды . [33] Родопласты содержат хлорофилл а и фикобилины [35] для фотосинтетических пигментов; фикобилин фикоэритрин отвечает за придание многим красным водорослям характерного красного цвета. [36] Однако, поскольку они также содержат сине-зеленый хлорофилл А и другие пигменты, многие из них имеют цвет от красноватого до фиолетового в результате сочетания. [33] [ сомнительно ] Красный пигмент фикоэритерин представляет собой адаптацию, помогающую красным водорослям улавливать больше солнечного света на глубокой воде [33] – поэтому некоторые красные водоросли, обитающие на мелководье, имеют меньше фикоэритрина в своих родопластах и могут появляться более зеленоватый. [36] Родопласты синтезируют форму крахмала, называемую флоридским крахмалом , [33] который собирается в гранулы вне родопласта, в цитоплазме красных водорослей. [17]
Хлоропласты хлоропластид , или зеленые хлоропласты, представляют собой еще одну крупную и весьма разнообразную первичную линию хлоропластов. Их организмы-хозяева широко известны как зеленые водоросли и наземные растения . [38] Они отличаются от хлоропластов глаукофитов и красных водорослей тем, что утратили свои фикобилисомы и вместо этого содержат хлорофилл b . [17] Большинство зеленых хлоропластов (очевидно) зеленые , хотя некоторые нет, например, некоторые формы Hæmatococcus pluvialis , из-за дополнительных пигментов, которые переопределяют зеленый цвет хлорофиллов. Хлоропласты хлоропластов утратили пептидогликановую стенку между двойной мембраной, оставив межмембранное пространство. [17] Некоторые растения, похоже, сохранили гены синтеза слоя пептидогликана, хотя вместо этого они были перепрофилированы для использования в делении хлоропластов. [39]
Большинство хлоропластов, изображенных в этой статье, являются зелеными хлоропластами.
Зеленые водоросли и растения хранят крахмал внутри своих хлоропластов, [17] [35] [38] , а у растений и некоторых водорослей тилакоиды хлоропластов расположены в стопках гран. Некоторые хлоропласты зеленых водорослей содержат структуру , называемую пиреноидом [17] , которая функционально аналогична карбоксисоме глаукофитов в том смысле, что именно здесь в хлоропласте концентрируются RuBisCO и CO 2 . [40]

Helicosporidium — род нефотосинтезирующих паразитических зеленых водорослей, которые, как полагают, содержат рудиментарный хлоропласт. [35] Гены хлоропласта [41] и ядерные гены, указывающие на наличие хлоропласта, были обнаружены у Helicosporidium [35], даже если сам хлоропласт никто не видел. [35]
Хотя большинство хлоропластов возникли в результате этого первого набора эндосимбиотических событий, Paulinella chromatophora является исключением, которое совсем недавно приобрело фотосинтезирующий цианобактериальный эндосимбионт. Неясно, тесно ли этот симбионт связан с предковым хлоропластом других эукариот. [19] Находясь на ранних стадиях эндосимбиоза, Paulinella chromatophora может предложить некоторое представление о том, как развивались хлоропласты. [26] [42] Клетки Paulinella содержат одну или две колбасообразные сине-зеленые фотосинтезирующие структуры, называемые хроматофорами, [26] [42] произошедшие от цианобактерии Synechococcus . Хроматофоры не могут выжить вне своего хозяина. [26] ДНК хроматофора имеет длину около миллиона пар оснований и содержит около 850 генов , кодирующих белки , что намного меньше, чем геном Synechococcus в три миллиона пар оснований, [26] но намного больше, чем геном из более ассимилированных хлоропластов, состоящий примерно из 150 000 пар оснований. . [43] [44] [45] Хроматофоры перенесли гораздо меньше своей ДНК в ядро своего хозяина. Около 0,3–0,8% ядерной ДНК Paulinella приходится на хроматофор, по сравнению с 11–14% на хлоропласт у растений. [42]
Многие другие организмы получили хлоропласты из первичных линий хлоропластов посредством вторичного эндосимбиоза — поглощения красных или зеленых водорослей, содержащих хлоропласты. Эти хлоропласты известны как вторичные пластиды. [33]
В то время как первичные хлоропласты имеют двойную мембрану от своего цианобактериального предка, вторичные хлоропласты имеют дополнительные мембраны помимо исходных двух, в результате вторичного эндосимбиотического события, когда нефотосинтезирующий эукариот поглотил содержащую хлоропласт водоросль, но не смог ее переварить - во многом аналогично цианобактерия в начале этой истории. [19] Поглощенная водоросль расщеплялась, оставляя только хлоропласт, а иногда и клеточную мембрану и ядро , образуя хлоропласт с тремя или четырьмя мембранами [46] — две мембраны цианобактерий, иногда клеточную мембрану съеденной водоросли и фагосомальную мембрану . вакуоль клеточной мембраны хозяина. [19]


Гены в ядре фагоцитированного эукариота часто передаются в ядро вторичного хозяина. [19] Криптомонады и хлорарахниофиты сохраняют фагоцитированное ядро эукариот, объект, называемый нуклеоморфом , [ 19] расположенный между второй и третьей мембранами хлоропласта. [17] [27]
Все вторичные хлоропласты происходят из зеленых и красных водорослей - вторичных хлоропластов из глаукофитов не наблюдалось, вероятно, потому, что глаукофиты относительно редки в природе, что снижает вероятность их поглощения другими эукариотами. [19]
Зеленые водоросли были поглощены эвгленидами , хлорарахниофитами , линией динофлагеллят [ 35] и, возможно, предками линии CASH ( криптомонады , альвеолаты , страменопилы и гаптофиты ) [47] в трех или четырех отдельных поглощениях. [48] Многие хлоропласты, полученные из зеленых водорослей, содержат пиреноиды , но в отличие от хлоропластов их предков из зеленых водорослей, продукты хранения собираются в гранулах вне хлоропласта. [17]

Эвгленофиты — это группа обыкновенных жгутиковых протистов , содержащих хлоропласты, полученные из зеленых водорослей. [19] Хлоропласты эвгленофитов имеют три мембраны - считается, что мембрана первичного эндосимбионта была потеряна, оставив мембраны цианобактерий и фагосомальную мембрану вторичного хозяина. [19] Хлоропласты эвгленофитов имеют пиреноид и тилакоиды, сгруппированные в группы по три. Продукт фотосинтеза сохраняется в виде парамилона , который содержится в мембраносвязанных гранулах в цитоплазме эвгленофита. [17] [35]

Хлорарахниофиты / ˌ k l ɔːr ə ˈ r æ k n i oʊ ˌ f aɪ t s / — редкая группа организмов, которые также содержат хлоропласты, полученные из зеленых водорослей, [19] хотя их история более сложна, чем у эвгленофитов. Считается, что предком хлорарахниофитов был эукариот с хлоропластом, полученным из красных водорослей. Считается, что он потерял свой первый хлоропласт из красных водорослей, а затем поглотил зеленую водоросль, дав ей второй хлоропласт, полученный из зеленых водорослей. [35]
Хлоропласты хлорарахниофитов ограничены четырьмя мембранами, за исключением клеточной мембраны, где мембраны хлоропластов сливаются в двойную мембрану. [17] Их тилакоиды расположены в виде свободных стопок по три штуки. [17] Хлорарахниофиты имеют форму полисахарида, называемого хризоламинарином , который они хранят в цитоплазме, [35] часто собираются вокруг пиреноида хлоропласта , который выпячивается в цитоплазму. [17]
Хлорарахниофитные хлоропласты примечательны тем, что зеленая водоросль, из которой они произошли, не полностью разрушилась — ее ядро все еще сохраняется в виде нуклеоморфа [ 19] , обнаруженного между второй и третьей мембранами хлоропласта [17] — перипластидное пространство, соответствующее зеленому Цитоплазма водоросли. [35]
Lepidodinium viride и его близкие родственники являются динофитами (см. ниже), которые потеряли свой первоначальный хлоропласт перидинина и заменили его хлоропластом, полученным из зеленых водорослей (точнее, празинофитом ) . [17] [49] Лепидодиниум — единственный динофит, у которого есть хлоропласт, не принадлежащий к линии родопластов . Хлоропласт окружен двумя мембранами и не имеет нуклеоморфа — все гены нуклеоморфа перенесены в ядро динофита . [49] Эндосимбиотическим событием, которое привело к появлению этого хлоропласта, был серийный вторичный эндосимбиоз, а не третичный эндосимбиоз — эндосимбионт представлял собой зеленую водоросль , содержащую первичный хлоропласт (образующий вторичный хлоропласт). [35]
Криптофиты , или криптомонады, представляют собой группу водорослей, содержащих хлоропласт, полученный из красных водорослей. Хлоропласты криптофитов содержат нуклеоморфы, внешне напоминающие нуклеоморфы хлорарахниофитов . [19] Хлоропласты криптофитов имеют четыре мембраны, самая внешняя из которых является продолжением шероховатой эндоплазматической сети . Они синтезируют обычный крахмал , который запасается в гранулах, находящихся в перипластидном пространстве — за пределами исходной двойной мембраны, в месте, соответствующем цитоплазме красной водоросли. Внутри хлоропластов криптофитов находится пиреноид и тилакоиды в стопках по два. [17]
Их хлоропласты не имеют фикобилисом , [17] , но у них есть пигменты фикобилина, которые они сохраняют в своем тилакоидном пространстве, а не закрепляются на внешней стороне своих тилакоидных мембран. [17] [19]
Криптофиты, возможно, сыграли ключевую роль в распространении хлоропластов на основе красных водорослей. [50] [51]

Гаптофиты сходны и тесно связаны с криптофитами или гетероконтофитами. [35] В их хлоропластах отсутствует нуклеоморф, [17] [19] их тилакоиды собраны в стопки по три, и они синтезируют сахар хризоламинарин , который они хранят полностью вне хлоропласта, в цитоплазме гаптофита. [17]

Гетероконтофиты , также известные как страменопилы, представляют собой очень большую и разнообразную группу эукариот. Фотоавтотрофная линия Ochrophyta , включающая диатомовые водоросли и бурые водоросли , золотые водоросли [36] и желто-зеленые водоросли , также содержит хлоропласты, полученные из красных водорослей. [35]
Гетероконтные хлоропласты очень похожи на гаптофитные хлоропласты, содержащие пиреноид , триплетные тилакоиды и, за некоторыми исключениями, [17] имеющие четырехслойную пластидную оболочку, самую внешнюю эпипластидную мембрану, соединенную с эндоплазматической сетью . Как и гаптофиты, гетероконтофиты хранят сахар в гранулах хризоламинарина в цитоплазме. [17] Хлоропласты гетероконтофитов содержат хлорофилл а и, за некоторыми исключениями, [17] хлорофилл с , [19] , но также содержат каротиноиды , которые придают им разнообразный цвет. [36]
Альвеолаты представляют собой основную кладу одноклеточных эукариот как автотрофных, так и гетеротрофных членов. Наиболее заметной общей характеристикой является наличие кортикальных (внешних) альвеол (мешочков). Это уплощенные везикулы (мешочки), упакованные в сплошной слой непосредственно под мембраной и поддерживающие ее, обычно образующие гибкую пленку (тонкую кожуру). У динофлагеллят они часто образуют панцирные пластинки. Многие представители содержат пластиду, полученную из красных водорослей. Одной из примечательных характеристик этой разнообразной группы является частая потеря фотосинтеза. Однако большинство этих гетеротрофов продолжают перерабатывать нефотосинтезирующие пластиды. [52]
Апикомплексаны представляют собой группу альвеолятов. Как и геликопроидии , они паразитические и имеют нефотосинтезирующий хлоропласт. [35] Когда-то считалось, что они связаны с helicosproidia, но теперь известно, что helicosproida — это зеленые водоросли, а не часть линии CASH. [35] К апикомплексам относятся Plasmodium , малярийный паразит. Многие апикомплексаны сохраняют рудиментарный хлоропласт, полученный из красных водорослей [53] [35] , называемый апикопластом , который они унаследовали от своих предков. Другие апикомплексы, такие как Cryptosporidium, полностью утратили хлоропласт. [53] Апикомплексаны хранят свою энергию в гранулах амилопектина , которые расположены в их цитоплазме, хотя они и не фотосинтезируют. [17]
Апикопласты утратили все фотосинтетические функции и не содержат фотосинтетических пигментов или настоящих тилакоидов. Они ограничены четырьмя мембранами, но мембраны не связаны с эндоплазматической сетью . [17] Тот факт, что апикомплексаны все еще сохраняют свой нефотосинтетический хлоропласт, демонстрирует, как хлоропласт выполняет важные функции, помимо фотосинтеза . Хлоропласты растений снабжают растительные клетки многими важными вещами, помимо сахара, и апикопласты ничем не отличаются — они синтезируют жирные кислоты , изопентенилпирофосфат , железо-серные кластеры и осуществляют часть гемового пути. [53] Это делает апикопласт привлекательной мишенью для лекарств для лечения заболеваний, связанных с апикомплексаном. [33] Наиболее важной функцией апикопласта является синтез изопентенилпирофосфата - фактически, апикомплексаны умирают, когда что-то мешает этой функции апикопласта, а когда апикомплексаны выращиваются в среде, богатой изопентенилпирофосфатом, они сбрасывают органеллу. [53]
Chromerida — это недавно открытая группа водорослей из австралийских кораллов, в которую входят некоторые близкие фотосинтезирующие родственники апикомплексов. Первый представитель, Chromera velia , был обнаружен и впервые выделен в 2001 году. Открытие Chromera velia со структурой, сходной с апикомплексами, обеспечивает важное звено в истории эволюции апикомплексов и динофитов. Их пластиды имеют четыре мембраны, лишены хлорофилла c и используют форму RuBisCO типа II , полученную в результате горизонтального переноса. [54]
Динофлагелляты — еще одна очень большая и разнообразная группа простейших , около половины из которых ( по крайней мере частично ) являются фотосинтезирующими . [36] [49]
Большинство хлоропластов динофитов представляют собой вторичные хлоропласты, полученные из красных водорослей . Многие другие динофиты утратили хлоропласт (став нефотосинтетической разновидностью динофлагеллят) или заменили его в результате третичного эндосимбиоза [55] — поглощения других эукариотических водорослей, содержащих хлоропласт, полученный из красных водорослей. Другие заменили свой первоначальный хлоропласт хлоропластом, полученным из зеленых водорослей . [19] [35] [49]
Большинство хлоропластов динофитов содержат форму II RuBisCO, по крайней мере фотосинтетические пигменты хлорофилл а , хлорофилл с 2 , бета -каротин и по крайней мере один уникальный для динофитов ксантофилл ( перидинин , диноксантин или диадиноксантин ), придающий многим золотисто-коричневый цвет. [52] [49] Все динофиты хранят крахмал в цитоплазме, и у большинства из них есть хлоропласты с тилакоидами, расположенными стопками по три. [17]

Наиболее распространенным хлоропластом динофитов является хлоропласт перидининового типа, характеризующийся каротиноидным пигментом перидинином в хлоропластах, наряду с хлорофиллом а и хлорофиллом с 2 . [19] [49] Перидинин не обнаружен ни в одной другой группе хлоропластов. [49] Хлоропласт перидинина ограничен тремя мембранами (иногда двумя), [17] потеряв исходную клеточную мембрану эндосимбионта красных водорослей. [19] [35] Самая внешняя мембрана не связана с эндоплазматической сетью. [17] [49] Они содержат пиреноид и тилакоиды, сложенные тройками. Крахмал находится вне хлоропласта. [17] Важной особенностью этих хлоропластов является то, что их хлоропластная ДНК сильно редуцирована и фрагментирована на множество маленьких кружков. Большая часть генома мигрировала в ядро, и в хлоропластах остались только критические гены, связанные с фотосинтезом. [49]
Считается, что хлоропласт перидинина является «исходным» хлоропластом динофитов [49] , который был утерян, редуцирован, заменен или присутствовал в нескольких других линиях динофитов. [35]

Линии фукоксантиновых динофитов (включая Karlodinium и Karenia ) [35] утратили свой первоначальный хлоропласт, полученный из красных водорослей, и заменили его новым хлоропластом, полученным из эндосимбионта гаптофита . Карлодиниум и Карения, вероятно, принадлежали к разным гетероконтофитам. [35] Поскольку хлоропласт гаптофита имеет четыре мембраны, ожидается, что третичный эндосимбиоз создаст шестимембранный хлоропласт, добавив клеточную мембрану гаптофита и фагосомальную вакуоль динофита . [57] Однако гаптофит был сильно редуцирован, лишен нескольких мембран и ядра, остался только хлоропласт (с исходной двойной мембраной) и, возможно, одна или две дополнительные мембраны вокруг него. [35] [57]
Хлоропласты, содержащие фукоксантин, характеризуются наличием пигмента фукоксантина (на самом деле 19'-гексаноилоксифукоксантин и/или 19'-бутаноилоксифукоксантин) и отсутствием перидинина. Фукоксантин также обнаружен в хлоропластах гаптофитов, что свидетельствует о его происхождении. [49]

Некоторые динофиты, такие как Kryptoperidinium и Durinskia , [35] имеют хлоропласт, происходящий из диатомовых водорослей ( гетероконтофитов ). [19] Эти хлоропласты окружены максимум пятью мембранами, [19] (в зависимости от того, считается ли весь диатомовый эндосимбионт хлоропластом или только хлоропласт, полученный из красных водорослей, внутри него). Эндосимбионт диатомовых водорослей редуцировался относительно немного — он все еще сохраняет свои первоначальные митохондрии [ 35] и имеет эндоплазматический ретикулум , рибосомы , ядро и, конечно же, хлоропласты, полученные из красных водорослей — практически полноценную клетку , [58] все внутри хозяина. Просвет эндоплазматической сети . [35] Однако эндосимбионт диатомовых водорослей не может хранить собственную пищу — вместо этого его запасной полисахарид находится в гранулах в цитоплазме динофитного хозяина. [17] [58] Ядро эндосимбионта диатомовой водоросли присутствует, но его, вероятно, нельзя назвать нуклеоморфом , поскольку оно не демонстрирует никаких признаков редукции генома и, возможно, даже было расширено . [35] Диатомеи были поглощены динофлагеллятами по крайней мере три раза. [35]
Эндосимбионт диатомовых водорослей ограничен одной мембраной, [49] внутри которой находятся хлоропласты с четырьмя мембранами. Подобно диатомовому предку диатомового эндосимбионта, хлоропласты имеют тройные тилакоиды и пиреноиды . [58]
В некоторых из этих родов хлоропласты эндосимбионта диатомовых водорослей не единственные хлоропласты динофитов. Исходный трехмембранный хлоропласт перидинина все еще существует, превратившись в глазное пятно . [19] [35]
У некоторых групп миксотрофных протистов , например у некоторых динофлагеллят (например, Dinophys ), хлоропласты отделяются от пойманной водоросли и используются временно. Эти клептохлоропласты могут жить всего несколько дней, а затем заменяются. [59] [60]
Представители рода Dinophys имеют фикобилинсодержащий [57] хлоропласт , взятый из криптофита . [19] Однако криптофит не является эндосимбионтом — похоже, был взят только хлоропласт, а хлоропласт был лишен своего нуклеоморфа и двух крайних мембран, оставив только двухмембранный хлоропласт. Хлоропластам криптофитов для поддержания себя требуется нуклеоморф, а виды Dinophys , выращенные в одной культуре клеток, не могут выжить, поэтому возможно (но не подтверждено), что хлоропласт Dinophys является клептопластом - если это так, хлоропласты Dinophys изнашиваются, и виды Dinophys должны постоянно поглощать криптофиты для получения новых хлоропластов взамен старых. [49]
Хлоропласты, как и другие типы пластид , содержат геном, отдельный от генома в ядре клетки . Существование хлоропластной ДНК (хпДНК) было идентифицировано биохимически в 1959 году [61] и подтверждено электронной микроскопией в 1962 году. [62] Открытие того, что хлоропласт содержит рибосомы [63] и осуществляет синтез белка [64], показало, что хлоропласт генетически полуавтономны. ДНК хлоропластов была впервые секвенирована в 1986 году. [65] С тех пор были секвенированы сотни ДНК хлоропластов различных видов , но в основном это ДНК наземных растений и зеленых водорослей — глаукофиты , красные водоросли и другие группы водорослей крайне недостаточно представлены. потенциально внося некоторую предвзятость во взгляды на «типичную» структуру и содержание ДНК хлоропластов. [66]
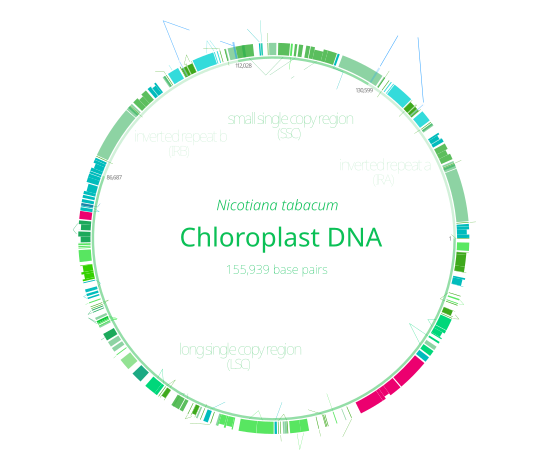
За некоторыми исключениями, у большинства хлоропластов весь хлоропластный геном объединен в одну большую кольцевую молекулу ДНК [66] , обычно длиной 120 000–170 000 пар оснований . [43] [44] [45] [21] Они могут иметь длину контура около 30–60 микрометров и массу около 80–130 миллионов дальтон . [67]
Хотя обычно молекулу считают кольцевой, есть некоторые свидетельства того, что молекулы ДНК хлоропластов чаще принимают линейную форму. [66] [68]
ДНК многих хлоропластов содержат два инвертированных повтора , которые отделяют длинный однокопийный участок (LSC) от короткого однокопийного участка (SSC). [45] Хотя данная пара инвертированных повторов редко бывает полностью идентична, они всегда очень похожи друг на друга, что, по-видимому, является результатом согласованной эволюции . [66]
Инвертированные повторы сильно различаются по длине: от 4000 до 25 000 пар оснований каждый и содержат от четырех до более 150 генов. [66] Инвертированные повторы у растений, как правило, находятся в верхней части этого диапазона, каждый из которых имеет длину 20 000–25 000 пар оснований. [45] [69]
Области инвертированных повторов высококонсервативны среди наземных растений и накапливают мало мутаций. [45] [69] Подобные инвертированные повторы существуют в геномах цианобактерий и двух других линий хлоропластов ( glaucophyta и rhodophyceae ), что позволяет предположить, что они предшествуют хлоропластам, [66] хотя некоторые ДНК хлоропластов с тех пор утеряны [69] [70] или перевернули инвертированные повторы (сделав их прямыми повторами). [66] Вполне возможно, что инвертированные повторы помогают стабилизировать остальную часть генома хлоропластов, поскольку ДНК хлоропластов, потерявшие некоторые сегменты инвертированных повторов, имеют тенденцию к большей перестройке. [70]
Новые хлоропласты могут содержать до 100 копий своей ДНК [43] , хотя число копий ДНК хлоропластов уменьшается примерно до 15–20 по мере старения хлоропластов. [71] Обычно они упакованы в нуклеоиды , которые могут содержать несколько одинаковых колец ДНК хлоропластов. В каждом хлоропласте можно обнаружить множество нуклеоидов. [67] У примитивных красных водорослей нуклеоиды ДНК хлоропластов сгруппированы в центре хлоропласта, тогда как у зеленых растений и зеленых водорослей нуклеоиды рассеяны по всей строме . [72]
Хотя ДНК хлоропластов не связана с настоящими гистонами , [10] в красных водорослях были обнаружены аналогичные белки, которые плотно упаковывают каждое кольцо ДНК хлоропласта в нуклеоид . [72]
В хлоропластах мха Physcomitrella patens белок репарации несоответствия ДНК Msh1 взаимодействует с белками рекомбинационной репарации RecA и RecG для поддержания стабильности генома хлоропластов . [73] В хлоропластах растения Arabidopsis thaliana белок RecA поддерживает целостность ДНК хлоропластов посредством процесса, который, вероятно, включает рекомбинационное восстановление повреждений ДНК . [74]

Механизм репликации ДНК хлоропластов (хпДНК) окончательно не определен, но были предложены две основные модели. Ученые пытались наблюдать репликацию хлоропластов с помощью электронной микроскопии с 1970-х годов. [75] [76] Результаты микроскопических экспериментов привели к идее, что ДНК хлоропластов реплицируется с использованием петли двойного смещения (D-петли). Когда D-петля движется по кольцевой ДНК, она принимает промежуточную тета-форму, также известную как промежуточный продукт репликации Кэрнса, и завершает репликацию с помощью механизма катящегося круга. [75] [68] Транскрипция начинается в определенных точках происхождения. Множественные репликационные вилки открываются, позволяя механизму репликации транскрибировать ДНК. По мере продолжения репликации вилки растут и в конечном итоге сходятся. Новые структуры хпДНК разделяются, образуя дочерние хромосомы хпДНК.
В дополнение к ранним экспериментам по микроскопии, эта модель также подтверждается количеством дезаминирования , наблюдаемым в хпДНК. [75] Дезаминирование происходит при потере аминогруппы и представляет собой мутацию, которая часто приводит к изменению оснований. При дезаминировании аденина он превращается в гипоксантин . Гипоксантин может связываться с цитозином, и когда пара оснований XC реплицируется, он становится GC (таким образом, происходит замена оснований A → G). [77]

В хпДНК существует несколько градиентов дезаминирования A → G. ДНК становится восприимчивой к событиям дезаминирования, когда она одноцепочечная. Когда образуются репликационные вилки, некопируемая цепь является одноцепочечной и, следовательно, подвергается риску дезаминирования A → G. Следовательно, градиенты дезаминирования указывают на то, что репликационные вилки, скорее всего, присутствовали, а также на направление, в котором они первоначально открывались (самый высокий градиент, скорее всего, находится ближе всего к стартовому сайту, поскольку он был одноцепочечным в течение самого длительного периода времени). [75] Этот механизм по-прежнему является ведущей теорией сегодня; однако вторая теория предполагает, что большая часть хпДНК на самом деле линейна и реплицируется посредством гомологичной рекомбинации. Далее утверждается, что лишь незначительная часть генетического материала хранится в кольцевых хромосомах, тогда как остальная часть находится в разветвленных, линейных или других сложных структурах. [75] [68]
Одна из конкурирующих моделей репликации хпДНК утверждает, что большая часть хпДНК является линейной и участвует в гомологичных структурах рекомбинации и репликации, подобных линейным и кольцевым структурам ДНК бактериофага Т4 . [68] [78] Было установлено, что некоторые растения имеют линейную хпДНК, например кукуруза, и что многие виды все еще содержат сложные структуры, которые ученые еще не понимают. [68] Когда были проведены оригинальные эксперименты с хпДНК, ученые заметили линейные структуры; однако они приписывали эти линейные формы разорванным кругам. [68] Если разветвленные и сложные структуры, наблюдаемые в экспериментах с хпДНК, реальны, а не являются артефактами сцепленной кольцевой ДНК или разорванных кругов, то механизма репликации D-петли недостаточно, чтобы объяснить, как эти структуры будут реплицироваться. [68] В то же время гомологичная рекомбинация не расширяет множественные градиенты A -> G, наблюдаемые в пластомах. [75] Из-за невозможности объяснить градиент дезаминирования, а также многочисленные виды растений, которые, как было показано, имеют кольцевую хпДНК, преобладающая теория продолжает утверждать, что большая часть хпДНК является кольцевой и, скорее всего, реплицируется посредством механизма D-петли.
Геном хлоропластов чаще всего включает около 100 генов [27] [44] , которые кодируют множество вещей, в основном связанных с белковым конвейером и фотосинтезом . Как и у прокариот , гены в ДНК хлоропластов организованы в опероны . [27] В отличие от молекул ДНК прокариот , молекулы ДНК хлоропластов содержат интроны ( в митохондриальной ДНК растений тоже есть интроны, но не в мтДНК человека). [79]
Среди наземных растений содержание генома хлоропластов довольно схоже. [45]
Со временем многие части генома хлоропласта были перенесены в ядерный геном хозяина, [43] [44] [80] этот процесс называется эндосимбиотическим переносом генов . В результате геном хлоропластов сильно редуцирован по сравнению с геномом свободноживущих цианобактерий. Хлоропласты могут содержать 60–100 генов, тогда как цианобактерии часто имеют в своем геноме более 1500 генов. [81] Недавно была обнаружена пластида без генома, что демонстрирует, что хлоропласты могут потерять свой геном во время эндосимбиотического процесса переноса генов. [82]
Эндосимбиотический перенос генов — это то, как мы узнаем об утраченных хлоропластах во многих линиях CASH. Даже если хлоропласт в конечном итоге теряется, гены, которые он пожертвовал ядру бывшего хозяина, сохраняются, что доказывает существование утраченного хлоропласта. Например, в то время как диатомовые водоросли ( гетероконтофит ) теперь имеют хлоропласт, полученный из красных водорослей , присутствие многих генов зеленых водорослей в ядре диатомовых водорослей свидетельствует о том, что предок диатомовых водорослей в какой-то момент имел хлоропласт, полученный из зеленых водорослей , который впоследствии был заменен на красный хлоропласт. [47]
У наземных растений около 11–14% ДНК в их ядрах можно отнести к хлоропластам, [42] до 18% у Arabidopsis , что соответствует примерно 4500 генам, кодирующим белки. [83] Недавно было несколько случаев переноса генов из ДНК хлоропластов в ядерный геном наземных растений. [44]
Из примерно 3000 белков, обнаруженных в хлоропластах, около 95% кодируются ядерными генами. Многие белковые комплексы хлоропластов состоят из субъединиц как генома хлоропласта, так и ядерного генома хозяина. В результате синтез белка должен быть скоординирован между хлоропластом и ядром. Хлоропласты в основном находятся под ядерным контролем, хотя хлоропласты также могут выдавать сигналы, регулирующие экспрессию генов в ядре, так называемые ретроградные сигналы . [84] Недавние исследования показывают, что части ретроградной сигнальной сети, которая когда-то считалась характерной для наземных растений, возникли уже у предшественников водорослей, [85] [86] [87] интегрировались в коэкспрессируемые когорты генов у ближайших водорослей-родственников наземных растений. растения. [88]
Синтез белка в хлоропластах основан на двух РНК-полимеразах . Один кодируется ДНК хлоропластов, другой имеет ядерное происхождение. Две РНК-полимеразы могут распознавать и связываться с различными типами промоторов в геноме хлоропластов. [89] Рибосомы в хлоропластах подобны бактериальным рибосомам. [90]
Поскольку так много генов хлоропластов было перенесено в ядро, многие белки , которые первоначально транслировались в хлоропластах, теперь синтезируются в цитоплазме растительной клетки. Эти белки должны быть направлены обратно в хлоропласты и импортированы как минимум через две мембраны хлоропластов. [91]
Любопытно, что около половины белковых продуктов перенесенных генов даже не доставляются обратно в хлоропласты. Многие из них стали экзаптациями , взяв на себя новые функции, такие как участие в делении клеток , маршрутизации белков и даже устойчивости к болезням . Несколько генов хлоропластов нашли новый дом в митохондриальном геноме — большинство из них стали нефункциональными псевдогенами , хотя несколько генов тРНК все еще работают в митохондриях . [81] Некоторые перенесенные белковые продукты ДНК хлоропластов направляются по секреторному пути , [81] хотя многие вторичные пластиды ограничены внешней мембраной, полученной из клеточной мембраны хозяина , и, следовательно, топологически находятся за пределами клетки, поскольку достигают хлоропласта из цитозоль , необходимо пересечь клеточную мембрану , что означает вход во внеклеточное пространство . В этих случаях белки, нацеленные на хлоропласты, первоначально перемещаются по секреторному пути. [35]
Поскольку клетка, приобретающая хлоропласт, уже имела митохондрии (и пероксисомы , а также клеточную мембрану для секреции), новому хозяину-хлоропласту пришлось разработать уникальную систему нацеливания на белки , чтобы избежать отправки белков хлоропласта в неправильную органеллу . [91]
![Два конца полипептида называются N-концом, или аминоконцом, и С-концом, или карбоксильным концом.[92] Этот полипептид состоит из четырех связанных между собой аминокислот. Слева находится N-конец, аминогруппа (H2N) которого выделена зеленым цветом. Синий С-конец с карбоксильной группой (CO2H) находится справа.](http://upload.wikimedia.org/wikipedia/commons/thumb/c/c0/Tetrapeptide_structural_formulae.svg/370px-Tetrapeptide_structural_formulae.svg.png)
В большинстве, но не во всех случаях, белки хлоропластов, кодируемые ядерным кодом, транслируются с помощью расщепляемого транзитного пептида , который добавляется к N-концу белка-предшественника. Иногда транзитная последовательность обнаруживается на С-конце белка [93] или внутри функциональной части белка. [91]
После того, как полипептид хлоропласта синтезируется на рибосоме в цитозоле , фермент , специфичный для белков хлоропластов [94] , фосфорилирует или добавляет фосфатную группу ко многим (но не всем) из них в их транзитных последовательностях. [91] Фосфорилирование помогает многим белкам связывать полипептид, предотвращая его преждевременное сворачивание . [91] Это важно, поскольку предотвращает принятие хлоропластными белками активной формы и выполнение своих хлоропластных функций не в том месте — цитозоле . [95] [96] В то же время они должны сохранять форму, достаточную для того, чтобы их мог распознать хлоропласт. [95] Эти белки также помогают полипептиду импортироваться в хлоропласты. [91]
Отсюда белки хлоропластов, связанные со стромой, должны пройти через два белковых комплекса — комплекс ТОС, или транслокон на внешней мембране хлоропласта , и транслокон TIC , или транслокон на внутренней мембране хлоропласта , транслокон . [91] Полипептидные цепи хлоропластов, вероятно, часто проходят через два комплекса одновременно, но комплекс TIC также может восстанавливать пребелки, потерянные в межмембранном пространстве . [91]

У наземных растений хлоропласты обычно имеют линзообразную форму, диаметром 3–10 мкм и толщиной 1–3 мкм. [97] [21] Хлоропласты проростков кукурузы имеют объем ≈20 мкм 3 . [21] Большее разнообразие форм хлоропластов существует среди водорослей , которые часто содержат один хлоропласт [17] , который может иметь форму сети (например, Oedogonium ), [98] чашечки (например, Chlamydomonas ), [99 ] лентообразная спираль по краям клетки (например, Spirogyra ), [100] или слегка закрученные полосы по краям клетки (например, Sirogonium ). [101] Некоторые водоросли имеют по два хлоропласта в каждой клетке; у Zygnema они имеют звездчатую форму [102] или могут повторять форму половины клетки отряда Desmidiales . [103] У некоторых водорослей хлоропласт занимает большую часть клетки с карманами для ядра и других органелл, [17] например, у некоторых видов хлореллы есть чашеобразный хлоропласт, занимающий большую часть клетки. [104]
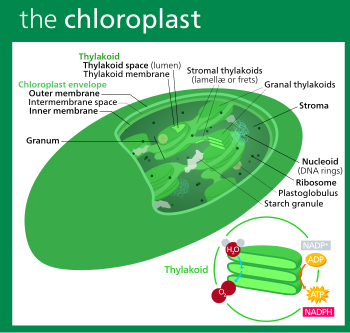
Все хлоропласты имеют как минимум три мембранные системы: внешнюю мембрану хлоропласта, внутреннюю мембрану хлоропласта и тилакоидную систему . Хлоропласты, являющиеся продуктом вторичного эндосимбиоза, могут иметь дополнительные мембраны, окружающие эти три. [46] Внутри внешней и внутренней мембран хлоропластов находится строма хлоропласта , полугелеобразная жидкость [33] , которая составляет большую часть объема хлоропласта и в которой плавает тилакоидная система.
Существуют некоторые распространенные заблуждения относительно внешних и внутренних мембран хлоропластов. Тот факт, что хлоропласты окружены двойной мембраной, часто приводят в качестве доказательства того, что они являются потомками эндосимбиотических цианобактерий . Это часто интерпретируется как означающее, что внешняя мембрана хлоропласта является продуктом сворачивания клеточной мембраны хозяина с образованием пузырька, окружающего предковую цианобактерию - что неверно - обе мембраны хлоропласта гомологичны исходным двойным мембранам цианобактерии. [19]
Двойную мембрану хлоропласта также часто сравнивают с двойной мембраной митохондрий . Это некорректное сравнение: внутренняя мембрана митохондрий используется для запуска протонных насосов и осуществления окислительного фосфорилирования для выработки энергии АТФ . Единственная структура хлоропласта, которую можно считать аналогичной ему, — это внутренняя тилакоидная система. Даже в этом случае, с точки зрения «внутрь-выход», направление потока ионов H + в хлоропластах противоположно направлению окислительного фосфорилирования в митохондриях. [33] [105] Кроме того, с точки зрения функции внутренняя мембрана хлоропласта, которая регулирует прохождение метаболитов и синтезирует некоторые материалы, не имеет аналога в митохондриях. [33]
Внешняя мембрана хлоропласта представляет собой полупористую мембрану, через которую могут легко диффундировать небольшие молекулы и ионы . [106] Однако он не проницаем для более крупных белков , поэтому полипептиды хлоропластов , синтезируемые в цитоплазме клетки , должны транспортироваться через внешнюю мембрану хлоропласта с помощью комплекса ТОС или транслокона на внешней мембране хлоропласта . [91]
Мембраны хлоропластов иногда выступают в цитоплазму, образуя стромулу или стромасодержащую трубочку . Стромулы очень редки в хлоропластах и гораздо чаще встречаются в других пластидах , таких как хромопласты и амилопласты в лепестках и корнях соответственно. [107] [108] Они могут существовать для увеличения площади поверхности хлоропластов для трансмембранного транспорта, поскольку они часто разветвлены и переплетаются с эндоплазматической сетью . [109] Когда их впервые наблюдали в 1962 году, некоторые биологи растений отвергли эти структуры как артефакты, утверждая, что стромулы были просто хлоропластами странной формы с суженными областями или делящимися хлоропластами . [110] Однако появляется все больше доказательств того, что стромулы являются функциональными, неотъемлемыми особенностями пластид растительных клеток, а не просто артефактами. [111]

Обычно между внешней и внутренней мембранами хлоропластов существует тонкое межмембранное пространство толщиной около 10–20 нанометров . [112]
Хлоропласты глаукофитных водорослей имеют слой пептидогликана между мембранами хлоропластов. Он соответствует клеточной стенке пептидогликана их цианобактериальных предков, которая расположена между их двумя клеточными мембранами. Эти хлоропласты называются муропластами (от латинского «mura» , что означает «стенка»). Предполагалось, что другие хлоропласты утратили цианобактериальную стенку, оставив межмембранное пространство между двумя оболочками хлоропластов [33] , но с тех пор их обнаруживали также во мхах, ликофитах и папоротниках. [113]
Внутренняя мембрана хлоропласта граничит со стромой и регулирует прохождение веществ в хлоропласт и из него. После прохождения комплекса ТОС во внешней мембране хлоропласта полипептиды должны пройти через комплекс TIC (транслокон на внутренней мембране хлоропласта ) , который расположен во внутренней мембране хлоропласта. [91]
Помимо регулирования прохождения материалов, внутренняя мембрана хлоропласта синтезирует жирные кислоты , липиды и каротиноиды . [33]
Некоторые хлоропласты содержат структуру, называемую периферической сетью хлоропластов . [112] Он часто встречается в хлоропластах C 4 растений , хотя он также был обнаружен в некоторых C 3 покрытосеменных растениях , [33] и даже в некоторых голосеменных растениях . [114] Периферическая сеть хлоропластов состоит из лабиринта мембранных трубочек и везикул, непрерывных с внутренней мембраной хлоропласта , которая простирается во внутреннюю стромальную жидкость хлоропласта. Считается, что его целью является увеличение площади поверхности хлоропласта для трансмембранного транспорта между его стромой и цитоплазмой клетки . Иногда наблюдаемые небольшие везикулы могут служить транспортными везикулами для перемещения веществ между тилакоидами и межмембранным пространством. [115]
Богатая белками , [ 33] щелочная , [105] водная жидкость внутри внутренней мембраны хлоропласта и вне тилакоидного пространства называется стромой, [33] что соответствует цитозолю исходной цианобактерии . В нем плавают нуклеоиды ДНК хлоропластов , рибосомы хлоропластов , тилакоидная система с пластоглобулами , гранулы крахмала и многие белки . Цикл Кальвина , который связывает CO 2 в G3P , происходит в строме.
Хлоропласты имеют собственные рибосомы, которые они используют для синтеза небольшой фракции своих белков. Рибосомы хлоропластов составляют примерно две трети размера цитоплазматических рибосом (около 17 нм против 25 нм ). [112] Они берут мРНК , транскрибированные с ДНК хлоропластов , и переводят их в белок. Хотя трансляция хлоропластов аналогична бактериальным рибосомам , [10] трансляция хлоропластов более сложна, чем у бактерий, поэтому рибосомы хлоропластов обладают некоторыми уникальными для хлоропластов особенностями. [116] [117]
Малые субъединичные рибосомальные РНК в некоторых хлоропластах Chlorophyta и эвгленид лишены мотивов для распознавания последовательностей Шайна-Дальгарно , [118] которые считаются важными для инициации трансляции в большинстве хлоропластов и прокариот . [119] [120] Такая потеря также редко наблюдается у других пластид и прокариот. [118] [121] Дополнительная 4,5S рРНК, гомологичная 3'-хвосту 23S, обнаружена у «высших» растений. [117]
Пластоглобули ( единственное слово plastoglobulus , иногда пишется как пластоглобула(и) ) представляют собой сферические пузырьки липидов и белков [33] диаметром около 45–60 нанометров. [122] Они окружены липидным монослоем. [122] Пластоглобулы обнаруживаются во всех хлоропластах, [112] но становятся более распространенными, когда хлоропласт находится в состоянии окислительного стресса , [122] или когда он стареет и превращается в геронтопласт . [33] Пластоглобулы также демонстрируют большую изменчивость размеров в этих условиях. [122] Они также часто встречаются в этиопластах , но их количество уменьшается по мере того, как этиопласты созревают в хлоропласты. [122]
Пластоглобулы содержат как структурные белки, так и ферменты, участвующие в синтезе и обмене липидов . Они содержат много типов липидов , включая пластохинон , витамин Е , каротиноиды и хлорофиллы . [122]
Когда-то считалось, что пластоглобулы свободно плавают в строме , но теперь считается, что они постоянно прикреплены либо к тилакоиду , либо к другому пластоглобулю, прикрепленному к тилакоиду, - конфигурация, которая позволяет пластоглобулусу обмениваться своим содержимым с сетью тилакоидов. . [122] В нормальных зеленых хлоропластах подавляющее большинство пластоглобул встречаются поодиночке, прикрепленные непосредственно к родительскому тилакоиду. В старых или находящихся в стрессе хлоропластах пластоглобулы имеют тенденцию встречаться в связанных группах или цепочках, все еще всегда прикрепленных к тилакоиду. [122]
Пластоглобулы образуются, когда между слоями липидного бислоя тилакоидной мембраны появляется пузырь или отросток из существующих пластоглобул, хотя они никогда не отделяются и не уплывают в строму. [122] Практически все пластоглобулы образуются на сильно изогнутых краях дисков или листов тилакоидов или вблизи них. Они также чаще встречаются на стромальных тилакоидах, чем на гранальных . [122]
Гранулы крахмала очень распространены в хлоропластах и обычно занимают 15% объема органеллы, [123] хотя в некоторых других пластидах, таких как амилопласты , они могут быть достаточно большими, чтобы искажать форму органеллы. [112] Гранулы крахмала представляют собой просто скопления крахмала в строме и не ограничены мембраной. [112]
Гранулы крахмала появляются и растут в течение дня, поскольку хлоропласты синтезируют сахара , и потребляются ночью для поддержания дыхания и продолжения экспорта сахара во флоэму , [124] хотя в зрелых хлоропластах крахмальные гранулы редко полностью расходуются. или для накопления новой гранулы. [123]
Гранулы крахмала различаются по составу и расположению в разных линиях хлоропластов. У красных водорослей гранулы крахмала находятся в цитоплазме , а не в хлоропластах. [125] У растений C 4 в хлоропластах мезофилла , которые не синтезируют сахара, отсутствуют крахмальные гранулы. [33]

Строма хлоропласта содержит много белков, но наиболее распространенным и важным является RuBisCO , который, вероятно, также является самым распространенным белком на планете. [105] RuBisCO — это фермент, который связывает CO 2 в молекулы сахара. У растений С 3 RuBisCO присутствует во всех хлоропластах, хотя у растений С 4 он ограничен хлоропластами оболочки пучка , где у растений С 4 осуществляется цикл Кальвина . [126]
Хлоропласты некоторых роголистников [127] и водорослей содержат структуры, называемые пиреноидами . Они не встречаются у высших растений. [128] Пиреноиды представляют собой примерно сферические тела с высокой преломляющей способностью, которые являются местом накопления крахмала в растениях, которые их содержат. Они состоят из непрозрачной для электронов матрицы, окруженной двумя полусферическими пластинками крахмала. Крахмал накапливается по мере созревания пиреноидов. [129] В водорослях с механизмом концентрации углерода фермент RuBisCO обнаружен в пиреноидах. Крахмал также может накапливаться вокруг пиреноидов при недостатке CO 2 . [128] Пиреноиды могут делиться с образованием новых пиреноидов или производиться «de novo» . [129] [130]

Тилакоиды (иногда называемые тилакоидами ) [132] представляют собой небольшие взаимосвязанные мешочки, содержащие мембраны, на которых происходят световые реакции фотосинтеза. Слово тилакоид происходит от греческого слова тилакос , что означает «мешок». [133]
Внутри стромы хлоропласта подвешена тилакоидная система , высокодинамичная совокупность мембранных мешочков, называемых тилакоидами , в которых находится хлорофилл и происходят световые реакции фотосинтеза . [16] В большинстве хлоропластов сосудистых растений тилакоиды расположены стопками, называемыми гранами, [134] хотя в некоторых хлоропластах растений C 4 [126] и некоторых хлоропластах водорослей тилакоиды находятся в свободном плавании. [17]

В световой микроскоп едва можно увидеть крошечные зеленые гранулы, которые получили название грана . [112] С помощью электронной микроскопии стало возможным рассмотреть тилакоидную систему более детально, обнаружив, что она состоит из стопок плоских тилакоидов , составляющих граны, и длинных соединяющихся стромальных тилакоидов, которые связывают разные граны. [112] В просвечивающем электронном микроскопе тилакоидные мембраны выглядят как чередующиеся светлые и темные полосы толщиной 8,5 нанометров. [112]
Трехмерная структура мембранной системы тилакоидов остается спорной. Было предложено множество моделей, наиболее распространенной из которых является спиральная модель, в которой стопки гранум тилакоидов обернуты спиральными стромальными тилакоидами. [135] Другая модель, известная как «модель бифуркации», которая была основана на первом исследовании тилакоидных мембран растений с помощью электронной томографии, изображает стромальные мембраны как широкие ламеллярные листы, перпендикулярные столбцам граны, которые раздваиваются на несколько параллельных дисков, образующих грану- сборка стромы. [136] Спиральная модель была подтверждена несколькими дополнительными работами, [134] [137] , но в конечном итоге в 2019 году было установлено, что особенности как спиральной, так и бифуркационной модели объединяются недавно обнаруженными левоспиральными мембранными соединениями. [131] Вероятно, для простоты, тилакоидная система до сих пор обычно изображается с помощью старых моделей «ступицы и спицы», где граны соединены друг с другом трубками стромальных тилакоидов. [138]
Граны состоят из стопок уплощенных круглых тилакоидов граналей, напоминающих блины. Каждая гранум может содержать от двух до ста тилакоидов, [112] хотя наиболее распространены граны с 10–20 тилакоидами. [134] Вокруг граны обернуты многочисленные параллельные правосторонние спиральные стромальные тилакоиды, также известные как лады или ламеллярные тилакоиды. Спирали поднимаются под углом ~20°, соединяясь с каждым гранальным тилакоидом мостовидным щелевым соединением. [134] [137] [131]
Ламели стромы простираются в виде больших листов перпендикулярно столбцам граны. Эти листы соединены с правыми спиралями либо напрямую, либо через бифуркации, образующие левоспиральные мембранные поверхности. [131] Левые винтовые поверхности имеют такой же угол наклона, как и правые спирали (~ 20°), но составляют ¼ шага. На одно зерно приходится примерно 4 левых спиральных соединения, в результате чего образуется сбалансированный по шагу массив право- и левоспиральных мембранных поверхностей с разными радиусами и шагом, которые консолидируют сеть с минимальной поверхностной и изгибной энергиями. [131] Хотя разные части тилакоидной системы содержат разные мембранные белки, тилакоидные мембраны непрерывны, а пространство тилакоидов, которое они заключают, образует единый непрерывный лабиринт. [134]
В мембранах тилакоидов встроены важные белковые комплексы , осуществляющие световые реакции фотосинтеза . Фотосистема II и фотосистема I содержат светособирающие комплексы с хлорофиллом и каротиноидами , которые поглощают энергию света и используют ее для подачи энергии электронам. Молекулы в тилакоидной мембране используют заряженные электроны для перекачки ионов водорода в пространство тилакоида, снижая pH и делая его кислым. АТФ-синтаза — это большой белковый комплекс, который использует градиент концентрации ионов водорода в тилакоидном пространстве для выработки энергии АТФ , когда ионы водорода возвращаются в строму — во многом подобно турбине плотины. [105]
Различают два типа тилакоидов — гранальные тилакоиды, расположенные в гранах, и стромальные тилакоиды, контактирующие со стромой . Гранальные тилакоиды представляют собой круглые диски блинообразной формы диаметром около 300–600 нанометров. Стромальные тилакоиды представляют собой спиральные пластинки, закручивающиеся вокруг гран. [134] Плоские верхние и нижние части гранальных тилакоидов содержат только относительно плоский белковый комплекс фотосистемы II . Это позволяет им плотно штабелироваться, образуя граны со многими слоями плотно прижатой мембраны, называемой гранальной мембраной, что увеличивает стабильность и площадь поверхности для улавливания света. [134]
Напротив, фотосистема I и АТФ-синтаза представляют собой большие белковые комплексы, выступающие в строму. Они не могут поместиться в прижатых гранальных мембранах и поэтому обнаруживаются в стромальных тилакоидных мембранах - краях гранальных тилакоидных дисков и стромальных тилакоидах. Эти крупные белковые комплексы могут действовать как прокладки между листами стромальных тилакоидов. [134]
Количество тилакоидов и общая площадь тилакоидов хлоропласта зависит от освещенности. Затененные хлоропласты содержат больше и больше гран с большей площадью тилакоидной мембраны, чем хлоропласты, подвергающиеся яркому свету, которые имеют все меньше и меньше гран и меньшую площадь тилакоидов. Размер тилакоида может измениться в течение нескольких минут после воздействия света или его удаления. [115]
Внутри фотосистем, встроенных в тилакоидные мембраны хлоропластов, находятся различные фотосинтетические пигменты , поглощающие и передающие световую энергию . Типы обнаруженных пигментов различны в разных группах хлоропластов и отвечают за самую разнообразную окраску хлоропластов.
Хлорофилл а содержится во всех хлоропластах, а также у их цианобактериальных предков. Хлорофилл а — сине-зеленый пигмент [139] , частично отвечающий за окраску большинства цианобактерий и хлоропластов. Существуют и другие формы хлорофилла, такие как дополнительные пигменты хлорофилл b , хлорофилл c , хлорофилл d [17] и хлорофилл f .
Хлорофилл b — оливково-зеленый пигмент, обнаруженный только в хлоропластах растений , зеленых водорослях , любых вторичных хлоропластах, полученных в результате вторичного эндосимбиоза зеленых водорослей, и некоторых цианобактерий . [17] Именно хлорофиллы a и b вместе делают большинство хлоропластов растений и зеленых водорослей зелеными. [139]
Хлорофилл С в основном обнаруживается во вторичных эндосимбиотических хлоропластах, произошедших от красных водорослей , хотя он не обнаружен в хлоропластах самих красных водорослей. Хлорофилл С также содержится в некоторых зеленых водорослях и цианобактериях . [17]
Хлорофиллы d и f — пигменты, встречающиеся только у некоторых цианобактерий. [17] [140]

Помимо хлорофиллов в фотосистемах обнаружена еще одна группа желто - оранжевых [139] пигментов, называемых каротиноидами . Существует около тридцати фотосинтетических каротиноидов. [141] Они помогают передавать и рассеивать избыточную энергию, [17] а их яркие цвета иногда затмевают зеленый цвет хлорофилла, как, например, осенью , когда листья некоторых наземных растений меняют цвет. [142] β-каротин представляет собой ярко-красно-оранжевый каротиноид, обнаруженный почти во всех хлоропластах, подобно хлорофиллу а . [17] Ксантофиллы , особенно оранжево-красный зеаксантин , также распространены. [141] Существует множество других форм каротиноидов, которые встречаются только в определенных группах хлоропластов. [17]
Фикобилины — третья группа пигментов, обнаруженных в цианобактериях , а также в хлоропластах глаукофитов , красных водорослей и криптофитов . [17] [143] Фикобилины бывают всех цветов, хотя фикоэритерин является одним из пигментов, который делает многие красные водоросли красными. [144] Фикобилины часто организуются в относительно большие белковые комплексы диаметром около 40 нанометров, называемые фикобилисомами . [17] Подобно фотосистеме I и АТФ-синтазе , фикобилисомы проникают в строму, предотвращая накопление тилакоидов в хлоропластах красных водорослей. [17] Хлоропласты криптофитов и некоторые цианобактерии не имеют своих фикобилиновых пигментов, организованных в фикобилисомы, и вместо этого удерживают их в своем тилакоидном пространстве. [17]
Чтобы фиксировать углекислый газ в молекулах сахара в процессе фотосинтеза , хлоропласты используют фермент под названием RuBisCO . RuBisCO не может отличить углекислый газ от кислорода , поэтому при высоких концентрациях кислорода RuBisCO начинает случайно добавлять кислород к предшественникам сахара. Это приводит к трате энергии АТФ и выделению CO 2 без образования сахара. Это большая проблема, поскольку O 2 вырабатывается в ходе начальных световых реакций фотосинтеза, вызывая проблемы в дальнейшем в цикле Кальвина , в котором используется RuBisCO. [145]
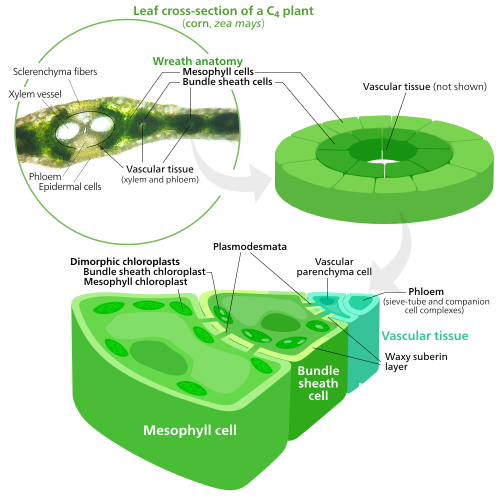
Растения C 4 нашли способ решить эту проблему — пространственно разделив световые реакции и цикл Кальвина. Световые реакции, в которых энергия света сохраняется в виде АТФ и НАДФН , происходят в клетках мезофилла листа С 4 . Цикл Кальвина, в котором накопленная энергия используется для производства сахара с использованием RuBisCO, осуществляется в клетках оболочки пучка — слое клеток, окружающем жилку листа . [145]
В результате хлоропласты в клетках С 4 мезофилла и клетках оболочки пучка специализируются на каждой стадии фотосинтеза. В клетках мезофилла хлоропласты специализированы для световых реакций, поэтому в них отсутствует RuBisCO и имеются нормальные граны и тилакоиды , [126] которые они используют для производства АТФ и НАДФН, а также кислорода. Они хранят CO 2 в виде четырехуглеродного соединения, поэтому этот процесс называется фотосинтезом C 4 . Затем четырехуглеродное соединение транспортируется к хлоропластам оболочки пучка, где отбрасывает CO 2 и возвращается в мезофилл. Хлоропласты оболочки пучка не осуществляют световые реакции, что препятствует накоплению в них кислорода и нарушению активности RuBisCO. [145] Из-за этого у них отсутствуют тилакоиды, организованные в стопки гран , хотя хлоропласты оболочки пучка все еще имеют свободно плавающие тилакоиды в строме, где они все еще осуществляют циклический поток электронов - управляемый светом метод синтеза АТФ для питания цикла Кальвина. без образования кислорода. У них отсутствует фотосистема II , и есть только фотосистема I — единственный белковый комплекс, необходимый для циклического потока электронов. [126] [145] Поскольку задача хлоропластов оболочки пучка заключается в осуществлении цикла Кальвина и производстве сахара, они часто содержат крупные крахмальные зерна. [126]
Оба типа хлоропластов содержат большое количество периферической сети хлоропластов , [126] которую они используют, чтобы получить большую площадь поверхности для транспортировки веществ внутрь и наружу. [114] [115] Хлоропласты мезофилла имеют немного больше периферического ретикулума, чем хлоропласты оболочки пучка. [146]
Не все клетки многоклеточного растения содержат хлоропласты. Все зеленые части растения содержат хлоропласты — хлоропласты, или, точнее, хлорофилл в них, делают фотосинтезирующие части растения зелеными. [16] Растительные клетки , содержащие хлоропласты, обычно представляют собой клетки паренхимы , хотя хлоропласты также можно найти в ткани колленхимы . [147] Растительная клетка, содержащая хлоропласты, известна как клетка хлоренхимы . Типичная клетка хлоренхимы наземного растения содержит от 10 до 100 хлоропластов.

У некоторых растений, таких как кактусы , хлоропласты находятся в стеблях , [148] хотя у большинства растений хлоропласты сосредоточены в листьях . Один квадратный миллиметр ткани листа может содержать полмиллиона хлоропластов. [16] Внутри листа хлоропласты в основном находятся в слоях мезофилла листа и замыкающих клетках устьиц . Клетки палисадного мезофилла могут содержать 30–70 хлоропластов на клетку, тогда как замыкающие клетки устьиц содержат только около 8–15 хлоропластов на клетку, а также гораздо меньше хлорофилла . Хлоропласты также можно обнаружить в клетках оболочки пучка листа, особенно у растений С 4 , которые осуществляют цикл Кальвина в своих клетках оболочки пучка. Они часто отсутствуют в эпидермисе листа. [149]
Хлоропласты клеток растений и водорослей могут ориентироваться так, чтобы наилучшим образом соответствовать доступному свету. В условиях низкой освещенности они раскладываются листом, увеличивая площадь поверхности для поглощения света. При интенсивном освещении они будут искать укрытие, выстраиваясь вертикальными колоннами вдоль клеточной стенки растительной клетки или поворачиваясь боком, чтобы свет падал на них с ребра. Это уменьшает воздействие и защищает их от фотоокислительного повреждения. [150] Эта способность распределять хлоропласты так, чтобы они могли укрываться друг за другом или расселяться, может быть причиной того, что наземные растения эволюционировали и стали иметь много маленьких хлоропластов вместо нескольких больших. [151] Движение хлоропластов считается одной из наиболее тщательно регулируемых систем стимул-реакция, которые можно найти у растений. [152] Также было замечено, что митохондрии следуют за хлоропластами во время их движения. [153]
У высших растений движение хлоропластов управляется фототропинами , фоторецепторами синего света, также ответственными за фототропизм растений . У некоторых водорослей, мхов , папоротников и цветковых растений на движение хлоропластов влияет не только синий свет, но и красный свет, [150] хотя очень длинные волны красного цвета тормозят движение, а не ускоряют его. Синий свет обычно заставляет хлоропласты искать укрытие, а красный свет вытягивает их наружу, чтобы максимизировать поглощение света. [153]
Исследования Vallisneria gigantea , водного цветкового растения , показали, что хлоропласты могут начать двигаться в течение пяти минут под воздействием света, хотя изначально они не проявляют какой-либо общей направленности. Они могут перемещаться по следам микроволокон , и тот факт, что сетка из микрофиламентов меняет форму, образуя сотовую структуру, окружающую хлоропласты после их перемещения, позволяет предположить, что микрофиламенты могут способствовать закреплению хлоропластов на месте. [152] [153]
В отличие от большинства эпидермальных клеток замыкающие клетки устьиц растений содержат относительно хорошо развитые хлоропласты. [149] Однако то, что именно они делают, вызывает споры. [154]
У растений отсутствуют специализированные иммунные клетки — в иммунном ответе растений участвуют все растительные клетки . Хлоропласты, наряду с ядром , клеточной мембраной и эндоплазматической сетью , [155] являются ключевыми игроками в защите от патогенов . Из-за его роли в иммунном ответе растительной клетки патогены часто поражают хлоропласты. [155]
У растений есть два основных иммунных ответа: гиперчувствительный ответ , при котором инфицированные клетки изолируются и подвергаются запрограммированной гибели клеток , и системная приобретенная устойчивость , когда инфицированные клетки выделяют сигналы, предупреждающие остальную часть растения о присутствии патогена. Хлоропласты стимулируют обе реакции, намеренно повреждая свою фотосинтетическую систему, производя активные формы кислорода . Высокие уровни активных форм кислорода вызовут реакцию гиперчувствительности . Активные формы кислорода также напрямую убивают любые патогены внутри клетки. Более низкие уровни активных форм кислорода инициируют системную приобретенную устойчивость , запуская выработку защитных молекул в остальной части растения. [155]
Известно, что у некоторых растений хлоропласты во время инфекции перемещаются ближе к месту заражения и ядру . [155]
Хлоропласты могут служить клеточными сенсорами. После обнаружения стресса в клетке, который может быть вызван патогеном, хлоропласты начинают вырабатывать такие молекулы, как салициловая кислота , жасмоновая кислота , оксид азота и активные формы кислорода , которые могут служить защитными сигналами. В качестве клеточных сигналов активные формы кислорода являются нестабильными молекулами, поэтому они, вероятно, не покидают хлоропласт, а вместо этого передают свой сигнал неизвестной молекуле-посреднику. Все эти молекулы инициируют ретроградную передачу сигналов — сигналы от хлоропласта, которые регулируют экспрессию генов в ядре. [155]
Помимо передачи защитных сигналов, хлоропласты с помощью пероксисом [ 156] помогают синтезировать важную защитную молекулу — жасмонат . Хлоропласты синтезируют все жирные кислоты в растительной клетке [155] [157] — линолевая кислота , жирная кислота, является предшественником жасмоната. [155]
Одной из основных функций хлоропласта является его роль в фотосинтезе , процессе, посредством которого свет преобразуется в химическую энергию для последующего производства пищи в виде сахаров . Вода (H 2 O) и углекислый газ (CO 2 ) используются в фотосинтезе, а сахар и кислород (O 2 ) производятся с использованием энергии света . Фотосинтез делится на две стадии: световые реакции , при которых вода расщепляется с образованием кислорода, и темновые реакции , или цикл Кальвина , в ходе которых молекулы сахара образуются из углекислого газа. Эти две фазы связаны энергоносителями аденозинтрифосфатом (АТФ) и никотинамидадениндинуклеотидфосфатом (НАДФ + ). [158] [159]

Световые реакции происходят на мембранах тилакоидов. Они берут световую энергию и хранят ее в НАДФН , форме НАДФ + , и АТФ, чтобы подпитывать темные реакции .
АТФ — это фосфорилированная версия аденозиндифосфата (АДФ), который сохраняет энергию в клетке и обеспечивает большую часть клеточной активности. АТФ — это активная форма, а АДФ — (частично) обедненная форма. НАДФ + является переносчиком электронов, который переносит электроны высокой энергии. В световых реакциях он восстанавливается , то есть захватывает электроны, превращаясь в НАДФН .
Подобно митохондриям, хлоропласты используют потенциальную энергию, запасенную в градиенте H + или ионов водорода, для генерации энергии АТФ. Две фотосистемы улавливают энергию света, чтобы снабдить энергией электроны , взятые из воды , и выпустить их по цепи переноса электронов . Молекулы между фотосистемами используют энергию электронов для перекачки ионов водорода в пространство тилакоидов, создавая градиент концентрации , при этом ионов водорода (до тысячи раз больше) [105] внутри тилакоидной системы, чем в строме. Ионы водорода в тилакоидном пространстве затем диффундируют обратно по градиенту своей концентрации, выходя обратно в строму через АТФ-синтазу . АТФ-синтаза использует энергию текущих ионов водорода для фосфорилирования аденозиндифосфата в аденозинтрифосфат или АТФ. [105] [160] Поскольку АТФ-синтаза хлоропластов выделяется в строму, АТФ синтезируется там, где его можно использовать в темновых реакциях. [161]
Электроны часто удаляются из цепей переноса электронов , чтобы заряжать НАДФ + электронами, восстанавливая его до НАДФН . Подобно АТФ-синтазе, ферредоксин-НАДФ + редуктаза , фермент, который восстанавливает НАДФ + , высвобождает НАДФН, который он производит, в строму, именно там, где он необходим для темновых реакций. [161]
Поскольку восстановление НАДФ + удаляет электроны из цепей переноса электронов, их необходимо заменить — это работа фотосистемы II , которая расщепляет молекулы воды (H 2 O), чтобы получить электроны от ее атомов водорода . [105] [158]
В то время как фотосистема II фотолизует воду для получения и подачи энергии новым электронам, фотосистема I просто восстанавливает энергию истощенных электронов в конце цепи переноса электронов. Обычно восстановленные электроны захватываются НАДФ + , хотя иногда они могут течь обратно по большему количеству H + -перекачивающих электронно-транспортных цепей, чтобы транспортировать больше ионов водорода в пространство тилакоидов для генерации большего количества АТФ. Это называется циклическим фотофосфорилированием , поскольку электроны перерабатываются. Циклическое фотофосфорилирование распространено у растений C 4 , которым требуется больше АТФ , чем НАДФН . [145]
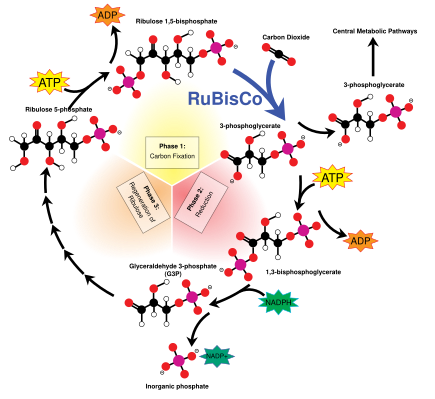
Цикл Кальвина , также известный как темновые реакции , представляет собой серию биохимических реакций, которые связывают CO 2 в молекулы сахара G3P и используют энергию и электроны АТФ и НАДФН , образующиеся в световых реакциях. Цикл Кальвина протекает в строме хлоропласта. [145]
Хотя их называют «темновыми реакциями» , у большинства растений они протекают на свету, поскольку темновые реакции зависят от продуктов световых реакций. [16]
Цикл Кальвина начинается с использования фермента RuBisCO для фиксации CO 2 в пятиуглеродных молекулах рибулозобисфосфата (RuBP). В результате образуются нестабильные шестиуглеродные молекулы, которые сразу же распадаются на трехуглеродные молекулы, называемые 3-фосфоглицериновой кислотой или 3-PGA. АТФ и НАДФН , образующиеся в световых реакциях, используются для превращения 3-ФГА в глицеральдегид-3-фосфат или молекулы сахара G3P. Большинство молекул G3P перерабатываются обратно в RuBP, используя энергию большего количества АТФ, но одна из каждых шести произведенных молекул покидает цикл — конечный продукт темных реакций. [145]
Глицеральдегид-3-фосфат может удваиваться, образуя более крупные молекулы сахара, такие как глюкоза и фруктоза . Эти молекулы подвергаются процессингу, и из них образуется еще более крупная сахароза , дисахарид , широко известный как столовый сахар, хотя этот процесс происходит вне хлоропласта, в цитоплазме . [162]
Альтернативно, мономеры глюкозы в хлоропластах могут соединяться вместе, образуя крахмал , который накапливается в крахмальных зернах , находящихся в хлоропластах. [162] В таких условиях, как высокие концентрации CO 2 в атмосфере , эти зерна крахмала могут вырасти очень большими, деформируя граны и тилакоиды. Гранулы крахмала вытесняют тилакоиды, но оставляют их нетронутыми. [163] Переувлажненные корни также могут вызывать накопление крахмала в хлоропластах, возможно, из-за того, что из хлоропласта (или, точнее, из растительной клетки ) выводится меньше сахарозы . Это истощает запасы свободных фосфатов в растениях , что косвенно стимулирует синтез крахмала в хлоропластах. [163] Хотя крахмальные зерна связаны с низкой скоростью фотосинтеза, сами по себе они не обязательно могут существенно влиять на эффективность фотосинтеза, [164] и могут быть просто побочным эффектом другого фактора, угнетающего фотосинтез. [163]
Фотодыхание может возникать при слишком высокой концентрации кислорода. RuBisCO не может очень хорошо различать кислород и углекислый газ, поэтому он может случайно добавить O 2 вместо CO 2 к RuBP . Этот процесс снижает эффективность фотосинтеза — он потребляет АТФ и кислород, выделяет CO 2 и не производит сахара. Он может тратить до половины углерода, зафиксированного циклом Кальвина. [158] В различных линиях развилось несколько механизмов, которые повышают концентрацию углекислого газа по отношению к кислороду внутри хлоропласта, увеличивая эффективность фотосинтеза. Эти механизмы называются механизмами концентрации углекислого газа или CCM. К ним относятся метаболизм крассулацовых кислот , фиксация углерода C 4 [158 ] и пиреноиды . Хлоропласты в растениях C 4 примечательны тем, что они демонстрируют отчетливый диморфизм хлоропластов.
Из-за градиента H + на тилакоидной мембране внутренняя часть тилакоида кислая , с pH около 4, [165] тогда как строма слегка щелочная, с pH около 8. [166] Оптимальный pH стромы для цикл Кальвина составляет 8,1, при этом реакция почти прекращается, когда pH падает ниже 7,3. [167]
CO 2 в воде может образовывать угольную кислоту , которая может нарушать pH изолированных хлоропластов, мешая фотосинтезу, хотя CO 2 используется в фотосинтезе. Однако хлоропласты в живых растительных клетках от этого страдают не так сильно. [166]
Хлоропласты могут перекачивать ионы K + и H + внутрь и наружу, используя плохо изученную транспортную систему, управляемую светом. [166]
В присутствии света pH просвета тилакоида может падать до 1,5 единиц pH, а pH стромы может повышаться почти на одну единицу pH. [167]
Только хлоропласты производят почти все аминокислоты растительных клеток в своей строме [168], за исключением серосодержащих, таких как цистеин и метионин . [169] [170] Цистеин вырабатывается в хлоропластах (в том числе и в пропластидах ), но он также синтезируется в цитозоле и митохондриях , вероятно, потому, что ему трудно проникать через мембраны, чтобы попасть туда, где он необходим. [170] Известно, что хлоропласты производят предшественники метионина, но неясно, выполняет ли органелла последний этап пути или это происходит в цитозоле . [171]
Хлоропласты производят все клеточные пурины и пиримидины — азотистые основания , содержащиеся в ДНК и РНК . [168] Они также преобразуют нитрит (NO 2 - ) в аммиак (NH 3 ), который снабжает растение азотом для производства аминокислот и нуклеотидов . [168]
Пластида является местом синтеза разнообразных и сложных липидов в растениях. [172] [173] Углерод, используемый для образования большей части липидов, происходит из ацетил-КоА , который является продуктом декарбоксилирования пирувата . [172] Пируват может проникать в пластиду из цитозоля путем пассивной диффузии через мембрану после образования в результате гликолиза . [174] Пируват также производится в пластиде из фосфоенолпирувата, метаболита, образующегося в цитозоле из пирувата или PGA . [172] Ацетат в цитозоле недоступен для биосинтеза липидов в пластидах. [175] Типичная длина жирных кислот, образующихся в пластиде, составляет 16 или 18 атомов углерода с 0–3 двойными цис -связями. [176]
Биосинтез жирных кислот из ацетил-КоА в первую очередь требует двух ферментов. Ацетил-КоА-карбоксилаза создает малонил-КоА, используемый как на первом, так и на дополнительных этапах синтеза. Синтаза жирных кислот (FAS) представляет собой большой комплекс ферментов и кофакторов, включая белок-носитель ацила (ACP), который удерживает ацильную цепь во время ее синтеза. Инициирование синтеза начинается с конденсации малонил-АПБ с ацетил-КоА с образованием кетобутирил-АПБ. 2 сокращения с использованием НАДФН и одно обезвоживание создают бутирил-АСР. Увеличение количества жирных кислот происходит в результате повторяющихся циклов конденсации, восстановления и дегидратации малонил-АПБ. [172]
Другие липиды образуются по пути метилэритритфосфата (МЭП) и состоят из гибберелинов , стеринов , абсцизовой кислоты , фитола и бесчисленных вторичных метаболитов . [172]
Хлоропласты — это особый тип органеллы растительной клетки, называемый пластидой , хотя эти два термина иногда используются как синонимы. Существует множество других типов пластид, выполняющих различные функции. Все хлоропласты растения происходят от недифференцированных пропластид , находящихся в зиготе [168] или оплодотворенной яйцеклетке. Пропластиды обычно обнаруживаются в апикальных меристемах взрослых растений . Хлоропласты обычно не развиваются из пропластид в меристемах кончиков корней [177] — вместо этого более распространено образование запасающих крахмал амилопластов . [168]
В побегах пропластиды из апикальных меристем побегов могут постепенно превращаться в хлоропласты в фотосинтезирующих тканях листа по мере созревания листа, если он подвергается воздействию необходимого света. [12] Этот процесс включает в себя инвагинацию внутренней пластидной мембраны, образуя листы мембраны, которые выступают во внутреннюю строму . Эти мембранные листы затем сворачиваются, образуя тилакоиды и граны . [178]
Если побеги покрытосеменных не подвергаются воздействию света, необходимого для образования хлоропластов, пропластиды могут развиться до стадии этиопласта , прежде чем стать хлоропластами. Этиопласт представляет собой пластиду, лишенную хлорофилла и имеющую впячивания внутренней мембраны, которые образуют решетку трубок в строме, называемую проламеллярным тельцем . Хотя в этиопластах отсутствует хлорофилл, в них имеется желтый предшественник хлорофилла . [12] В течение нескольких минут воздействия света проламеллярное тело начинает реорганизовываться в стопки тилакоидов, и начинает вырабатываться хлорофилл. Этот процесс, когда этиопласт становится хлоропластом, занимает несколько часов. [178] Голосеменные растения не требуют света для образования хлоропластов. [178]
Однако свет не гарантирует, что пропластид превратится в хлоропласт. Превращение пропластиды в хлоропласт в какой-либо другой вид пластид в основном контролируется ядром [ 12] и во многом зависит от типа клетки, в которой он находится. [168]
Дифференциация пластид не является постоянной, фактически возможны многие взаимопревращения. Хлоропласты могут превращаться в хромопласты , которые представляют собой заполненные пигментами пластиды, отвечающие за яркие цвета цветов и спелых фруктов . Амилопласты , запасающие крахмал, также могут превращаться в хромопласты, а пропластиды могут развиваться прямо в хромопласты. Хромопласты и амилопласты также могут стать хлоропластами, как это происходит при освещении моркови или картофеля . Если растение повреждено или что-то еще заставляет растительную клетку вернуться в меристематическое состояние, хлоропласты и другие пластиды могут снова превратиться в пропластиды. Хлоропласт, амилопласт, хромопласт, пропластид не являются абсолютными; состояние — распространены промежуточные формы. [168]
Большинство хлоропластов в фотосинтетической клетке не развиваются непосредственно из пропластид или этиопластов. Фактически типичная меристематическая клетка побега содержит всего 7–20 пропластид . Эти пропластиды дифференцируются в хлоропласты, которые делятся, образуя 30–70 хлоропластов, обнаруженных в зрелой фотосинтезирующей растительной клетке. Если клетка делится , деление хлоропластов обеспечивает дополнительные хлоропласты для распределения между двумя дочерними клетками. [179]
У одноклеточных водорослей деление хлоропластов — единственный путь образования новых хлоропластов. Дифференциация пропластид отсутствует — при делении клетки водоросли вместе с ней делится и ее хлоропласт, и каждая дочерняя клетка получает зрелый хлоропласт. [178]
Делятся почти все хлоропласты в клетке, а не небольшая группа быстро делящихся хлоропластов. [180] Хлоропласты не имеют определенной S-фазы — репликация их ДНК не синхронизирована и не ограничена репликацией клеток-хозяев. [181] Большая часть того, что мы знаем о делении хлоропластов, получено в результате изучения таких организмов, как Arabidopsis и красная водоросль Cyanidioschyzon merolæ . [151]
![Большинство хлоропластов в растительных клетках и все хлоропласты в водорослях возникают в результате деления хлоропластов.[178] Ссылки на изображения,[151][182]](http://upload.wikimedia.org/wikipedia/commons/thumb/d/df/Chloroplast_division.svg/800px-Chloroplast_division.svg.png)
Процесс деления начинается, когда белки FtsZ1 и FtsZ2 собираются в нити и с помощью белка ARC6 образуют структуру, называемую Z-кольцом, внутри стромы хлоропласта. [151] [182] Система Min управляет размещением Z-кольца, обеспечивая более или менее равномерное расщепление хлоропласта. Белок MinD предотвращает соединение FtsZ и образование нитей. Другой белок ARC3 также может быть задействован, но он еще недостаточно изучен. Эти белки активны на полюсах хлоропласта, предотвращая образование там Z-кольца, но вблизи центра хлоропласта MinE ингибирует их, позволяя сформироваться Z-кольцу. [151]
Далее образуются два пластид-разделительных кольца, или ПД-кольца. Внутреннее пластидное разделительное кольцо расположено на внутренней стороне внутренней мембраны хлоропласта и формируется первым. [151] Наружное пластидное разделительное кольцо обернуто вокруг внешней мембраны хлоропласта. Он состоит из нитей диаметром около 5 нанометров, [151] расположенных рядами на расстоянии 6,4 нанометра друг от друга и сжимающихся, сжимая хлоропласт. В этот момент начинается сокращение хлоропластов. [182]
У некоторых видов, таких как Cyanidioschyzon merolæ , хлоропласты имеют третье пластидное разделительное кольцо, расположенное в межмембранном пространстве хлоропласта. [151] [182]
На поздней стадии фазы сжатия белки динамина собираются вокруг внешнего разделительного кольца пластид, [182] помогая обеспечить силу, сжимающую хлоропласт. [151] Тем временем Z-кольцо и внутреннее пластидное разделительное кольцо разрушаются. [182] На этом этапе множество хлоропластных ДНК-плазмид, плавающих в строме, разделяются и распределяются по двум образующимся дочерним хлоропластам. [183]
Позже динамины мигрируют под внешнее разделительное кольцо пластиды, вступая в прямой контакт с внешней мембраной хлоропласта [182] и расщепляя хлоропласт на два дочерних хлоропласта. [151]
Остаток внешнего пластидного разделительного кольца остается плавающим между двумя дочерними хлоропластами, а остаток динаминового кольца остается прикрепленным к одному из дочерних хлоропластов. [182]
Из пяти или шести колец, участвующих в делении хлоропластов, на протяжении всей фазы сужения и деления присутствует только внешнее пластидразделительное кольцо - в то время как Z-кольцо формируется первым, сужение не начинается до тех пор, пока не сформируется внешнее пластидразделительное кольцо. [182]

У видов водорослей , содержащих один хлоропласт, регуляция деления хлоропластов чрезвычайно важна для обеспечения того, чтобы каждая дочерняя клетка получала хлоропласт — хлоропласты не могут быть созданы с нуля. [79] [151] В таких организмах, как растения, клетки которых содержат несколько хлоропластов, координация менее выражена и менее важна. Вполне вероятно, что деление хлоропластов и клеток в некоторой степени синхронизировано, хотя механизмы этого по большей части неизвестны. [151]
Было доказано, что свет необходим для деления хлоропластов. Хлоропласты могут расти и проходить некоторые стадии сжатия при плохом зеленом свете , но завершают деление медленно — для завершения деления им требуется воздействие яркого белого света. Было обнаружено, что листья шпината, выращенные под зеленым светом, содержат множество крупных хлоропластов гантелевидной формы. Воздействие белого света может стимулировать эти хлоропласты к делению и уменьшению популяции хлоропластов в форме гантелей. [180] [183]
Как и митохондрии , хлоропласты обычно наследуются от одного родителя. Двуродительское наследование хлоропластов, когда пластидные гены наследуются от обоих родительских растений, у некоторых цветковых растений встречается в очень небольших количествах. [184]
Многие механизмы предотвращают наследование ДНК хлоропластов от двух родителей, включая избирательное разрушение хлоропластов или их генов внутри гаметы или зиготы , а также исключение хлоропластов одного родителя из эмбриона. Родительские хлоропласты можно отсортировать так, чтобы у каждого потомства присутствовал только один тип. [185]
Голосеменные растения , такие как сосны , в основном передают хлоропласты по отцовской линии, тогда как цветковые растения часто наследуют хлоропласты по материнской линии . [187] [188] Когда-то считалось, что цветковые растения наследуют хлоропласты только по материнской линии. Однако в настоящее время зарегистрировано много случаев, когда покрытосеменные наследовали хлоропласты по отцовской линии. [184]
Покрытосеменные растения , передающие хлоропласты по материнской линии, имеют множество способов предотвратить наследование по отцовской линии. Большинство из них производят сперматозоиды , не содержащие пластид. Существует множество других документированных механизмов, которые предотвращают отцовское наследование у этих цветковых растений, например, разная скорость репликации хлоропластов внутри эмбриона. [184]
Среди покрытосеменных отцовское наследование хлоропластов наблюдается чаще у гибридов , чем у потомков от родителей одного вида. Это предполагает, что несовместимые гибридные гены могут мешать механизмам, предотвращающим наследование от отца. [184]
Недавно хлоропласты привлекли внимание разработчиков генетически модифицированных сельскохозяйственных культур . Поскольку у большинства цветковых растений хлоропласты не наследуются от родителя-мужчины, трансгены в этих пластидах не могут распространяться с помощью пыльцы . Это делает пластидную трансформацию ценным инструментом для создания и выращивания генетически модифицированных растений, которые являются биологически изолированными, что создает значительно меньшие экологические риски. Таким образом, эта стратегия биологического сдерживания подходит для сосуществования традиционного и органического сельского хозяйства . Хотя надежность этого механизма еще не изучена для всех соответствующих видов сельскохозяйственных культур, недавние результаты, полученные на табачных растениях, являются многообещающими: они показывают, что уровень неудачного сдерживания транспластомных растений составляет 3 на 1 000 000. [188]
количество копий цДНК на хлоропласт.
У сосен геном хлоропластов передается через пыльцу.