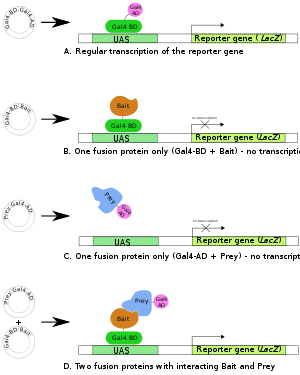
Двухгибридный скрининг (первоначально известный как дрожжевая двухгибридная система или Y2H ) — это метод молекулярной биологии, используемый для обнаружения белок-белковых взаимодействий (ББВ) [1] и белок-ДНК-взаимодействий [2] [3] путем тестирования физических взаимодействий (таких как связывание) между двумя белками или одним белком и молекулой ДНК соответственно.
Предпосылка теста — активация нижестоящего репортерного гена (ов) путем связывания фактора транскрипции с вышестоящей активирующей последовательностью (UAS). Для двухгибридного скрининга фактор транскрипции разделяется на два отдельных фрагмента, называемых доменом связывания ДНК (DBD или часто также сокращенно BD) и активирующим доменом (AD). BD — это домен, отвечающий за связывание с UAS, а AD — это домен, отвечающий за активацию транскрипции . [1] [2] Таким образом, Y2H — это анализ комплементации белковых фрагментов .
Впервые предложенный Стэнли Филдсом и Ок-Кю Сонгом в 1989 году, этот метод изначально был разработан для обнаружения белок-белковых взаимодействий с использованием транскрипционного активатора Gal4 дрожжей Saccharomyces cerevisiae . Белок Gal4 активировал транскрипцию гена, участвующего в утилизации галактозы, что легло в основу селекции. [4] С тех пор этот же принцип был адаптирован для описания многих альтернативных методов, включая некоторые, которые обнаруживают взаимодействия белок-ДНК или взаимодействия ДНК-ДНК, а также методы, которые используют другие организмы-хозяева, такие как Escherichia coli или клетки млекопитающих вместо дрожжей. [3] [5]
Ключ к двухгибридному скринингу заключается в том, что в большинстве эукариотических факторов транскрипции активирующие и связывающие домены являются модульными и могут функционировать в непосредственной близости друг от друга без прямого связывания. [6] Это означает, что даже если фактор транскрипции разделен на два фрагмента, он все равно может активировать транскрипцию, когда два фрагмента связаны косвенно.
Наиболее распространенным подходом к скринингу является дрожжевой двугибридный анализ. При этом подходе исследователь знает, где на используемой среде (агаровые пластины) находится каждая жертва. За последнее десятилетие с использованием высокопроизводительных систем скрининга (часто с использованием роботов) были проверены миллионы потенциальных взаимодействий в нескольких организмах, и более тысяч взаимодействий были обнаружены и классифицированы в базах данных как BioGRID. [7] [8] Эта система часто использует генетически модифицированный штамм дрожжей, в котором отсутствует биосинтез определенных питательных веществ (обычно аминокислот или нуклеиновых кислот ). При выращивании на среде, в которой отсутствуют эти питательные вещества, дрожжи не выживают. Этот мутантный штамм дрожжей можно заставить включать чужеродную ДНК в форме плазмид . При дрожжевом двугибридном скрининге отдельные плазмиды приманки и добычи одновременно вводятся в мутантный штамм дрожжей или используется стратегия спаривания, чтобы получить обе плазмиды в одной клетке-хозяине. [9]
Вторым высокопроизводительным подходом является подход скрининга библиотеки. В этой установке клетки-приманки и клетки-жертвы спариваются в случайном порядке. После спаривания и отбора выживших клеток на селективной среде ученый секвенирует изолированные плазмиды, чтобы увидеть, какая добыча (последовательность ДНК) взаимодействует с использованной приманкой. Этот подход имеет более низкую скорость воспроизводимости и имеет тенденцию давать большее количество ложноположительных результатов по сравнению с матричным подходом. [9]
Плазмиды конструируются для получения белкового продукта, в котором фрагмент домена связывания ДНК (BD) слит с белком, в то время как другая плазмида конструируется для получения белкового продукта, в котором фрагмент домена активации (AD) слит с другим белком. Белок, слитый с BD, может называться белком-приманкой и обычно является известным белком, который исследователь использует для идентификации новых партнеров по связыванию. Белок, слитый с AD, может называться белком-жертвой и может быть либо отдельным известным белком, либо библиотекой известных или неизвестных белков. В этом контексте библиотека может состоять из коллекции последовательностей, кодирующих белок, которые представляют все белки, экспрессируемые в определенном организме или ткани, или могут быть получены путем синтеза случайных последовательностей ДНК. [3] Независимо от источника, они впоследствии включаются в последовательность, кодирующую белок, плазмиды, которая затем трансфицируется в клетки, выбранные для метода скрининга. [3] При использовании библиотеки этот метод предполагает, что каждая клетка трансфицирована не более чем одной плазмидой и, следовательно, каждая клетка в конечном итоге экспрессирует не более одного члена из библиотеки белков.
Если белки приманки и добычи взаимодействуют (т.е. связываются), то AD и BD фактора транскрипции связаны косвенно, что приводит AD в близость к месту начала транскрипции и может произойти транскрипция гена(ов)-репортера. Если два белка не взаимодействуют, транскрипция гена-репортера не происходит. Таким образом, успешное взаимодействие между слитым белком связано с изменением фенотипа клетки. [1]
Проблема разделения клеток, экспрессирующих белки, взаимодействующие с соответствующими белками слияния, от клеток, не взаимодействующих с ними, рассматривается в следующем разделе.
В любом исследовании некоторые из доменов белка, которые исследуются, будут варьироваться в соответствии с целями исследования, тогда как другие домены, которые сами не исследуются, будут оставаться постоянными. Например, в двухгибридном исследовании для выбора доменов связывания ДНК, домен связывания ДНК, BD, будет варьироваться, в то время как два взаимодействующих белка, приманка и добыча, должны оставаться постоянными для поддержания сильной связи между BD и AD. Существует ряд доменов, из которых можно выбрать BD, приманку и добычу и AD, если они должны оставаться постоянными. В исследованиях взаимодействия белок-белок BD может быть выбран из любого из многих сильных доменов связывания ДНК, таких как Zif268 . [2] Частым выбором доменов приманки и добычи являются остатки 263–352 дрожжевого Gal11P с мутацией N342V [2] и остатки 58–97 дрожжевого Gal4, [2] соответственно. Эти домены могут использоваться в методах селекции как на основе дрожжей, так и бактерий, и, как известно, они прочно связываются друг с другом. [1] [2]
Выбранный AD должен быть способен активировать транскрипцию репортерного гена, используя собственный аппарат транскрипции клетки. Таким образом, разнообразие AD, доступных для использования в дрожжевых методах, может не подходить для использования в их бактериальных аналогах. AD, полученные из вируса простого герпеса, VP16 и дрожжевой Gal4 AD были успешно использованы в дрожжах [1], в то время как часть α-субъединицы РНК-полимеразы E. coli была использована в методах, основанных на E. coli . [2] [3]
В то время как домены с мощной активацией могут обеспечивать большую чувствительность к более слабым взаимодействиям, наоборот, более слабый AD может обеспечить большую строгость.
Для проведения двугибридного анализа или одного из его производных методов в клетку-хозяина необходимо включить ряд сконструированных генетических последовательностей. Соображения и методы, используемые при построении и доставке этих последовательностей, различаются в зависимости от потребностей анализа и организма, выбранного в качестве экспериментального фона.
Существует две широкие категории гибридных библиотек: случайные библиотеки и библиотеки на основе кДНК. Библиотека кДНК состоит из кДНК, полученной путем обратной транскрипции мРНК, собранной из определенных типов клеток. Эта библиотека может быть лигирована в конструкцию так, чтобы она была прикреплена к BD или AD, используемым в анализе. [1] Случайная библиотека использует отрезки ДНК случайной последовательности вместо этих участков кДНК. Существует ряд методов для получения этих случайных последовательностей, включая кассетный мутагенез . [2] Независимо от источника библиотеки ДНК, она лигируется в соответствующее место в соответствующей плазмиде/фагмиде с использованием соответствующих эндонуклеаз рестрикции . [2]
Помещая гибридные белки под контроль IPTG -индуцируемых lac -промоторов , они экспрессируются только на средах, дополненных IPTG. Кроме того, путем включения различных генов устойчивости к антибиотикам в каждую генетическую конструкцию, рост нетрансформированных клеток легко предотвращается посредством культивирования на средах, содержащих соответствующие антибиотики. Это особенно важно для методов встречной селекции, в которых для выживания клеток необходимо отсутствие взаимодействия. [2]
Ген-репортер может быть вставлен в геном E. coli , если сначала вставить его в эписому , тип плазмиды, способной встраиваться в геном бактериальной клетки [2] с числом копий приблизительно одна на клетку. [10]
Гибридные экспрессирующие фагмиды могут быть электропорированы в клетки E. coli XL-1 Blue, которые после амплификации и инфицирования вспомогательным фагом VCS-M13 дадут запас библиотечного фага. Каждый из этих фагов будет содержать один одноцепочечный член библиотеки фагмид. [2]
После того, как отбор выполнен, необходимо определить первичную структуру белков, которые демонстрируют соответствующие характеристики. Это достигается путем извлечения последовательностей, кодирующих белки (в том виде, в котором они были изначально вставлены) из клеток, демонстрирующих соответствующий фенотип.
Фагемида, используемая для трансформации клеток E. coli , может быть «спасена» из выбранных клеток путем инфицирования их вспомогательным фагом VCS-M13. Полученные в результате фаговые частицы содержат одноцепочечные фагмиды и используются для инфицирования клеток XL-1 Blue. [2] Двухцепочечные фагмиды впоследствии собираются из этих клеток XL-1 Blue, по сути, обращая процесс, используемый для получения исходного библиотечного фага. Наконец, последовательности ДНК определяются с помощью дидезоксисеквенирования . [2]
Tet-R -репрессор, полученный из Escherichia coli, может использоваться в соответствии с обычным репортерным геном и может контролироваться тетрациклином или доксициклином (ингибиторы Tet-R). Таким образом, экспрессия Tet-R контролируется стандартной двухгибридной системой, но Tet-R в свою очередь контролирует (подавляет) экспрессию ранее упомянутого репортера, такого как HIS3 , через свой Tet-R-промотор. Тетрациклин или его производные затем могут использоваться для регулирования чувствительности системы, использующей Tet-R. [1]
Чувствительность также может контролироваться путем изменения зависимости клеток от их репортерных генов. Например, на это можно повлиять, изменив концентрацию гистидина в питательной среде для клеток, зависимых от his3 , и концентрацию стрептомицина для клеток, зависимых от aadA . [2] [3] Зависимость от гена селекции также может контролироваться путем применения ингибитора гена селекции в подходящей концентрации. Например, 3-амино-1,2,4-триазол (3-AT) является конкурентным ингибитором продукта гена HIS3 и может использоваться для титрования минимального уровня экспрессии HIS3 , необходимого для роста на среде с дефицитом гистидина. [2]
Чувствительность также можно регулировать, изменяя количество последовательностей операторов в репортерной ДНК.
Третий, не слитый белок может быть ко-экспрессирован с двумя слитыми белками. В зависимости от исследования, третий белок может модифицировать один из слитых белков или опосредовать или мешать их взаимодействию. [1]
Совместная экспрессия третьего белка может быть необходима для модификации или активации одного или обоих белков слияния. Например, S. cerevisiae не обладает эндогенной тирозинкиназой. Если исследование включает белок, требующий фосфорилирования тирозина, киназа должна быть предоставлена в форме гена тирозинкиназы. [1]
Неслитый белок может опосредовать взаимодействие, связывая оба слитых белка одновременно, как в случае лиганд-зависимой димеризации рецептора. [1]
Для белка с взаимодействующим партнером его функциональная гомология с другими белками может быть оценена путем поставки третьего белка в неслитой форме, который затем может или не может конкурировать с слитым белком за своего связывающего партнера. Связывание между третьим белком и другим слитым белком прервет формирование комплекса активации экспрессии репортера и, таким образом, снизит экспрессию репортера, что приведет к отличительному изменению фенотипа. [1]
Одним из ограничений классических дрожжевых двухгибридных скринингов является то, что они ограничены растворимыми белками. Поэтому их невозможно использовать для изучения белок-белковых взаимодействий между нерастворимыми интегральными мембранными белками . Система сплит-убиквитина обеспечивает метод преодоления этого ограничения. [11] В системе сплит-убиквитина два изучаемых интегральных мембранных белка сливаются с двумя различными фрагментами убиквитина : С-концевым фрагментом убиквитина («Cub», остатки 35–76) и N-концевым фрагментом убиквитина («Nub», остатки 1–34). Эти слитые белки называются приманкой и добычей соответственно. Помимо слияния с интегральным мембранным белком, фрагмент Cub также сливается с фактором транскрипции (TF), который может быть отщеплен специфичными для убиквитина протеазами . При взаимодействии приманки и добычи Nub и Cub-фрагменты собираются, восстанавливая расщепленный убиквитин. Восстановленная молекула расщепленного убиквитина распознается специфичными для убиквитина протеазами, которые расщепляют фактор транскрипции, позволяя ему индуцировать транскрипцию репортерных генов . [12]
Золгхадр и его коллеги представили флуоресцентную двухгибридную систему, которая использует два гибридных белка, которые слиты с разными флуоресцентными белками, а также с LacI, lac-репрессором . Структура белков слияния выглядит следующим образом: FP2-LacI-приманка и FP1-добыча, где белки приманки и добычи взаимодействуют и приближают флуоресцентные белки (FP1 = GFP , FP2 = mCherry ) в непосредственной близости к сайту связывания белка LacI в геноме клетки-хозяина. [13] Систему также можно использовать для скрининга ингибиторов белок-белковых взаимодействий. [14]
В то время как исходная система Y2H использовала реконструированный фактор транскрипции, другие системы создают ферментативные активности для обнаружения PPI. Например, KInase Substrate Sensor («KISS») — это двугибридный подход млекопитающих, разработанный для картирования внутриклеточных PPI. Здесь белок-приманка сливается с частью TYK2, содержащей киназу , а добыча соединяется с фрагментом рецептора цитокина gp130 . Когда приманка и добыча взаимодействуют, TYK2 фосфорилирует сайты стыковки STAT3 на химере добычи, что в конечном итоге приводит к активации репортерного гена . [15]
Одногибридная вариация этой техники предназначена для исследования взаимодействий белок-ДНК и использует один слитый белок, в котором AD напрямую связан с доменом связывания. Однако домен связывания в этом случае не обязательно имеет фиксированную последовательность, как в двухгибридном анализе белок-белок, а может быть образован библиотекой. Эта библиотека может быть выбрана в соответствии с желаемой целевой последовательностью, которая вставлена в область промотора конструкции гена-репортера. В системе положительного отбора таким образом выбирается домен связывания, который успешно связывает UAS и позволяет транскрипцию. [1]
Обратите внимание, что выбор доменов связывания ДНК не обязательно выполняется с использованием одногибридной системы, но может также выполняться с использованием двухгибридной системы, в которой домен связывания варьируется, а белки приманки и добычи остаются постоянными. [2] [3]

Взаимодействия РНК-белок были исследованы с помощью трехгибридной вариации двухгибридной техники. В этом случае гибридная молекула РНК служит для соединения двух доменов слияния белков, которые не предназначены для взаимодействия друг с другом, а скорее с промежуточной молекулой РНК (через их домены связывания РНК). [1] Методы, включающие негибридные белки, которые выполняют схожую функцию, как описано в разделе «негибридные белки» выше, также могут называться трехгибридными методами.
Одновременное использование одно- и двухгибридных методов (то есть одновременного взаимодействия белок-белок и белок-ДНК) известно как одно-двухгибридный подход и, как ожидается, повысит строгость скрининга. [1]
Хотя теоретически любая живая клетка может быть использована в качестве фона для двухгибридного анализа, существуют практические соображения, которые диктуют, что именно следует выбрать. Выбранная линия клеток должна быть относительно дешевой и простой в культивировании и достаточно прочной, чтобы выдерживать применение исследовательских методов и реагентов. [1] Последнее особенно важно для проведения высокопроизводительных исследований . Поэтому дрожжи S. cerevisiae были основным организмом-хозяином для двухгибридных исследований. Однако это не всегда идеальная система для изучения взаимодействующих белков из других организмов. [16] Дрожжевые клетки часто не имеют одинаковых посттрансляционных модификаций, имеют разное использование кодонов или не имеют определенных белков, которые важны для правильной экспрессии белков. Чтобы справиться с этими проблемами, было разработано несколько новых двухгибридных систем. В зависимости от используемой системы для выращивания клеток и обеспечения отбора для взаимодействия используются агаровые пластины или определенная среда роста. Наиболее распространенным используемым методом является метод агарового посева, при котором клетки высеваются на селективную среду, чтобы увидеть, происходит ли взаимодействие. Клетки, не имеющие взаимодействующих белков, не должны выживать на этой селективной среде. [7] [17]
Дрожжи S. cerevisiae были модельным организмом, использованным при создании двухгибридной техники. Она широко известна как система Y2H. Она обладает несколькими характеристиками, которые делают ее надежным организмом для взаимодействия, включая способность образовывать третичные белковые структуры, нейтральный внутренний pH, повышенную способность образовывать дисульфидные связи и восстановленный глутатион среди других факторов цитозольного буфера для поддержания гостеприимной внутренней среды. [1] Моделью дрожжей можно манипулировать с помощью немолекулярных методов, и известна ее полная последовательность генома. [1] Дрожжевые системы устойчивы к различным условиям культивирования и агрессивным химикатам, которые нельзя применять к культурам тканей млекопитающих. [1]
Ряд штаммов дрожжей были созданы специально для скрининга Y2H, например, Y187 [18] и AH109 , [19] оба производятся Clontech . Также использовались штаммы дрожжей R2HMet и BK100. [20]
C. albicans — это дрожжи с особой особенностью: они транслируют кодон CUG в серин, а не в лейцин. Из-за этого различного использования кодонов сложно использовать модельную систему S. cerevisiae в качестве Y2H для проверки белок-белковых взаимодействий с использованием генов C. albicans . Чтобы обеспечить более нативную среду,была разработана двугибридная (C2H) система C. albicans . С помощью этой системы белок-белковые взаимодействия можно изучать в самом C. albicans . [21] [22] Недавним дополнением стало создание высокопроизводительной системы. [23] [24] [25]
Бактериальные двухгибридные методы (B2H или BTH) обычно применяются в E. coli и имеют некоторые преимущества по сравнению с системами на основе дрожжей. Например, более высокая эффективность трансформации и более высокая скорость роста позволяют E. coli использовать более крупные библиотеки (более 10 8 ). [2] Отсутствие необходимости включения сигнала ядерной локализации в последовательность белка и возможность изучать белки, которые были бы токсичны для дрожжей, также могут быть основными факторами, которые следует учитывать при выборе экспериментального фонового организма. [2]
Метилирующая активность некоторых белков метилтрансферазы ДНК E. coli может мешать некоторым выборам связывающих ДНК белков. Если это ожидается, то использование штамма E. coli , дефектного для определенной метилтрансферазы, может быть очевидным решением. [2] B2H может быть не идеальным при изучении эукариотических белок-белковых взаимодействий (например, человеческих белков), поскольку белки могут не сворачиваться, как в эукариотических клетках, или могут не иметь другой обработки.
В последние годы была разработана система млекопитающих с двумя гибридами (M2H) для изучения белок-белковых взаимодействий млекопитающих в клеточной среде, которая точно имитирует нативную белковую среду. [26] В этой системе используются транзиторно трансфицированные клетки млекопитающих для поиска белок-белковых взаимодействий. [27] [28] Использование линии клеток млекопитающих для изучения белок-белковых взаимодействий млекопитающих дает преимущество работы в более нативном контексте. [5] Посттрансляционные модификации, фосфорилирование, ацилирование и гликозилирование аналогичны. Внутриклеточная локализация белков также более правильная по сравнению с использованием дрожжевой двухгибридной системы. [29] [30] С помощью двугибридной системы млекопитающих также можно изучать входные сигналы. [31] Еще одним большим преимуществом является то, что результаты могут быть получены в течение 48 часов после трансфекции. [5]
В 2005 году была разработана двухгибридная система в растениях. Используя протопласты A. thaliana, можно изучать белок-белковые взаимодействия в растениях. Таким образом, взаимодействия можно изучать в их нативном контексте. В этой системе GAL4 AD и BD находятся под контролем сильного промотора 35S. Взаимодействие измеряется с помощью репортера GUS. Для обеспечения высокопроизводительного скрининга векторы были сделаны совместимыми с шлюзом. Система известна как система двухгибридных протопластов (P2H). [32]
Морской заяц A californica является модельным организмом в нейробиологии для изучения, среди прочего, молекулярных механизмов долговременной памяти. Для изучения взаимодействий, важных в неврологии, в более естественной среде была разработана двухгибридная система в нейронах A californica . В этой системе используются A GAL4 AD и BD. [33] [34]
Система двугибридного насекомого (I2H) была разработана в клеточной линии шелкопряда из личинки или гусеницы одомашненного шелкопряда Bombyx mori (клетки BmN4). Эта система использует GAL4 BD и домен активации мышиного NF-κB P65. Оба находятся под контролем промотора OpIE2. [35]
Изменяя определенные аминокислоты путем мутации соответствующих пар оснований ДНК в используемых плазмидах, можно определить важность этих аминокислотных остатков в поддержании взаимодействия. [1]
После использования метода на основе бактериальных клеток для отбора ДНК-связывающих белков необходимо проверить специфичность этих доменов, поскольку существует предел тому, в какой степени геном бактериальной клетки может действовать как поглотитель для доменов со сродством к другим последовательностям (или, по сути, общим сродством к ДНК). [2]
Взаимодействия белок-белковой сигнализации представляют собой подходящие терапевтические цели из-за их специфичности и всепроникаемости. Подход случайного открытия лекарств использует банки соединений, которые включают случайные химические структуры, и требует высокопроизводительного метода для проверки этих структур в их предполагаемой цели. [1] [17]
Клетка, выбранная для исследования, может быть специально сконструирована так, чтобы отражать молекулярный аспект, который исследователь намерен изучить, а затем использоваться для идентификации новых терапевтических средств для человека или животных или средств против вредителей. [1] [17]
Путем определения партнеров по взаимодействию неизвестных белков можно сделать вывод о возможных функциях этих новых белков. [1] Это можно сделать, используя один известный белок против библиотеки неизвестных белков или наоборот, выбрав из библиотеки известных белков один белок с неизвестной функцией. [1]
Для отбора белков цинковых пальцев (ZFP) для белковой инженерии с успехом использовались методы, адаптированные из техники двухгибридного скрининга. [2] [3] ZFP сам по себе является ДНК-связывающим белком, используемым для построения индивидуальных ДНК-связывающих доменов, которые связываются с желаемой последовательностью ДНК. [36]
Используя ген отбора с желаемой целевой последовательностью, включенной в UAS, и рандомизируя соответствующие аминокислотные последовательности для получения библиотеки ZFP, можно выбрать клетки, которые содержат взаимодействие ДНК-ZFP с требуемыми характеристиками. Каждый ZFP обычно распознает только 3–4 пары оснований, поэтому для предотвращения распознавания участков за пределами UAS рандомизированный ZFP конструируется в «каркас», состоящий из еще двух ZFP постоянной последовательности. Таким образом, UAS разработан для включения целевой последовательности постоянного каркаса в дополнение к последовательности, для которой выбран ZFP. [2] [3]
С помощью этой системы можно также исследовать ряд других доменов связывания ДНК. [2]
Причина столь высокого уровня ошибок кроется в характеристиках экрана:
Каждый из этих пунктов в отдельности может привести к ложным результатам. Из-за совокупного воздействия всех источников ошибок дрожжевые двугибридные следует интерпретировать с осторожностью. Вероятность генерации ложноположительных результатов означает, что все взаимодействия должны быть подтверждены высоконадежным анализом, например, коиммунопреципитацией эндогенных белков, что сложно для крупномасштабных данных белок-белкового взаимодействия. В качестве альтернативы данные Y2H можно проверить с помощью нескольких вариантов Y2H [38] или методов биоинформатики. Последние проверяют, экспрессируются ли взаимодействующие белки одновременно, имеют ли некоторые общие черты (например, аннотации онтологии генов или определенные топологии сетей ), имеют ли гомологичные взаимодействия в других видах. [39]