В органической химии окисление Сверна , названное в честь Дэниела Сверна , представляет собой химическую реакцию , в которой первичный или вторичный спирт ( −OH ) окисляется до альдегида ( −CH=O ) или кетона ( >C=O ) с использованием оксалилхлорида , диметилсульфоксида (ДМСО) и органического основания , такого как триэтиламин . [1] [2] [3] Это одна из многих реакций окисления, обычно называемых окислениями «активированного ДМСО». Реакция известна своим мягким характером и широкой толерантностью к функциональным группам . [4] [5] [6] [7]

Побочными продуктами являются диметилсульфид ((CH 3 ) 2 S), оксид углерода (CO), диоксид углерода (CO 2 ) и — когда в качестве основания используется триэтиламин — хлорид триэтиламмония (Et 3 NHCl). Из летучих побочных продуктов диметилсульфид имеет сильный, всепроникающий запах, а оксид углерода является остротоксичным, поэтому реакцию и обработку необходимо проводить в вытяжном шкафу. Диметилсульфид — летучая жидкость (Ткип. 37 °C) с неприятным запахом даже при низких концентрациях. [8] [9] [10]
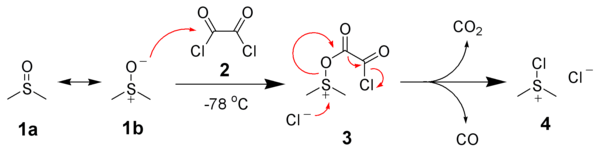
Первым этапом окисления Сверна является низкотемпературная реакция ДМСО, 1a , формально как резонансного вкладчика 1b , с оксалилхлоридом, 2. Первый промежуточный продукт, 3 , быстро разлагается с выделением диоксида углерода и монооксида углерода и образованием хлор(диметил)сульфонийхлорида, 4 .
После добавления спирта 5 хлор(диметил)сульфонийхлорид 4 реагирует со спиртом, давая ключевой промежуточный ион алкоксисульфония 6. Добавление по крайней мере 2 эквивалентов основания — обычно триэтиламина — депротонирует ион алкоксисульфония, давая илид серы 7. В переходном состоянии пятичленного кольца илид серы 7 разлагается, давая диметилсульфид и желаемое карбонильное соединение 8 .

При использовании оксалилхлорида в качестве дегидратирующего агента реакция должна поддерживаться при температуре ниже -60 °C, чтобы избежать побочных реакций. При использовании цианурхлорида [11] или трифторуксусного ангидрида [12] вместо оксалилхлорида реакция может быть нагрета до -30 °C без побочных реакций. Другие методы активации ДМСО для инициирования образования ключевого промежуточного продукта 6 включают использование карбодиимидов ( окисление Пфицнера-Моффатта ), комплекса триоксида серы с пиридином ( окисление Париха-Дёринга ) или уксусного ангидрида ( окисление Олбрайта-Голдмана ). Промежуточный продукт 4 также может быть получен из диметилсульфида и N -хлорсукцинимида ( окисление Кори-Кима ).
В некоторых случаях использование триэтиламина в качестве основания может привести к эпимеризации на альфа-углероде к новообразованному карбонилу. Использование более объемного основания, такого как диизопропилэтиламин , может смягчить эту побочную реакцию.
Диметилсульфид, побочный продукт окисления Сверна, является одним из самых известных неприятных запахов, известных в органической химии. Люди могут обнаружить это соединение в концентрациях от 0,02 до 0,1 частей на миллион. [13] Простым средством для решения этой проблемы является промывание использованной стеклянной посуды отбеливателем или раствором оксона , который окислит диметилсульфид обратно в диметилсульфоксид или диметилсульфон , оба из которых не имеют запаха и нетоксичны. [14]
Условия реакции позволяют окислять кислоточувствительные соединения, которые могут разлагаться в условиях кислотного окисления, таких как окисление Джонса . Например, в синтезе сесквитерпенового изовеллерала Томпсона и Хиткока [15] на последнем этапе используется протокол Сверна, что позволяет избежать перегруппировки кислоточувствительного циклопропанметанольного фрагмента.

{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ){{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ){{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ){{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ); Собрание томов , т. 10, стр. 320.{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка )