Ишемия почек [1] — это заболевание с высокой заболеваемостью и смертностью. [2] Кровеносные сосуды сжимаются и подвергаются апоптозу , что приводит к плохому кровотоку в почках. Больше осложнений происходит, когда нарушение функций почек приводит к токсичности в различных частях тела, что может вызвать септический шок , гиповолемию и необходимость хирургического вмешательства. [3] Причины ишемии почек не совсем известны, но были выяснены некоторые патофизиологии, связанные с этим заболеванием. Возможные причины ишемии почек включают активацию IL-17C и гипоксию из-за хирургического вмешательства или трансплантации. Некоторые признаки и симптомы включают повреждение микрососудистого эндотелия, апоптоз клеток почек из-за перегрузки эндоплазматического ретикулума, дисфункции митохондрий , аутофагию , воспаление почек и неадаптивное восстановление. [ необходима цитата ]
Ишемию почек можно диагностировать, проверив уровни нескольких биомаркеров, таких как кластерин и цистатин С. Хотя продолжительность ишемии использовалась в качестве биомаркера , было обнаружено, что она имеет существенные недостатки в прогнозировании результатов почечной функции. Более новые методы лечения находятся в клинических испытаниях, таких как Bendavia, направленный на митохондриальную дисфункцию и использующий терапию мезенхимальными стволовыми клетками . Несколько агонистов и антагонистов рецепторов показали многообещающие результаты в исследованиях на животных; однако они еще не были доказаны клинически. [ необходима цитата ]
Мало что известно о причинах ишемического повреждения почек; однако, как утверждается, несколько физических повреждений активируются во время травмы. Физический стресс, такой как инфаркт, операция и трансплантация, может вызвать ишемию почек. Пищевые привычки и генетика также могут вызвать ишемическое повреждение. Такие заболевания, как сепсис, также могут вызвать ишемию почек. [4]
Инфаркт определяется как блокировка кровотока в тканях или органах, которая может вызвать некроз или гибель группы клеток в ткани. [5] В исследованиях на мышах зажим почки может привести к ишемии почки. [6]
Почечная хирургия и аортокоронарное шунтирование могут вызвать почечную ишемию и реперфузионное повреждение. Это может привести к острому повреждению почек . Более того, почечная ишемия может вызвать задержку функции трансплантата после пересадки почки и может вызвать отторжение трансплантата. [7]
В исследованиях на мышах диета с высоким содержанием жиров может вызывать более выраженное повреждение почек с почечной ишемией-реперфузией по сравнению с мышами с нормальной диетой. [8] Это происходит потому, что в модели диеты с высоким содержанием жиров накопление фосфолипидов приводит к увеличению лизосом в проксимальных канальцевых клетках. [8] Это накопление фосфолипидов приводит к увеличению агрегации убиквитина в клетках почек. Когда это происходит, аутофагия становится чрезмерной и приводит к нарушению работы митохондрий и воспалению ткани. [8]
Распространенной причиной ишемической болезни почек является атеросклероз . [9] Атеросклероз — это особый тип артериосклероза. Артериосклероз определяется как утолщение или жесткость или и то, и другое кровеносных сосудов ; более конкретно, атеросклероз относится к накоплению холестерина и жиров в стенках артерий. [10] Поскольку кровеносные сосуды переносят кислород и питательные вещества по всему телу, атеросклероз ограничивает кровоток и, следовательно, препятствует поступлению необходимых питательных веществ в почки. [10] Это составляет 60–97% поражений почечных артерий, что может привести к окклюзии почечной артерии и ишемической атрофии почек. [9]
Несколько генетических путей, которые приводят к апоптозу клеток почек, были вовлечены в мышиные модели и анализы in vitro. Это проапоптотические гены, которые можно разделить на две категории: внешние и внутренние пути. Внешние пути напрямую индуцируются при ишемическом повреждении почек, в то время как внутренние пути зависят от митохондриальных сигнальных путей. [11] Более того, несколько генов были вовлечены в качестве факторов риска в развитии ишемического повреждения. [12]
Активация прокаспазы 8 инициирует апоптоз посредством сигнализации от рецепторов смерти на поверхности клеток, таких как белки Fas и их лиганды FADD и DAXX . [11] Эта серия каскада сигнализации обычно регулирует запрограммированную гибель клеток или апоптоз . Повышение уровня Fas и белка FADD наблюдалось в мышиных моделях после 24-часового периода ишемического повреждения. [11] Это также показано в клеточных анализах, в которых клетки канальцев отслеживаются после ишемически-подобного повреждения. Это показывает, что путь Fas может играть роль в патогенезе апоптоза клеток канальцев в течение раннего периода ишемии-реперфузии. Роль DAXX до сих пор неясна; однако, DAXX опосредует как Fas-зависимый, так и TGF-бета -индуцированный апоптоз, а почечная индукция TGF-бета хорошо документирована в исследованиях почечной ишемии. [11]
Активация прокаспазы 9 зависит от митохондриальных сигнальных путей, которые регулируются семейством белков Bcl-2 . Активация белков Bcl-2, таких как Bax и Bak, запускает каскад сигналов, который приводит к высвобождению цитохрома c в цитозоль. Затем это активирует прокаспазу 9 и приводит к апоптозу клеток. [11]
Было показано, что полиморфизмы генов увеличивают или уменьшают риск ишемического повреждения почек. Такие гены, как аполипопротеин E (APO E) , который контролирует метаболизм холестерина, НАДФН-оксидаза , которая регулирует окислительный стресс, ангиотензинпревращающий фермент ( АПФ ) для вазомоторной регуляции, HSP72 , который помогает переносить ишемическое повреждение, интерлейкин -цитокины, которые являются модуляторами воспаления, и VEGF , который регулирует ангиогенез или образование кровеносных сосудов, как было показано, оказывают значительное влияние на острое повреждение почек. [12]
Аполипопротеин E — это белки, которые метаболизируют жиры в организме. В исследованиях пациентов, перенесших аортокоронарное шунтирование , было обнаружено, что носители аллеля APO-E e4 имеют сниженный риск острого повреждения почек по сравнению с неносителями аллеля. [12]
НАДФН-оксидаза регулирует окислительный стресс путем конъюгации с активными формами кислорода в клетках. Полиморфизмы в НАДФН-оксидазе p22phox и с аллелем T, как было показано, имеют более высокий риск диализа и смертности. [12]
Ангиотензин-превращающий фермент регулирует вазомоторное движение, контролируя давление крови, проходящей через почки. Подобно полиморфизму APO-E, пациенты с D-аллелем ACE также имеют повышенный риск острого повреждения почек после аортокоронарного шунтирования. [12]
В исследованиях младенцев было показано, что ген HSP72 с аллелем G повышает риск острого повреждения почек. [12]
Исследователи обнаружили, что IL-17C активируется при повреждении почек. В исследованиях мышей, вызванных гипоксией, было очевидно повышение синтеза IL-17C при потере кислорода в почке. Более того, нокаутные варианты IL-17C уменьшили воспаление, вызванное активацией IL-17C. Использование антител и siRNA против IL-17C также дало те же результаты. [13] Кроме того, исследования IL-60174GG показали, что носители этого полиморфизма имеют более высокий уровень креатинина в крови; однако, носители G-аллеля IL-10 имеют сниженный риск смерти после отказа органов. [12]
В отличие от полиморфизма HSP72, исследования младенцев показывают, что VEGF с гомозиготным аллелем А приводит к снижению риска острого повреждения почек. [12]

Ниже перечислены несколько патофизиологических состояний, которые изменяются, когда почка подвергается ишемическим повреждениям. Сюда входят изменения в сосудистой системе , стресс эндоплазматического ретикулума , дисфункция митохондрий , аутофагия клеток, воспаление и неправильное или неадаптивное восстановление. [ необходима цитата ]
Нормальные функции почек требуют большого количества кислорода, поэтому подача кислорода в почки хорошо регулируется. Производство аденозинтрифосфата и оксида азота требует высокой концентрации кислорода. Эти соединения, а также некоторые активные формы кислорода, необходимы для правильного функционирования почек. При травме нарушается клеточное дыхание. Это приводит к дисбалансу поставки кислорода и продуктов клеточного дыхания . Когда это происходит, почка подвергается окислительному стрессу , а повреждение микрососудистого эндотелия способствует привлечению лейкоцитов и тромбоцитов . Это приводит к изменениям перфузии и доставки кислорода. [14]
Неправильно свернутые и развернутые белки накапливаются в эндоплазматическом ретикулуме. Это запускает реакцию развернутого белка (UPR). Реакция развернутого белка является адаптивным механизмом для восстановления гомеостаза клеток и тканей. Если стресс слишком сильный, активируется неадаптивный ответ и индуцируется путь гомологичного белка C/EBP (CHOP). Это приводит к апоптозу. [14]
При острой ишемии почек проксимальные канальцы уязвимы для митохондриальной дисфункции, поскольку они зависят от аэробного метаболизма и находятся в более окисленном состоянии по сравнению с дистальными канальцами . [14] Когда происходит митохондриальная дисфункция, нарушается клеточное дыхание. Это приводит к тому, что митохондрии высвобождают проапоптотические белки, такие как цитохром c , и в конечном итоге приводят к гибели клеток почек. [ необходима цитата ]
Во время ишемического стресса активируется перекрестное взаимодействие между митохондриями и UPR . Это приводит к аутофагии, при которой белки, органеллы и цитоплазматические компоненты перерабатываются и разрушаются лизосомами. Процесс аутофагии помогает удалять ненужные компоненты клеток для поддержания более важных функций. В этом случае аутофагия индуцируется в почках в ответ на гипоксию для защиты от дальнейшего повреждения почек. [14]
Воспалительный процесс в почках включает события, которые приводят к повреждению или гибели почечных клеток. [15] Когда почки подвергаются воспалительным реакциям, они вырабатывают медиаторы, такие как брадикинин , гистамин и провоспалительные цитокины, такие как интерлейкин-1 и фактор некроза опухоли-a . На моделях мышей были проведены исследования, в которых наблюдалось удаление этих медиаторов из плазмы, и это показало пользу для мышей. [15]
При тяжелой травме адаптивные реакции, которые активируются для восстановления нормального гомеостаза клеток и тканей , становятся неадаптивными. Это приводит к нарушению работы клеток и тканей. Это может привести к прогрессированию хронической болезни почек. [14]

Почечные признаки могут быть клинически предположительными для почечной ишемии. Поскольку почечная недостаточность может быть связана с гипертонией, обе эти ситуации наблюдались. [16] В целом, размеры почек различаются у пациентов с острой почечной ишемией. Гипертония, острая почечная недостаточность, прогрессирующая азотемия и острый отек легких также являются признаками развивающегося ишемического повреждения у пациентов с гипертонией. [ необходима цитата ]
У здоровых пациентов длина двух почек отличается менее чем на 1,5 см; однако у пациентов с гипертонией наблюдается тенденция к асимметричному размеру почек. Это убедительно свидетельствует об ишемической болезни почек. [16]
Реноваскулярная гипертензия или стеноз почечной артерии характеризуется повышением давления крови через артерии к почкам. [17] Это происходит из-за аномального сужения артерий. [17]
У пациентов с гипертонией иногда необходимо лечение заболевания с использованием ингибиторов ангиотензинпревращающего фермента (ИАПФ). [16] Скорость клубочковой фильтрации (СКФ) у пациентов регулируется вазоконстрикцией эфферентной артериолы. [16] Когда пациент принимает ИАПФ, этот вазоконстрикторный эффект эфферентной артериолы блокируется. Это затем приводит к снижению СКФ и приводит к острой почечной недостаточности. Исследования показали, что у 6-38% пациентов с сосудистым заболеванием почек или гипертонией разовьется острая почечная ишемия через острую почечную недостаточность. [16]
Азотемия характеризуется повышением креатинина и азота мочевины крови (АМК) в плазме. У пациентов с реноваскулярной гипертензией часто наблюдается ухудшение функции почек. [16]
Аналогично вышесказанному, у пациентов, получающих антигипертензивные препараты для лечения реноваскулярной, рефрактерной или тяжелой гипертензии, наблюдается прогрессирующая азотемия. [16] Острая ишемия почек может возникнуть в результате приема ИАПФ из-за изменения внутрипочечной гемодинамики. [16]
Острый отек легких характеризуется скоплением жидкости в воздушных мешочках легких. Это затрудняет дыхание пациентов. [18] Пациенты с плохо контролируемой гипертонией и почечной недостаточностью обычно также имеют рецидивирующий острый отек легких. [16] Хотя у пациентов могут быть и другие факторы риска отека легких, объемно-зависимая реноваскулярная гипертензия, по-видимому, является доминирующим фактором. [16]
Скрининг биомаркеров — один из способов диагностировать у пациента, нормально ли функционируют его почки.

Дуплексная допплерография (DDS) — это визуальный тест для оценки кровотока в почке или почечной системе. Ультразвуковое исследование в В-режиме сочетается с допплерографией для определения местоположения и оценки почечной артерии и скорости кровотока в ней. Этот тест полезен даже при наличии азотемии , а для пациентов с гипертонией нет необходимости прекращать прием ИАПФ. Оценивая скорость кровотока, врачи могут определить, получает ли почка достаточно крови и питательных веществ для нормального функционирования. [16]
Подобно DDS, магнитно-резонансная ангиография (МРА) также визуализирует кровеносные сосуды. МРА использует магнитный резонанс и, в отличие от традиционной ангиограммы, не требует введения катетера. [24] Этот тест можно использовать для оценки стеноза и окклюзии в почке. Этот тест также можно использовать для определения аневризм в мозге. Более клиническое применение МРА заключается в проверке кровеносных сосудов в различных частях тела, таких как грудная клетка, нижние конечности и сердце. [25]
Активность ренина плазмы также известна как анализ ренина. Этот анализ измеряет активность ренина , также известного как ангиотензиногеназа , который играет роль в регуляции артериального давления и диуреза. [26] Это считается неинвазивным тестом, и пациентам, принимающим ИАПФ, следует его пройти. Это связано с тем, что он полезен для выявления реноваскулярной гипертензии, одного из симптомов ишемии почек, с чувствительностью до 90%. [16] Однако почечная недостаточность может снизить точность этого теста. [16]
Ренография использует радиоизотопы для диагностики реноваскулярного заболевания. Этот тест сравнивает нормальную функцию почки со стенозированной почкой, измеряя количество радионуклеотидов, поступающих в почку и выводимых ею. [16] В ренографии используются два радионуклида : Tc99m- MAG3 (меркаптоацетилтриглицин) и TC99m-DTPA (диэтилентриаминпентаацетат). [27] В этом тесте радионуклеотиды вводятся внутривенно в систему. Затем соединение продвигается по почечной системе и отслеживается гамма-камерой . [28] Затем камера делает снимки через определенные интервалы, и производится измерение радиоактивности. Выполняя это сканирование, врачи могут различать ишемию почки и внутреннее почечное заболевание, проверяя количество времени, необходимое для пика и спада радиоактивности. Реноваскулярная гипертензия очень чувствительна к этой визуализации, со специфичностью 95% и чувствительностью 96%. [16]
Наши знания о почечной ишемии получены из исследований на животных. На основании этих исследований, трансплантация почек и ретроспективные серии частичной нефрэктомии указывают на риск нарушения функции почек, чем дольше сохраняется ишемическое повреждение. [29] Однако, на основании исторических исследований, было обнаружено, что использование продолжительности ишемии в качестве дихотомического маркера имеет существенные недостатки в прогнозировании результатов функции почек. Продолжительность ишемии почек не влияет на функцию почек ни в краткосрочной, ни в долгосрочной перспективе. [29]
Пациентам, которым пересаживают почку или делают аортокоронарное шунтирование , проводится ишемическая прекондиционирование . При ишемической прекондиционировании почка подвергается допустимому уровню ишемии. Это готовит почку к переносимости последующих повреждений, вызванных ишемией. Это снижает клеточный лизис и апоптоз почечных клеток и улучшает общую почечную функцию почек после ишемии по сравнению с отсутствием прекондиционирования. [4]
.jpg/440px-Furosemide_(cropped).jpg)
Фуросемид является распространенным диуретиком и используется для профилактики или устранения острого повреждения почек. [30] Диуретик - это вещество, которое способствует выведению воды из организма. [31] Когда почки подвергаются ишемии, это приводит к реперфузии или восстановлению кровоснабжения органов. Таким образом, использование диуретиков помогло избавиться от избытка воды в почках после реперфузии. Прием фуросемида в виде таблетки, в виде жидкого раствора или путем инъекции используется в качестве профилактической меры или для лечения ишемии почек, и показал, что он снижает тяжесть почечной недостаточности, уменьшает апоптоз, вызванный ишемией, и ускоряет восстановление почечной функции. Это также приводит к снижению необходимости хирургической замены почки у некоторых пациентов. [30] [31] [29]
Фенолдопам используется после операции при лечении острого повреждения почек , если он использовался до повреждения почек. Подобно фуросемиду, его можно принимать внутрь или внутривенно; однако биодоступность , или количество препарата, которое достигает кровообращения, снижается при приеме внутрь. Фенолдопам используется как вазодилататор и может увеличивать приток крови к почкам, а также секрецию ренина. Таким образом, его можно использовать для регулирования кровяного давления в артериях и уменьшения повреждений, вызванных ишемией. [32]
В настоящее время Бендавия проходит клинические исследования, направленные на митохондриальную дисфункцию. Препарат оказывает защитное действие на крысиных моделях ишемии почек, если его вводили до травмы. Бендавия связывается с кардиолипином на внутренней митохондриальной мембране, что подавляет активность пероксидазы цитохрома с. Это защищает дыхание во время ранней реперфузии и ускоряет восстановление АТФ. В животных моделях было обнаружено, что гибель и дисфункция канальцевых клеток были снижены. [14]
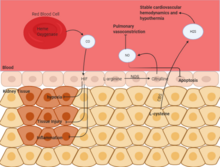
Оксид углерода (CO) помогает стабилизировать HIF , который помогает регулировать аутофагию и гипоксическую реакцию. Благодаря этому стабилизируются воспаление и повреждение тканей. Оксид азота (NO) является побочным продуктом метаболизма аргинина в цитруллин с помощью NO-синтазы . Этот газ присутствует во всех клетках, и было обнаружено, что вдыхание NO является терапевтически активным. Это уменьшает легочную вазоконстрикцию и уменьшает апоптоз во время почечной ишемии. Сероводород (H2S) также является эндогенным продуктом метаболической активности в клетках. Это побочный продукт метаболизма цистеина с помощью цистатионин-b-синтазы . Как и в случае с NO, было обнаружено, что вдыхание H2S является терапевтическим и, как было показано, стабилизирует гипотермию и стабилизирует сердечно-сосудистую гемодинамику, что защищает от ишемического повреждения. [33]
Мезенхимальные стволовые клетки (МСК) — это мультипотентные зрелые стволовые клетки, способные дифференцироваться в различные типы клеток. Это многообещающее направление терапии, поскольку регенеративная медицина продемонстрировала преимущества в восстановлении почек. МСК обладают противовоспалительными свойствами и применяются у животных и людей. Благодаря своим регенеративным способностям почки могут извлечь из этого пользу путем трансдифференциации в почечные клетки. Более того, они могут давать противовоспалительные и иммуномодулирующие свойства и, следовательно, защищать почку, а также восстанавливать ее от ишемического повреждения. [34]
Ишемическое повреждение почек может привести к фиброзу , необратимой почечной дисфункции и необходимости заместительной почечной терапии . Острая ишемия почек связана с высокой смертностью. Хроническая ишемическая болезнь почек (ХИБП) обычно включает потерю почечной паренхимы или снижение СКФ, вызванное постепенной сосудистой обструкцией. Клинически термин «ишемическая болезнь почек» чаще всего описывает ХИБП, которая обусловливает 6–27% терминальной стадии заболевания почек, особенно среди пациентов старше 50 лет [34]