Просвечивающая электронная криомикроскопия ( КриоТЭМ ), обычно известная как крио-ЭМ , является формой криогенной электронной микроскопии , а точнее типом просвечивающей электронной микроскопии (ПЭМ), где образец изучается при криогенных температурах (обычно температурах жидкого азота ). [1] Крио-ЭМ, в частности 3-мерная электронная микроскопия ( 3DEM ), набирает популярность в структурной биологии . [2]
Полезность просвечивающей электронной криомикроскопии заключается в том, что она позволяет наблюдать образцы, которые не были окрашены или зафиксированы каким-либо образом, показывая их в их естественной среде. Это отличается от рентгеновской кристаллографии , которая требует кристаллизации образца, что может быть сложным, и помещения его в нефизиологическую среду, что иногда может приводить к функционально нерелевантным конформационным изменениям.
Достижения в технологии электронных детекторов , в частности DED (Direct Electron Detectors), а также более мощные программные алгоритмы визуализации позволили определять макромолекулярные структуры с разрешением, близким к атомному. [3] Визуализируемые макромолекулы включают вирусы , рибосомы , митохондрии , ионные каналы и ферментные комплексы. Начиная с 2018 года, крио-ЭМ может применяться к структурам размером до гемоглобина (64 кДа ) [4] и с разрешением до 1,8 Å . [5] В 2019 году структуры крио-ЭМ составляли 2,5% структур, депонированных в Банке данных белков [6] , и это число продолжает расти. [7] Применением крио-ЭМ является криоэлектронная томография (крио-ЭТ), где трехмерная реконструкция образца создается из наклонных двухмерных изображений.
Первоначальное обоснование CryoTEM было как средство борьбы с радиационным повреждением биологических образцов. Количество радиации, необходимое для получения изображения образца в электронном микроскопе, достаточно велико, чтобы быть потенциальным источником повреждения образца для деликатных структур. Кроме того, высокий вакуум, необходимый на колонне электронного микроскопа, делает среду для образца довольно жесткой.
Проблема вакуума была частично решена введением негативных пятен , но даже при негативных пятнах биологические образцы склонны к структурному коллапсу при дегидратации образца. Помещение образцов в лед ниже температуры сублимации было возможностью, которая рассматривалась на раннем этапе, но вода имеет тенденцию организовываться в кристаллическую решетку с меньшей плотностью при замерзании, и это может разрушить структуру всего, что в нее вмонтировано.
В начале 1980-х годов несколько групп, изучающих физику твердого тела, пытались получить стекловидный лед разными способами, такими как замораживание под высоким давлением или мгновенное замораживание. В основополагающей статье 1984 года группа под руководством Жака Дюбоше из Европейской лаборатории молекулярной биологии продемонстрировала изображения аденовируса , внедренного в застеклованный слой воды. [8] Эта статья обычно считается началом крио-ЭМ, и эта техника была развита до такой степени, что стала рутинной во многих лабораториях по всему миру.
Энергия электронов, используемых для визуализации (80–300 кВ), достаточно высока, чтобы ковалентные связи могли быть разорваны. Когда образцы визуализации уязвимы к радиационному повреждению, необходимо ограничить электронное воздействие, используемое для получения изображения. Эти низкие воздействия требуют, чтобы изображения тысяч или даже миллионов идентичных замороженных молекул были выбраны, выровнены и усреднены для получения карт высокого разрешения с использованием специализированного программного обеспечения. Значительное улучшение структурных характеристик было достигнуто в 2012 году за счет внедрения прямых электронных детекторов и лучших вычислительных алгоритмов. [1] [2]
В 2015 году Бриджит Каррагер и ее коллеги из Национального ресурса Скриппса по автоматизированной молекулярной микроскопии использовали методы, разработанные ею и Клинтом Поттером, для определения первой крио-ЭМ-структуры с разрешением менее 3 Å, тем самым подняв CryoTEM как инструмент, сопоставимый и потенциально превосходящий традиционные методы рентгеновской кристаллографии. [9] [10] С тех пор были достигнуты более высокие разрешения, включая структуру бактериального фермента β-галактозидазы размером 2,2 Å в 2015 году [11] и структуру глутаматдегидрогеназы размером 1,8 Å в 2016 году [12] Крио-ЭМ также использовалась для определения структуры различных вирусов, включая вирус Зика , [13] и применялась к крупным комплексам, таким как сплайсосома . [14] В 2017 году Нобелевская премия по химии была присуждена совместно Жаку Дюбоше , Иоахиму Франку и Ричарду Хендерсону «за разработку криоэлектронной микроскопии для определения структуры биомолекул в растворе с высоким разрешением». [15]
Биологический материал распределяется по сетке электронного микроскопа и сохраняется в замороженно-гидратированном состоянии путем быстрого замораживания, обычно в жидком этане , близком к температуре жидкого азота . Поддерживая образцы при температуре жидкого азота или ниже, их можно вводить в высокий вакуум колонки электронного микроскопа . Большинство биологических образцов чрезвычайно радиочувствительны , поэтому их необходимо визуализировать с помощью низкодозовых методов (полезно, что низкая температура просвечивающей электронной криомикроскопии обеспечивает дополнительный защитный фактор от радиационного повреждения).
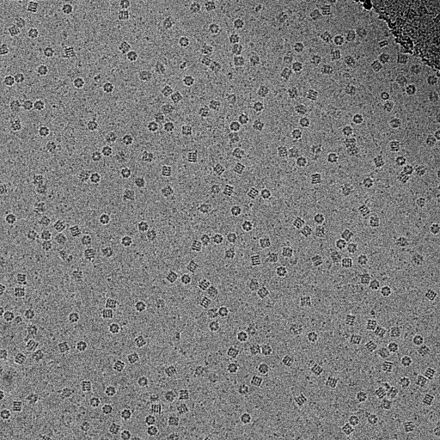
Следовательно, изображения чрезвычайно шумные . Для некоторых биологических систем возможно усреднение изображений для увеличения отношения сигнал/шум и получения информации высокого разрешения об образце с помощью метода, известного как анализ отдельных частиц . Этот подход в целом требует, чтобы усредняемые объекты были идентичны, хотя теперь можно изучать некоторую ограниченную конформационную гетерогенность (например, рибосому ). Трехмерные реконструкции из изображений CryoTEM белковых комплексов и вирусов были решены с субнанометровым или почти атомным разрешением, что позволяет по-новому взглянуть на структуру и биологию этих больших сборок.
Анализ упорядоченных массивов белков, таких как двумерные кристаллы трансмембранных белков или спиральные массивы белков, также позволяет проводить своего рода усреднение, которое может предоставить информацию высокого разрешения об образце. Этот метод называется электронной кристаллографией .
Метод тонкой пленки ограничен тонкими образцами (обычно < 500 нм), поскольку электроны не могут пересекать более толстые образцы без множественных событий рассеяния. Более толстые образцы можно витрифицировать путем погружения в замораживание ( криофиксация ) в этане (до десятков мкм в толщину) или, что более распространено, путем замораживания под высоким давлением (до сотен мкм). Затем их можно разрезать на тонкие срезы (толщиной от 40 до 200 нм) алмазным ножом в криоультрамикротоме при температурах ниже −135 °C (температура расстекловывания). Срезы собираются на сетке электронного микроскопа и визуализируются таким же образом, как и образцы, витрифицированные в тонкой пленке. Этот метод называется просвечивающей электронной криомикроскопией стекловидных срезов (CEMOVIS) или просвечивающей электронной криомикроскопией замороженных-гидратированных срезов.
Помимо возможности визуализации витрифицированных биологических образцов, CryoTEM также может использоваться для визуализации образцов материалов, которые слишком летучи в вакууме, чтобы визуализировать их с помощью стандартной электронной микроскопии при комнатной температуре. Например, витрифицированные секции интерфейсов жидкость-твердое тело могут быть извлечены для анализа с помощью CryoTEM, [16] а сера, которая склонна к сублимации в вакууме электронных микроскопов, может быть стабилизирована и визуализирована в CryoTEM. [17]
Несмотря на то, что в большинстве подходов в электронной микроскопии пытаются получить изображение материала с наилучшим разрешением, это не всегда так в крио-ПЭМ. Помимо всех преимуществ изображений с высоким разрешением, соотношение сигнал/шум остается основным препятствием, которое не позволяет назначить ориентацию каждой частице. Например, в макромолекулярных комплексах есть несколько различных структур, которые проецируются из 3D в 2D во время визуализации, и если они не различаются, результат обработки изображения будет размытым. Вот почему вероятностные подходы становятся более эффективными в этом типе исследований. [18] Существует два популярных подхода, которые в настоящее время широко используются в обработке изображений крио-ЭМ: подход максимального правдоподобия, который был открыт в 1998 году [19] и относительно недавно адаптированный байесовский подход. [20]
Подход оценки максимального правдоподобия пришел в эту область из статистики. Здесь все возможные ориентации частиц суммируются, чтобы получить результирующее распределение вероятностей. Мы можем сравнить это с типичной оценкой наименьших квадратов , где частицы получают точные ориентации на изображение. [21] Таким образом, частицы в образце получают «размытые» ориентации после вычислений, взвешенные соответствующими вероятностями. Весь процесс является итеративным, и с каждой следующей итерацией модель становится лучше. Хорошие условия для создания модели, которая близко представляет реальную структуру, — это когда данные не имеют слишком большого шума, а частицы не имеют какого-либо предпочтительного направления. Главный недостаток подхода максимального правдоподобия заключается в том, что результат зависит от первоначального предположения, и оптимизация модели иногда может застрять на локальном минимуме. [22]
Байесовский подход , который сейчас используется в крио-ПЭМ, является эмпирическим по своей природе. Это означает, что распределение частиц основано на исходном наборе данных. Аналогично, в обычном байесовском методе есть фиксированная априорная вероятность , которая изменяется после наблюдения данных. Основное отличие от оценки максимального правдоподобия заключается в специальном члене реконструкции, который помогает сглаживать полученные карты, а также уменьшать шум во время реконструкции. [21] Сглаживание карт происходит путем предположения, что априорная вероятность является гауссовым распределением, и анализа данных в пространстве Фурье. Поскольку связь между априорными знаниями и набором данных установлена, меньше вероятность ошибок человеческого фактора, что потенциально увеличивает объективность реконструкции изображения. [20]
С появлением новых методов крио-ТЭМ визуализации и реконструкции изображений появляются новые программные решения, которые помогают автоматизировать процесс. После того, как эмпирический байесовский подход был реализован в открытой компьютерной программе RELION (REgularized LIkelihood OptimizatioN) для 3D реконструкции, [23] [24] программа получила широкое распространение в области крио-ТЭМ. Она предлагает ряд исправлений, которые улучшают разрешение реконструированных изображений, позволяет реализовывать универсальные скрипты с использованием языка python и выполняет обычные задачи классификации 2D/3D моделей или создания моделей de novo . [25] [26]
В CryoTEM можно использовать различные методы. [27] Популярные методы включают в себя: