Моносахариды (от греч. monos : одиночный, sacchar : сахар), также называемые простыми сахарами , являются простейшими формами сахара и основными единицами ( мономерами ), из которых построены все углеводы .
Они обычно бесцветные , водорастворимые и кристаллические органические твердые вещества. Вопреки своему названию (сахара), только некоторые моносахариды имеют сладкий вкус . Большинство моносахаридов имеют формулу (CH2O ) x ( хотя не все молекулы с этой формулой являются моносахаридами) .
Примерами моносахаридов являются глюкоза (декстроза), фруктоза (левулоза) и галактоза . Моносахариды являются строительными блоками дисахаридов (таких как сахароза , лактоза и мальтоза ) и полисахаридов (таких как целлюлоза и крахмал ). Столовый сахар, используемый в повседневной речи, сам по себе является дисахаридом сахарозой, включающим по одной молекуле каждого из двух моносахаридов D -глюкозы и D -фруктозы. [1]
Каждый атом углерода , поддерживающий гидроксильную группу, является хиральным , за исключением тех, которые находятся в конце цепи. Это приводит к появлению ряда изомерных форм, все с одинаковой химической формулой. Например, галактоза и глюкоза являются альдогексозами , но имеют разные физические структуры и химические свойства.
Моносахарид глюкоза играет ключевую роль в метаболизме , где химическая энергия извлекается через гликолиз и цикл лимонной кислоты для обеспечения энергией живых организмов. Мальтоза представляет собой дегидратационный конденсат двух молекул глюкозы.
За немногими исключениями (например, дезоксирибоза ) моносахариды имеют следующую химическую формулу : ( CH2O ) x , где условно x ≥ 3. Моносахариды можно классифицировать по числу x содержащихся в них атомов углерода: триоза ( 3 ), тетроза (4), пентоза (5), гексоза (6), гептоза (7) и т. д.
Глюкоза, используемая в качестве источника энергии и для синтеза крахмала, гликогена и целлюлозы, является гексозой . Рибоза и дезоксирибоза (в РНК и ДНК соответственно) являются пентозными сахарами. Примерами гептоз являются кетозы , манногептулоза и седогептулоза . Моносахариды с восемью или более атомами углерода встречаются редко, поскольку они довольно нестабильны. В водных растворах моносахариды существуют в виде колец, если у них больше четырех атомов углерода.
Простые моносахариды имеют линейный и неразветвленный углеродный скелет с одной карбонильной (C=O) функциональной группой и одной гидроксильной (OH) группой на каждом из оставшихся атомов углерода . Таким образом, молекулярную структуру простого моносахарида можно записать как H(CHOH) n (C=O)(CHOH) m H, где n + 1 + m = x ; так что его элементарная формула C x H 2 x O x .
По соглашению атомы углерода нумеруются от 1 до x вдоль остова, начиная с конца, который ближе всего к группе C=O. Моносахариды — это простейшие единицы углеводов и самая простая форма сахара.
Если карбонил находится в положении 1 (то есть n или m равно нулю), молекула начинается с формильной группы H(C=O)− и технически является альдегидом . В этом случае соединение называется альдозой . В противном случае молекула имеет кетонную группу, карбонил −(C=O)− между двумя атомами углерода; тогда это формально кетон и называется кетозой. Кетозы, представляющие биологический интерес, обычно имеют карбонил в положении 2.
Различные классификации, приведенные выше, можно объединить, получив в результате такие названия, как «альдогексоза» и «кетотриоза».
Более общая номенклатура для моносахаридов с открытой цепью объединяет греческий префикс для указания числа атомов углерода (три-, тетр-, пент-, гекс- и т. д.) с суффиксами «-оза» для альдоз и «-улоза» для кетоз. [2] В последнем случае, если карбонил не находится в положении 2, его положение тогда указывается числовым инфиксом. Так, например, H(C=O)(CHOH) 4 H — это пентоза, H(CHOH)(C=O)(CHOH) 3 H — это пентулоза, а H(CHOH) 2 (C=O)(CHOH) 2 H — это пент-3-улоза.
Два моносахарида с эквивалентными молекулярными графами (одинаковая длина цепи и одинаковое положение карбонила) могут по-прежнему быть различными стереоизомерами , молекулы которых отличаются пространственной ориентацией. Это происходит только в том случае, если молекула содержит стереогенный центр , в частности, атом углерода, который является хиральным (связанным с четырьмя различными молекулярными субструктурами). Эти четыре связи могут иметь любую из двух конфигураций в пространстве, отличающихся своей хиральностью . В простом моносахариде с открытой цепью каждый углерод является хиральным, за исключением первого и последнего атомов цепи, и (в кетозах) углерода с кетогруппой.
Например, трикетоза H(CHOH)(C=O)(CHOH)H (глицерон, дигидроксиацетон ) не имеет стереогенного центра и, следовательно, существует в виде одного стереоизомера. Другая триоза, альдоза H(C=O)(CHOH) 2 H ( глицеральдегид ), имеет один хиральный углерод — центральный, номер 2 — который связан с группами −H, −OH, −C(OH)H 2 и −(C=O)H. Поэтому она существует в виде двух стереоизомеров, молекулы которых являются зеркальными отражениями друг друга (как левая и правая перчатки). Моносахариды с четырьмя или более атомами углерода могут содержать несколько хиральных атомов углерода, поэтому они обычно имеют более двух стереоизомеров. Число различных стереоизомеров с одинаковой диаграммой ограничено 2 c , где c — общее число хиральных атомов углерода.
Проекция Фишера — это систематический способ построения скелетной формулы ациклического моносахарида, так что хиральная направленность каждого хирального углерода хорошо определена. Каждый стереоизомер простого моносахарида с открытой цепью может быть идентифицирован по положению (справа или слева) хиральных гидроксилов (гидроксилов, присоединенных к хиральным углеродам) на диаграмме Фишера.
Большинство стереоизомеров сами по себе хиральны (отличаются от своих зеркальных отображений). В проекции Фишера два зеркальных изомера отличаются тем, что у них все хиральные гидроксилы обращены справа налево. Зеркальные изомеры химически идентичны в нехиральных средах, но обычно имеют очень разные биохимические свойства и случаи в природе.
В то время как большинство стереоизомеров можно расположить в парах зеркальных форм, существуют некоторые нехиральные стереоизомеры, которые идентичны своим зеркальным отражениям, несмотря на наличие хиральных центров. Это происходит всякий раз, когда молекулярный граф симметричен, как в 3-кетопентозах H(CHOH) 2 (CO)(CHOH) 2 H, и две половины являются зеркальными отражениями друг друга. В этом случае зеркальное отображение эквивалентно повороту на пол-оборота. По этой причине существует только три различных стереоизомера 3-кетопентозы, хотя молекула имеет два хиральных атома углерода.
Отдельные стереоизомеры, которые не являются зеркальными отражениями друг друга, обычно имеют разные химические свойства, даже в нехиральных средах. Поэтому каждой зеркальной паре и каждому нехиральному стереоизомеру можно дать определенное название моносахарида . Например, существует 16 отдельных стереоизомеров альдогексозы, но название «глюкоза» означает определенную пару зеркальных отображений альдогексоз. В проекции Фишера один из двух изомеров глюкозы имеет гидроксил слева на C3 и справа на C4 и C5; в то время как другой изомер имеет обратную структуру. Эти определенные названия моносахаридов имеют общепринятые трехбуквенные сокращения, например «Glu» для глюкозы и «Thr» для треозы .
Обычно моносахарид с n асимметричными атомами углерода имеет 2 n стереоизомеров. Число стереоизомеров с открытой цепью для моносахарида альдозы на один больше, чем для моносахарида кетозы той же длины. Каждая кетоза будет иметь 2 ( n −3) стереоизомера, где n > 2 — число атомов углерода. Каждая альдоза будет иметь 2 ( n −2) стереоизомера, где n > 2 — число атомов углерода. Их также называют эпимерами, которые имеют различное расположение групп −OH и −H у асимметричных или хиральных атомов углерода (это не относится к тем атомам углерода, которые имеют карбонильную функциональную группу).
Как и многие хиральные молекулы, два стереоизомера глицеральдегида будут постепенно вращать направление поляризации линейно поляризованного света , проходящего через него, даже в растворе. Два стереоизомера идентифицируются префиксами D - и L -, в соответствии с направлением вращения: D -глицеральдегид является правовращающим (вращает ось поляризации по часовой стрелке), тогда как L -глицеральдегид является левовращающим (вращает ее против часовой стрелки).

Префиксы D - и L - также используются с другими моносахаридам, чтобы различать два конкретных стереоизомера, которые являются зеркальными отражениями друг друга. Для этой цели рассматривается хиральный углерод, который наиболее удален от группы C=O. Его четыре связи должны соединяться с −H, −OH, −C(OH)H и остальной частью молекулы. Если молекулу можно вращать в пространстве так, чтобы направления этих четырех групп совпадали с направлениями аналоговых групп в C2 D -глицеральдегида, то изомер получает префикс D -. В противном случае он получает префикс L -.
В проекции Фишера префиксы D- и L- указывают на конфигурацию у второго снизу атома углерода: D- , если гидроксил находится справа, и L- , если он находится слева.
Обратите внимание, что префиксы D - и L - не указывают направление вращения поляризованного света, которое является совокупным эффектом расположения во всех хиральных центрах. Однако два энантиомера всегда будут вращать свет в противоположных направлениях, на одинаковую величину. См. также систему D/L .
Моносахарид часто переходит из ациклической (открытоцепочечной) формы в циклическую посредством реакции нуклеофильного присоединения между карбонильной группой и одной из гидроксильных групп той же молекулы. Реакция создает кольцо атомов углерода, замкнутое одним мостиковым атомом кислорода . Полученная молекула имеет полуацетальную или полукетальную группу в зависимости от того, была ли линейная форма альдозой или кетозой. Реакцию легко обратить, давая исходную форму с открытой цепью.
В этих циклических формах кольцо обычно имеет пять или шесть атомов. Эти формы называются фуранозами и пиранозами , соответственно, — по аналогии с фураном и пираном , простейшими соединениями с тем же углеродно-кислородным кольцом (хотя у них отсутствуют двойные связи этих двух молекул). Например, альдогексозаглюкоза может образовывать полуацетальную связь между альдегидной группой на углероде 1 и гидроксилом на углероде 4, давая молекулу с 5-членным кольцом, называемую глюкофураноза . Та же реакция может происходить между углеродами 1 и 5, образуя молекулу с 6-членным кольцом, называемую глюкопираноза . Циклические формы с семиатомным кольцом (то же самое у оксепана ), встречающиеся редко, называются гептозами .


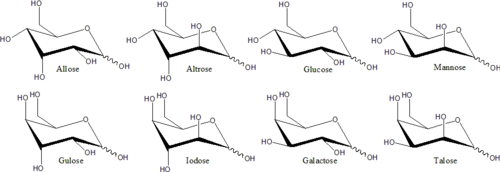
Для многих моносахаридов (включая глюкозу) преобладают циклические формы, как в твердом состоянии, так и в растворах, и поэтому для изомеров с открытой и закрытой цепью обычно используется одно и то же название. Так, например, термин «глюкоза» может обозначать глюкофуранозу, глюкопиранозу, форму с открытой цепью или смесь этих трех.
Циклизация создает новый стереогенный центр на углероде, несущем карбонил. Группа −ОН, которая заменяет кислород карбонила, может оказаться в двух различных положениях относительно средней плоскости кольца. Таким образом, каждый моносахарид с открытой цепью дает два циклических изомера ( аномера ), обозначаемых префиксами α- и β-. Молекула может изменяться между этими двумя формами с помощью процесса, называемого мутаротацией , который заключается в обращении реакции образования кольца с последующим образованием другого кольца. [3]
Стереохимическая структура циклического моносахарида может быть представлена в проекции Хаворта . На этой диаграмме α-изомер для пиранозной формы D -альдогексозы имеет −OH аномерного углерода под плоскостью атомов углерода, в то время как β-изомер имеет −OH аномерного углерода над плоскостью. Пиранозы обычно принимают конформацию кресла, похожую на конформацию циклогексана . В этой конформации α-изомер имеет −OH аномерного углерода в аксиальном положении, тогда как β-изомер имеет −OH аномерного углерода в экваториальном положении (рассматривая сахара D -альдогексозы). [4]
Существует большое количество биологически важных модифицированных моносахаридов: