Релятивистская квантовая химия объединяет релятивистскую механику с квантовой химией для расчета свойств и структуры элементов , особенно для более тяжелых элементов периодической таблицы . Ярким примером является объяснение цвета золота : из-за релятивистских эффектов оно не серебристое, как большинство других металлов. [1]
Термин релятивистские эффекты был разработан в свете истории квантовой механики. Первоначально квантовая механика была разработана без учета теории относительности . [2] Релятивистские эффекты — это те расхождения между значениями, рассчитанными с помощью моделей, которые учитывают относительность, и тех, которые ее не учитывают. [3] Релятивистские эффекты важны для более тяжелых элементов с высокими атомными номерами , таких как лантаноиды и актиниды . [4]
Релятивистские эффекты в химии можно рассматривать как возмущения или небольшие поправки к нерелятивистской теории химии, которая разработана из решений уравнения Шредингера . Эти поправки влияют на электроны по-разному в зависимости от скорости электронов по сравнению со скоростью света . Релятивистские эффекты более заметны в тяжелых элементах, потому что только в этих элементах электроны достигают достаточных скоростей для того, чтобы элементы имели свойства, отличающиеся от того, что предсказывает нерелятивистская химия. [5]
Начиная с 1935 года, Берта Свирлз описала релятивистскую трактовку многоэлектронной системы [6] , несмотря на утверждение Поля Дирака 1929 года о том, что единственные несовершенства, оставшиеся в квантовой механике, «приводят к трудностям только тогда, когда речь идет о высокоскоростных частицах, и поэтому не имеют значения при рассмотрении атомной и молекулярной структуры и обычных химических реакций, в которых она, как правило, достаточно точна, если пренебречь относительной вариацией массы и скорости и предположить только кулоновские силы между различными электронами и атомными ядрами». [7]
Химики-теоретики в целом соглашались с мнением Дирака до 1970-х годов, когда релятивистские эффекты были обнаружены в тяжелых элементах. [8] Уравнение Шредингера было разработано без учета теории относительности в статье Шредингера 1926 года. [9] Релятивистские поправки были внесены в уравнение Шредингера (см. уравнение Клейна–Гордона ) для описания тонкой структуры атомных спектров, но это развитие и другие не сразу просочились в химическое сообщество. Поскольку атомные спектральные линии в основном находились в области физики, а не в области химии, большинство химиков были незнакомы с релятивистской квантовой механикой, и их внимание было сосредоточено на более легких элементах, типичных для фокуса органической химии того времени. [10]
Мнение Дирака о роли релятивистской квантовой механики для химических систем неверно по двум причинам. Во-первых, электроны в атомных орбиталях s и p движутся со значительной долей скорости света. Во-вторых, релятивистские эффекты приводят к косвенным последствиям, которые особенно очевидны для атомных орбиталей d и f . [8]
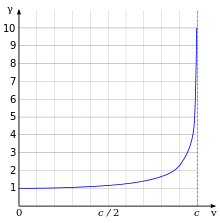
Одним из наиболее важных и известных результатов теории относительности является то, что релятивистская масса электрона увеличивается с ростом
где - масса покоя электрона , скорость электрона и скорость света соответственно. Рисунок справа иллюстрирует этот релятивистский эффект как функцию скорости.
Это имеет непосредственное отношение к радиусу Бора ( ), который определяется выражением
где — приведенная постоянная Планка , а α — постоянная тонкой структуры (релятивистская поправка для модели Бора ).
Бор подсчитал, что 1s-орбитальный электрон атома водорода, вращающийся по орбите с радиусом Бора 0,0529 нм, движется со скоростью, близкой к 1/137 скорости света. [11] Можно распространить это на более крупный элемент с атомным номером Z , используя выражение для 1s-электрона, где v — его радиальная скорость , т. е. его мгновенная скорость по касательной к радиусу атома. Для золота с Z = 79 v ≈ 0,58 c , поэтому 1s-электрон будет двигаться со скоростью, составляющей 58% от скорости света. Подставляя это вместо v / c в уравнение для релятивистской массы, находим, что m rel = 1,22 m e , и, в свою очередь, подставляя это для радиуса Бора выше, находим, что радиус сокращается на 22%.
Если подставить «релятивистскую массу» в уравнение для радиуса Бора, то можно записать

Из этого следует, что
Справа приведенное выше отношение релятивистского и нерелятивистского радиусов Бора было построено как функция скорости электрона. Обратите внимание, как релятивистская модель показывает, что радиус уменьшается с ростом скорости.
Когда трактовка Бора распространяется на водородные атомы , радиус Бора становится где - главное квантовое число , а Z - целое число для атомного номера . В модели Бора угловой момент задается как . Подставляя в уравнение выше и решая для , получаем
С этого момента можно использовать атомные единицы для упрощения выражения:
Подставляя это в выражение для соотношения Бора, упомянутое выше, получаем
На этом этапе можно увидеть, что низкое значение и высокое значение приводят к . Это соответствует интуиции: электроны с более низкими главными квантовыми числами будут иметь более высокую плотность вероятности оказаться ближе к ядру. Ядро с большим зарядом заставит электрон иметь большую скорость. Более высокая скорость электрона означает увеличенную релятивистскую массу электрона, и в результате электроны будут находиться около ядра большую часть времени и тем самым сокращать радиус для малых главных квантовых чисел. [12]
Ртуть (Hg) является жидкостью вплоть до температуры плавления примерно −39 °C . Силы связи для связей Hg–Hg слабее, чем для их непосредственных соседей, таких как кадмий (т.пл. 321 °C) и золото (т.пл. 1064 °C). Сокращение лантаноидов лишь частично объясняет эту аномалию. [11] Поскольку орбиталь 6s 2 сокращается из-за релятивистских эффектов и, следовательно, может вносить лишь слабый вклад в любую химическую связь, связь Hg–Hg должна быть в основном результатом сил Ван-дер-Ваальса . [11] [13] [14]
Газообразная ртуть в основном одноатомна, Hg(г). Hg 2 (г) образуется редко и имеет низкую энергию диссоциации, как и ожидалось из-за отсутствия прочных связей. [15]
Au 2 (г) и Hg(г) аналогичны H 2 (г) и He(г) в отношении того, что имеют одинаковую природу различия. Релятивистское сокращение орбитали 6s 2 приводит к тому, что газообразную ртуть иногда называют псевдоблагородным газом . [11]


Отражательная способность алюминия (Al), серебра (Ag) и золота (Au) показана на графике справа. Человеческий глаз воспринимает электромагнитное излучение с длиной волны около 600 нм как желтое. Золото поглощает синий свет больше, чем другие видимые длины волн света; поэтому отраженный свет, достигающий глаза, не имеет синего цвета по сравнению с падающим светом. Поскольку желтый цвет является дополнительным к синему, это делает кусок золота под белым светом желтым для человеческого глаза.
Электронный переход с 5d-орбитали на 6s-орбиталь ответственен за это поглощение. Аналогичный переход происходит в серебре, но релятивистские эффекты меньше, чем в золоте. В то время как 4d-орбиталь серебра испытывает некоторое релятивистское расширение и 5s-орбитальное сжатие, расстояние 4d–5s в серебре намного больше, чем расстояние 5d–6s в золоте. Релятивистские эффекты увеличивают расстояние 5d-орбитали от ядра атома и уменьшают расстояние 6s-орбитали. Из-за уменьшенного расстояния 6s-орбитали электронный переход поглощает в основном в фиолетово-синей области видимого спектра, в отличие от УФ-области. [16]
Цезий , самый тяжелый из щелочных металлов , который можно собрать в количествах, достаточных для наблюдения, имеет золотистый оттенок, тогда как другие щелочные металлы серебристо-белые. Однако релятивистские эффекты не очень значительны при Z = 55 для цезия (недалеко от Z = 47 для серебра). Золотистый цвет цезия возникает из-за уменьшения частоты света, необходимого для возбуждения электронов щелочных металлов по мере понижения группы. Для лития через рубидий эта частота находится в ультрафиолетовом диапазоне, но для цезия она достигает сине-фиолетового конца видимого спектра; другими словами, плазмонная частота щелочных металлов становится ниже от лития к цезию. Таким образом, цезий пропускает и частично поглощает фиолетовый свет преимущественно, в то время как другие цвета (имеющие более низкую частоту) отражаются; поэтому он кажется желтоватым. [17]
Без теории относительности свинец ( Z = 82) должен вести себя так же, как олово ( Z = 50), поэтому оловянно-кислотные батареи должны работать так же хорошо, как свинцово-кислотные батареи, обычно используемые в автомобилях. Однако расчеты показывают, что около 10 В из 12 В, производимых 6-элементной свинцово-кислотной батареей, возникают исключительно из-за релятивистских эффектов, что объясняет, почему оловянно-кислотные батареи не работают. [18]
В комплексах Tl(I) ( таллий ), Pb(II) ( свинец ) и Bi(III) ( висмут ) существует пара электронов 6s 2. Эффект инертной пары заключается в тенденции этой пары электронов противостоять окислению из-за релятивистского сжатия орбитали 6s. [8]
Дополнительные явления, обычно вызываемые релятивистскими эффектами, следующие:
{{cite web}}: CS1 maint: numeric names: authors list (link)