Позитронно-эмиссионная томография ( ПЭТ ) [1] — это метод функциональной визуализации , который использует радиоактивные вещества, известные как радиотрейсеры, для визуализации и измерения изменений в метаболических процессах и других физиологических активностях, включая кровоток , региональный химический состав и поглощение. Различные трейсеры используются для различных целей визуализации в зависимости от целевого процесса в организме.
Например:
ПЭТ — это распространенный метод визуализации , метод медицинской сцинтилляции, используемый в ядерной медицине . Радиофармпрепарат — радиоизотоп , прикрепленный к лекарству — вводится в организм в качестве трассера . Когда радиофармпрепарат подвергается бета-распаду , испускается позитрон , а когда позитрон взаимодействует с обычным электроном, две частицы аннигилируют, и два гамма-луча испускаются в противоположных направлениях. [2] Эти гамма-лучи регистрируются двумя гамма-камерами для формирования трехмерного изображения.
ПЭТ-сканеры могут включать в себя сканер компьютерной томографии (КТ) и известны как сканеры ПЭТ-КТ . Изображения ПЭТ-сканирования могут быть реконструированы с использованием КТ-сканирования, выполненного с использованием одного сканера в течение того же сеанса.
Одним из недостатков ПЭТ-сканера является его высокая первоначальная стоимость и текущие эксплуатационные расходы. [3]
ПЭТ является как медицинским, так и исследовательским инструментом, используемым в доклинических и клинических условиях. Он широко используется для визуализации опухолей и поиска метастазов в области клинической онкологии , а также для клинической диагностики некоторых диффузных заболеваний мозга, таких как те, которые вызывают различные типы деменции . ПЭТ является ценным исследовательским инструментом для изучения и расширения наших знаний о нормальном человеческом мозге, функции сердца и поддержки разработки лекарственных препаратов. ПЭТ также используется в доклинических исследованиях с использованием животных. Он позволяет проводить повторные исследования одних и тех же субъектов с течением времени, где субъекты могут выступать в качестве своего собственного контроля, и существенно сокращает количество животных, необходимых для данного исследования. Этот подход позволяет научным исследованиям уменьшать необходимый размер выборки, одновременно повышая статистическое качество ее результатов. [ необходима цитата ]
Физиологические процессы приводят к анатомическим изменениям в организме. Поскольку ПЭТ способна обнаруживать биохимические процессы, а также экспрессию некоторых белков, ПЭТ может предоставить информацию на молекулярном уровне задолго до того, как какие-либо анатомические изменения станут видимыми. Сканирование ПЭТ делает это с помощью радиоактивно меченых молекулярных зондов, которые имеют разные скорости поглощения в зависимости от типа и функции вовлеченной ткани. Региональное поглощение трассера в различных анатомических структурах может быть визуализировано и относительно количественно определено с точки зрения введенного излучателя позитронов в рамках сканирования ПЭТ. [ необходима цитата ]
ПЭТ-визуализацию лучше всего выполнять с помощью специального ПЭТ-сканера. Также можно получать ПЭТ-изображения с помощью обычной гамма-камеры с двумя головками , оснащенной детектором совпадений. Качество ПЭТ-изображения с помощью гамма-камеры ниже, а сканирование занимает больше времени. Однако этот метод позволяет использовать недорогое решение на месте для учреждений с низким спросом на ПЭТ-сканирование. Альтернативой было бы направление таких пациентов в другой центр или обращение к мобильному сканеру.
Альтернативные методы медицинской визуализации включают однофотонную эмиссионную компьютерную томографию (SPECT), компьютерную томографию (CT), магнитно-резонансную томографию (МРТ) и функциональную магнитно-резонансную томографию (fMRI), а также ультразвук . SPECT — это метод визуализации, аналогичный ПЭТ, который использует радиолиганды для обнаружения молекул в организме. SPECT менее затратен и обеспечивает худшее качество изображения, чем ПЭТ.

ПЭТ-сканирование с радиоактивным индикатором [ 18 F]фтордезоксиглюкозой (ФДГ) широко используется в клинической онкологии. ФДГ — это аналог глюкозы , который поглощается клетками, использующими глюкозу, и фосфорилируется гексокиназой ( митохондриальная форма которой значительно повышена в быстрорастущих злокачественных опухолях). [4] Метаболическое улавливание радиоактивной молекулы глюкозы позволяет использовать ПЭТ-сканирование. Концентрации визуализируемого индикатора ФДГ указывают на метаболическую активность тканей, поскольку она соответствует региональному поглощению глюкозы. ФДГ используется для изучения возможности распространения рака на другие участки тела ( метастазы рака ). Эти ПЭТ-сканирования с ФДГ для обнаружения метастазов рака являются наиболее распространенными в стандартной медицинской помощи (составляя 90% текущих сканирований). Тот же индикатор может также использоваться для диагностики типов деменции . Реже для визуализации концентрации различных видов молекул в тканях организма используются другие радиоактивные индикаторы , обычно, но не всегда, меченые фтором-18 ( 18F ). [ требуется ссылка ]
Типичная доза ФДГ, используемая при онкологическом сканировании, имеет эффективную дозу облучения 7,6 мЗв . [5] Поскольку гидроксильная группа, которая заменяется фтором-18 для генерации ФДГ, требуется для следующего этапа метаболизма глюкозы во всех клетках, в ФДГ не происходит никаких дальнейших реакций. Более того, большинство тканей (за исключением печени и почек) не могут удалить фосфат, добавленный гексокиназой. Это означает, что ФДГ удерживается в любой клетке, которая его принимает, пока он не распадется, поскольку фосфорилированные сахара из-за своего ионного заряда не могут выйти из клетки. Это приводит к интенсивной радиомеченности тканей с высоким поглощением глюкозы, таких как нормальный мозг, печень, почки и большинство раковых заболеваний, которые имеют более высокое поглощение глюкозы, чем большинство нормальных тканей из-за эффекта Варбурга . В результате ФДГ-ПЭТ можно использовать для диагностики, стадирования и мониторинга лечения рака, особенно лимфомы Ходжкина , [6] неходжкинской лимфомы , [7] и рака легких . [8] [9] [10]
Обзор исследований по использованию ПЭТ при лимфоме Ходжкина, проведенный в 2020 году, выявил доказательства того, что отрицательные результаты промежуточного ПЭТ-сканирования связаны с более высокой общей выживаемостью и выживаемостью без прогрессирования ; однако достоверность имеющихся доказательств была умеренной для выживаемости и очень низкой для выживаемости без прогрессирования. [11]
Несколько других изотопов и радиоактивных индикаторов постепенно внедряются в онкологию для определенных целей. Например,Метомидат, меченый 11 C (11C-метомидат), использовался для обнаружения опухолей коркового вещества надпочечников . [12] [13] Кроме того, ПЭТ/КТ с фтордопой (FDOPA) (также называемая ПЭТ/КТ с F-18-DOPA) оказалась более чувствительной альтернативой для обнаружения и локализации феохромоцитомы , чем сканирование с иобенгуаном (MIBG). [14] [15] [16]

ПЭТ-визуализация с использованием кислорода-15 косвенно измеряет приток крови к мозгу. В этом методе повышенный сигнал радиоактивности указывает на повышенный приток крови, который, как предполагается, коррелирует с повышенной активностью мозга. Из-за своего 2-минутного периода полураспада кислород-15 должен подаваться по трубам непосредственно из медицинского циклотрона для такого использования, что затруднительно. [17]
ПЭТ-визуализация с ФДГ использует тот факт, что мозг обычно быстро потребляет глюкозу. Стандартная ФДГ-ПЭТ мозга измеряет региональное использование глюкозы и может использоваться в нейропатологической диагностике.
Патологии мозга, такие как болезнь Альцгеймера (БА), значительно снижают метаболизм глюкозы и кислорода в мозге одновременно. Поэтому ПЭТ с ФДГ мозга также может быть использована для успешной дифференциации болезни Альцгеймера от других дементивных процессов, а также для ранней диагностики болезни Альцгеймера. Преимуществом ПЭТ с ФДГ для этих целей является ее гораздо более широкая доступность. Некоторые радиоактивные индикаторы на основе фтора-18, используемые для болезни Альцгеймера, включают флорбетапир , флутеметамол , питтсбургское соединение B (PiB) и флорбетабен , которые все используются для обнаружения бляшек бета-амилоида , потенциального биомаркера болезни Альцгеймера в мозге. [18]
ПЭТ-визуализация с ФДГ также может использоваться для локализации «фокуса приступа». Фокус приступа будет выглядеть как гипометаболический во время межприступного сканирования. [19] Было разработано несколько радиоактивных индикаторов (т. е. радиолигандов) для ПЭТ, которые являются лигандами для определенных подтипов нейрорецепторов , таких как [ 11 C] раклоприд , [ 18 F] фаллиприд и [ 18 F] десметоксифаллиприд для дофаминовых рецепторов D 2 / D 3 ; [ 11 C] McN5652 и [ 11 C] DASB для транспортеров серотонина ; [ 18 F] мефвей для серотониновых 5HT 1A рецепторов ; и [ 18 F] нифен для никотиновых ацетилхолиновых рецепторов или субстратов ферментов (например, 6- FDOPA для фермента AADC ). Эти агенты позволяют визуализировать пулы нейрорецепторов в контексте множества нейропсихиатрических и неврологических заболеваний.
ПЭТ также может использоваться для диагностики склероза гиппокампа , который вызывает эпилепсию. Для этой цели были исследованы ФДГ и менее распространенные трассеры флумазенил и МПФ . [20] [21] Если склероз односторонний (правый гиппокамп или левый гиппокамп), поглощение ФДГ можно сравнить со здоровой стороной. Даже если диагноз с помощью МРТ поставить сложно, его можно диагностировать с помощью ПЭТ. [22] [23]
Разработка ряда новых зондов для неинвазивной in vivo ПЭТ -визуализации нейроагрегатов в мозге человека приблизила визуализацию амилоида к клиническому использованию. Самые ранние зонды для визуализации амилоида включали [ 18 F] FDDNP [24], разработанный в Калифорнийском университете в Лос-Анджелесе, и соединение B (PiB) в Питтсбурге [25], разработанное в Питтсбургском университете . Эти зонды позволяют визуализировать амилоидные бляшки в мозге пациентов с болезнью Альцгеймера и могут помочь врачам в постановке положительного клинического диагноза болезни Альцгеймера до смерти и в разработке новых методов лечения амилоида. [ 11 C] полиметилпентен (ПМП) — это новый радиофармацевтический препарат, используемый в ПЭТ-визуализации для определения активности ацетилхолинергической нейротрансмиттерной системы, действуя в качестве субстрата для ацетилхолинэстеразы . Посмертное обследование пациентов с болезнью Альцгеймера показало снижение уровня ацетилхолинэстеразы. [ 11 C]PMP используется для картирования активности ацетилхолинэстеразы в мозге, что может позволить проводить предварительную диагностику болезни Альцгеймера и помогать контролировать лечение болезни Альцгеймера. [26] Компания Avid Radiopharmaceuticals разработала и вывела на рынок соединение под названием флорбетапир, которое использует более длительный радионуклид фтор-18 для обнаружения амилоидных бляшек с помощью ПЭТ-сканирования. [27]
Изучить связи между конкретными психологическими процессами или расстройствами и активностью мозга.
Многочисленные соединения, которые селективно связываются с нейрорецепторами, представляющими интерес в биологической психиатрии, были радиоактивно помечены C-11 или F-18. Радиолиганды, которые связываются с рецепторами дофамина ( D 1 , [28] D 2 , [29] [30] транспортер обратного захвата), рецепторами серотонина ( 5HT 1A , 5HT 2A , транспортер обратного захвата), опиоидными рецепторами ( мю и каппа ), холинергическими рецепторами (никотиновыми и мускариновыми ) и другими сайтами, были успешно использованы в исследованиях с участием людей. Были проведены исследования, изучающие состояние этих рецепторов у пациентов по сравнению со здоровыми контрольными лицами при шизофрении , злоупотреблении психоактивными веществами , расстройствах настроения и других психиатрических состояниях. [ необходима цитата ]
ПЭТ также может использоваться в хирургии под визуальным контролем для лечения внутричерепных опухолей, артериовенозных мальформаций и других состояний, поддающихся хирургическому лечению. [31]
Кардиология , атеросклероз и исследование сосудистых заболеваний: ПЭТ с ФДГ может помочь в выявлении спящего миокарда . Однако экономическая эффективность ПЭТ для этой роли по сравнению с ОФЭКТ неясна. Визуализация атеросклероза с ФДГ ПЭТ для выявления пациентов с риском инсульта также осуществима. Кроме того, она может помочь проверить эффективность новых методов лечения атеросклероза. [32]
Визуализация инфекций с помощью технологий молекулярной визуализации может улучшить диагностику и последующее лечение. В клинической практике ПЭТ широко используется для визуализации бактериальных инфекций с использованием ФДГ для выявления воспалительной реакции, связанной с инфекцией. Для визуализации бактериальных инфекций in vivo были разработаны три различных контрастных агента ПЭТ: [ 18 F] мальтоза , [33] [ 18 F] мальтогексаоза и [ 18 F] 2-фтордезоксисорбитол ( FDS). [34] FDS имеет дополнительное преимущество, поскольку может воздействовать только на Enterobacteriaceae .
В доклинических испытаниях новый препарат может быть помечен радиоактивным изотопом и введен животным. Такие сканирования называются исследованиями биораспределения. Информация о поглощении, удержании и выведении препарата с течением времени может быть получена быстро и экономически эффективно по сравнению со старой техникой умерщвления и вскрытия животных. Обычно о занятости препарата в предполагаемом месте действия можно косвенно судить по исследованиям конкуренции между немеченым препаратом и радиомечеными соединениями для связывания со специфичностью к месту. Один радиолиганд может быть использован таким образом для проверки многих потенциальных кандидатов на препараты для одной и той же цели. Связанная техника включает сканирование с радиолигандами, которые конкурируют с эндогенным (природным) веществом в заданном рецепторе, чтобы продемонстрировать, что препарат вызывает высвобождение природного вещества. [35]
Был создан миниатюрный ПЭТ для животных, который достаточно мал для сканирования полностью сознательной крысы . [36] Этот RatCAP (ПЭТ для животных с сознанием крыс) позволяет сканировать животных без мешающих эффектов анестезии . ПЭТ-сканеры, разработанные специально для визуализации грызунов , часто называемые микроПЭТ, а также сканеры для мелких приматов , продаются для академических и фармацевтических исследований. Сканеры основаны на микроминиатюрных сцинтилляторах и усиленных лавинных фотодиодах (APD) через систему, которая использует однокристальные кремниевые фотоумножители . [1]
В 2018 году Школа ветеринарной медицины Калифорнийского университета в Дэвисе стала первым ветеринарным центром, который использовал небольшой клинический ПЭТ-сканер в качестве сканера для клинической (а не исследовательской) диагностики животных. Из-за стоимости, а также незначительной полезности обнаружения метастазов рака у животных-компаньонов (основное применение этого метода) ожидается, что ветеринарное ПЭТ-сканирование будет редко доступно в ближайшем будущем. [ необходима цитата ]
ПЭТ-визуализация использовалась для визуализации мышц и костей. ФДГ является наиболее часто используемым трейсером для визуализации мышц, а NaF-F18 является наиболее широко используемым трейсером для визуализации костей.
ПЭТ является приемлемым методом изучения скелетных мышц во время упражнений. [37] Кроме того, ПЭТ может предоставить данные об активации мышц, лежащих глубоко (таких как широкая промежуточная мышца и малая ягодичная мышца ) по сравнению с такими методами, как электромиография , которые можно использовать только для поверхностных мышц, расположенных непосредственно под кожей. Однако недостатком является то, что ПЭТ не предоставляет информацию о времени активации мышц, поскольку ее необходимо измерять после завершения упражнения. Это связано со временем, которое требуется для накопления ФДГ в активированных мышцах. [38]
Вместе с [ 18 F] фторидом натрия ПЭТ для визуализации костей используется уже 60 лет для измерения регионального метаболизма костей и кровотока с использованием статического и динамического сканирования. Исследователи недавно начали использовать [ 18 F] фторид натрия также для изучения метастазов костей. [39]
ПЭТ-сканирование неинвазивно, но подразумевает воздействие ионизирующего излучения . [3] ФДГ, которая в настоящее время является стандартным радиофармпрепаратом, используемым для нейровизуализации ПЭТ и лечения онкологических пациентов, [40] имеет эффективную дозу облучения 14 мЗв . [5]
Количество радиации в ФДГ аналогично эффективной дозе, полученной за один год пребывания в американском городе Денвер, штат Колорадо (12,4 мЗв/год). [41] Для сравнения, доза радиации при других медицинских процедурах составляет от 0,02 мЗв для рентгенографии грудной клетки и 6,5–8 мЗв для КТ грудной клетки. [42] [43] В среднем экипажи гражданских самолетов подвергаются воздействию 3 мЗв/год, [44] а предельная доза профессионального облучения всего тела для работников ядерной энергетики в США составляет 50 мЗв/год. [45] Для масштаба см. Порядки величины (излучение) .
При сканировании ПЭТ-КТ воздействие радиации может быть значительным — около 23–26 мЗв (для человека весом 70 кг — доза, вероятно, будет выше для большей массы тела). [46] [47]

Радионуклиды включаются либо в соединения, обычно используемые организмом, такие как глюкоза (или аналоги глюкозы), вода или аммиак , либо в молекулы, которые связываются с рецепторами или другими участками действия лекарств. Такие меченые соединения известны как радиотрейсеры . Технология ПЭТ может использоваться для отслеживания биологического пути любого соединения в живых людях (и многих других видах), при условии, что оно может быть радиомечено изотопом ПЭТ. Таким образом, конкретные процессы, которые можно исследовать с помощью ПЭТ, практически безграничны, и радиотрейсеры для новых целевых молекул и процессов продолжают синтезироваться. На момент написания этой статьи уже десятки используются в клинической практике и сотни применяются в исследованиях. В 2020 году наиболее часто используемым радиотрейсером в клиническом ПЭТ-сканировании является производное углевода ФДГ. Этот радиотрейсер используется практически во всех сканированиях в онкологии и большинстве сканов в неврологии, таким образом, составляет подавляющее большинство радиотрейсеров (>95%), используемых в ПЭТ и ПЭТ-КТ-сканировании.
Из-за коротких периодов полураспада большинства радиоизотопов, испускающих позитроны, радиотрейсеры традиционно производились с использованием циклотрона в непосредственной близости от объекта ПЭТ-визуализации. Период полураспада фтора-18 достаточно велик, чтобы радиотрейсеры, меченные фтором-18, можно было производить в коммерческих целях вне производственных помещений и отправлять в центры визуализации. Недавно генераторы рубидия-82 стали коммерчески доступны. [49] Они содержат стронций-82, который распадается путем захвата электронов с образованием рубидия-82, испускающего позитроны.
Было рассмотрено использование позитронно-излучающих изотопов металлов в ПЭТ-сканировании, включая элементы, не перечисленные выше, такие как лантаноиды. [50]
Изотоп 89 Zr применялся для отслеживания и количественной оценки молекулярных антител с помощью ПЭТ-камер (метод, называемый «иммуно-ПЭТ»). [51] [52] [53]
Биологический период полураспада антител обычно составляет порядка дней, см. даклизумаб и эренумаб в качестве примера. Для визуализации и количественной оценки распределения таких антител в организме хорошо подходит изотоп ПЭТ 89 Zr, поскольку его физический период полураспада соответствует типичному биологическому периоду полураспада антител, см. таблицу выше.

Для проведения сканирования в живого субъекта (обычно в кровоток) вводят короткоживущий радиоактивный изотоп-трассер . Каждый атом-трассер химически включен в биологически активную молекулу. Существует период ожидания, пока активная молекула концентрируется в интересующих тканях. Затем субъект помещается в сканер визуализации. Молекула, наиболее часто используемая для этой цели, — это ФДГ, сахар, для которого период ожидания обычно составляет час. Во время сканирования производится запись концентрации в ткани по мере распада трассера.
Когда радиоизотоп подвергается распаду с испусканием позитрона (также известному как положительный бета-распад ), он испускает позитрон, античастицу электрона с противоположным зарядом. Испускаемый позитрон перемещается в ткани на короткое расстояние (обычно менее 1 мм, но в зависимости от изотопа [54] ), в течение которого он теряет кинетическую энергию, пока не замедлится до точки, где он может взаимодействовать с электроном. [ 55] Столкновение аннигилирует как электрон, так и позитрон, производя пару аннигиляционных ( гамма ) фотонов, движущихся примерно в противоположных направлениях. Они обнаруживаются, когда достигают сцинтиллятора в сканирующем устройстве, создавая вспышку света, которая обнаруживается фотоумножительными трубками или кремниевыми лавинными фотодиодами (Si APD). Методика основана на одновременном или совпадающем обнаружении пары фотонов, движущихся приблизительно в противоположных направлениях (они были бы точно противоположны в своей системе отсчета центра масс , но сканер не может этого знать, поэтому имеет встроенную небольшую погрешность направления). Фотоны, которые не прибывают во временных «парах» (т. е. в пределах временного окна в несколько наносекунд), игнорируются.
Наиболее значительная часть электронно-позитронных аннигиляций приводит к тому, что два гамма-фотона 511 кэВ испускаются под углом почти 180 градусов друг к другу. Следовательно, можно локализовать их источник вдоль прямой линии совпадения (также называемой линией отклика , или LOR ). На практике LOR имеет ненулевую ширину, поскольку испускаемые фотоны не находятся точно под углом 180 градусов друг к другу. Если разрешающее время детекторов составляет менее 500 пикосекунд , а не около 10 наносекунд , можно локализовать событие в сегменте хорды , длина которого определяется временным разрешением детектора. По мере улучшения временного разрешения улучшается отношение сигнал/шум (SNR) изображения, требуя меньше событий для достижения того же качества изображения. Эта технология пока не распространена, но она доступна в некоторых новых системах. [56]
Необработанные данные, собранные сканером ПЭТ, представляют собой список «совпадений событий», представляющих собой почти одновременное обнаружение (обычно в пределах окна от 6 до 12 наносекунд друг от друга) фотонов аннигиляции парой детекторов. Каждое совпадение событий представляет собой линию в пространстве, соединяющую два детектора, вдоль которых произошла эмиссия позитрона (т. е. линию отклика (LOR)).
Аналитические методы, во многом похожие на реконструкцию данных компьютерной томографии (КТ) и однофотонной эмиссионной компьютерной томографии (ОФЭКТ), широко используются, хотя набор данных, собранный в ПЭТ, намного хуже, чем КТ, поэтому методы реконструкции сложнее. События совпадения могут быть сгруппированы в проекционные изображения, называемые синограммами . Синограммы сортируются по углу каждого вида и наклону (для 3D-изображений). Изображения синограмм аналогичны проекциям, полученным с помощью КТ-сканеров, и могут быть реконструированы аналогичным образом. Статистика полученных таким образом данных намного хуже, чем статистика, полученная с помощью трансмиссионной томографии. Обычный набор данных ПЭТ имеет миллионы отсчетов для всего сбора данных, в то время как КТ может достигать нескольких миллиардов отсчетов. Это приводит к тому, что изображения ПЭТ кажутся «более шумными», чем КТ. Двумя основными источниками шума в ПЭТ являются рассеяние (обнаруженная пара фотонов, по крайней мере один из которых отклонился от своего первоначального пути из-за взаимодействия с веществом в поле зрения, что привело к тому, что пара была отнесена к неправильному LOR) и случайные события (фотоны, происходящие из двух разных событий аннигиляции, но неправильно зарегистрированные как совпадающая пара, поскольку их прибытие на соответствующие детекторы произошло в пределах временного окна совпадения).
На практике требуется значительная предварительная обработка данных — коррекция случайных совпадений, оценка и вычитание рассеянных фотонов, коррекция мертвого времени детектора (после обнаружения фотона детектор должен снова «остыть») и коррекция чувствительности детектора (как собственной чувствительности детектора, так и изменения чувствительности из-за угла падения).
Фильтрованная обратная проекция (FBP) часто использовалась для реконструкции изображений из проекций. Этот алгоритм имеет преимущество в простоте при низких требованиях к вычислительным ресурсам. Недостатки в том, что дробовой шум в необработанных данных заметен в реконструированных изображениях, а области с высоким поглощением трассера имеют тенденцию образовывать полосы по всему изображению. Кроме того, FBP обрабатывает данные детерминированно — он не учитывает присущую хаотичность, связанную с данными ПЭТ, поэтому требует всех предреконструкционных поправок, описанных выше.
Статистические, основанные на правдоподобии подходы : Статистические, основанные на правдоподобии [57] [58] итеративные алгоритмы максимизации ожидания, такие как алгоритм Шеппа–Варди [59], в настоящее время являются предпочтительным методом реконструкции. Эти алгоритмы вычисляют оценку вероятного распределения событий аннигиляции, которые привели к измеренным данным, на основе статистических принципов. Преимуществом является лучший профиль шума и устойчивость к артефактам полос, обычным для FBP, но недостатком являются большие требования к компьютерным ресурсам. Еще одним преимуществом статистических методов реконструкции изображений является то, что физические эффекты, которые необходимо было бы предварительно скорректировать при использовании аналитического алгоритма реконструкции, такие как рассеянные фотоны, случайные совпадения, затухание и мертвое время детектора, могут быть включены в модель правдоподобия, используемую при реконструкции, что позволяет дополнительно снизить уровень шума. Также было показано, что итеративная реконструкция приводит к улучшению разрешения реконструированных изображений, поскольку в модель правдоподобия могут быть включены более сложные модели физики сканера, чем те, которые используются в аналитических методах реконструкции, что позволяет улучшить количественную оценку распределения радиоактивности. [60]
Исследования показали, что байесовские методы, которые включают пуассоновскую функцию правдоподобия и соответствующую априорную вероятность (например, сглаживающее априорное значение, приводящее к регуляризации полной вариации , или распределение Лапласа, приводящее к регуляризации на основе θ в вейвлете или другой области), такие как решетчатая оценка Ульфа Гренадера [ 61] [62] или методы штрафа Байеса [63] [64] или метод грубости И. Дж. Гуда [65] [66], могут обеспечить более высокую производительность по сравнению с методами, основанными на максимизации ожиданий, которые включают пуассоновскую функцию правдоподобия, но не включают такую априорную вероятность. [67] [68] [69]
Коррекция затухания : Количественная ПЭТ-визуализация требует коррекции затухания. [70] В этих системах коррекция затухания основана на сканировании пропускания с использованием вращающегося стержневого источника 68 Ge. [71]
Пропускающее сканирование напрямую измеряет значения затухания при 511 кэВ. [72] Затухание происходит, когда фотоны, испускаемые радиоактивным индикатором внутри тела, поглощаются промежуточной тканью между детектором и испусканием фотона. Поскольку различные LOR должны проходить через разную толщину ткани, фотоны ослабляются по-разному. В результате структуры, находящиеся глубоко в теле, реконструируются как имеющие ложно низкое поглощение индикатора. Современные сканеры могут оценивать затухание с использованием интегрированного рентгеновского КТ-оборудования вместо более раннего оборудования, которое предлагало грубую форму КТ с использованием источника гамма-излучения ( позитронного излучения) и детекторов ПЭТ.
Хотя изображения с исправленным затуханием, как правило, являются более точными представлениями, сам процесс исправления подвержен значительным артефактам. В результате исправленные и неисправленные изображения всегда реконструируются и считываются вместе.
2D/3D реконструкция : Ранние ПЭТ-сканеры имели только одно кольцо детекторов, поэтому получение данных и последующая реконструкция были ограничены одной поперечной плоскостью. Более современные сканеры теперь включают несколько колец, по сути, образуя цилиндр детекторов.
Существует два подхода к восстановлению данных с такого сканера:
3D-методы обладают лучшей чувствительностью (потому что обнаруживается и используется больше совпадений), следовательно, меньше шума, но они более чувствительны к эффектам рассеяния и случайных совпадений, а также требуют больших компьютерных ресурсов. Появление детекторов с субнаносекундным временным разрешением обеспечивает лучшее отклонение случайных совпадений, тем самым способствуя реконструкции 3D-изображений.
Времяпролетный (TOF) ПЭТ : Для современных систем с более высоким временным разрешением (примерно 3 наносекунды) используется метод, называемый «времяпролетным», для улучшения общей производительности. Времяпролетный ПЭТ использует очень быстрые детекторы гамма-излучения и систему обработки данных, которые могут более точно определять разницу во времени между обнаружением двух фотонов. Невозможно точно локализовать точку возникновения события аннигиляции (в настоящее время в пределах 10 см). Поэтому реконструкция изображения по-прежнему необходима. Метод TOF дает значительное улучшение качества изображения, особенно соотношения сигнал/шум.
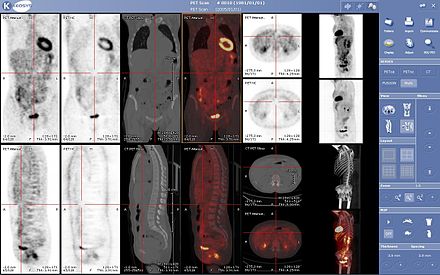

Сканирование ПЭТ все чаще считывается вместе с КТ или МРТ, причем комбинация ( совместная регистрация ) дает как анатомическую, так и метаболическую информацию (т. е., какова структура и что она делает биохимически). Поскольку ПЭТ-визуализация наиболее полезна в сочетании с анатомической визуализацией, такой как КТ, современные ПЭТ-сканеры теперь доступны со встроенными высококачественными многорядными детекторными КТ-сканерами (ПЭТ-КТ). Поскольку два сканирования могут быть выполнены в непосредственной последовательности в течение одного сеанса, при этом пациент не меняет положение между двумя типами сканирования, два набора изображений регистрируются более точно , так что области аномалии на ПЭТ-изображении могут быть более точно соотнесены с анатомией на КТ-изображениях. Это очень полезно для отображения подробных видов движущихся органов или структур с более высокой анатомической вариацией, что чаще встречается за пределами мозга.
В Институте нейронаук и биофизики в Юлихе в апреле 2009 года начал работу крупнейший в мире ПЭТ-МРТ-аппарат. Магнитно-резонансный томограф (МРТ) с индукцией 9,4 тесла в сочетании с ПЭТ. В настоящее время при таких высоких значениях напряженности магнитного поля можно визуализировать только голову и мозг. [73]
Для визуализации мозга регистрация КТ, МРТ и ПЭТ-сканов может быть выполнена без необходимости использования интегрированного сканера ПЭТ-КТ или ПЭТ-МРТ с помощью устройства, известного как N-локализатор . [31] [74] [75] [76]
Минимизация дозы облучения субъекта является привлекательной чертой использования короткоживущих радионуклидов. Помимо своей устоявшейся роли в качестве диагностического метода, ПЭТ играет все более важную роль в качестве метода оценки ответа на терапию, в частности, терапию рака, [77] где риск для пациента из-за отсутствия знаний о ходе болезни намного больше, чем риск от тестового облучения. Поскольку трассеры радиоактивны, пожилые [ сомнительно – обсудить ] и беременные не могут использовать его из-за рисков, связанных с радиацией.
Ограничения для широкого использования ПЭТ возникают из-за высокой стоимости циклотронов, необходимых для производства короткоживущих радионуклидов для сканирования ПЭТ, и необходимости специально адаптированного на месте химического синтеза для производства радиофармацевтических препаратов после подготовки радиоизотопов. Органические молекулы радиоизотопных индикаторов, которые будут содержать позитронно-излучающий радиоизотоп, не могут быть синтезированы сначала, а затем радиоизотоп приготовлен в них, поскольку бомбардировка циклотроном для подготовки радиоизотопа разрушает любой органический носитель для него. Вместо этого сначала должен быть подготовлен изотоп, затем химия для приготовления любого органического радиоизотопного индикатора (такого как ФДГ), выполненная очень быстро, за короткое время до распада изотопа. Немногие больницы и университеты способны поддерживать такие системы, и большинство клинических ПЭТ поддерживается сторонними поставщиками радиоизотопных индикаторов, которые могут поставлять их на многие объекты одновременно. Это ограничение ограничивает клиническую ПЭТ в первую очередь использованием трассеров, меченых фтором-18, который имеет период полураспада 110 минут и может транспортироваться на разумное расстояние перед использованием, или рубидием-82 (используется как хлорид рубидия-82 ) с периодом полураспада 1,27 минуты, который создается в портативном генераторе и используется для исследований перфузии миокарда . В последние годы несколько циклотронов на месте со встроенной защитой и «горячими лабораториями» (автоматизированные химические лаборатории, которые могут работать с радиоизотопами) начали сопровождать отделения ПЭТ в отдаленных больницах. Наличие небольшого циклотрона на месте обещает расшириться в будущем, поскольку циклотроны сокращаются в ответ на высокую стоимость транспортировки изотопов к удаленным машинам ПЭТ. [78] В последние годы в США нехватка ПЭТ-сканеров уменьшилась, поскольку развертывание радиофармацевтических предприятий по поставке радиоизотопов выросло на 30% в год. [79]
Поскольку период полураспада фтора-18 составляет около двух часов, приготовленная доза радиофармпрепарата, содержащего этот радионуклид, будет подвергаться многократным периодам полураспада в течение рабочего дня. Это требует частой перекалибровки оставшейся дозы (определения активности на единицу объема) и тщательного планирования в отношении графика приема пациентов.

Концепция эмиссионной и трансмиссионной томографии была введена Дэвидом Э. Кулем , Люком Чепменом и Роем Эдвардсом в конце 1950-х годов. Их работа привела к проектированию и созданию нескольких томографических инструментов в Медицинской школе Вашингтонского университета , а затем в Университете Пенсильвании . [80] В 1960-х и 70-х годах томографические инструменты и методы визуализации были дополнительно разработаны Мишелем Тер-Погосяном , Майклом Э. Фелпсом , Эдвардом Дж. Хоффманом и другими в Медицинской школе Вашингтонского университета . [81] [82]
Работа Гордона Браунелла, Чарльза Бернхэма и их коллег в Массачусетской больнице общего профиля, начавшаяся в 1950-х годах, внесла значительный вклад в развитие технологии ПЭТ и включала первую демонстрацию аннигиляционного излучения для медицинской визуализации. [83] Их инновации, включая использование световодов и объемного анализа, сыграли важную роль в развертывании ПЭТ-визуализации. В 1961 году Джеймс Робертсон и его коллеги в Брукхейвенской национальной лаборатории построили первый одноплоскостной ПЭТ-скан, прозванный «head-shrinker». [84]
Одним из факторов, наиболее ответственных за принятие позитронной визуализации, было развитие радиофармацевтических препаратов. В частности, разработка меченой 2-фтордезокси-D-глюкозы (ФДГ, впервые синтезированной и описанной двумя чешскими учеными из Карлова университета в Праге в 1968 году) [85] группой из Брукхейвена под руководством Эла Вольфа и Джоанны Фаулер стала основным фактором расширения сферы применения ПЭТ-визуализации. [86] Впервые соединение было введено двум нормальным добровольцам Аббасом Алави в августе 1976 года в Университете Пенсильвании. Изображения мозга, полученные с помощью обычного (не ПЭТ) ядерного сканера, продемонстрировали концентрацию ФДГ в этом органе. Позднее это вещество использовалось в специализированных позитронных томографических сканерах, что позволило создать современную процедуру.

Логическим продолжением позитронного инструментария стала конструкция с использованием двух двумерных массивов. PC-I был первым инструментом, использующим эту концепцию, и был разработан в 1968 году, завершен в 1969 году и представлен в 1972 году. Первые применения PC-I в томографическом режиме, в отличие от режима компьютерной томографии, были представлены в 1970 году. [87] Вскоре многим из тех, кто участвовал в разработке ПЭТ, стало ясно, что круговая или цилиндрическая решетка детекторов является логическим следующим шагом в инструментировании ПЭТ. Хотя многие исследователи придерживались этого подхода, Джеймс Робертсон [88] и Занг-Хи Чо [89] были первыми, кто предложил кольцевую систему, которая стала прототипом нынешней формы ПЭТ. Первый многосрезовый цилиндрический решетчатый ПЭТ-сканер был завершен в 1974 году в Институте радиологии Маллинкродта группой под руководством Тер-Погосяна. [90]
Сканер ПЭТ-КТ, приписываемый Дэвиду Таунсенду и Рональду Натту, был назван журналом Time медицинским изобретением года в 2000 году. [91]
По данным Cancer Care Ontario на август 2008 года, текущая средняя стоимость выполнения ПЭТ-сканирования в провинции составляет 1000–1200 канадских долларов за сканирование. Сюда входит стоимость радиофармпрепарата и стипендия для врача, читающего сканирование. [92]
В Соединенных Штатах стоимость ПЭТ-сканирования оценивается в 1500–5000 долларов США.
В Англии ориентировочная стоимость Национальной службы здравоохранения (2015–2016 гг.) для амбулаторного ПЭТ-сканирования для взрослых составляет 798 фунтов стерлингов. [93]
В Австралии по состоянию на июль 2018 года плата за ПЭТ-исследование всего тела с использованием ФДГ составляет от 953 до 999 австралийских долларов в зависимости от показаний к сканированию. [94]
Общую эффективность систем ПЭТ можно оценить с помощью инструментов контроля качества, таких как фантом Ящака . [95]
{{cite journal}}: Цитировать журнал требует |journal=( помощь ){{cite web}}: CS1 maint: url-status ( ссылка )