Холестерин является основным стеролом всех высших животных , он распространен в тканях организма , особенно в головном и спинном мозге , а также в животных жирах и маслах . [3] [4]
Холестерин биосинтезируется всеми животными клетками и является важным структурным компонентом мембран животных клеток . У позвоночных гепатоциты обычно производят наибольшее количество. В мозге астроциты производят холестерин и транспортируют его к нейронам . [5] Он отсутствует среди прокариот ( бактерий и архей ), хотя есть некоторые исключения, такие как микоплазма , которым холестерин необходим для роста. [6] Холестерин также служит предшественником биосинтеза стероидных гормонов , желчной кислоты [7] и витамина D.
Повышенный уровень холестерина в крови, особенно связанный с липопротеинами низкой плотности (ЛПНП, часто называемыми «плохим холестерином»), может увеличить риск сердечно-сосудистых заболеваний . [8]
Франсуа Пуллетье де ла Саль впервые обнаружил холестерин в твердой форме в желчных камнях в 1769 году. В 1815 году химик Мишель Эжен Шеврель назвал это соединение «холестерином». [9] [10]
Слово «холестерин» происходит от древнегреческих слов chole- « желчь » и stereos «твердый», за которыми следует химический суффикс -ол, обозначающий спирт .
Холестерин необходим для всей животной жизни. Хотя большинство клеток способны синтезировать его, большая часть холестерина поглощается или синтезируется гепатоцитами и транспортируется в крови к периферическим клеткам. Уровень холестерина в периферических тканях определяется балансом поглощения и экспорта. [11] В нормальных условиях холестерин мозга отделен от периферического холестерина, т. е. пищевой и печеночный холестерин не пересекают гематоэнцефалический барьер. Вместо этого астроциты производят и распределяют холестерин в мозге. [12]
Синтез de novo, как в астроцитах, так и в гепатоцитах, происходит посредством сложного 37-шагового процесса. Он начинается с пути мевалоната или HMG-CoA-редуктазы , цели статиновых препаратов, который охватывает первые 18 шагов. Затем следуют 19 дополнительных шагов для преобразования полученного ланостерола в холестерин. [13] Мужчина весом 68 кг (150 фунтов) обычно синтезирует около 1 грамма (1000 мг) холестерина в день, и его организм содержит около 35 г, в основном содержащихся в клеточных мембранах.
Типичное ежедневное потребление холестерина для мужчины в Соединенных Штатах составляет 307 мг. [14] Большая часть потребляемого холестерина этерифицирована , что приводит к его плохому усвоению кишечником. Организм также компенсирует усвоение потребляемого холестерина за счет снижения собственного синтеза холестерина. [15] По этим причинам холестерин в пище, через семь-десять часов после приема пищи, оказывает незначительное влияние, если вообще оказывает, на концентрацию холестерина в крови. Удивительно, но у крыс уровень холестерина в крови обратно пропорционален потреблению холестерина. Чем больше холестерина съедает крыса, тем ниже уровень холестерина в крови. [16] В течение первых семи часов после приема холестерина, поскольку поглощенные жиры распределяются по телу во внеклеточной воде различными липопротеинами (которые транспортируют все жиры в воде за пределы клеток), концентрации увеличиваются. [17]
Растения вырабатывают холестерин в очень малых количествах. [18] В больших количествах они вырабатывают фитостерины , химически схожие вещества, которые могут конкурировать с холестерином за реабсорбцию в кишечном тракте, тем самым потенциально снижая реабсорбцию холестерина. [19] Когда клетки слизистой оболочки кишечника поглощают фитостерины, вместо холестерина они обычно выделяют молекулы фитостерина обратно в желудочно-кишечный тракт , что является важным защитным механизмом. Потребление природных фитостеринов, которые включают в себя растительные стерины и станолы , колеблется между ≈200–300 мг/день в зависимости от привычек питания. [20] Были разработаны специально разработанные вегетарианские экспериментальные диеты, дающие более 700 мг/день. [21]
Холестерин присутствует в разной степени во всех мембранах животных клеток , но отсутствует у прокариот. [22] Он необходим для построения и поддержания мембран и модулирует текучесть мембран в диапазоне физиологических температур. Гидроксильная группа каждой молекулы холестерина взаимодействует с молекулами воды, окружающими мембрану, как и полярные головки мембранных фосфолипидов и сфинголипидов , в то время как объемный стероид и углеводородная цепь встроены в мембрану вместе с неполярной жирнокислотной цепью других липидов. Благодаря взаимодействию с жирнокислотными цепями фосфолипидов холестерин увеличивает упаковку мембраны, что как изменяет текучесть мембраны [23] , так и поддерживает целостность мембраны, так что клеткам животных не нужно строить клеточные стенки (как растениям и большинству бактерий). Мембрана остается стабильной и прочной, не будучи жесткой, что позволяет клеткам животных менять форму, а животным — двигаться.
Структура тетрациклического кольца холестерина способствует текучести клеточной мембраны, поскольку молекула находится в транс- конформации, что делает все, кроме боковой цепи холестерина, жесткими и плоскими. [24] В этой структурной роли холестерин также снижает проницаемость плазматической мембраны для нейтральных растворенных веществ, [25] ионов водорода и ионов натрия . [26]
Холестерин регулирует биологический процесс презентации субстрата и ферменты, которые используют презентацию субстрата в качестве механизма их активации. Фосфолипаза D2 ( PLD2 ) является хорошо определенным примером фермента, активируемого презентацией субстрата. [27] Фермент пальмитоилируется , что заставляет фермент перемещаться к холестеринзависимым липидным доменам, иногда называемым « липидными плотами ». Субстратом фосфолипазы D является фосфатидилхолин (PC), который является ненасыщенным и имеет низкое содержание в липидных плотах. PC локализуется в неупорядоченной области клетки вместе с полиненасыщенным липидом фосфатидилинозитол 4,5-бисфосфатом (PIP2). PLD2 имеет домен связывания PIP2 . Когда концентрация PIP2 в мембране увеличивается, PLD2 покидает холестеринзависимые домены и связывается с PIP2, где он затем получает доступ к своему субстрату PC и начинает катализ на основе презентации субстрата.
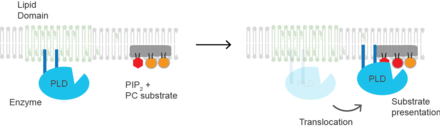
Холестерин также участвует в процессах клеточной сигнализации, помогая формировать липидные плоты в плазматической мембране , что приводит рецепторные белки в непосредственной близости с высокими концентрациями молекул вторичных мессенджеров. [28] В нескольких слоях холестерин и фосфолипиды, оба электрические изоляторы, могут способствовать скорости передачи электрических импульсов по нервной ткани. Для многих нейронных волокон миелиновая оболочка, богатая холестерином, поскольку она получена из уплотненных слоев мембран шванновских клеток или олигодендроцитов, обеспечивает изоляцию для более эффективного проведения импульсов. [29] Демиелинизация (потеря миелина) считается частью основы рассеянного склероза .
Холестерин связывается и влияет на управление рядом ионных каналов, таких как никотиновый ацетилхолиновый рецептор , рецептор ГАМК А и внутренний выпрямляющий калиевый канал . [30] Холестерин также активирует эстроген-связанный рецептор альфа (ERRα) и может быть эндогенным лигандом для рецептора . [31] [32] Конститутивно активная природа рецептора может быть объяснена тем фактом, что холестерин повсеместно присутствует в организме. [32] Ингибирование сигнализации ERRα путем снижения продукции холестерина было идентифицировано как ключевой медиатор эффектов статинов и бисфосфонатов на кости , мышцы и макрофаги . [31] [32] На основании этих результатов было высказано предположение, что ERRα следует десиротировать и классифицировать как рецептор холестерина. [31] [32]
Внутри клеток холестерин также является молекулой-предшественником для нескольких биохимических путей . Например, это молекула-предшественник для синтеза витамина D в метаболизме кальция и всех стероидных гормонов , включая гормоны надпочечников кортизол и альдостерон , а также половые гормоны прогестерон , эстрогены и тестостерон и их производные. [7] [33]
Роговой слой — это самый внешний слой эпидермиса. [34] [35] Он состоит из окончательно дифференцированных и энуклеированных корнеоцитов , которые находятся в липидной матрице, как «кирпичи и раствор». [34] [35] Вместе с церамидами и свободными жирными кислотами холестерин образует липидный раствор, непроницаемый для воды барьер, который предотвращает испарение воды. Как правило, эпидермальный липидный матрикс состоит из эквимолярной смеси церамидов (≈50% по весу), холестерина (≈25% по весу) и свободных жирных кислот (≈15% по весу), а также присутствуют меньшие количества других липидов. [34] [35] Холестеринсульфат достигает своей самой высокой концентрации в зернистом слое эпидермиса. Затем стероидсульфатаза сульфата снижает свою концентрацию в роговом слое, самом внешнем слое эпидермиса. [36] Относительное содержание сульфата холестерина в эпидермисе варьируется в зависимости от участка тела, при этом самая низкая концентрация наблюдается в пятке стопы. [35]
Холестерин перерабатывается в организме. Печень выделяет холестерин в желчные жидкости, которые затем хранятся в желчном пузыре , который затем выделяет их в неэтерифицированной форме (через желчь) в пищеварительный тракт. Обычно около 50% выделенного холестерина реабсорбируется тонким кишечником обратно в кровоток.
Почти все ткани животных синтезируют холестерин из ацетил-КоА . Все клетки животных (исключения существуют среди беспозвоночных) производят холестерин как для структуры мембран, так и для других целей, с относительными скоростями производства, варьирующимися в зависимости от типа клеток и функции органов. Около 80% от общего суточного производства холестерина происходит в печени и кишечнике ; [ 37] другие места с более высокими скоростями синтеза включают мозг , надпочечники и репродуктивные органы .
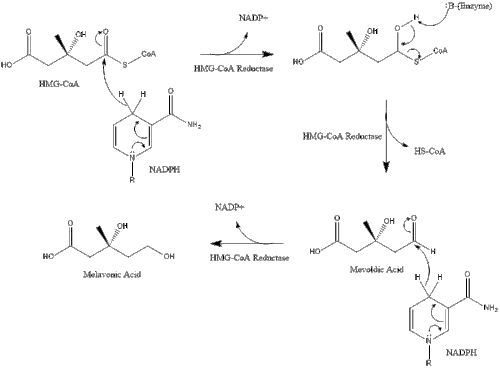
Синтез в организме начинается с мевалонатного пути , где две молекулы ацетил-КоА конденсируются с образованием ацетоацетил-КоА . Затем следует вторая конденсация между ацетил-КоА и ацетоацетил-КоА с образованием 3-гидрокси-3-метилглутарил-КоА ( HMG-CoA ). [38]

Затем эта молекула восстанавливается до мевалоната ферментом HMG-CoA-редуктазой . Производство мевалоната является лимитирующим и необратимым этапом синтеза холестерина и местом действия статинов (класса препаратов, снижающих уровень холестерина).
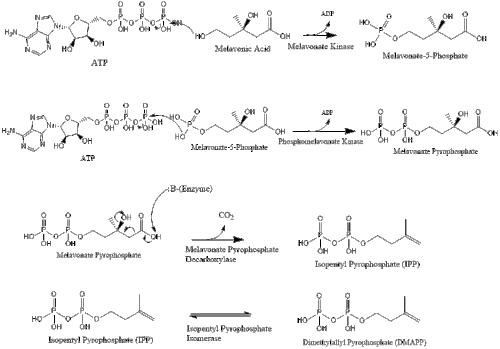
В конечном итоге мевалонат преобразуется в изопентенилпирофосфат (ИПП) через два этапа фосфорилирования и один этап декарбоксилирования, требующий АТФ .
Три молекулы изопентенилпирофосфата конденсируются, образуя фарнезилпирофосфат под действием геранилтрансферазы.
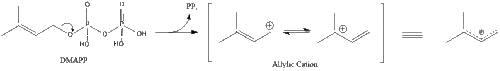

Две молекулы фарнезилпирофосфата затем конденсируются, образуя сквален под действием скваленсинтазы в эндоплазматическом ретикулуме . [38]
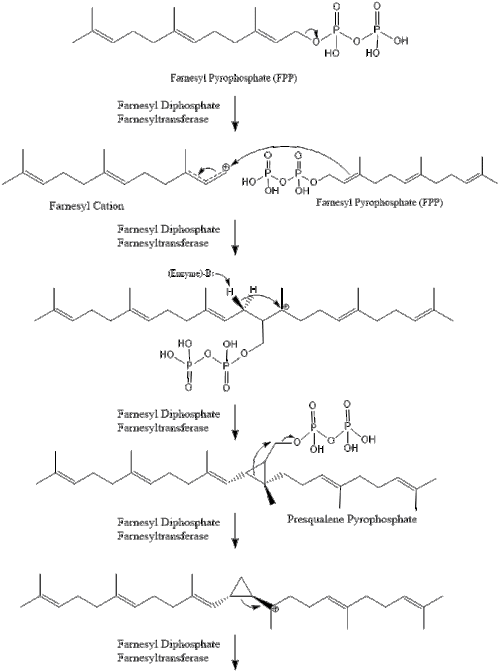
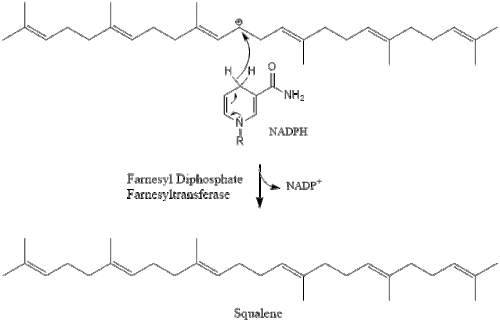
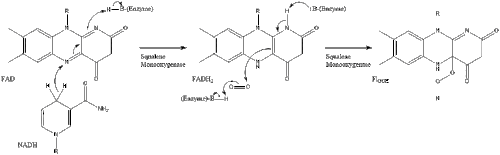
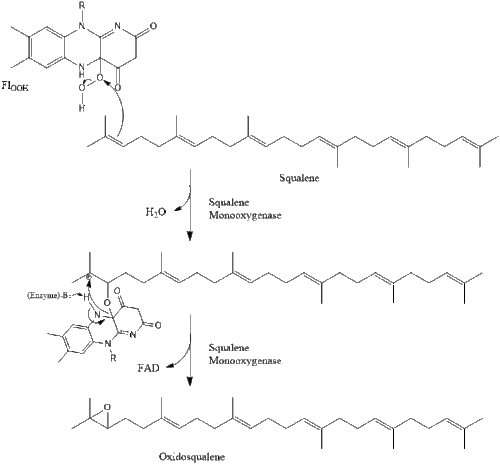
Затем оксидоскваленциклаза циклизует сквален с образованием ланостерола .
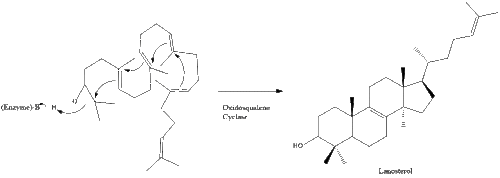
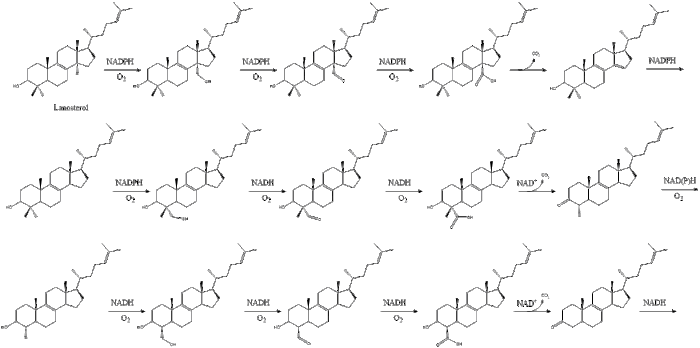
Наконец, ланостерол преобразуется в холестерин посредством одного из двух путей: пути Блоха или пути Кандуча-Рассела. [39] [40] [41] [42] [43] Последние 19 шагов к холестерину содержат НАДФН и кислород, помогающие окислять метильные группы для удаления углерода, мутазы для перемещения алкеновых групп и НАДН , помогающий восстанавливать кетоны .

Конрад Блох и Федор Линен разделили Нобелевскую премию по физиологии и медицине в 1964 году за открытия, касающиеся некоторых механизмов и методов регуляции метаболизма холестерина и жирных кислот . [44]
Биосинтез холестерина напрямую регулируется имеющимися уровнями холестерина, хотя задействованные гомеостатические механизмы изучены лишь частично. Более высокое потребление пищи приводит к чистому снижению эндогенной продукции, тогда как более низкое потребление пищи имеет противоположный эффект. Основным регуляторным механизмом является обнаружение внутриклеточного холестерина в эндоплазматическом ретикулуме белком SREBP (стерол-регуляторный элемент-связывающий белок 1 и 2). [45] В присутствии холестерина SREBP связан с двумя другими белками: SCAP ( белок, активирующий расщепление SREBP) и INSIG-1 . Когда уровень холестерина падает, INSIG-1 диссоциирует от комплекса SREBP-SCAP, что позволяет комплексу мигрировать в аппарат Гольджи . Здесь SREBP расщепляется S1P и S2P (протеаза сайта 1 и протеаза сайта 2), двумя ферментами, которые активируются SCAP, когда уровень холестерина низкий.
Затем расщепленный SREBP мигрирует в ядро и действует как фактор транскрипции для связывания с регуляторным элементом стерола (SRE), который стимулирует транскрипцию многих генов. Среди них рецептор липопротеинов низкой плотности ( LDL ) и HMG-CoA-редуктаза . Рецептор LDL удаляет циркулирующие LDL из кровотока, тогда как HMG-CoA-редуктаза приводит к увеличению эндогенной продукции холестерина. [46] Большая часть этого сигнального пути была прояснена доктором Майклом С. Брауном и доктором Джозефом Л. Голдштейном в 1970-х годах. В 1985 году они получили Нобелевскую премию по физиологии и медицине за свою работу. Их последующая работа показывает, как путь SREBP регулирует экспрессию многих генов, которые контролируют образование и метаболизм липидов, а также распределение топлива в организме.
Синтез холестерина также может быть отключен, когда уровень холестерина высок. HMG-CoA-редуктаза содержит как цитозольный домен (ответственный за его каталитическую функцию), так и мембранный домен. Мембранный домен воспринимает сигналы для его деградации. Увеличение концентрации холестерина (и других стеролов) вызывает изменение состояния олигомеризации этого домена, что делает его более восприимчивым к разрушению протеасомой . Активность этого фермента также может быть снижена путем фосфорилирования AMP-активируемой протеинкиназой . Поскольку эта киназа активируется AMP, который вырабатывается при гидролизе АТФ, следует, что синтез холестерина останавливается, когда уровень АТФ низкий. [47]

Как изолированная молекула, холестерин лишь минимально растворим в воде , или гидрофилен . Из-за этого он растворяется в крови в чрезвычайно малых концентрациях. Для эффективной транспортировки холестерин вместо этого упаковывается в липопротеины , сложные дискоидальные частицы с внешними амфифильными белками и липидами, чьи внешние поверхности растворимы в воде, а внутренние поверхности растворимы в липидах. Это позволяет ему перемещаться по крови посредством эмульгирования . Несвязанный холестерин, будучи амфипатическим, транспортируется в монослойной поверхности липопротеиновой частицы вместе с фосфолипидами и белками. С другой стороны, эфиры холестерина, связанные с жирной кислотой, транспортируются внутри жирного гидрофобного ядра липопротеина вместе с триглицеридом. [48]
В крови есть несколько типов липопротеинов. В порядке увеличения плотности это хиломикроны , липопротеины очень низкой плотности (ЛПОНП), липопротеины промежуточной плотности (ЛПСП), липопротеины низкой плотности (ЛПНП) и липопротеины высокой плотности (ЛПВП). Более низкие соотношения белок/липид делают липопротеины менее плотными. Холестерин в разных липопротеинах идентичен, хотя некоторые из них переносят его в виде его нативной «свободной» спиртовой формы (холестерин-ОН-группа, обращенная к воде, окружающей частицы), а другие — в виде жирных ацильных эфиров, известных также как эфиры холестерина, внутри частиц. [48]
Частицы липопротеинов организованы сложными аполипопротеинами , обычно 80–100 различных белков на частицу, которые могут быть распознаны и связаны специфическими рецепторами на клеточных мембранах, направляя их липидную полезную нагрузку в специфические клетки и ткани, которые в настоящее время поглощают эти частицы транспорта жира. Эти поверхностные рецепторы служат уникальными молекулярными сигнатурами, которые затем помогают определить распределение жира и доставку по всему телу. [48]
Хиломикроны, наименее плотные частицы-транспортеры холестерина, содержат в своих оболочках аполипопротеин B-48 , аполипопротеин C и аполипопротеин E (основной переносчик холестерина в мозге [49] ). Хиломикроны переносят жиры из кишечника в мышцы и другие ткани, которым нужны жирные кислоты для производства энергии или жира. Неиспользованный холестерин остается в более богатых холестерином остатках хиломикронов и оттуда поступает в кровоток печенью. [48]
Частицы ЛПОНП вырабатываются печенью из триацилглицерина и холестерина, который не использовался в синтезе желчных кислот. Эти частицы содержат аполипопротеин B100 и аполипопротеин E в своих оболочках и могут быть разрушены липопротеинлипазой на стенке артерии до IDL. Это расщепление артериальной стенки позволяет абсорбировать триацилглицерин и увеличивает концентрацию циркулирующего холестерина. Затем частицы IDL потребляются в двух процессах: половина метаболизируется HTGL и поглощается рецептором ЛПНП на поверхности клеток печени, в то время как другая половина продолжает терять триацилглицерины в кровотоке, пока они не станут частицами ЛПНП, нагруженными холестерином. [48]
Частицы ЛПНП являются основными переносчиками холестерина в крови. Каждая из них содержит приблизительно 1500 молекул эфира холестерина. Оболочки частиц ЛПНП содержат всего одну молекулу аполипопротеина B100 , распознаваемую рецепторами ЛПНП в периферических тканях. После связывания аполипопротеина B100 многие рецепторы ЛПНП концентрируются в покрытых клатрином ямках. И ЛПНП, и его рецептор образуют везикулы внутри клетки посредством эндоцитоза . Затем эти везикулы сливаются с лизосомой , где фермент лизосомальной кислой липазы гидролизует эфиры холестерина. Затем холестерин может быть использован для биосинтеза мембран или этерифицирован и сохранен внутри клетки, чтобы не мешать клеточным мембранам. [48]
Рецепторы ЛПНП расходуются во время абсорбции холестерина, а его синтез регулируется SREBP , тем же белком, который контролирует синтез холестерина de novo , в зависимости от его присутствия внутри клетки. У клетки с обильным холестерином синтез рецептора ЛПНП будет заблокирован, чтобы предотвратить захват нового холестерина в частицах ЛПНП. И наоборот, синтез рецептора ЛПНП продолжается, когда клетка испытывает дефицит холестерина. [48]
Когда этот процесс становится нерегулируемым, в крови начинают появляться частицы ЛПНП без рецепторов. Эти частицы ЛПНП окисляются и поглощаются макрофагами , которые набухают и образуют пенистые клетки. Эти пенистые клетки часто попадают в ловушку на стенках кровеносных сосудов и способствуют образованию атеросклеротических бляшек . Различия в гомеостазе холестерина влияют на развитие раннего атеросклероза (толщина интима-медиа сонной артерии). [50] Эти бляшки являются основными причинами сердечных приступов, инсультов и других серьезных медицинских проблем, что приводит к ассоциации так называемого холестерина ЛПНП (на самом деле липопротеина ) с «плохим» холестерином. [47]
Считается, что частицы ЛПВП транспортируют холестерин обратно в печень, либо для выведения, либо для других тканей, синтезирующих гормоны, в процессе, известном как обратный транспорт холестерина (ОТХ). [51] Большое количество частиц ЛПВП коррелирует с лучшими результатами для здоровья, [52] тогда как низкое количество частиц ЛПВП связано с прогрессированием атероматозного заболевания в артериях. [53]
Холестерин подвержен окислению и легко образует кислородсодержащие производные, называемые оксистеролами . Их образование может происходить по трем различным механизмам: автоокисление, вторичное окисление до перекисного окисления липидов и окисление ферментами, метаболизирующими холестерин. Большой интерес к оксистеролам возник, когда было показано, что они оказывают ингибирующее действие на биосинтез холестерина. [54] Это открытие стало известно как «гипотеза оксистерола». Дополнительные роли оксистеролов в физиологии человека включают их участие в биосинтезе желчных кислот, функцию в качестве транспортных форм холестерина и регуляцию транскрипции генов. [55]
В биохимических экспериментах используются радиоактивно меченые формы холестерина, такие как тритиевый холестерин. Эти производные подвергаются деградации при хранении, и перед использованием необходимо очистить холестерин. Холестерин можно очистить с помощью небольших колонок Sephadex LH-20. [56]
Холестерин окисляется печенью в различные желчные кислоты . [57] Они, в свою очередь, конъюгируются с глицином , таурином , глюкуроновой кислотой или сульфатом . Смесь конъюгированных и неконъюгированных желчных кислот вместе с самим холестерином выводится из печени в желчь . Примерно 95% желчных кислот реабсорбируются из кишечника, а остальная часть теряется с калом. [58] Выделение и реабсорбция желчных кислот составляют основу энтерогепатической циркуляции , которая необходима для переваривания и усвоения пищевых жиров. При определенных обстоятельствах, когда он более концентрирован, как в желчном пузыре , холестерин кристаллизуется и является основным компонентом большинства желчных камней ( также встречаются лецитиновые и билирубиновые желчные камни, но реже). [59] Каждый день в толстую кишку поступает до 1 г холестерина. Этот холестерин поступает из пищи, желчи и слущенных кишечных клеток, и он может метаболизироваться бактериями толстой кишки. Холестерин в основном преобразуется в копростанол , неабсорбируемый стерол, который выводится с калом. [ необходима цитата ]
Хотя холестерин является стероидом, обычно связанным с млекопитающими, человеческий патоген Mycobacterium tuberculosis способен полностью расщеплять эту молекулу и содержит большое количество генов, которые регулируются его присутствием. [60] Многие из этих генов, регулируемых холестерином, являются гомологами генов β-окисления жирных кислот , но эволюционировали таким образом, чтобы связывать крупные стероидные субстраты, такие как холестерин. [61] [62]
Животные жиры представляют собой сложные смеси триглицеридов с меньшим количеством молекул фосфолипидов и холестерина, из которых построены все клеточные мембраны животных (и человека). Поскольку все клетки животных вырабатывают холестерин, все продукты животного происхождения содержат холестерин в разных количествах. [63] Основными пищевыми источниками холестерина являются красное мясо , яичные желтки и цельные яйца , печень , почки , потроха , рыбий жир и сливочное масло . [64] Грудное молоко человека также содержит значительные количества холестерина. [65]
Растительные клетки синтезируют холестерин в качестве предшественника других соединений, таких как фитостерины и стероидные гликоалкалоиды , при этом холестерин остается в растительной пище только в незначительных количествах или отсутствует. [64] [66] Некоторые растительные продукты, такие как авокадо , семена льна и арахис , содержат фитостерины, которые конкурируют с холестерином за всасывание в кишечнике и снижают всасывание как пищевого, так и желчного холестерина. [67] Типичная диета содержит порядка 0,2 грамма фитостеринов, что недостаточно для существенного влияния на блокирование всасывания холестерина. Потребление фитостеринов может быть дополнено за счет использования функциональных продуктов питания, содержащих фитостерины , или диетических добавок , которые, как признано, обладают потенциалом для снижения уровня холестерина ЛПНП . [68]
В 2015 году научная консультативная группа Министерства здравоохранения и социальных служб США и Министерства сельского хозяйства США для редакции Рекомендаций по питанию для американцев 2015 года снизила ранее рекомендованный предел потребления пищевого холестерина до 300 мг в день, добавив новую рекомендацию «потреблять как можно меньше пищевого холестерина», тем самым признав связь между диетой с низким содержанием холестерина и снижением риска сердечно-сосудистых заболеваний. [69]
В отчете Американской кардиологической ассоциации и Американского колледжа кардиологии за 2013 год рекомендуется сосредоточиться на здоровых диетических моделях, а не на конкретных ограничениях холестерина, поскольку их трудно реализовать для врачей и потребителей. Они рекомендуют диету DASH и средиземноморскую диету , которые содержат мало холестерина. [70] В обзоре Американской кардиологической ассоциации за 2017 год рекомендуется заменить насыщенные жиры на полиненасыщенные жиры , чтобы снизить риск сердечно-сосудистых заболеваний . [71]
Некоторые дополнительные руководства рекомендовали дозы фитостеролов в диапазоне 1,6–3,0 грамма в день (Health Canada, EFSA, ATP III, FDA). Мета-анализ продемонстрировал 12%-ное снижение уровня холестерина ЛПНП при средней дозе 2,1 грамма в день. [72] Преимущества диеты, дополненной фитостеролами, также были поставлены под сомнение. [73]

Согласно липидной гипотезе , повышенный уровень холестерина в крови приводит к атеросклерозу , который может увеличить риск сердечного приступа , инсульта и заболевания периферических артерий . Поскольку более высокий уровень ЛПНП в крови — особенно более высокие концентрации ЛПНП и меньший размер частиц ЛПНП — вносит больший вклад в этот процесс, чем содержание холестерина в частицах ЛПВП, [8] частицы ЛПНП часто называют «плохим холестерином». Высокие концентрации функциональных ЛПВП, которые могут удалять холестерин из клеток и атером, обеспечивают защиту и обычно называются «хорошим холестерином». Эти балансы в основном определяются генетически, но могут быть изменены составом тела, лекарствами , диетой [74] и другими факторами. [75] Исследование 2007 года показало, что общий уровень холестерина в крови оказывает экспоненциальное влияние на сердечно-сосудистую и общую смертность, причем эта связь более выражена у молодых людей. Поскольку сердечно-сосудистые заболевания относительно редки у молодого населения, влияние высокого уровня холестерина на здоровье больше у пожилых людей. [76]
Повышенные уровни фракций липопротеинов, ЛПНП, ЛПНП и ЛПОНП, а не общий уровень холестерина, коррелируют со степенью и прогрессированием атеросклероза. [77] И наоборот, общий уровень холестерина может быть в пределах нормы, но при этом состоять в основном из мелких частиц ЛПНП и мелких частиц ЛПВП, при которых темпы роста атеромы высоки. Постанализ перспективных исследований IDEAL и EPIC обнаружил связь между высокими уровнями холестерина ЛПВП (с поправкой на аполипопротеин AI и аполипопротеин B) и повышенным риском сердечно-сосудистых заболеваний, что ставит под сомнение кардиопротекторную роль «хорошего холестерина». [78] [79]
Примерно у одного из 250 человек может быть генетическая мутация рецептора холестерина ЛПНП, которая вызывает у них семейную гиперхолестеринемию. [80] Наследственный высокий уровень холестерина может также включать генетические мутации в гене PCSK9 и гене аполипопротеина B. [81]
Повышенный уровень холестерина поддается лечению с помощью диеты, которая снижает или исключает насыщенные жиры, трансжиры и продукты с высоким содержанием холестерина, [82] [83] часто сопровождается одним из различных гиполипидемических средств , таких как статины , фибраты , ингибиторы абсорбции холестерина, терапия моноклональными антителами ( ингибиторы PCSK9 ), производные никотиновой кислоты или секвестранты желчных кислот. [84] Существует несколько международных рекомендаций по лечению гиперхолестеринемии. [85]
Испытания на людях с использованием ингибиторов HMG-CoA-редуктазы , известных как статины , неоднократно подтверждали, что изменение моделей транспорта липопротеинов с нездоровых на более здоровые значительно снижает частоту сердечно-сосудистых заболеваний, даже у людей со значениями холестерина, которые в настоящее время считаются низкими для взрослых. [86] Исследования показали, что снижение уровня холестерина ЛПНП примерно на 38,7 мг/дл при использовании статинов может снизить риск сердечно-сосудистых заболеваний и инсульта примерно на 21%. [87] Исследования также показали, что статины снижают прогрессирование атеромы. [88] В результате люди с историей сердечно-сосудистых заболеваний могут получить пользу от статинов независимо от уровня их холестерина (общий холестерин ниже 5,0 ммоль/л [193 мг/дл]), [89] а у мужчин без сердечно-сосудистых заболеваний есть польза от снижения аномально высокого уровня холестерина («первичная профилактика»). [90] Первичная профилактика у женщин изначально практиковалась только путем расширения результатов исследований с участием мужчин, [91] поскольку ни одно из крупных исследований статинов, проведенных до 2007 года, не продемонстрировало значительного снижения общей смертности или сердечно-сосудистых конечных точек у женщин. [92] Мета-анализы продемонстрировали значительное снижение смертности от всех причин и сердечно-сосудистой смертности без значительной гетерогенности по полу. [93]
В отчете Национальной образовательной программы по холестерину , Группы по лечению взрослых за 1987 год, предполагается, что общий уровень холестерина в крови должен быть: < 200 мг/дл нормального холестерина в крови, 200–239 мг/дл погранично высокого уровня, > 240 мг/дл высокого уровня холестерина. [94] Американская кардиологическая ассоциация предоставляет аналогичный набор рекомендаций по общему (натощак) уровню холестерина в крови и риску сердечных заболеваний: [82] Статины эффективны для снижения холестерина ЛПНП и широко используются для первичной профилактики у людей с высоким риском сердечно-сосудистых заболеваний, а также для вторичной профилактики у тех, у кого развились сердечно-сосудистые заболевания. [95] Средний общемировой уровень общего холестерина для людей оставался на уровне около 4,6 ммоль/л (178 мг/дл) для мужчин и женщин, как общий, так и стандартизированный по возрасту, в течение почти 40 лет с 1980 по 2018 год, с некоторыми региональными вариациями и снижением общего холестерина в западных странах. [96]
Более современные методы тестирования определяют холестерин ЛПНП («плохой») и ЛПВП («хороший») отдельно, что позволяет проводить более детальный анализ холестерина. Желательным считается уровень ЛПНП менее 100 мг/дл (2,6 ммоль /л). [97] [98]

Общий холестерин определяется как сумма ЛПВП, ЛПНП и ЛПОНП. Обычно измеряются только общие ЛПВП и триглицериды. По соображениям стоимости ЛПОНП обычно оценивается как одна пятая триглицеридов, а ЛПНП оценивается с использованием формулы Фридевальда (или ее варианта ) : оцененный ЛПНП = [общий холестерин] − [общий ЛПВП] − [оцененный ЛПОНП]. Прямые измерения ЛПНП используются, когда триглицериды превышают 400 мг/дл. Оцененные ЛПОНП и ЛПНП имеют большую погрешность, когда триглицериды превышают 400 мг/дл. [99]
В исследовании сердца Фрамингема каждое увеличение общего уровня холестерина на 10 мг/дл (0,6 ммоль /л) увеличивало общую смертность за 30 лет на 5% и смертность от сердечно-сосудистых заболеваний на 9%. В то время как у лиц старше 50 лет общая смертность увеличивалась на 11%, а смертность от сердечно-сосудистых заболеваний увеличивалась на 14% на падение общего уровня холестерина на 1 мг/дл (0,06 ммоль /л) в год. Исследователи приписали это явление другой корреляции , при которой само заболевание увеличивает риск смерти, а также изменяет множество факторов, таких как потеря веса и невозможность есть, которые снижают уровень холестерина в сыворотке. [100] Этот эффект также был показан у мужчин всех возрастов и женщин старше 50 лет в Программе мониторинга и укрепления здоровья Форарльберга. Эти группы с большей вероятностью умирали от рака, заболеваний печени и психических заболеваний с очень низким общим уровнем холестерина, 186 мг/дл (10,3 ммоль /л) и ниже. Этот результат указывает на то, что эффект низкого уровня холестерина наблюдается даже среди молодых респондентов, что противоречит предыдущей оценке среди групп пожилых людей, согласно которой это является маркером слабости, возникающей с возрастом. [101]
Аномально низкие уровни холестерина называются гипохолестеринемией . Исследования причин этого состояния относительно ограничены, но некоторые исследования предполагают связь с депрессией , раком и кровоизлиянием в мозг . В целом, низкие уровни холестерина, по-видимому, являются следствием, а не причиной основного заболевания. [76] Генетический дефект синтеза холестерина вызывает синдром Смита-Лемли-Опица , который часто связан с низким уровнем холестерина в плазме. Гипертиреоз или любое другое эндокринное нарушение, вызывающее повышенную регуляцию рецептора ЛПНП , может привести к гипохолестеринемии. [102]
Американская кардиологическая ассоциация рекомендует людям в возрасте 20 лет и старше проверять уровень холестерина каждые 4–6 лет. [103] Отдельный набор рекомендаций Американской кардиологической ассоциации, выпущенный в 2013 году, указывает, что люди, принимающие статины , должны проверять уровень холестерина через 4–12 недель после первой дозы, а затем каждые 3–12 месяцев после этого. [104] [105] Мужчинам в возрасте от 45 до 65 лет и женщинам в возрасте от 55 до 65 лет тест на холестерин следует проводить каждые 1–2 года, а пожилым людям старше 65 лет — ежегодно. [104]
Образец крови берется медицинским работником из вены руки после 12 часов голодания для измерения липидного профиля для a) общего холестерина, b) холестерина ЛПВП, c) холестерина ЛПНП и d) триглицеридов . [3] [104] Результаты могут быть выражены как «расчетные», что означает расчет общего холестерина, ЛПВП и триглицеридов. [3]
Холестерин тестируется для определения «нормального» или «желательного» уровня, если у человека общий холестерин составляет 5,2 ммоль/л или менее (200 мг/дл), значение ЛПВП более 1 ммоль/л (40 мг/дл, «чем выше, тем лучше»), значение ЛПНП менее 2,6 ммоль/л (100 мг/дл) и уровень триглицеридов менее 1,7 ммоль/л (150 мг/дл). [104] [3] Уровень холестерина в крови у людей с определенным образом жизни, старением или сердечно-сосудистыми факторами риска, такими как сахарный диабет , гипертония , семейный анамнез ишемической болезни сердца или стенокардии , оценивается на разных уровнях. [104]
Нажмите на гены, белки и метаболиты ниже, чтобы перейти к соответствующим статьям. [§ 1]
Известно, что некоторые производные холестерина (среди других простых холестерических липидов) генерируют жидкокристаллическую «холестерическую фазу». Холестерическая фаза, по сути, является хиральной нематической фазой , и она меняет цвет при изменении температуры. Это делает производные холестерина полезными для индикации температуры в жидкокристаллических дисплеях термометров и в термочувствительных красках. [ необходима цитата ]

Холестерин имеет 256 стереоизомеров , которые возникают из его восьми стереоцентров, хотя только два из стереоизомеров имеют биохимическое значение ( нат -холестерин и энт -холестерин, для натурального и энантиомерного соответственно) [106] [107] и только один встречается в природе ( нат -холестерин).
Je nommerai
cholesterine
, de χολη, желчь, et στερεος, Solide, la вещество cristallisée des Calculs biliares humanes, ...[назову холестерин – от χολη (желчь) и στερεος (твердое) – кристаллизованное вещество из желчных камней человека.. .]