Термодинамическая температура — это величина, определенная в термодинамике в отличие от кинетической теории или статистической механики .
Исторически термодинамическая температура была определена лордом Кельвином с точки зрения макроскопической связи между термодинамической работой и теплопередачей , как это определено в термодинамике, но кельвин был переопределен международным соглашением в 2019 году с точки зрения явлений, которые теперь понимаются как проявления кинетической энергии. свободного движения микроскопических частиц, таких как атомы, молекулы и электроны. С термодинамической точки зрения, по историческим причинам, из-за того, как оно определяется и измеряется, это микроскопическое кинетическое определение считается «эмпирической» температурой. Она была принята потому, что на практике ее обычно можно измерить точнее, чем термодинамическую температуру Кельвина.
Нулевая термодинамическая температура имеет особое значение для третьего закона термодинамики . По соглашению, температура указывается по шкале Кельвина , единицей измерения которой является кельвин (символ единицы измерения: К). Для сравнения, температура 295 К соответствует 21,85 °С и 71,33 °F.
Термодинамическая температура, в отличие от температуры SI, определяется в терминах макроскопического цикла Карно. Термодинамическая температура имеет важное значение в термодинамике, поскольку она определяется чисто термодинамически. Температура SI концептуально сильно отличается от термодинамической температуры. Термодинамическая температура была строго определена исторически задолго до того, как появились достоверные знания о микроскопических частицах, таких как атомы, молекулы и электроны.
Международная система единиц (СИ) определяет международную абсолютную шкалу измерения температуры и единицу измерения кельвин (символ единицы измерения: К) для определенных значений по шкале. Кельвин также используется для обозначения температурных интервалов (диапазона или разницы между двумя температурами), как показано в следующем примере использования: «Припой олово/свинец 60/40 не является эвтектическим и пластичным в диапазоне температур 5 К по мере затвердевания. ." Температурный интервал в один градус Цельсия равен одному кельвину.
Величина кельвина была переопределена в 2019 году в отношении физического свойства, лежащего в основе термодинамической температуры: кинетической энергии движения атомных свободных частиц. Переопределение зафиксировало постоянную Больцмана точно на уровне1,380 649 × 10 −23 джоулей на кельвин (Дж/К). [1]
Микроскопическое свойство, которое наделяет материальные вещества температурой, можно легко понять, исследуя закон идеального газа , который, согласно постоянной Больцмана, связывает то, как тепловая энергия вызывает точно определенные изменения давления и температуры некоторых газов. Это связано с тем, что одноатомные газы , такие как гелий и аргон , ведут себя кинетически как свободно движущиеся совершенно упругие и сферические бильярдные шары, которые движутся только в определенном подмножестве возможных движений, которые могут произойти в материи: включающем три поступательные степени свободы . Поступательные степени свободы — это знакомые движения, подобные бильярдному шару, вдоль осей X, Y и Z трехмерного пространства (см. рис. 1 ниже). Вот почему все благородные газы имеют одинаковую удельную теплоемкость на атом и почему это значение является самым низким среди всех газов.
Молекулы (два или более химически связанных атома), однако, имеют внутреннюю структуру и, следовательно, имеют дополнительные внутренние степени свободы (см. рис. 3 ниже), что заставляет молекулы поглощать больше тепловой энергии при любом заданном повышении температуры, чем одноатомные молекулы. газы. Тепловая энергия рождается во всех доступных степенях свободы; это соответствует теореме о равнораспределении , поэтому все доступные внутренние степени свободы имеют ту же температуру, что и их три внешние степени свободы. Однако свойство, которое придает всем газам их давление , которое представляет собой результирующую силу на единицу площади, действующую на контейнер, возникающую в результате отскока от него частиц газа, является функцией кинетической энергии, заключенной в трех степенях поступательного движения свободно движущихся атомов и молекул. свободы. [2]
Фиксация константы Больцмана на определенном значении, наряду с установлением других правил, позволила точно установить величину единичного интервала температуры SI, кельвина, с точки зрения среднего кинетического поведения благородных газов. Более того, была подтверждена отправная точка термодинамической температурной шкалы, абсолютный ноль, как точка, в которой в образце остается нулевая средняя кинетическая энергия ; единственное оставшееся движение частицы состоит из случайных вибраций, вызванных энергией нулевой точки.
Температурные шкалы числовые. Числовой ноль температурной шкалы не связан с абсолютным нулем температуры. Тем не менее, в некоторых температурных шкалах числовой нуль совпадает с абсолютным нулем температуры. Примерами являются Международная температурная шкала СИ, температурная шкала Ренкина и термодинамическая температурная шкала. Другие температурные шкалы имеют числовой нуль, далекий от абсолютного нуля температуры. Примерами являются шкала Фаренгейта и шкала Цельсия.
В нулевой точке термодинамической температуры, абсолютном нуле , частицы, составляющие материю, имеют минимальное движение и не могут стать холоднее. [3] [4] Абсолютный ноль, то есть температура в ноль кельвинов (0 К), точно соответствует –273,15 °C и –459,67 °F. Материя при абсолютном нуле не имеет оставшейся передаваемой средней кинетической энергии, и единственное оставшееся движение частиц обусловлено постоянно распространяющимся квантово-механическим явлением, называемым ZPE ( энергия нулевой точки ). [5] Хотя атомы, например, в контейнере с жидким гелием , находящимся точно при абсолютном нуле, все равно слегка толкались бы из-за энергии нулевой точки, теоретически совершенная тепловая машина с таким гелием в качестве одного из рабочих тел никогда не могла бы перемещать любая чистая кинетическая энергия ( тепловая энергия ) передается другому рабочему телу, и никакая термодинамическая работа не может произойти.
Температура обычно выражается в абсолютных величинах при научном изучении взаимосвязей температуры с некоторыми другими физическими свойствами материи, такими как ее объем или давление (см. Закон Гей-Люссака ) или длина волны испускаемого ею излучения черного тела . Абсолютная температура также полезна при расчете скорости химических реакций (см. уравнение Аррениуса ). Кроме того, абсолютная температура обычно используется в криогенике и связанных с ней явлениях, таких как сверхпроводимость , как показано в следующем примере: «Удобно, что температура перехода тантала ( T c ) 4,4924 Кельвина немного выше точки кипения гелия 4,2221 К».
Константа Больцмана и связанные с ней формулы описывают область кинетики частиц и векторов скорости, тогда как ZPE ( энергия нулевой точки ) — это энергетическое поле, которое толкает частицы способами, описанными математикой квантовой механики. При атомных и молекулярных столкновениях в газах ZPE вносит определенную степень хаоса , т. е. непредсказуемости, в кинетику отскока; вполне вероятно, что после данного столкновения движение частиц, вызванное ZPE, будет меньше , чем больше . Именно случайный характер ZPE является причиной того, что он не оказывает общего влияния ни на давление, ни на объем любого объемного количества (статистически значимого количества частиц) газов. Однако при температуре Т = 0 конденсируется вещество ; например, в твердых телах и жидкостях ZPE вызывает межатомные столкновения там, где в противном случае атомы были бы совершенно неподвижными. Поскольку реальное воздействие, которое ZPE оказывает на вещества, может меняться по мере изменения термодинамической системы (например, из-за ZPE гелий не замерзнет, если не окажется под давлением не менее 2,5 МПа (25 бар )), ZPE во многом является формой тепловой энергии и может быть правильно включен при подсчете внутренней энергии вещества.
Хотя на протяжении всей истории существовало множество других температурных шкал , существовало только две шкалы для измерения термодинамической температуры, где абсолютный ноль является их нулевой точкой (0): шкала Кельвина и шкала Ренкина .
Во всем научном мире, где современные измерения почти всегда производятся с использованием Международной системы единиц, термодинамическая температура измеряется по шкале Кельвина. Шкала Рэнкина является частью английских инженерных единиц в Соединенных Штатах и находит применение в определенных инженерных областях, особенно в устаревших справочных изданиях. В качестве единицы измерения в шкале Рэнкина используется градус Рэнкина (обозначение: °R), который соответствует той же величине, что и градус Фаренгейта (обозначение: °F).
Приращение единицы измерения в один кельвин ровно в 1,8 раза превышает один градус Рэнкина; таким образом, чтобы преобразовать определенную температуру по шкале Кельвина в шкалу Ренкина, x K = 1,8 x °R , а для преобразования температуры по шкале Ренкина в шкалу Кельвина, x ° R = x /1,8 K. Следовательно, абсолютный ноль равен «0» для обеих шкал, а температура плавления водяного льда (0 °С и 273,15 К) равна 491,67 °R.
Для преобразования температурных интервалов (диапазона или разницы между двумя температурами) используются те же формулы из предыдущего параграфа; например, диапазон в 5 кельвинов точно равен диапазону в 9 градусов Ренкина.
В течение 65 лет, с 1954 года по переопределение базовых единиц СИ в 2019 году , температурный интервал в один кельвин определялся как1/273,16разница между тройной точкой воды и абсолютным нулем. Резолюция Международного бюро мер и весов 1954 года (известная под аббревиатурой BIPM на французском языке), а также более поздние резолюции и публикации определили тройную точку воды как точно 273,16 К и признали, что принятие этого значения является «обычной практикой». Из-за предыдущих соглашений (а именно, что 0 ° C долгое время определялся как температура плавления воды и что тройная точка воды уже давно была экспериментально определена как неотличимо близкая к 0,01 ° C), разница между шкалой Цельсия и Шкала Кельвина принята равной 273,15 Кельвина; то есть 0 ° C соответствует 273,15 Кельвина. [6] Конечный эффект этой, а также более поздних резолюций был двояким: 1) они определили абсолютный ноль как точно 0 К и 2) они определили, что тройная точка специальной изотопно-контролируемой воды, называемой Венским стандартом средней океанской воды, возникает точно при температуре 273,16 К и 0,01 °С. Одним из последствий вышеупомянутых решений было то, что температура плавления воды, хотя и была очень близка к 273,15 К и 0 °C, не была определяющей величиной и подлежала уточнению с помощью более точных измерений.
Стандарт BIPM 1954 года хорошо справился с определением (с учетом неопределенностей, связанных с изотопными различиями между пробами воды) температур вокруг точки замерзания и тройной точки воды, но требовал, чтобы промежуточные значения между тройной точкой и абсолютным нулем, а также экстраполированные значения от комнатной температуры и выше, что будет определено экспериментально с помощью аппаратуры и процедур в отдельных лабораториях. Этот недостаток был устранен с помощью Международной температурной шкалы 1990 года , или ITS-90, которая определила 13 дополнительных точек от 13,8033 К до 1357,77 К. Несмотря на определение, ITS-90 имела – и до сих пор имеет – некоторые проблемы, отчасти потому, что восемь из его экстраполированные значения зависят от температур плавления или замерзания образцов металлов, которые должны оставаться чрезвычайно чистыми, чтобы не повлиять на их температуры плавления или замерзания - обычно заниженные.
Переопределение базовых единиц СИ в 2019 году было в первую очередь направлено на отделение большей части определений системы СИ от килограмма , который был последним физическим артефактом, определяющим базовую единицу СИ (платиново-иридиевый цилиндр, хранящийся под тремя вложенными колпаками в сейф, расположенный во Франции) и стабильность которого была весьма сомнительной. Решение потребовало, чтобы четыре физические константы, включая постоянную Больцмана, были фиксированы по определению.
Присвоение константе Больцмана точно определенного значения не оказало практического влияния на современную термометрию, за исключением самых точных измерений. До переопределения тройная точка воды составляла ровно 273,16 К и 0,01 ° C, а константа Больцмана была экспериментально определена как1,380 649 03 (51) × 10 -23 Дж/К , где «(51)» обозначает неопределенность в двух младших цифрах (03) и соответствует относительной стандартной неопределенности 0,37 частей на миллион. [7] После этого, определив константу Больцмана точно как1,380 649 × 10 -23 Дж/К , неопределенность 0,37 ppm была перенесена в тройную точку воды, которая стала экспериментально определенной величиной273,1600 ± 0,0001 К (0,0100 ± 0,0001 °С ). То, что тройная точка воды после переопределения системы SI оказалась чрезвычайно близкой к 273,16 К, не было случайностью; окончательное значение постоянной Больцмана было частично определено посредством умных экспериментов с аргоном и гелием, в которых тройная точка воды использовалась в качестве ключевой эталонной температуры. [8] [9]
Несмотря на новое определение в 2019 году, водные трехточечные ячейки продолжают служить в современной термометрии в качестве чрезвычайно точных эталонов для калибровки при 273,16 К и 0,01 °C. Более того, тройная точка воды остается одной из 14 калибровочных точек, составляющих ITS-90, которая простирается от тройной точки водорода (13,8033 К) до точки замерзания меди (1357,77 К), что почти в стократном диапазоне термодинамических значений. температура.
Термодинамическая температура любого объемного количества вещества (статистически значимого количества частиц) прямо пропорциональна средней средней кинетической энергии определенного вида движения частиц, известного как поступательное движение . Эти простые движения в трех измерениях пространства по осям X, Y и Z означают, что частицы движутся в трех пространственных степенях свободы . Эту особую форму кинетической энергии иногда называют кинетической температурой . Поступательное движение — это всего лишь одна из форм тепловой энергии, именно оно придает газам не только температуру, но и давление и большую часть их объема. Эта связь между температурой, давлением и объемом газов устанавливается формулой закона идеального газа pV = nRT и воплощается в газовых законах .
Хотя кинетическая энергия, приходящаяся исключительно на три поступательные степени свободы, включает термодинамическую температуру вещества, молекулы, как видно на рис. 3, могут иметь и другие степени свободы, все из которых подпадают под три категории: длина связи, валентный угол и вращательный. Все три дополнительные категории не обязательно доступны всем молекулам, и даже те молекулы, которые могут испытывать все три, некоторые из них могут быть «заморожены» при температуре ниже определенной. Тем не менее, все те степени свободы, которые доступны молекулам при определенном наборе условий, вносят вклад в удельную теплоемкость вещества; иными словами, они увеличивают количество тепла (кинетической энергии), необходимое для поднятия данного количества вещества на один кельвин или один градус Цельсия.
Связь кинетической энергии, массы и скорости дается формулой E k = 1/2МВ 2 . [10] Соответственно, частицы с одной единицей массы, движущиеся с одной единицей скорости, имеют точно такую же кинетическую энергию и точно ту же температуру, что и частицы с вчетверо большей массой, но вдвое меньшей скоростью.
Степень, в которой кинетическая энергия поступательного движения в статистически значимом наборе атомов или молекул в газе способствует давлению и объему этого газа, является пропорциональной функцией термодинамической температуры, установленной постоянной Больцмана (обозначение : k B ) . . Постоянная Больцмана также связывает термодинамическую температуру газа со средней кинетической энергией поступательного движения отдельных частиц следующим образом:
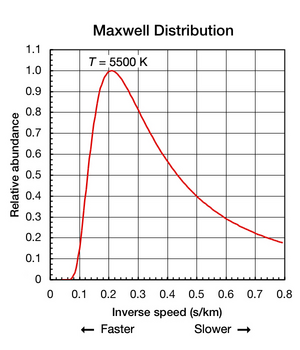
Хотя константа Больцмана полезна для определения средней кинетической энергии в образце частиц, важно отметить, что даже когда вещество изолировано и находится в термодинамическом равновесии (все части имеют одинаковую температуру и тепло не поступает внутрь или наружу). Из этого следует, что поступательное движение отдельных атомов и молекул происходит в широком диапазоне скоростей (см. анимацию на рис. 1 выше). В любой момент времени доля частиц, движущихся с заданной скоростью в этом диапазоне, определяется вероятностью, описываемой распределением Максвелла-Больцмана . График, показанный здесь на рис. 2, показывает распределение скоростей атомов гелия с температурой 5500 К. Их наиболее вероятная скорость составляет 4,780 км/с (0,2092 с/км). Однако определенная часть атомов в любой данный момент движутся быстрее, тогда как другие движутся относительно медленно; некоторые на мгновение практически остановились (от оси X вправо). На этом графике используется обратная скорость для оси X , поэтому форму кривой можно легко сравнить с кривыми на рисунке 5 ниже. На обоих графиках ноль на оси x представляет бесконечную температуру. Кроме того, оси x и y на обоих графиках масштабируются пропорционально.
Хотя для непосредственного обнаружения поступательных движений требуется очень специализированное лабораторное оборудование, возникающие в результате столкновения атомов или молекул с мелкими частицами, взвешенными в жидкости, вызывают броуновское движение , которое можно увидеть в обычный микроскоп. Поступательные движения элементарных частиц очень быстрые [11] , и для их непосредственного наблюдения необходимы температуры, близкие к абсолютному нулю . Например, когда в 1994 году ученые из НИСТ достигли рекордной температуры холода в 700 нК (миллиардные доли Кельвина), они использовали лазерное оборудование на оптической решетке для адиабатического охлаждения атомов цезия . Затем они выключили захватывающие лазеры и непосредственно измерили скорость атомов 7 мм в секунду, чтобы вычислить их температуру. [12] Формулы для расчета скорости и скорости поступательного движения приведены в следующей сноске. [13]
Нетрудно представить движение атомов, обусловленное кинетической температурой, и отличить такие движения от движений, вызванных нулевой энергией. Рассмотрим следующий гипотетический мысленный эксперимент, показанный на рис. 2.5 слева, с атомом, чрезвычайно близким к абсолютному нулю. Представьте себе, что вы смотрите в обычный оптический микроскоп с увеличением 400, что соответствует максимальному практическому увеличению для оптических микроскопов. Такие микроскопы обычно обеспечивают поле зрения диаметром чуть более 0,4 мм. В центре поля зрения находится одинокий левитирующий атом аргона (аргон составляет около 0,93% воздуха), который освещается и светится на темном фоне. Если бы этот атом аргона находился на рекордной высоте в одну триллионную кельвина выше абсолютного нуля [14] и двигался перпендикулярно полю зрения вправо, ему потребовалось бы 13,9 секунды, чтобы переместиться из центра изображение до отметки 200 микрон; это расстояние примерно такое же, как ширина точки в конце этого предложения на современных компьютерных мониторах. Поскольку атом аргона медленно двигался, позиционное дрожание из-за энергии нулевой точки было бы намного меньше, чем разрешение оптического микроскопа с разрешением 200 нанометров (0,0002 мм). Важно отметить, что поступательная скорость атома, составляющая 14,43 микрона в секунду, составляет всю его оставшуюся кинетическую энергию, поскольку она не находится точно в абсолютном нуле. Если бы атом находился точно в абсолютном нуле, незаметные толчки, вызванные энергией нулевой точки, заставили бы его очень слегка блуждать, но атом в среднем постоянно находился бы в одном и том же месте в поле зрения. Это аналогично лодке, у которой выключили мотор и теперь она слегка покачивается в относительно спокойных и безветренных океанских водах; даже несмотря на то, что лодку беспорядочно дрейфует взад и вперед, она остается на одном и том же месте в течение длительного времени и не продвигается по воде. Соответственно, атом, находящийся точно в абсолютном нуле, не будет «неподвижным», и тем не менее статистически значимая совокупность таких атомов будет иметь нулевую чистую кинетическую энергию, доступную для передачи любому другому набору атомов. Это связано с тем, что независимо от кинетической температуры второй группы атомов, они тоже испытывают воздействие нулевой энергии. Таковы следствия статистической механики и природы термодинамики.
Как упоминалось выше, есть и другие способы, которыми молекулы могут покачиваться, помимо трех поступательных степеней свободы, которые наделяют вещества своей кинетической температурой. Как видно на анимации справа, молекулы — это сложные объекты; они представляют собой совокупность атомов, и термическое перемешивание может напрягать их внутренние химические связи тремя различными способами: посредством вращения, изменения длины связи и изменения валентного угла; это все виды внутренних степеней свободы . Это отличает молекулы от одноатомных веществ (состоящих из отдельных атомов), таких как благородные газы гелий и аргон , которые имеют только три поступательные степени свободы (оси X, Y и Z). Кинетическая энергия хранится во внутренних степенях свободы молекул, что придает им внутреннюю температуру . Несмотря на то, что эти движения называются «внутренними», внешние части молекул все равно движутся — подобно покачиванию неподвижного воздушного шара с водой . Это обеспечивает двусторонний обмен кинетической энергией между внутренними движениями и поступательными движениями при каждом молекулярном столкновении. Соответственно, по мере отвода внутренней энергии от молекул одновременно уменьшаются в равных пропорциях и их кинетическая температура (кинетическая энергия поступательного движения), и их внутренняя температура. Это явление описывается теоремой равнораспределения , которая утверждает, что для любого объемного количества вещества, находящегося в равновесии, кинетическая энергия движения частицы равномерно распределяется между всеми активными степенями свободы, доступными частицам. Поскольку внутренняя температура молекул обычно равна их кинетической температуре, различие обычно представляет интерес только при детальном изучении явлений нелокального термодинамического равновесия (ЛТР), таких как горение , сублимация твердых тел и диффузия горячих газов. в частичном вакууме.
Кинетическая энергия, запасенная внутри молекул, заставляет вещества содержать больше тепловой энергии при любой заданной температуре и поглощать дополнительную внутреннюю энергию при заданном повышении температуры. Это связано с тем, что любая кинетическая энергия, которая в данный момент связана во внутренних движениях, не способствует поступательному движению молекул в тот же момент. [15] Эта дополнительная кинетическая энергия просто увеличивает количество внутренней энергии, которую вещество поглощает при данном повышении температуры. Это свойство известно как удельная теплоемкость вещества .
Разные молекулы поглощают разное количество внутренней энергии при каждом постепенном повышении температуры; то есть они имеют разную удельную теплоемкость. Высокая удельная теплоемкость возникает отчасти потому, что молекулы некоторых веществ обладают большим количеством внутренних степеней свободы, чем другие. Например, азот при комнатной температуре , который представляет собой двухатомную молекулу, имеет пять активных степеней свободы: три включают поступательное движение плюс две внутренние вращательные степени свободы. Неудивительно, что в соответствии с теоремой о равнораспределении азот имеет пять третей удельной теплоемкости на моль (определенное количество молекул), как и одноатомные газы. [16] Другим примером является бензин (см. таблицу , показывающую его удельную теплоемкость). Бензин может поглощать большое количество тепловой энергии на моль при лишь незначительном изменении температуры, поскольку каждая молекула состоит в среднем из 21 атома и, следовательно, имеет множество внутренних степеней свободы. Даже более крупные и сложные молекулы могут иметь десятки внутренних степеней свободы.
Теплопроводность – это диффузия тепловой энергии от горячих частей системы к холодным. Система может представлять собой либо единый объемный объект, либо множество дискретных объемных объектов. Термин «масса» в этом контексте означает статистически значимое количество частиц (которое может быть микроскопическим). Всякий раз, когда тепловая энергия распространяется внутри изолированной системы, разница температур внутри системы уменьшается (и энтропия увеличивается).
Один конкретный механизм теплопроводности возникает, когда поступательное движение (движение частиц, лежащее в основе температуры) передает импульс от частицы к частице при столкновениях. В газах эти поступательные движения имеют природу, показанную выше на рис. 1 . Как можно видеть на этой анимации, не только импульс (тепло) распространяется по объему газа посредством последовательных столкновений, но и целые молекулы или атомы могут двигаться вперед на новую территорию, неся с собой свою кинетическую энергию. Следовательно, разница температур в газах очень быстро выравнивается, особенно для легких атомов или молекул; конвекция еще больше ускоряет этот процесс. [17]
Однако поступательное движение в твердых телах принимает форму фононов (см. рис. 4 справа). Фононы — это ограниченные квантованные волновые пакеты, которые движутся со скоростью звука данного вещества. Способ взаимодействия фононов внутри твердого тела определяет множество его свойств, в том числе теплопроводность. В электроизолирующих твердых телах фононная теплопроводность обычно неэффективна [18] , и такие твердые тела считаются теплоизоляторами (например, стекло, пластик, резина, керамика и камень). Это связано с тем, что в твердых телах атомы и молекулы зафиксированы на своих местах относительно своих соседей и не могут свободно перемещаться.
Однако металлы не ограничиваются только фононной теплопроводностью. Тепловая энергия проходит через металлы необычайно быстро, поскольку вместо прямых столкновений между молекулами подавляющее большинство тепловой энергии передается через очень легкие, подвижные электроны проводимости . Вот почему существует почти идеальная корреляция между теплопроводностью металлов и их электропроводностью . [19] Электроны проводимости придают металлам необычайную проводимость, поскольку они делокализованы (т.е. не привязаны к конкретному атому) и ведут себя скорее как своего рода квантовый газ из-за эффектов нулевой энергии (подробнее о ZPE см. Примечание 1 ниже). Кроме того , электроны относительно легкие, их масса покоя составляет всего 1/1836 массы протона . Это примерно такое же соотношение, как у короткой пули .22 (29 гран или 1,88 г ) по сравнению с винтовкой, из которой она стреляет. Как писал Исаак Ньютон в своем третьем законе движения :
Закон №3: Все силы действуют парами, и эти две силы равны по величине и противоположны по направлению.
Однако при равной силе пуля ускоряется быстрее, чем винтовка. Поскольку кинетическая энергия увеличивается пропорционально квадрату скорости, почти вся кинетическая энергия переходит в пулю, а не в винтовку, хотя обе они испытывают одинаковую силу со стороны расширяющихся пороховых газов. Точно так же, поскольку они гораздо менее массивны, тепловая энергия легко переносится подвижными электронами проводимости. Кроме того, поскольку они делокализованы и очень быстры, кинетическая тепловая энергия очень быстро проходит через металлы с большим количеством электронов проводимости.

Тепловое излучение является побочным продуктом столкновений, возникающих в результате различных колебательных движений атомов. Эти столкновения заставляют электроны атомов испускать тепловые фотоны (известные как излучение черного тела ). Фотоны испускаются каждый раз, когда электрический заряд ускоряется (как это происходит при столкновении электронных облаков двух атомов). Даже отдельные молекулы с внутренней температурой выше абсолютного нуля также излучают излучение черного тела от своих атомов. В любом объемном количестве вещества, находящегося в равновесии, фотоны черного тела излучаются в диапазоне длин волн в спектре, имеющем форму колоколообразной кривой, называемую кривой Планка (см. график на рис. 5 справа). Вершина кривой Планка ( пиковая длина волны эмиттанса ) расположена в определенной части электромагнитного спектра в зависимости от температуры черного тела. Вещества при экстремальных криогенных температурах излучают длинные радиоволны, тогда как при очень высоких температурах производятся короткие гамма-лучи (см. Таблицу обычных температур ).
Излучение черного тела рассеивает тепловую энергию по всему веществу, поскольку фотоны поглощаются соседними атомами, передавая при этом импульс. Фотоны черного тела также легко покидают вещество и могут быть поглощены окружающей средой; кинетическая энергия при этом теряется.
Как установлено законом Стефана-Больцмана , интенсивность излучения черного тела увеличивается как четвертая степень абсолютной температуры. Таким образом, черное тело при температуре 824 К (чуть меньше светящегося тускло-красным) излучает в 60 раз большую мощность излучения , чем при 296 К (комнатная температура). Вот почему так легко почувствовать лучистое тепло от горячих предметов на расстоянии. При более высоких температурах, например, в лампе накаливания , излучение черного тела может быть основным механизмом выхода тепловой энергии из системы.
В таблице ниже показаны различные точки термодинамической шкалы в порядке возрастания температуры.

Кинетическая энергия движения частиц является лишь одним из факторов, вносящих вклад в общую тепловую энергию вещества; другой — фазовые переходы , которые представляют собой потенциальную энергию молекулярных связей, которые могут образовываться в веществе при его охлаждении (например, при конденсации и замерзании ). Тепловая энергия, необходимая для фазового перехода, называется скрытой теплотой . Это явление легче понять, рассматривая его в обратном направлении: скрытая теплота — это энергия, необходимая для разрыва химических связей (например, во время испарения и плавления ). Почти каждый знаком с эффектами фазовых переходов; например, пар температурой 100 °C может вызвать серьезные ожоги гораздо быстрее, чем воздух температурой 100 °C из фена . Это происходит потому, что при конденсации пара в жидкую воду на коже выделяется большое количество скрытого тепла.
Несмотря на то, что тепловая энергия высвобождается или поглощается во время фазовых переходов, чистые химические элементы , соединения и эвтектические сплавы не претерпевают никаких изменений температуры во время этих переходов (см. рис. 7 внизу справа). Рассмотрим один конкретный тип фазового перехода: плавление. Когда твердое тело плавится, химические связи кристаллической решетки разрываются; вещество переходит из так называемого более упорядоченного состояния в менее упорядоченное . На рис. 7 таяние льда показано в левом нижнем поле с цветом от синего к зеленому.
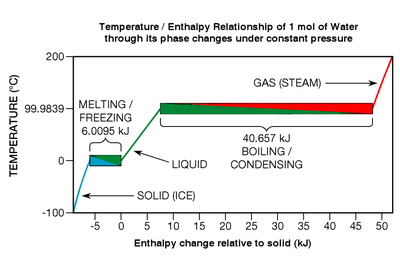
В одной конкретной термодинамической точке, температуре плавления (которая в случае воды составляет 0 °C в широком диапазоне давлений), все атомы или молекулы в среднем находятся на максимальном энергетическом пороге, который их химические связи могут выдержать, не разрываясь. из решетки. Химические связи представляют собой силы, действующие по принципу «все или ничего»: они либо держатся крепко, либо разрываются; никакого промежуточного состояния нет. Следовательно, когда вещество находится при температуре плавления, каждый джоуль добавленной тепловой энергии лишь разрывает связи определенного количества его атомов или молекул, [33] превращая их в жидкость точно такой же температуры; к поступательному движению не добавляется кинетическая энергия (именно это придает веществу температуру). Эффект похож на попкорн : при определенной температуре дополнительная тепловая энергия не может сделать ядра более горячими, пока переход (хлопанье) не завершится. Если процесс обратный (как при замерзании жидкости), от вещества необходимо отвести тепловую энергию.
Как говорилось выше, тепловая энергия, необходимая для фазового перехода, называется скрытой теплотой . В конкретных случаях плавления и замерзания это называется энтальпией плавления или теплотой плавления . Если молекулярные связи в кристаллической решетке прочные, теплота плавления может быть относительно высокой, обычно в диапазоне от 6 до 30 кДж на моль для воды и большинства металлических элементов. [34] Если вещество представляет собой один из одноатомных газов (которые имеют мало склонности к образованию молекулярных связей), теплота плавления более скромная и варьируется от 0,021 до 2,3 кДж на моль. [35] Условно говоря, фазовые переходы могут быть действительно энергетическими событиями. Чтобы полностью растопить лед при 0 °C в воду при 0 °C, необходимо добавить примерно в 80 раз больше тепловой энергии, чем требуется для повышения температуры той же массы жидкой воды на один градус Цельсия. Соотношения металлов еще выше, обычно в диапазоне от 400 до 1200 раз. [36] И фазовый переход кипения гораздо более энергичный, чем замерзание. Например, энергия, необходимая для полного кипячения или испарения воды (так называемая энтальпия испарения ), примерно в 540 раз превышает энергию, необходимую для повышения температуры на один градус. [37]
Значительная энтальпия испарения воды является причиной того, что кожу можно обжечь так быстро, когда на ней конденсируется пар (от красного к зеленому на рис. 7 выше); водяные пары (газовая фаза) сжижаются на коже с выделением большого количества энергии (энтальпии) в окружающую среду, включая кожу, что приводит к повреждению кожи. С другой стороны, именно поэтому кожа ощущается прохладной, когда жидкая вода на ней испаряется (процесс, который происходит при температуре ниже комнатной по влажному термометру , которая зависит от относительной влажности ); Испарение воды на коже забирает большое количество энергии из окружающей среды, включая кожу, снижая температуру кожи. Высокоэнергетическая энтальпия испарения воды также является важным фактором, объясняющим, почему солнечные покрытия для бассейнов (плавающие изолированные одеяла, которые накрывают плавательные бассейны , когда бассейны не используются) настолько эффективны для снижения затрат на отопление: они предотвращают испарение. (Другими словами, получение энергии из воды при ее испарении ограничено.) Например, испарение всего 20 мм воды из бассейна глубиной 1,29 метра охлаждает воду на 8,4 градуса Цельсия (15,1 °F).
Суммарная энергия всех поступательных и внутренних движений частиц, в том числе электронов проводимости, плюс потенциальная энергия фазовых переходов, плюс нулевая энергия [5] вещества составляют его внутреннюю энергию .

По мере охлаждения вещества различные формы внутренней энергии и связанные с ними эффекты одновременно уменьшаются по величине: скрытая теплота доступных фазовых переходов высвобождается по мере перехода вещества из менее упорядоченного состояния в более упорядоченное; уменьшаются поступательные движения атомов и молекул (уменьшается их кинетическая энергия или температура); внутренние движения молекул уменьшаются (уменьшается их внутренняя энергия или температура); электроны проводимости (если вещество является электрическим проводником) движутся несколько медленнее; [38] и пиковая длина волны эмиттанса излучения черного тела увеличивается (энергия фотонов уменьшается). Когда частицы вещества максимально близки к полному покою и сохраняют только квантовомеханическое движение, индуцированное ZPE (нулевой энергией), вещество находится при температуре абсолютного нуля ( T = 0).

Обратите внимание: хотя абсолютный ноль является точкой нулевой термодинамической температуры, а также точкой, в которой частицы, составляющие материи, имеют минимальное движение, абсолютный ноль не обязательно является точкой, в которой вещество содержит нулевую внутреннюю энергию; нужно очень точно понимать, что понимать под внутренней энергией . Зачастую все фазовые изменения, которые могут произойти в веществе, уже произойдут к тому моменту, когда оно достигнет абсолютного нуля. Тем не менее, это не всегда так. Примечательно, что гелий с T = 0 остается жидким при комнатном давлении ( рис. 9 справа) и для кристаллизации должен находиться под давлением не менее 25 бар (2,5 МПа ). Это связано с тем, что теплота плавления гелия (энергия, необходимая для плавления гелиевого льда) настолько мала (всего 21 джоуль на моль), что вызывающего движение эффекта энергии нулевой точки достаточно, чтобы предотвратить его замерзание при более низких давлениях.
Еще одна сложность заключается в том, что многие твердые тела меняют свою кристаллическую структуру на более компактную при чрезвычайно высоких давлениях (до миллионов бар или сотен гигапаскалей). Они известны как фазовые переходы твердое тело-твердое тело , при которых скрытая теплота высвобождается по мере изменения кристаллической решетки на более термодинамически выгодную, компактную.
Вышеупомянутые сложности приводят к довольно громоздким общим утверждениям относительно внутренней энергии веществ с T = 0. Однако независимо от давления можно сказать, что при абсолютном нуле все твердые тела с кристаллической решеткой с наименьшей энергией, такие как те, которые имеют плотнейшую упаковку (см. рис. 8 , вверху слева), содержат минимальную внутреннюю энергию, сохраняя только ту, которая обусловлена к вездесущему фону нулевой энергии. [5] [39] Можно также сказать, что для данного вещества при постоянном давлении абсолютный ноль является точкой наименьшей энтальпии (мера рабочего потенциала, которая учитывает внутреннюю энергию, давление и объем). [40] Наконец, всегда верно сказать, что все вещества с T = 0 содержат нулевую кинетическую тепловую энергию. [5] [13]
Термодинамическая температура полезна не только для ученых, она также может быть полезна непрофессионалам во многих дисциплинах, связанных с газами. Выражая переменные в абсолютных величинах и применяя закон пропорциональности температуры/давления Гей-Люссака , решения повседневных проблем становятся простыми; например, расчет того, как изменение температуры влияет на давление внутри автомобильной шины. Если в шине холодное [41] давление равно 200 кПа , то ее абсолютное давление равно 300 кПа. [42] [43] Комнатная температура («холодная» в терминах шин) равна 296 К. Если температура шины на 20 °C выше (20 К), решение рассчитывается как316 К/296 К = на 6,8% выше термодинамическая температура и абсолютное давление; то есть абсолютное давление 320 кПа, что соответствует избыточному давлению 220 кПа.
Термодинамическая температура тесно связана с законом идеального газа и его следствиями. Это также можно связать со вторым законом термодинамики. Можно показать, что термодинамическая температура обладает особыми свойствами и, в частности, можно увидеть, что она определяется однозначно (с точностью до некоторого постоянного мультипликативного коэффициента), рассматривая эффективность идеализированных тепловых двигателей . Таким образом, отношение Т 2 / Т 1 двух температур Т 1 и Т 2 одинаково во всех абсолютных масштабах.
Строго говоря, температура системы четко определена только в том случае, если она находится в состоянии теплового равновесия . С микроскопической точки зрения материал находится в тепловом равновесии, если количество тепла между его отдельными частицами уравновешивается. Существует множество возможных шкал температуры, полученных на основе различных наблюдений физических явлений.
Грубо говоря, разница температур определяет направление тепла между двумя системами таким образом, чтобы их объединенная энергия максимально распределялась между их наименьшими возможными состояниями. Мы называем это распределение « энтропией ». Чтобы лучше понять взаимосвязь между температурой и энтропией, рассмотрим взаимосвязь между теплом, работой и температурой, проиллюстрированную тепловой машиной Карно . Двигатель преобразует тепло в работу, направляя температурный градиент между источником тепла с более высокой температурой TH и радиатором с более низкой температурой TC через газонаполненный поршень. Работа, совершаемая за цикл, по величине равна чистому полученному теплу, которое представляет собой сумму тепла q H , полученного двигателем от высокотемпературного источника, плюс отходящее тепло, отдаваемое двигателем, q C < 0. [44] КПД двигателя — это работа, деленная на количество тепла, поступившего в систему, или
Теорема Карно утверждает, что все обратимые двигатели, работающие с одними и теми же тепловыми резервуарами, одинаково эффективны. Таким образом, любая обратимая тепловая машина, работающая между температурами Т 1 и Т 2, должна иметь одинаковый КПД, то есть КПД является функцией только температур.
Кроме того, обратимая тепловая машина, работающая между парой тепловых резервуаров при температурах Т 1 и Т 3 , должна иметь такой же КПД, как и состоящая из двух циклов, один между Т 1 и другой (промежуточной) температурой Т 2 , а второй между Т 2 и Т 3 . Если бы это было не так, то энергия (в форме q ) была бы потрачена или получена впустую, что приводило бы к различной общей эффективности каждый раз, когда цикл разбивается на составные циклы; очевидно, что цикл может состоять из любого количества меньших циклов в зависимости от конструкции двигателя, и любой реверсивный двигатель между одним и тем же резервуаром в точках Т 1 и Т 3 должен быть одинаково эффективным независимо от конструкции двигателя.
Если мы выберем двигатели так, чтобы работа, выполняемая однотактным двигателем и двухтактным двигателем, была одинаковой, то КПД каждой тепловой машины запишется следующим образом.
Здесь двигатель 1 представляет собой однотактный двигатель, а двигатели 2 и 3 образуют двухтактный двигатель с промежуточным резервуаром в точке Т 2 . Мы также использовали тот факт, что тепло проходит через промежуточный тепловой резервуар без потери своей энергии. (т.е. не теряется при прохождении через резервуар при .) Этот факт можно доказать следующим.
Чтобы обеспечить согласованность в последнем уравнении, тепло, передаваемое от двигателя 2 к промежуточному резервуару, должно быть равно теплу, передаваемому от резервуара к двигателю 3.
При таком понимании q 1 , q 2 и q 3 математически
Но поскольку первая функция НЕ является функцией T 2 , произведение последних двух функций ДОЛЖНО привести к удалению T 2 как переменной. Поэтому единственный способ — определить функцию f следующим образом:
Т.е. коэффициент теплообмена является функцией соответствующих температур, при которых они происходят. Мы можем выбрать любую монотонную функцию для нашего ; [45] Выбор зависит от удобства и условности . Выбрав затем одну фиксированную эталонную температуру (т.е. тройную точку воды), мы устанавливаем термодинамическую температурную шкалу.
Такое определение совпадает с определением образования идеального газа; Кроме того , именно это определение термодинамической температуры позволяет нам представить эффективность Карно через TH и TC и, следовательно , вывести, что (полный) цикл Карно изэнтропичен:
Подставив это обратно в нашу первую формулу для эффективности, получим зависимость, выраженную в температуре:
Обратите внимание, что для TC = 0 эффективность составляет 100%, а при TC < 0 эта эффективность становится больше 100% , что нереально. Вычитание 1 из правой части уравнения (4) и средней части дает и, таким образом, [46] [44]
Обобщением этого уравнения является теорема Клаузиуса , которая предполагает существование функции состояния (т. е. функции, которая зависит только от состояния системы, а не от того, как она достигла этого состояния), определяемой (с точностью до аддитивной константы) формулой
где индекс rev указывает на теплообмен в обратимом процессе. Функция представляет собой энтропию системы, упомянутую ранее, и изменение ее в любом цикле равно нулю (что необходимо для любой функции состояния). Уравнение 5 можно перестроить, чтобы получить альтернативное определение температуры с точки зрения энтропии и тепла (чтобы избежать логической петли, мы должны сначала определить энтропию с помощью статистической механики):
Для системы постоянного объема (то есть без механической работы ), в которой энтропия является функцией ее внутренней энергии , и поэтому термодинамическая температура определяется выражением

1702–1703: Гийом Амонтон (1663–1705) опубликовал две статьи, которые можно использовать для признания его первым исследователем, который пришел к выводу о существовании фундаментальной (термодинамической) температурной шкалы с абсолютным нулем. Он сделал это открытие, пытаясь улучшить воздушные термометры, использовавшиеся в то время. Его термометры с J-образной трубкой представляли собой ртутный столбик, который поддерживался фиксированной массой воздуха, захваченной чувствительной частью термометра. С термодинамической точки зрения его термометры основывались на соотношении объема и температуры газа при постоянном давлении. Его измерения температуры кипения воды и температуры плавления льда показали, что независимо от массы воздуха, заключенного внутри его термометров, или веса ртути, которую поддерживал воздух, уменьшение объема воздуха в точке льда всегда было одним и тем же соотношением. . Это наблюдение привело его к предположению, что достаточное снижение температуры приведет к уменьшению объема воздуха до нуля. Фактически, его расчеты показали, что абсолютный ноль эквивалентен -240 °C, что всего на 33,15 градуса меньше истинного значения -273,15 °C. Открытие Амонтоном взаимно однозначной зависимости между абсолютной температурой и абсолютным давлением было вновь открыто столетие спустя и популяризировано в научном сообществе Жозефом Луи Гей-Люссаком . Сегодня этот принцип термодинамики широко известен как закон Гей-Люссака , но также известен как закон Амонтона .

1742: Андерс Цельсий (1701–1744) создал «обратную» версию современной температурной шкалы Цельсия. В исходной шкале Цельсия ноль означал температуру кипения воды, а 100 — точку плавления льда. В своей статье «Наблюдения двух постоянных градусов на термометре» он рассказал о своих экспериментах, показавших, что давление практически не влияет на точку плавления льда. Он также с поразительной точностью определил, как меняется температура кипения воды в зависимости от атмосферного давления. Он предложил, чтобы ноль его температурной шкалы (точки кипения воды) был откалиброван по среднему барометрическому давлению на среднем уровне моря.

1744: Одновременно со смертью Андерса Цельсия, знаменитый ботаник Карл Линней (1707–1778) фактически перевернул [47] шкалу Цельсия после получения своего первого термометра со шкалой, где ноль представлял точку плавления льда, а 100 — температуру кипения воды. . Изготовленный по индивидуальному заказу термометр Линнея для использования в его теплицах был изготовлен Даниэлем Экстрёмом, ведущим шведским производителем научных приборов того времени. В течение следующих 204 лет научные и термометрические сообщества во всем мире называли эту шкалу стоградусной шкалой . Температуры по шкале Цельсия часто сообщались просто в градусах или, когда требовалась большая конкретность, в градусах Цельсия . Символом значений температуры по этой шкале было °C (в разных форматах на протяжении многих лет). Поскольку термин « стоградус» также был на французском языке названием единицы углового измерения (одна сотая прямого угла) и имел аналогичный смысл в других языках, термин « сотенная степень » использовался, когда требовался очень точный и недвусмысленный язык. требуется международными органами по стандартизации, такими как Международное бюро мер и весов ( Международное бюро мер и весов ) (BIPM). 9-я ГКМВ ( Генеральная конференция по мерам и весам ( Conférence générale des Poids et Mesures ) и CIPM ( Международный комитет мер и весов ( Comité International des Poids et Mesures ) официально приняли [48] градус Цельсия (обозначение: °C) в 1948 год.

1777: В своей книге «Пирометрия» (Берлин: Haude & Spener, 1779), завершенной за четыре месяца до его смерти, Иоганн Генрих Ламберт (1728–1777), которого иногда неправильно называют Йозефом Ламбертом, предложил абсолютную температурную шкалу, основанную на давлении/температуре. отношение фиксированного объема газа. Это отличается от соотношения объема и температуры газа под постоянным давлением, которое Гийом Амонтон обнаружил 75 лет назад. Ламберт заявил, что абсолютный ноль — это точка, в которой простая прямолинейная экстраполяция достигает нулевого давления газа и равна -270 ° C.

Около 1787 года. Несмотря на работу Гийома Амонтона 85 годами ранее, Жаку Александру Сезару Шарлю (1746–1823) часто приписывают открытие, но не публикацию, того, что объем газа под постоянным давлением пропорционален его абсолютной температуре. Созданная им формула была V 1 / T 1 = V 2 / T 2 .

1802: Жозеф Луи Гей-Люссак (1778–1850) опубликовал работу (признавая неопубликованные лабораторные записи Жака Шарля пятнадцатью годами ранее), описывающую, как объем газа под постоянным давлением изменяется линейно с его абсолютной (термодинамической) температурой. Такое поведение называется законом Чарльза и является одним из газовых законов . Это первая известная формула, в которой используется число 273 для коэффициента расширения газа относительно температуры плавления льда (что указывает на то, что абсолютный ноль эквивалентен -273 ° C).

1848: Уильям Томсон (1824–1907), также известный как лорд Кельвин, написал в своей статье « Об абсолютной термометрической шкале » о необходимости шкалы, в которой бесконечный холод (абсолютный ноль) был бы нулевой точкой шкалы и которая использовала бы градус Цельсия для его единичного приращения.
Как и Гей-Люссак, Томсон подсчитал, что абсолютный ноль по воздушным термометрам того времени был эквивалентен -273 °C. Эта абсолютная шкала известна сегодня как термодинамическая температурная шкала Кельвина. Примечательно, что значение Томсона -273 на самом деле было получено из 0,00366, что было общепринятым коэффициентом расширения газа на градус Цельсия относительно точки льда. Обратное значение -0,00366, выраженное пятью значащими цифрами, составляет -273,22 °C, что очень близко к истинному значению -273,15 °C.
В статье он предложил определять температуру с помощью идеализированных тепловых двигателей. Подробно он предположил, что при наличии трёх резервуаров тепла при температурах , если две обратимые тепловые машины ( двигатель Карно ), одна работающая между , а другая между , могут производить одинаковое количество механической работы , пропуская одинаковое количество тепла , то определять .
Обратите внимание, что, как и Карно, Кельвин исходил из предположения, что тепло сохраняется («преобразование тепла (или теплоты) в механический эффект, вероятно, невозможно»), и если тепло поступает в тепловую машину, то тепло должно выходить наружу. [49]
1851: Уильям Томсон, поняв после экспериментов Джоуля, что теплота не является сохраняющейся величиной, а может быть преобразована с помощью механической работы, изменил свою шкалу в « Очерке теории Карно о движущей силе тепла» . В этой работе он определил следующее: [50]
Даны два тепловых резервуара и реверсивная тепловая машина, работающая между ними, так что если во время цикла двигателя тепло поступает в двигатель, а тепло выходит из двигателя, то .
Приведенное выше определение фиксирует соотношение между абсолютными температурами, но не устанавливает шкалу абсолютной температуры. В качестве шкалы Томсон предложил использовать градус Цельсия, то есть интервал между температурой замерзания и кипения воды.

1859: Маккуорн Рэнкин (1820–1872) предложил термодинамическую температурную шкалу, аналогичную шкале Уильяма Томсона, но в которой в качестве единицы приращения использовался градус Фаренгейта , то есть интервал между температурой замерзания и температурой кипения воды. Эта абсолютная шкала известна сегодня как термодинамическая температурная шкала Ренкина .

1877–1884: Людвиг Больцман (1844–1906) внес большой вклад в термодинамику благодаря пониманию роли, которую играют кинетика частиц и излучение черного тела. Его имя теперь связано с несколькими формулами, используемыми сегодня в термодинамике.
Примерно 1930-е годы: эксперименты по газовой термометрии, тщательно откалиброванные по температуре плавления льда и температуре кипения воды, показали, что абсолютный ноль эквивалентен -273,15 °C.
1948: Резолюция 3 9-й ГКМВ (Общая конференция мер и весов, также известная как Генеральная конференция по мерам и весам ) зафиксировала тройную точку воды на уровне точно 0,01 ° C. В то время тройная точка все еще не имела формального определения ее эквивалентного значения в Кельвинах, которое, как было заявлено в резолюции, «будет зафиксировано позднее». Подразумевается, что если значение абсолютного нуля, измеренное в 1930-х годах, действительно составляло -273,15 °C, то тройная точка воды (0,01 °C) была эквивалентна 273,16 К. , также известный как Международный комитет мер и весов) и CGPM официально приняла название « Цельсий» для градуса Цельсия и температурной шкалы Цельсия . [51]
1954: Резолюция 3 10-й ГКМВ дала шкале Кельвина ее современное определение, выбрав тройную точку воды в качестве верхней определяющей точки (без изменения абсолютного нуля, являющегося нулевой точкой) и присвоив ей температуру точно 273,16 Кельвина (что на самом деле в то время было записано 273,16 градуса Кельвина ). Это, в сочетании с Резолюцией 3 9-й ГКМВ, привело к определению абсолютного нуля как точного нуля Кельвинов и -273,15 ° C.
1967/1968: Резолюция 3 13-й ГКМВ переименовала единицу приращения термодинамической температуры в кельвин , символ K, заменив абсолютную степень , символ °K. Кроме того, посчитав полезным более четко определить величину приращения единицы измерения, 13-я ГКМВ также решила в Резолюции 4, что «Кельвин, единица термодинамической температуры, представляет собой долю 1/273,16 термодинамической температуры тройной точки воды». ".
2005: CIPM (Международный комитет мер и весов, также известный как Международный комитет мер и весов ) подтвердил, что для целей определения температуры тройной точки воды определение термодинамической температурной шкалы Кельвина будет относиться к вода, изотопный состав которой точно равен номинальной спецификации средней океанской воды по Венскому стандарту .
2019: В ноябре 2018 года 26-я Генеральная конференция по мерам и весам (CGPM) изменила определение Кельвина, установив постоянную Больцмана на1,380 649 × 10 −23 в единицах Дж/К. Это изменение (и другие изменения в определении единиц СИ) вступило в силу в 144-ю годовщину Метрической конвенции, 20 мая 2019 года.

Хотя абсолютный ноль ( T = 0 ) не является состоянием нулевого движения молекул, он является точкой нулевой температуры и, в соответствии с постоянной Больцмана, также является точкой нулевой кинетической энергии частицы и нулевой кинетической скорости.Чтобы понять, как атомы могут иметь нулевую кинетическую скорость и одновременно вибрировать из-за ZPE, рассмотрим следующий мысленный эксперимент: два атома гелия с Т = 0 в невесомости тщательно располагаются и наблюдают, что среднее расстояние между ними составляет 620 пм (зазор десяти атомных диаметров). Это «среднее» разделение, потому что ZPE заставляет их суетиться из-за своих фиксированных позиций. Тогда один атом получает кинетический удар ровно в 83 йоктокельвина (1 yK =1 × 10 −24 К ). Это делается таким образом, что вектор скорости этого атома направляется на другой атом. При кинетической энергии между ними 83 кК разрыв в 620 пм через их общий барицентр закроется со скоростью 719 пм/с, и они столкнутся через 0,862 секунды. Это та же скорость, что показана на анимации рис. 1 выше. До получения кинетического удара оба атома с T = 0 имели нулевую кинетическую энергию и нулевую кинетическую скорость, потому что они могли бесконечно сохраняться в этом состоянии и относительной ориентации, даже если оба подвергались воздействию ZPE. При T = 0 кинетическая энергия недоступна для передачи другим системам.
Обратите также внимание, что абсолютный ноль служит базовой линией, на которой основывается термодинамика и ее уравнения , поскольку они имеют дело с обменом тепловой энергией между « системами » (множеством частиц и полей, смоделированных как среднее). Соответственно, можно исследовать движение частиц, вызванное ZPE, внутри системы, которая находится при абсолютном нуле, но из такой системы никогда не может быть чистого оттока тепловой энергии. Кроме того, пиковая длина волны эмиттанса излучения черного тела смещается к бесконечности при абсолютном нуле; действительно, пика больше не существует, и фотоны черного тела больше не могут покинуть его. Однако из-за ZPE виртуальные фотоны все еще испускаются при T = 0 . Такие фотоны называются «виртуальными», потому что их невозможно перехватить и наблюдать. Более того, это нулевое излучение имеет уникальный нулевой спектр . Однако даже несмотря на то, что система с T = 0 излучает нулевое излучение, никакого чистого теплового потока Q из такой системы возникнуть не может, поскольку, если температура окружающей среды превышает T = 0 , тепло будет течь внутрь, и если окружающая среда находится при ' T = 0 , поток излучения ЗП будет одинаковым как внутрь, так и наружу. Аналогичное Q- равновесие существует при T = 0 с спонтанным излучением фотонов , индуцированным ZPE (которое в данном контексте правильнее называть вынужденным излучением). График в правом верхнем углу иллюстрирует взаимосвязь абсолютного нуля и энергии нулевой точки. График также помогает понять, как энергия нулевой точки получила свое название: это колебательная энергия, которую материя сохраняет в точке нулевого Кельвина . Получение классического спектра электромагнитного нулевого излучения с помощью классической термодинамической операции с участием сил Ван-дер-Ваальса, Дэниел К. Коул, Physical Review A, 42 (1990) 1847.
уравнения
(39), (40) и (65).
уравнение(64).
{{cite book}}: CS1 maint: location missing publisher (link){{cite book}}: CS1 maint: location missing publisher (link)