
Азотный цикл — это биогеохимический цикл , посредством которого азот преобразуется в несколько химических форм, циркулируя между атмосферными , наземными и морскими экосистемами . Преобразование азота может осуществляться как посредством биологических, так и физических процессов. Важные процессы в азотном цикле включают фиксацию , аммонификацию , нитрификацию и денитрификацию . Большая часть атмосферы Земли (78%) состоит из атмосферного азота , [16] что делает его крупнейшим источником азота. Однако атмосферный азот имеет ограниченную доступность для биологического использования, что приводит к дефициту пригодного для использования азота во многих типах экосистем .
Азотный цикл представляет особый интерес для экологов, поскольку доступность азота может влиять на скорость ключевых процессов экосистемы, включая первичное производство и разложение . Человеческая деятельность, такая как сжигание ископаемого топлива, использование искусственных азотных удобрений и выброс азота в сточные воды, кардинально изменила глобальный азотный цикл . [17] [18] [19] Изменение человеком глобального азотного цикла может негативно повлиять на природную экологическую систему, а также на здоровье человека. [20] [21]
Азот присутствует в окружающей среде в самых разных химических формах, включая органический азот, аммоний ( NH+4), нитрит ( НЕТ−2), нитрат ( NO−3), закись азота ( N 2 O ), оксид азота (NO) или неорганический азотный газ ( N 2 ). Органический азот может быть в форме живого организма, гумуса или в промежуточных продуктах разложения органического вещества. Процессы в азотном цикле заключаются в преобразовании азота из одной формы в другую. Многие из этих процессов осуществляются микробами , либо в их стремлении собрать энергию, либо накопить азот в форме, необходимой для их роста. Например, азотистые отходы в моче животных расщепляются нитрифицирующими бактериями в почве для использования растениями. На схеме рядом показано, как эти процессы сочетаются друг с другом, образуя азотный цикл.
Превращение азотного газа ( N2 ) в нитраты и нитриты посредством атмосферных, промышленных и биологических процессов называется азотфиксацией. Атмосферный азот должен быть обработан или « зафиксирован » в форму, пригодную для усвоения растениями. От 5 до 10 миллиардов кг в год фиксируется ударами молний , но большая часть фиксации осуществляется свободноживущими или симбиотическими бактериями, известными как диазотрофы . Эти бактерии имеют фермент нитрогеназу , который объединяет газообразный азот с водородом для получения аммиака , который преобразуется бактериями в другие органические соединения . Большая часть биологической фиксации азота происходит за счет активности молибденовой (Mo)-нитрогеназы, обнаруженной у самых разных бактерий и некоторых архей . Mo-нитрогеназа — это сложный двухкомпонентный фермент , который имеет несколько металлсодержащих простетических групп. [22] Примером свободноживущих бактерий является Azotobacter . Симбиотические азотфиксирующие бактерии, такие как Rhizobium, обычно живут в корневых клубеньках бобовых (таких как горох, люцерна и акация). Здесь они образуют мутуалистические отношения с растением, производя аммиак в обмен на углеводы . Из-за этих отношений бобовые часто увеличивают содержание азота в бедных азотом почвах. Несколько не бобовых также могут образовывать такие симбиозы . Сегодня около 30% от общего количества фиксированного азота производится промышленным способом с использованием процесса Габера-Боша [23] , который использует высокие температуры и давления для преобразования газообразного азота и источника водорода (природного газа или нефти) в аммиак. [24]
Растения могут поглощать нитрат или аммоний из почвы корневыми волосками. Если поглощается нитрат, он сначала восстанавливается до ионов нитрита, а затем до ионов аммония для включения в аминокислоты, нуклеиновые кислоты и хлорофилл. У растений, которые имеют симбиотические отношения с ризобиями, часть азота усваивается в форме ионов аммония непосредственно из клубеньков. Теперь известно, что существует более сложный цикл аминокислот между бактероидами ризобий и растениями. Растение поставляет аминокислоты бактероидам, поэтому усвоение аммиака не требуется, и бактероиды передают аминокислоты (с недавно зафиксированным азотом) обратно растению, таким образом формируя взаимозависимые отношения. [25] В то время как многие животные, грибы и другие гетеротрофные организмы получают азот путем потребления аминокислот , нуклеотидов и других небольших органических молекул, другие гетеротрофы (включая многие бактерии ) способны использовать неорганические соединения, такие как аммоний, в качестве единственного источника N. Использование различных источников N тщательно регулируется во всех организмах.
Когда растение или животное умирает или животное выделяет отходы, первоначальная форма азота является органической . Бактерии или грибы преобразуют органический азот в остатках обратно в аммоний ( NH+4), процесс, называемый аммонификацией или минерализацией . Ферменты, участвующие в этом:

Превращение аммония в нитрат осуществляется в основном почвенными бактериями и другими нитрифицирующими бактериями. На первичной стадии нитрификации происходит окисление аммония ( NH+4) осуществляется бактериями, такими как вид Nitrosomonas , которые преобразуют аммиак в нитриты ( NO−2). Другие виды бактерий, такие как Nitrobacter , отвечают за окисление нитритов ( NO−2) в нитраты ( NO−3). Важно, чтобы аммиак ( NH 3 ) был преобразован в нитраты или нитриты, поскольку газообразный аммиак токсичен для растений.
Из-за их очень высокой растворимости и из-за того, что почвы в значительной степени неспособны удерживать анионы , нитраты могут попадать в грунтовые воды . Повышенное содержание нитратов в грунтовых водах является проблемой для использования питьевой воды, поскольку нитраты могут влиять на уровень кислорода в крови у младенцев и вызывать метгемоглобинемию или синдром синего ребенка. [28] Там, где грунтовые воды пополняют поток рек, обогащенные нитратами грунтовые воды могут способствовать эвтрофикации , процессу, который приводит к высокой популяции и росту водорослей, особенно популяций сине-зеленых водорослей. Хотя нитраты не являются напрямую токсичными для рыб, как аммиак, они могут оказывать косвенное воздействие на рыб, если способствуют этой эвтрофикации. Азот способствовал серьезным проблемам эвтрофикации в некоторых водоемах. С 2006 года применение азотных удобрений все больше контролируется в Великобритании и Соединенных Штатах. Это происходит по тем же направлениям, что и контроль фосфорных удобрений, ограничение которых обычно считается необходимым для восстановления эвтрофированных водоемов.
Денитрификация — это восстановление нитратов обратно в газообразный азот ( N
2), завершая азотный цикл. Этот процесс выполняется бактериальными видами, такими как Pseudomonas и Paracoccus , в анаэробных условиях. Они используют нитрат в качестве акцептора электронов вместо кислорода во время дыхания. Эти факультативно (то есть необязательно) анаэробные бактерии могут также жить в аэробных условиях. Денитрификация происходит в анаэробных условиях, например, в заболоченных почвах. Денитрифицирующие бактерии используют нитраты в почве для осуществления дыхания и, следовательно, производят газообразный азот, который инертен и недоступен для растений. Денитрификация происходит в свободноживущих микроорганизмах, а также облигатных симбионтах анаэробных инфузорий. [29]
Диссимиляционное восстановление нитрата до аммония (DNRA), или аммонификация нитрата/нитрита, является анаэробным процессом дыхания . Микробы, которые осуществляют DNRA, окисляют органическое вещество и используют нитрат в качестве акцептора электронов, восстанавливая его до нитрита , затем аммония ( NO−3 → НЕТ−2 → Нью-Гэмпшир+4). [30] Как денитрифицирующие, так и нитратаммонифицирующие бактерии будут конкурировать за нитрат в окружающей среде, хотя DNRA действует, чтобы сохранить биодоступный азот в виде растворимого аммония, а не производить газообразный диазот. [31]
Процесс аэробного окисления АММ на ния также известен как процесс ANAMMOX , аббревиатура, образованная путем соединения первых слогов каждого из этих трех слов. Этот биологический процесс представляет собой реакцию окислительно-восстановительного пропорционального пропорционального расщепления , в которой аммиак ( восстанавливающий агент, отдающий электроны) и нитрит ( окислитель, принимающий электроны) переносят три электрона и превращаются в одну молекулу двухатомного азота ( N
2) газа и двух молекул воды. Этот процесс составляет основную долю конверсии азота в океанах . Стехиометрически сбалансированная формула для химической реакции ANAMMOX может быть записана следующим образом, где ион аммония включает молекулу аммиака, ее сопряженное основание :
Это экзергонический процесс (здесь также экзотермическая реакция ), высвобождающий энергию, на что указывает отрицательное значение ΔG ° , разность свободной энергии Гиббса между продуктами реакции и реагентами.
Хотя фиксация азота является основным источником азота, доступного растениям в большинстве экосистем , в районах с богатой азотом коренной породой разрушение этой породы также служит источником азота. [33] [34] [35] Восстановление нитрата также является частью цикла железа , в бескислородных условиях Fe(II) может отдавать электрон NO−3и окисляется до Fe(III), в то время как NO−3сводится к НЕТ−2, N 2 O, N 2 и NH+4в зависимости от условий и видов микроорганизмов. [36] Фекальные шлейфы китообразных также действуют как связующее звено в морском азотном цикле, концентрируя азот в эпипелагических зонах океанической среды перед его рассеиванием через различные морские слои, в конечном итоге повышая первичную продуктивность океана. [37]
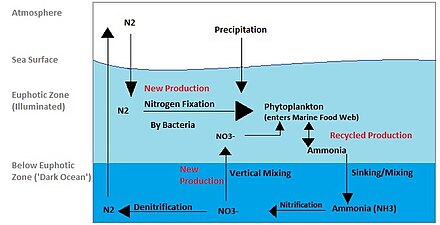


Азотный цикл также является важным процессом в океане. Хотя общий цикл похож, существуют различные игроки [40] и способы передачи азота в океане. Азот попадает в воду через осадки, сток или как N
2из атмосферы. Азот не может быть использован фитопланктоном в виде N
2поэтому он должен подвергаться фиксации азота, которая выполняется преимущественно цианобактериями . [41] Без поставок фиксированного азота, поступающего в морской цикл, фиксированный азот был бы израсходован примерно за 2000 лет. [42] Фитопланктону нужен азот в биологически доступных формах для начального синтеза органического вещества. Аммиак и мочевина выделяются в воду путем выделения из планктона. Источники азота удаляются из эвфотической зоны путем нисходящего движения органического вещества. Это может происходить из-за погружения фитопланктона, вертикального перемешивания или погружения отходов вертикальных мигрантов. Погружение приводит к тому, что аммиак попадает на более низкие глубины ниже эвфотической зоны. Бактерии способны преобразовывать аммиак в нитрит и нитрат, но они ингибируются светом, поэтому это должно происходить ниже эвфотической зоны. [43] Аммонификация или минерализация выполняется бактериями для преобразования органического азота в аммиак. Затем может произойти нитрификация , в результате которой аммоний преобразуется в нитрит и нитрат. [44] Нитрат может быть возвращен в эвфотическую зону путем вертикального перемешивания и подъема глубинных вод, где он может быть поглощен фитопланктоном для продолжения цикла. N
2могут быть возвращены в атмосферу посредством денитрификации .
Аммоний считается предпочтительным источником фиксированного азота для фитопланктона, поскольку его усвоение не включает окислительно-восстановительную реакцию и, следовательно, требует мало энергии. Нитрат требует окислительно-восстановительной реакции для усвоения, но его больше, поэтому большинство фитопланктона приспособилось иметь ферменты, необходимые для осуществления этого восстановления ( нитратредуктаза ). Есть несколько заметных и хорошо известных исключений, которые включают большинство Prochlorococcus и некоторые Synechococcus , которые могут поглощать азот только в виде аммония. [42]
Питательные вещества в океане распределены неравномерно. Области апвеллинга обеспечивают поставки азота из-под эвфотической зоны. Прибрежные зоны обеспечивают азот из стока, и апвеллинг легко происходит вдоль побережья. Однако скорость, с которой азот может быть поглощен фитопланктоном, снижается в олиготрофных водах круглый год и в умеренных водах летом, что приводит к снижению первичной продукции. [45] Распределение различных форм азота также различается по всему океану.
Нитрат истощен в приповерхностных водах, за исключением регионов апвеллинга. Прибрежные регионы апвеллинга обычно имеют высокие уровни нитрата и хлорофилла в результате увеличения производства. Однако есть регионы с высоким содержанием нитрата на поверхности, но низким содержанием хлорофилла, которые называются регионами HNLC (высокий азот, низкий хлорофилл). Лучшее объяснение регионов HNLC связано с дефицитом железа в океане, которое может играть важную роль в динамике океана и циклах питательных веществ. Поступление железа различается в зависимости от региона и доставляется в океан пылью (из пыльных бурь ) и выщелачивается из горных пород. Железо рассматривается как истинный ограничивающий элемент для продуктивности экосистемы в океане.
Аммоний и нитрит показывают максимальную концентрацию на глубине 50–80 м (нижняя граница эвфотической зоны ) с уменьшением концентрации ниже этой глубины. Такое распределение можно объяснить тем фактом, что нитрит и аммоний являются промежуточными видами. Они оба быстро производятся и потребляются через толщу воды. [42] Количество аммония в океане примерно на 3 порядка меньше, чем нитрата. [42] Из аммония, нитрита и нитрата нитрит имеет самую высокую скорость оборота. Он может производиться во время ассимиляции нитрата, нитрификации и денитрификации; однако он немедленно снова потребляется.
Азот, поступающий в эвфотическую зону, называется новым азотом, поскольку он вновь поступает из-за пределов продуктивного слоя. [41] Новый азот может поступать из-под эвфотической зоны или из внешних источников. Внешние источники — это подъем глубинных вод и фиксация азота. Если органическое вещество съедается, вдыхается, доставляется в воду в виде аммиака и повторно включается в органическое вещество фитопланктоном, оно считается переработанным/регенерированным производством.
Новое производство является важным компонентом морской среды. Одна из причин заключается в том, что только постоянное поступление нового азота может определить общую способность океана производить устойчивый улов рыбы. [45] Вылов рыбы из регенерированных азотных зон приведет к снижению азота и, следовательно, к снижению первичной продукции. Это окажет негативное влияние на систему. Однако, если рыба вылавливается из зон нового азота, азот будет восполнен.
Как показано на диаграмме справа, дополнительный углекислый газ (CO 2 ) поглощается океаном и реагирует с водой, образуя угольную кислоту ( H
2КО
3) образуется и распадается на бикарбонат ( HCO−3) и водород ( H+) ионы (серая стрелка), что снижает биодоступный карбонат ( CO2−3) и снижает pH океана (черная стрелка). Это, вероятно, усиливает фиксацию азота диазотрофами (серая стрелка), которые используют H+
ионы для преобразования азота в биодоступные формы, такие как аммиак ( NH
3) и ионы аммония ( NH+4). Однако по мере снижения pH и преобразования большего количества аммиака в ионы аммония (серая стрелка) снижается окисление аммиака до нитрита (NO–
2), что приводит к общему снижению нитрификации и денитрификации (черные стрелки). Это, в свою очередь, приведет к дальнейшему накоплению фиксированного азота в океане с потенциальным последствием эвтрофикации . Серые стрелки представляют собой увеличение, а черные стрелки представляют собой уменьшение связанного процесса. [39]
.jpg/440px-Global_-_Global_Fertilizer_and_Manure,_Version_1_Nitrogen_Fertilizer_Application_(6074011960).jpg)
.jpg/440px-Global_Global_Fertilizer_and_Manure,_Version_1_Nitrogen_in_Manure_Production_(6173194512).jpg)
В результате обширного выращивания бобовых (особенно сои , люцерны и клевера ), растущего использования процесса Габера-Боша в производстве химических удобрений и загрязнения, выбрасываемого транспортными средствами и промышленными предприятиями, люди более чем удвоили ежегодный перенос азота в биологически доступные формы. [28] Кроме того, люди внесли значительный вклад в перенос азотных микропримесей с Земли в атмосферу и с суши в водные системы. Человеческие изменения в глобальном цикле азота наиболее интенсивны в развитых странах и в Азии, где выбросы транспортных средств и промышленное сельское хозяйство являются самыми высокими. [46]
Генерация Nr, реактивного азота , увеличилась более чем в 10 раз за последнее столетие из-за глобальной индустриализации . [2] [47] Эта форма азота следует каскадом через биосферу посредством различных механизмов и накапливается, поскольку скорость ее генерации превышает скорость денитрификации . [ 48]
Закись азота ( N
2O ) повысился в атмосфере в результате использования сельскохозяйственных удобрений, сжигания биомассы, содержания крупного рогатого скота и откорма скота, а также промышленных источников. [49] N
2O оказывает пагубное воздействие в стратосфере , где он распадается и действует как катализатор в разрушении атмосферного озона . Закись азота также является парниковым газом и в настоящее время является третьим по величине фактором глобального потепления после углекислого газа и метана . Хотя он не так распространен в атмосфере, как углекислый газ, он, при эквивалентной массе, почти в 300 раз более эффективен в своей способности нагревать планету. [50]
Аммиак ( NH
3) в атмосфере утроилось в результате деятельности человека. Это реагент в атмосфере, где он действует как аэрозоль , снижая качество воздуха и прилипая к каплям воды, в конечном итоге приводя к образованию азотной кислоты (HNO3 ) , которая вызывает кислотные дожди . Атмосферный аммиак и азотная кислота также повреждают дыхательную систему.
Очень высокая температура молнии естественным образом производит небольшое количество NO
х, Нью-Гэмпшир
3, и HNO
3, но высокотемпературное горение способствовало 6- или 7-кратному увеличению потока NO
хв атмосферу. Его производство зависит от температуры сгорания - чем выше температура, тем больше NO
хпроизводится. Сжигание ископаемого топлива является основным источником, но также и биотопливо и даже сжигание водорода. Однако скорость, с которой водород напрямую впрыскивается в камеры сгорания двигателей внутреннего сгорания, можно контролировать, чтобы предотвратить более высокие температуры сгорания, которые производят NO
х.
Аммиак и оксиды азота активно изменяют химию атмосферы . Они являются предшественниками тропосферного (нижних слоев атмосферы) производства озона, что способствует смогу и кислотным дождям , повреждает растения и увеличивает поступление азота в экосистемы. Экосистемные процессы могут усиливаться при азотном удобрении , но антропогенное поступление может также привести к насыщению азотом, что ослабляет производительность и может нанести вред здоровью растений, животных, рыб и людей. [28]
Сокращение биоразнообразия может также произойти, если более высокая доступность азота увеличит потребность в азоте трав, что приведет к деградации бедных азотом, но разнообразных по видам пустошей . [51]

Показано, что повышение уровня осаждения азота имеет несколько неблагоприятных последствий как для наземных, так и для водных экосистем . [52] [53] Азотные газы и аэрозоли могут быть напрямую токсичными для определенных видов растений, влияя на надземную физиологию и рост растений вблизи крупных точечных источников загрязнения азотом. Изменения видов растений могут также происходить по мере того, как накопление соединений азота увеличивает доступность в данной экосистеме, в конечном итоге изменяя состав видов, разнообразие растений и круговорот азота. Аммиак и аммоний — две восстановленные формы азота — могут быть пагубными с течением времени из-за повышенной токсичности для чувствительных видов растений, [54] особенно тех, которые привыкли использовать нитрат в качестве источника азота, вызывая плохое развитие их корней и побегов. Повышенное осаждение азота также приводит к подкислению почвы, что увеличивает выщелачивание катионов оснований в почве и количество алюминия и других потенциально токсичных металлов, а также снижает количество происходящей нитрификации и увеличивает количество растительного опада. Из-за постоянных изменений, вызванных высоким содержанием азота, восприимчивость окружающей среды к экологическому стрессу и нарушениям, таким как вредители и патогены , может возрасти, что сделает ее менее устойчивой к ситуациям, которые в противном случае оказали бы незначительное влияние на ее долгосрочную жизнеспособность.
Дополнительные риски, связанные с увеличением доступности неорганического азота в водных экосистемах, включают закисление воды; эвтрофикацию пресноводных и соленых систем; и проблемы токсичности для животных, включая людей. [55] Эвтрофикация часто приводит к снижению уровня растворенного кислорода в толще воды, включая гипоксические и аноксические условия, которые могут вызвать гибель водной фауны. Относительно неподвижный бентос или донные существа особенно уязвимы из-за отсутствия подвижности, хотя гибель крупных рыб не является редкостью. Океанические мертвые зоны вблизи устья Миссисипи в Мексиканском заливе являются хорошо известным примером гипоксии , вызванной цветением водорослей . [56] [57] Озера Адирондак в Нью-Йорке , Кэтскилл , Гудзонское нагорье , плато Ренсселер и части Лонг-Айленда демонстрируют влияние осаждения азотнокислых дождей , что приводит к гибели рыб и многих других водных видов. [58]
Аммиак ( NH
3) очень токсичен для рыб, и уровень аммиака, сбрасываемого из очистных сооружений, должен тщательно контролироваться. Нитрификация посредством аэрации перед сбросом часто желательна для предотвращения гибели рыб. Внесение в почву может быть привлекательной альтернативой аэрации.
Утечка Nr (реактивного азота) в результате деятельности человека может привести к накоплению нитратов в природной водной среде, что может оказать вредное воздействие на здоровье человека. Чрезмерное использование азотных удобрений в сельском хозяйстве стало существенным источником загрязнения нитратами грунтовых и поверхностных вод. [59] [60] Из-за своей высокой растворимости и низкого удержания почвой нитраты могут легко выходить из подпочвенного слоя в грунтовые воды, вызывая загрязнение нитратами. Некоторые другие неточечные источники загрязнения нитратами грунтовых вод возникают из-за кормления скота, загрязнения животных и людей, а также муниципальных и промышленных отходов. Поскольку грунтовые воды часто служат основным источником бытового водоснабжения, загрязнение нитратами может распространяться от грунтовых вод до поверхностных и питьевых вод во время производства питьевой воды , особенно для небольших коммунальных систем водоснабжения, где используются плохо регулируемые и не отвечающие санитарным нормам воды. [61]
Норма ВОЗ для питьевой воды составляет 50 мг NO.−3L −1 для кратковременного воздействия и для 3 мг NO−3L −1 хронические эффекты. [62] Попадая в организм человека, нитрат может вступать в реакцию с органическими соединениями посредством реакций нитрозирования в желудке с образованием нитрозаминов и нитрозамидов , которые участвуют в некоторых типах рака (например, рак полости рта и рак желудка ). [63]
Человеческая деятельность также кардинально изменила глобальный цикл азота, производя азотистые газы, связанные с глобальным загрязнением атмосферы азотом. Существует множество источников потоков реактивного азота (Nr) в атмосфере. Сельскохозяйственные источники реактивного азота могут вызывать выбросы в атмосферу аммиака ( NH 3 ), оксидов азота ( NO
х) и закись азота ( N
2O ). Процессы горения в производстве энергии, на транспорте и в промышленности также могут образовывать новый реактивный азот посредством выделения NO
х, непреднамеренный отход. Когда эти реактивные азоты выбрасываются в нижние слои атмосферы, они могут вызывать образование смога, твердых частиц и аэрозолей, все из которых являются основными факторами неблагоприятного воздействия на здоровье человека от загрязнения воздуха. [64] В атмосфере NO
2может быть окислен до азотной кислоты ( HNO
3), и он может далее реагировать с NH
3для образования нитрата аммония ( NH 4 NO 3 ), что способствует образованию дисперсного нитрата. Более того, NH
3может реагировать с другими кислыми газами ( серной и соляной кислотами ) с образованием аммонийсодержащих частиц, которые являются предшественниками вторичных органических аэрозольных частиц в фотохимическом смоге . [65]
{{cite web}}: CS1 maint: multiple names: authors list (link){{cite book}}: CS1 maint: multiple names: authors list (link)