Пурпура Шенлейна-Геноха ( ПШГ ), также известная как IgA-васкулит , представляет собой заболевание кожи , слизистых оболочек и иногда других органов , которое чаще всего поражает детей . На коже заболевание вызывает пальпируемую пурпуру (небольшие, приподнятые области кровотечения под кожей), часто с болью в суставах и болью в животе . При поражении почек может наблюдаться потеря небольшого количества крови и белка с мочой ( гематурия и протеинурия ) , но это обычно остается незамеченным; в небольшой части случаев поражение почек переходит в хроническую болезнь почек . ПШГ часто предшествует инфекция , например, инфекция горла .
HSP — это системный васкулит ( воспаление кровеносных сосудов ), который характеризуется отложением иммунных комплексов , содержащих антитело иммуноглобулин А (IgA); точная причина этого явления неизвестна. У детей он обычно проходит в течение нескольких недель и не требует никакого лечения, кроме контроля симптомов, но может рецидивировать в трети случаев и вызывать необратимое повреждение почек примерно в одном из ста случаев. У взрослых прогноз отличается от прогноза у детей. Средняя продолжительность кожных поражений составляет 27,9 месяцев. [3] У многих он имеет тенденцию к рецидивирующе-ремиттирующему характеру в течение длительного периода времени, а не к самоограничению, и, как правило, имеет больше осложнений. [4]


Пурпура , артрит и боль в животе известны как «классическая триада» пурпуры Шенлейна-Геноха. [5] Пурпура встречается во всех случаях, боли в суставах и артрит в 80%, а боль в животе в 62%. Некоторые включают желудочно-кишечное кровотечение в качестве четвертого критерия; это происходит в 33% случаев, иногда, но не обязательно всегда, из-за инвагинации . [6] Пурпура обычно появляется на ногах и ягодицах, но может также наблюдаться на руках, лице и туловище. Боль в животе носит коликообразный характер и может сопровождаться тошнотой, рвотой, запором или диареей. В стуле может быть кровь или слизь. [7] Суставы, как правило, поражаются голеностопными , коленными и локтевыми , но возможен артрит рук и ног; артрит неэрозивный и, следовательно, не вызывает постоянной деформации. [5] У сорока процентов наблюдаются признаки поражения почек , в основном в виде гематурии (кровь в моче), но только у четверти это будет в достаточном количестве, чтобы быть заметным без лабораторных тестов. [6] Могут возникнуть проблемы в других органах, таких как центральная нервная система (головной и спинной мозг) и легкие , но они встречаются гораздо реже, чем в коже, кишечнике и почках. [8]
Из 40% пациентов, у которых развивается поражение почек, почти у всех есть доказательства (видимые или при анализе мочи ) наличия крови в моче. Более половины также имеют протеинурию (белок в моче), которая у одной восьмой является достаточно серьезной, чтобы вызвать нефротический синдром (генерализованный отек из-за низкого содержания белка в крови). Хотя отклонения в анализе мочи могут сохраняться в течение длительного времени, только у 1% всех пациентов с HSP развивается хроническое заболевание почек . [8] Может возникнуть гипертония (высокое кровяное давление). Потеря белка и высокое кровяное давление, а также особенности биопсии почки, если они выполнены, могут предсказать прогрессирование прогрессирующего заболевания почек. Взрослые более склонны к развитию прогрессирующего заболевания почек, чем дети. [8] [9]
Пурпура Шенлейна-Геноха — васкулит мелких сосудов, при котором комплексы иммуноглобулина А (IgA) и компонента комплемента 3 (C3) откладываются на артериолах, капиллярах и венулах (следовательно, это реакция гиперчувствительности типа III). Активация альтернативного пути комплемента приводит к отложению агрегатов IgA или комплексов IgA в органах-мишенях (с отложением C3). [10] Это приводит к выработке воспалительных медиаторов, включая сосудистые простагландины, такие как простациклин, которые могут играть ключевую роль в развитии IgAV и его органоспецифических клинических проявлений. [11] Как и в случае с нефропатией IgA , сывороточные уровни IgA высоки при HSP, и при биопсии почек наблюдаются идентичные результаты; однако нефропатия IgA имеет склонность к молодым людям, тогда как HSP более распространена среди детей. Кроме того, нефропатия IgA обычно поражает только почки, тогда как HSP является системным заболеванием. HSP затрагивает кожу и соединительные ткани, мошонку, суставы, желудочно-кишечный тракт и почки. [12] Генетическая основа остается неясной, за исключением вовлечения области человеческого лейкоцитарного антигена генома. [13] Предполагается, что она связана с аутоиммунитетом, вызванным инфекциями. Штаммы стрептококка и вирус парагриппа являются наиболее часто связанными патогенами, а у детей частым вирусным триггером является человеческий парвовирус B19 [14]

Диагноз основывается на сочетании симптомов, так как очень немногие другие заболевания вызывают те же симптомы вместе. Анализы крови могут показать повышенный уровень креатинина и мочевины (при поражении почек), повышенный уровень IgA (примерно у 50% [12] ), а также повышенный уровень С-реактивного белка (СРБ) или скорость оседания эритроцитов (СОЭ); ни один из них не является специфическим для пурпуры Шенлейна-Геноха. Количество тромбоцитов может быть повышено, и это отличает его от заболеваний, при которых причиной пурпуры являются низкие тромбоциты, таких как идиопатическая тромбоцитопеническая пурпура и тромботическая тромбоцитопеническая пурпура . [5]
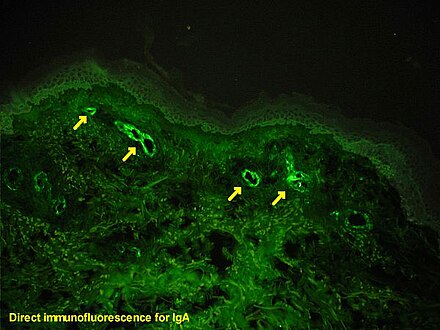
Если есть сомнения относительно причины кожных поражений, можно провести биопсию кожи, чтобы отличить пурпуру от других заболеваний, которые ее вызывают, таких как васкулит , вызванный криоглобулинемией ; при микроскопии появляются признаки гиперчувствительного васкулита , а иммунофлюоресценция выявляет IgA и C3 (белок системы комплемента ) в стенке кровеносного сосуда. [5] Однако общие уровни комплемента в сыворотке остаются нормальными.
На основе симптомов можно отличить HSP от гиперчувствительного васкулита (HV). В серии, сравнивающей 85 пациентов с HSP с 93 пациентами с HV, было обнаружено пять симптомов, указывающих на HSP: пальпируемая пурпура, брюшная жаба , кровотечение из пищеварительного тракта (не из-за инвагинации), гематурия и возраст менее 20 лет. Наличие трех или более из этих показателей имеет 87% чувствительность для прогнозирования HSP. [15]
Биопсия почки может быть выполнена как для установления диагноза, так и для оценки тяжести уже подозреваемого заболевания почек. Основными результатами биопсии почки являются увеличение клеток и отложение Ig в мезангиуме ( часть клубочка , где фильтруется кровь), лейкоциты и развитие полулуний . Изменения неотличимы от тех, которые наблюдаются при нефропатии IgA . [12]
HSP может развиться после заражения стрептококками ( β-гемолитическим, группа Лэнсфилда А ), гепатитом В , вирусом простого герпеса , парвовирусом В19 , вирусом Коксаки , аденовирусом , Helicobacter pylori , [8] корью , эпидемическим паротитом , краснухой , микоплазмой и многими другими. [12] Лекарственные препараты, связанные с HSP, обычно как идиосинкразическая реакция, включают антибиотики ванкомицин и цефуроксим , ингибиторы АПФ эналаприл и каптоприл , противовоспалительное средство диклофенак , а также ранитидин и стрептокиназу . Сообщалось о нескольких заболеваниях, связанных с HSP, часто без причинной связи. Только примерно в 35% случаев HSP можно отследить до любой из этих причин. [12]
Точная причина HSP неизвестна, но большинство ее признаков обусловлено отложением аномальных антител в стенке кровеносных сосудов, что приводит к васкулиту . Эти антитела относятся к подклассу IgA 1 в полимерах ; неясно, является ли основной причиной перепроизводство (в пищеварительном тракте или костном мозге ) или снижение удаления аномального IgA из кровообращения. [12] Предполагается, что аномалии в молекуле IgA 1 могут объяснить ее аномальное поведение как при HSP, так и при связанном с этим состоянии нефропатии IgA . Одной из характеристик IgA 1 (и IgD ) является наличие «шарнирной области» длиной 18 аминокислот между комплемент -фиксирующими областями 1 и 2. Из аминокислот половина — пролин , в то время как остальные в основном серин и треонин . Большинство серинов и треонинов имеют сложные сахарные цепи, соединенные через атомы кислорода ( O-гликозилирование ). Считается, что этот процесс стабилизирует молекулу IgA и делает ее менее склонной к протеолизу . Первым сахаром всегда является N-ацетилгалактозамин (GalNAc), за которым следуют другие галактозы и сиаловая кислота . В HSP и IgAN эти сахарные цепи, по-видимому, дефицитны. Точная причина этих аномалий неизвестна. [8] [12]
Существует множество стандартов для определения пурпуры Шенлейна-Геноха, включая классификацию Американской коллегии ревматологов (ACR) 1990 года [16] [17] и Консенсусную конференцию Чапел-Хилл 1994 года (CHCC). [18] Некоторые сообщают, что критерии ACR более чувствительны , чем критерии CHCC. [19]
Более поздние классификации, классификация Европейской лиги против ревматизма (EULAR) 2006 года и Детского ревматологического общества (PReS), включают пальпируемую пурпуру в качестве обязательного критерия вместе с по крайней мере одним из следующих признаков: диффузная боль в животе, преобладающее отложение IgA (подтвержденное биопсией кожи), острый артрит в любом суставе и поражение почек (о чем свидетельствует наличие крови и/или белка в моче). [20]
Пурпура Шенлейна-Геноха может иметь атипичные проявления, которые можно спутать с папулезной крапивницей , системной красной волчанкой , менингококцемией , герпетиформным дерматитом и острым геморрагическим отеком младенцев . [21]
По состоянию на 2017 год оптимальный способ лечения пурпуры Шенлейна-Геноха остается спорным. [22] Анальгетики могут быть необходимы при болях в животе и суставах. Уход за ранами оправдан, если происходит отмирание кожи и образование язв. [22] Неясно, нуждается ли HSP в лечении, выходящем за рамки контроля симптомов. Большинство людей не получают терапию из-за высокой частоты спонтанного выздоровления. Эксперты расходятся во мнениях относительно того, следует ли регулярно использовать кортикостероиды для лечения HSP. [22] Однако, если их назначать на ранней стадии заболевания, продолжительность симптомов может сократиться, а боль в животе может значительно уменьшиться. [22] Более того, может быть снижена вероятность серьезных проблем с почками. [23] Систематический обзор не обнаружил никаких доказательств того, что лечение стероидами ( преднизон ) эффективно для снижения вероятности развития долгосрочного заболевания почек. [24]
Признаки ухудшения повреждения почек обычно требуют биопсии почки. Лечение может быть назначено на основе внешнего вида образца биопсии; могут использоваться различные методы лечения, от стероидов внутрь до комбинации внутривенного метилпреднизолона (стероид), циклофосфамида и дипиридамола с последующим преднизоном. Другие схемы включают стероиды/ азатиоприн и стероиды/циклофосфамид (с гепарином и варфарином или без них ). Иногда используется внутривенный иммуноглобулин (IVIG). [12]
Нет никаких убедительных доказательств того, что лечение детей с HSP антиагрегантными средствами предотвращает стойкое заболевание почек. [25] [ необходимо обновление ] Также нет никаких доказательств того, что лечение детей или взрослых циклофосфамидом предотвращает тяжелое заболевание почек. [25] Лечение гепарином не оправдано. [25]
В целом прогноз благоприятный у большинства пациентов, одно исследование показало, что выздоровление происходит у 94% и 89% детей и взрослых соответственно (некоторым требовалось лечение). [26] У детей младше десяти лет заболевание рецидивирует примерно в трети всех случаев, обычно в течение четырех месяцев после первоначального приступа. [6] Рецидив чаще встречается у детей старшего возраста и взрослых. [8]
У взрослых поражение почек прогрессирует до терминальной стадии почечной недостаточности (ESKD) чаще, чем у детей. В серии из 37 пациентов в Великобритании у 10 (27%) развилась прогрессирующая почечная недостаточность. Протеинурия, гипертензия при поступлении и патологические признаки (полумесяцы, интерстициальный фиброз и атрофия канальцев) предсказывали прогрессирование. [9] Около 20% детей, у которых проявляются нефротические или нефритические признаки, испытывают длительную постоянную почечную недостаточность. [27]
Результаты биопсии почек коррелируют с тяжестью симптомов: у пациентов с бессимптомной гематурией может наблюдаться только очаговая мезангиальная пролиферация, тогда как у пациентов с протеинурией может наблюдаться выраженная клеточная пролиферация или даже образование полумесяцев. Количество полулунных клубочков является важным прогностическим фактором в определении того, разовьется ли у пациента хроническое заболевание почек. [8]
При ESKD некоторым в конечном итоге требуется гемодиализ или эквивалентная заместительная почечная терапия (ЗПТ). Если пациенту, находящемуся на ЗПТ, подберут почечный трансплантат , то примерно в 35% случаев заболевание рецидивирует в трансплантате (пересаженной почке), а в 11% трансплантат полностью откажет (потребуется возобновление ЗПТ и еще одна трансплантация). [12]
HSP встречается чаще у детей, чем у взрослых, [26] и обычно следует за инфекцией верхних дыхательных путей . Половина пораженных пациентов моложе шести лет, а 90% моложе десяти. Он встречается примерно в два раза чаще у мальчиков, чем у девочек. [8] Заболеваемость HSP у детей составляет около 20 на 100 000 детей в год, что делает его наиболее распространенным васкулитом у детей. [28]
Случаи HSP могут возникнуть в любое время года, но некоторые исследования показали, что меньше случаев происходит в летние месяцы. [29]

Заболевание названо в честь Эдуарда Генриха Геноха (1820–1910), немецкого педиатра (племянника Морица Генриха Ромберга, пионера неврологии, опубликовавшего свой классический учебник между 1840 и 1846 годами и первого, кто описал симптом Ромберга.) и его учителя Иоганна Лукаса Шёнляйна (1793–1864). Иоганн Шёнляйн описал это состояние как сущность в 1837 году; Эдуард Генрих Генох в 1868 году сообщил о первом случае пациента с коликами, кровавым поносом, болезненными суставами и сыпью. [30] Английский врач Уильям Геберден (1710–1801) и дерматолог Роберт Виллан (1757–1812) уже описали это заболевание в 1802 и 1808 годах соответственно, но название болезнь Гебердена–Виллана вышло из употребления. [31] Более того, Виллан был первым, кто описал экзантематозную сыпь у детей, известную как инфекционная эритема в 1799 году [32] . В 1920 году Эдуард Гланцманн (1887-1959), швейцарский педиатр, известный своим вкладом в области инфекционных заболеваний, витаминотерапии и, в основном, в области гематологии. Он признал роль аллергии в патогенезе пурпуры Шенлейн-Геноха, отсюда и понимание аллергического компонента в ПШГ. [33] Уильям Ослер также первым признал основной аллергический механизм ПШГ. [34] В 2012 году Международная конференция по консенсусу в Чапел-Хилл переименовала ПШГ в IgA-васкулит. До этого заболевание чаще называли пурпурой Шенлейн-Геноха, а не наоборот. [35]