

Энантиоселективный синтез , также называемый асимметричным синтезом , [1] является формой химического синтеза . Он определяется ИЮПАК как « химическая реакция (или последовательность реакций), в которой один или несколько новых элементов хиральности образуются в молекуле субстрата и которая производит стереоизомерные ( энантиомерные или диастереомерные ) продукты в неравных количествах ». [2]
Проще говоря: это синтез соединения методом, который благоприятствует образованию определенного энантиомера или диастереомера. Энантиомеры — это стереоизомеры, которые имеют противоположные конфигурации в каждом хиральном центре. Диастереомеры — это стереоизомеры, которые различаются в одном или нескольких хиральных центрах.
Энантиоселективный синтез является ключевым процессом в современной химии и особенно важен в области фармацевтики , поскольку различные энантиомеры или диастереомеры молекулы часто обладают различной биологической активностью .

Многие из строительных блоков биологических систем, таких как сахара и аминокислоты, производятся исключительно как один энантиомер . В результате живые системы обладают высокой степенью химической хиральности и часто реагируют по-разному с различными энантиомерами данного соединения. Примеры такой селективности включают:
Таким образом, энантиоселективный синтез имеет большое значение, но его также может быть трудно достичь. Энантиомеры обладают идентичными энтальпиями и энтропиями и, следовательно, должны быть получены в равных количествах ненаправленным процессом, что приводит к рацемической смеси. Энантиоселективный синтез может быть достигнут с использованием хиральной особенности, которая благоприятствует образованию одного энантиомера по сравнению с другим посредством взаимодействий в переходном состоянии . Это смещение известно как асимметричная индукция и может включать хиральные особенности в субстрате , реагенте , катализаторе или среде [9] и работает, делая энергию активации, необходимую для образования одного энантиомера, ниже, чем у противоположного энантиомера. [10]
Энантиоселективность обычно определяется относительными скоростями энантиодифференцирующего шага — точки, в которой один реагент может стать одним из двух энантиомерных продуктов. Константа скорости , k , для реакции является функцией энергии активации реакции, иногда называемой энергетическим барьером , и зависит от температуры. Использование свободной энергии Гиббса энергетического барьера, Δ G *, означает, что относительные скорости для противоположных стереохимических результатов при данной температуре, T , составляют:
Эта температурная зависимость означает, что разница в скорости, а следовательно, и энантиоселективность, больше при более низких температурах. В результате даже небольшие различия в энергетических барьерах могут привести к заметному эффекту.
Энантиоселективный катализ (традиционно известный как «асимметричный катализ») осуществляется с использованием хиральных катализаторов , которые обычно представляют собой хиральные координационные комплексы . Катализ эффективен для более широкого диапазона преобразований, чем любой другой метод энантиоселективного синтеза. Хиральные металлические катализаторы почти всегда становятся хиральными с помощью хиральных лигандов , но можно создавать хиральные комплексы с металлом, состоящие полностью из ахиральных лигандов. [11] [12] [13] Большинство энантиоселективных катализаторов эффективны при низких соотношениях субстрат/катализатор. [14] [15] Учитывая их высокую эффективность, они часто подходят для синтеза в промышленных масштабах, даже с дорогими катализаторами. [16] Универсальным примером энантиоселективного синтеза является асимметричное гидрирование , которое используется для восстановления широкого спектра функциональных групп .

Разработка новых катализаторов во многом определяется разработкой новых классов лигандов . Некоторые лиганды, часто называемые « привилегированными лигандами », эффективны в широком диапазоне реакций; примерами служат BINOL , Salen и BOX . Большинство катализаторов эффективны только для одного типа асимметричной реакции. Например, асимметричное гидрирование Нойори с BINAP/Ru требует β-кетона, хотя другой катализатор, BINAP/diamine-Ru, расширяет область применения до α,β- алкенов и ароматических химикатов .
Хиральное вспомогательное вещество — это органическое соединение, которое соединяется с исходным материалом, образуя новое соединение, которое затем может подвергаться диастереоселективным реакциям посредством внутримолекулярной асимметричной индукции. [17] [18] В конце реакции вспомогательное вещество удаляется в условиях, которые не вызовут рацемизации продукта. [19] Затем его обычно восстанавливают для будущего использования.

Хиральные вспомогательные вещества должны использоваться в стехиометрических количествах, чтобы быть эффективными, и требуют дополнительных синтетических шагов для добавления и удаления вспомогательного вещества. Однако в некоторых случаях единственная доступная стереоселективная методология опирается на хиральные вспомогательные вещества, и эти реакции, как правило, универсальны и очень хорошо изучены, что позволяет наиболее эффективно с точки зрения времени получать энантиомерно чистые продукты. [18] Кроме того, продуктами реакций, направленных на вспомогательные вещества, являются диастереомеры , что позволяет легко разделять их такими методами, как колоночная хроматография или кристаллизация.
Биокатализ использует биологические соединения, от изолированных ферментов до живых клеток, для выполнения химических превращений. [20] [21] Преимущества этих реагентов включают очень высокий ЭЭС и специфичность реагента, а также мягкие условия эксплуатации и низкое воздействие на окружающую среду . Биокатализаторы чаще используются в промышленности, чем в академических исследованиях; [22] например, в производстве статинов . [23] Однако высокая специфичность реагента может быть проблемой, поскольку часто требуется, чтобы широкий спектр биокатализаторов был проверен, прежде чем будет найден эффективный реагент.
Органокатализ относится к форме катализа , при которой скорость химической реакции увеличивается за счет органического соединения, состоящего из углерода , водорода , серы и других неметаллических элементов. [24] [25] Когда органокатализатор является хиральным , то может быть достигнут энантиоселективный синтез; [26] [27] например, ряд реакций образования углерод-углеродной связи становятся энантиоселективными в присутствии пролина , при этом альдольная реакция является ярким примером. [28] Органокатализ часто использует природные соединения и вторичные амины в качестве хиральных катализаторов; [29] они недороги и экологически безопасны , так как не участвуют металлы.
Синтез хирального пула является одним из самых простых и старых подходов к энантиоселективному синтезу. Легкодоступный хиральный исходный материал обрабатывается посредством последовательных реакций, часто с использованием ахиральных реагентов, для получения желаемой целевой молекулы. Это может соответствовать критериям энантиоселективного синтеза, когда создается новый хиральный вид, например, в реакции S N 2 .

Синтез хирального пула особенно привлекателен для целевых молекул, имеющих хиральность, близкую к относительно недорогим природным строительным блокам, таким как сахар или аминокислота . Однако число возможных реакций, которые может пройти молекула, ограничено, и могут потребоваться извилистые синтетические пути (например, полный синтез осельтамивира ). Этот подход также требует стехиометрического количества энантиочистого исходного материала, что может быть дорогим, если он не встречается в природе.
Два энантиомера молекулы обладают многими одинаковыми физическими свойствами (например, точкой плавления , точкой кипения , полярностью и т. д.) и поэтому ведут себя идентично друг другу. В результате они будут мигрировать с идентичным R f в тонкослойной хроматографии и иметь одинаковое время удерживания в ВЭЖХ и ГХ . Их ЯМР- и ИК -спектры идентичны.
Это может сильно затруднить определение того, был ли в результате процесса получен один энантиомер (и, что особенно важно, какой именно это энантиомер), а также затруднить разделение энантиомеров из реакции, которая не была на 100% энантиоселективной. К счастью, энантиомеры ведут себя по-разному в присутствии других хиральных материалов, и это можно использовать для их разделения и анализа.
Энантиомеры не мигрируют одинаково на хиральных хроматографических средах, таких как кварц или стандартные среды, которые были хирально модифицированы. Это составляет основу хиральной колоночной хроматографии , которая может использоваться в небольших масштабах для проведения анализа с помощью ГХ и ВЭЖХ или в больших масштабах для разделения хирально загрязненных материалов. Однако этот процесс может потребовать большого количества хирального упаковочного материала, который может быть дорогим. Распространенной альтернативой является использование хирального дериватизирующего агента для преобразования энантиомеров в диастереомеры, во многом таким же образом, как и хиральные вспомогательные вещества. Они имеют различные физические свойства и, следовательно, могут быть разделены и проанализированы с использованием обычных методов. Специальные хиральные дериватизирующие агенты, известные как «хиральные разделяющие агенты», используются в ЯМР-спектроскопии стереоизомеров , они обычно включают координацию с хиральными комплексами европия, такими как Eu(fod) 3 и Eu(hfc) 3 .
Разделение и анализ энантиомеров компонентов рацемических лекарств или фармацевтических веществ называется хиральным анализом . [30] или энантиоселективным анализом . Наиболее часто используемый метод проведения хирального анализа включает в себя процедуры науки разделения, в частности, хиральные хроматографические методы. [31]
Энантиомерный избыток вещества также может быть определен с помощью определенных оптических методов. Самый старый метод для этого — использовать поляриметр для сравнения уровня оптического вращения в продукте со «стандартом» известного состава. Также возможно выполнить ультрафиолетово-видимую спектроскопию стереоизомеров, используя эффект Коттона .
Одним из наиболее точных способов определения хиральности соединения является определение его абсолютной конфигурации методом рентгеновской кристаллографии . Однако это трудоемкий процесс, требующий выращивания подходящего монокристалла .
В 1815 году французский физик Жан-Батист Био показал, что некоторые химические вещества могут вращать плоскость луча поляризованного света, свойство, называемое оптической активностью . [32] Природа этого свойства оставалась загадкой до 1848 года, когда Луи Пастер предположил, что оно имеет молекулярную основу, происходящую из некоторой формы диссимметрии , [33] [34] а термин хиральность был придуман лордом Кельвином годом позже. [35] Происхождение самой хиральности было окончательно описано в 1874 году, когда Якобус Генрикус ван 'т Хофф и Жозеф Ле Бель независимо друг от друга предложили тетраэдрическую геометрию углерода. [36] [37] Структурные модели до этой работы были двумерными, и ван 'т Хофф и Ле Бель предположили, что расположение групп вокруг этого тетраэдра может определять оптическую активность полученного соединения с помощью того, что стало известно как правило Ле Беля–ван 'т Хоффа .

В 1894 году Герман Эмиль Фишер изложил концепцию асимметричной индукции ; [39] в которой он правильно приписал селективное образование D -глюкозы растениями, обусловленное влиянием оптически активных веществ в хлорофилле. Фишер также успешно выполнил то, что теперь будет считаться первым примером энантиоселективного синтеза, энантиоселективно удлиняя сахара посредством процесса, который в конечном итоге стал синтезом Килиани-Фишера . [40]
Первый энантиоселективный химический синтез чаще всего приписывают Вилли Марквальду из Берлинского университета , который в 1904 году осуществил катализируемое бруцином энантиоселективное декарбоксилирование 2-этил-2- метилмалоновой кислоты . [38] [41] Был получен небольшой избыток левовращающей формы продукта реакции, 2-метилмасляной кислоты; поскольку этот продукт также является природным продуктом — например, как боковая цепь ловастатина, образованная его дикетидсинтазой (LovF) во время его биосинтеза [42], — этот результат представляет собой первый зарегистрированный полный синтез с энантиоселективностью, а также другие первые (как отмечает Коскинен, первый «пример асимметричного катализа , энантиотопного отбора и органокатализа »). [38] Это наблюдение также имеет историческое значение, поскольку в то время энантиоселективный синтез мог быть понят только с точки зрения витализма . В то время многие выдающиеся химики, такие как Йенс Якоб Берцелиус, утверждали, что природные и искусственные соединения принципиально различны и что хиральность была просто проявлением «жизненной силы», которая могла существовать только в природных соединениях. [43] В отличие от Фишера, Марквальд провел энантиоселективную реакцию на ахиральном, неприродном исходном материале, хотя и с хиральным органическим катализатором (как мы теперь понимаем эту химию). [38] [44] [45]
Развитие энантиоселективного синтеза изначально было медленным, в основном из-за ограниченного набора методов, доступных для их разделения и анализа. Диастереомеры обладают различными физическими свойствами, что позволяет проводить разделение обычными способами, однако в то время энантиомеры можно было разделить только спонтанным разделением (когда энантиомеры разделяются при кристаллизации) или кинетическим разделением (когда один энантиомер селективно разрушается). Единственным инструментом для анализа энантиомеров была оптическая активность с использованием поляриметра , метод, который не дает структурных данных.
Только в 1950-х годах начался настоящий прогресс. Отчасти благодаря таким химикам, как Р. Б. Вудворд и Владимир Прелог , но также и благодаря разработке новых методов. Первым из них была рентгеновская кристаллография , которая была использована для определения абсолютной конфигурации органического соединения Йоханнесом Бийвоетом в 1951 году. [46] Хиральная хроматография была представлена годом позже Далглишем, который использовал бумажную хроматографию для разделения хиральных аминокислот. [47] Хотя Далглиш не был первым, кто наблюдал такие разделения, он правильно приписал разделение энантиомеров дифференциальному удерживанию хиральной целлюлозой. Это было расширено в 1960 году, когда Клем и Рид впервые сообщили об использовании хирально модифицированного силикагеля для хирального разделения ВЭЖХ . [48]

Хотя было известно, что различные энантиомеры препарата могут иметь различную активность, и существенная ранняя работа была проделана Артуром Робертсоном Кашни [49] [50] , это не учитывалось при раннем проектировании и тестировании лекарств. Однако после катастрофы с талидомидом разработка и лицензирование лекарств кардинально изменились.
Впервые синтезированный в 1953 году, талидомид широко назначался при утренней тошноте с 1957 по 1962 год, но вскоре было обнаружено, что он является серьезным тератогенным средством , [51] в конечном итоге вызвав врожденные дефекты у более чем 10 000 младенцев. Катастрофа побудила многие страны ввести более жесткие правила тестирования и лицензирования лекарств, такие как поправка Кефовера-Харриса (США) и Директива 65/65/EEC1 (ЕС).
Ранние исследования тератогенного механизма с использованием мышей предполагали, что один энантиомер талидомида был тератогенным, в то время как другой обладал всей терапевтической активностью. Позднее было показано, что эта теория неверна, и теперь она была заменена совокупностью исследований. [52] Однако она повысила важность хиральности в разработке лекарств, что привело к увеличению исследований в области энантиоселективного синтеза.
Правила приоритета Кана-Ингольда-Прелога (часто сокращенно называемые системой CIP ) были впервые опубликованы в 1966 году, что позволило более легко и точно описывать энантиомеры. [53] [54] В том же году было осуществлено первое успешное разделение энантиомеров методом газовой хроматографии [55], что стало важным достижением, поскольку в то время эта технология широко использовалась.
Металл-катализируемый энантиоселективный синтез был впервые предложен Уильямом С. Ноулзом , Рёдзи Ноёри и К. Барри Шарплессом ; за что они получили Нобелевскую премию по химии 2001 года . Ноулз и Ноёри начали с разработки асимметричного гидрирования , которое они разработали независимо в 1968 году. Ноулз заменил ахиральные трифенилфосфиновые лиганды в катализаторе Уилкинсона на хиральные фосфиновые лиганды . Этот экспериментальный катализатор использовался в асимметричном гидрировании со скромным 15% энантиомерным избытком . Ноулз также был первым, кто применил энантиоселективный металлический катализ к синтезу в промышленных масштабах; работая в компании Monsanto, он разработал стадию энантиоселективного гидрирования для производства L-ДОФА , используя лиганд DIPAMP . [56] [57] [58]
Нойори разработал медный комплекс с использованием хирального лиганда Шиффова основания , который он использовал для металл-карбеноидного циклопропанирования стирола . [59] Как и открытия Ноулза, результаты Нойори по энантиомерному избытку для этого лиганда первого поколения были разочаровывающе низкими: 6%. Однако продолжающиеся исследования в конечном итоге привели к разработке реакции асимметричного гидрирования Нойори .
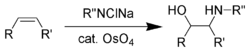
Шарплесс дополнил эти восстановительные реакции, разработав ряд асимметричных окислений ( эпоксидирование Шарплесс , [60] асимметричное дигидроксилирование Шарплесс , [61] оксиаминирование Шарплесс [62] ) в 1970-х и 1980-х годах. При этом реакция асимметричного оксиаминирования с использованием тетроксида осмия была самой ранней.
В тот же период были разработаны методы, позволяющие проводить анализ хиральных соединений с помощью ЯМР ; либо с использованием хиральных дериватизирующих агентов, таких как кислота Мошера , [63] или реагентов сдвига на основе европия , из которых Eu(DPM) 3 был самым ранним. [64]
Хиральные вспомогательные вещества были введены Э. Дж. Кори в 1978 году [65] и заняли видное место в работе Дитера Эндерса . Примерно в то же время был разработан энантиоселективный органокатализ, среди пионерских работ которого была реакция Хайоса-Пэрриша-Эдера-Зауэра-Вихерта . Энантиоселективные реакции, катализируемые ферментами, становились все более распространенными в 1980-х годах, [66] особенно в промышленности, [67] с их приложениями, включая асимметричный гидролиз эфира с эстеразой печени свиньи . Возникающая технология генной инженерии позволила адаптировать ферменты к определенным процессам, что позволило расширить диапазон селективных преобразований. Например, при асимметричном гидрировании предшественников статинов . [23]
{{cite book}}: CS1 maint: несколько имен: список авторов ( ссылка )