
Вестерн -блоттинг (иногда называемый белковым иммуноблоттингом ), или вестерн-блоттинг , представляет собой широко используемый аналитический метод в молекулярной биологии и иммуногенетике для обнаружения специфических белков в образце гомогената или экстракта ткани. [1] Помимо обнаружения белков, этот метод также используется для визуализации, различения и количественной оценки различных белков в сложной белковой комбинации. [2]
Метод вестерн-блоттинга использует три элемента для достижения своей задачи по отделению конкретного белка от комплекса: разделение по размеру, перенос белка на твердую подложку и маркировку целевого белка с использованием первичного и вторичного антитела для визуализации. [1] Создается синтетическое антитело или антитело животного происхождения (известное как первичное антитело ), которое распознает определенный целевой белок и связывается с ним. Мембрану для электрофореза промывают раствором, содержащим первичное антитело, прежде чем смыть избыток антител. [3] Добавляется вторичное антитело , которое распознает первичное антитело и связывается с ним. Вторичное антитело визуализируется с помощью различных методов, таких как окрашивание , иммунофлуоресценция и радиоактивность, что позволяет косвенно обнаружить конкретный целевой белок. [3]
Другие родственные методы включают дот-блот- анализ, количественный дот-блоттинг , иммуногистохимию и иммуноцитохимию , где антитела используются для обнаружения белков в тканях и клетках с помощью иммуноокрашивания , а также иммуноферментный анализ (ELISA).
Название вестерн-блот является обыгрыванием Саузерн-блоттинга , метода обнаружения ДНК , названного в честь его изобретателя, английского биолога Эдвина Саузерна . Точно так же обнаружение РНК называется нозерн-блоттингом . [4] Термин «вестерн-блоттинг» был предложен У. Нилом Бёрнеттом в 1981 году, [5] хотя сам метод был независимо изобретен в 1979 году Хайме Ренартом, Якобом Райзером и Джорджем Старком в Стэнфордском университете , [6] и Гарри Таубин, Теофил Штелин и Джулиан Гордон в Институте Фридриха Мишера в Базеле , Швейцария . [7] Группа Таубина также использовала для обнаружения вторичные антитела, что напоминало реальный метод, который сегодня почти повсеместно используется. В период с 1979 по 2019 год «он упоминался в названиях, рефератах и ключевых словах более чем 400 000 публикаций, внесенных в список PubMed » и, возможно, до сих пор остается наиболее используемым методом анализа белков. [8]

Вестерн-блоттинг широко используется в биохимии для качественного обнаружения отдельных белков и их модификаций (например, посттрансляционных модификаций ). По оценкам, не менее 8–9% всех публикаций, связанных с белками, используют вестерн-блоттинг. [8] Он используется как общий метод для определения присутствия конкретного белка в сложной смеси белков. Полуколичественную оценку белка можно получить по размеру и интенсивности цвета полосы белка на блот-мембране. Кроме того, для более точной оценки концентрации белка можно использовать серию разведений очищенного белка известных концентраций. Вестерн-блоттинг обычно используется для проверки продукции белка после клонирования . Он также используется в медицинской диагностике, например, при тестировании на ВИЧ или BSE -Test. [9]
Подтверждающий тест на ВИЧ использует вестерн-блоттинг для обнаружения антител к ВИЧ в образце сыворотки человека . Белки из известных ВИЧ -инфицированных клеток отделяют и наносят на мембрану, как указано выше. Затем тестируемую сыворотку применяют на этапе инкубации первичных антител; Свободное антитело смывают и добавляют вторичное античеловеческое антитело, связанное с сигналом фермента. Окрашенные полосы указывают на белки, к которым сыворотка пациента содержит антитела. [10] Вестерн-блоттинг также используется в качестве окончательного теста на вариант болезни Крейтцфельдта-Якоба , тип прионной болезни, связанной с потреблением зараженной говядины крупного рогатого скота с губчатой энцефалопатией крупного рогатого скота (ГЭКРС, обычно называемой «коровьим бешенством»). ). [11] Другое применение – диагностика туляремии . Оценка способности вестерн-блоттинга выявлять антитела против F. tularensis показала, что его чувствительность составляет почти 100%, а специфичность - 99,6%. [12] В некоторых формах тестирования на болезнь Лайма используется вестерн-блоттинг. [13] Вестерн-блоттинг также можно использовать в качестве подтверждающего теста на инфекцию гепатита B и инфекцию простого герпеса 2 (герпес типа 2). [14] [15] В ветеринарной медицине вестерн-блоттинг иногда используется для подтверждения статуса FIV + у кошек. [16]
Дальнейшее применение метода вестерн-блоттинга включает его использование Всемирным антидопинговым агентством (ВАДА). Допинг крови — это неправильное использование определенных методов и/или веществ для увеличения массы эритроцитов, что позволяет организму транспортировать больше кислорода к мышцам и, следовательно, повысить выносливость и работоспособность. Есть три широко известных вещества или метода, используемых для допинга крови, а именно: эритропоэтин (ЭПО), синтетические переносчики кислорода и переливание крови. Каждый из них запрещен Списком запрещенных веществ и методов ВАДА. Техника вестерн-блоттинга использовалась во время чемпионата мира по футболу 2014 года в рамках антидопинговой кампании на этом мероприятии. [17] В общей сложности Райхель и др. собрали и проанализировали более 1000 образцов. [18] в аккредитованной ВАДА лаборатории Лозанны, Швейцария . Недавние исследования с использованием метода вестерн-блоттинга показали улучшенное обнаружение ЭПО в крови и моче на основе новых сборных горизонтальных гелей Velum SAR, оптимизированных для рутинного анализа. [19] С внедрением горизонтального SAR-PAGE в сочетании со сборными гелями Velum SAR на пленочной основе дискриминационная способность применения микродоз rEPO была значительно улучшена.
Помимо применения вестерн-блоттинга в научных исследованиях, он также используется в областях клинических исследований. Поскольку вестерн-блоттинг можно применять для процесса прямой идентификации белков, он считается мощным диагностическим инструментом, который часто используется в клинических условиях. Методы обнаружения WB и белков можно использовать для поиска биомаркеров заболеваний, таких как специфические белки или антитела. Считается, что это жизнеспособный метод идентификации определенных белков при диагностике таких заболеваний, как рак, аутоиммунные заболевания и прионные заболевания. Обнаружение нескольких биомаркеров, используемых в диагностике неврологических и онкологических заболеваний, с помощью вестерн-блоттинга является распространенной процедурой. [2] [20] [21] Например, широко распространено мнение, что появление множественной лекарственной устойчивости (МЛУ) сделало эффективную терапию рака чрезвычайно сложной задачей. Поэтому важно раннее, точное и чувствительное открытие механизма МЛУ, а также поиск более эффективных химиотерапевтических подходов для применения в клинических условиях. Экспрессию MDR1/P-гликопротеина в клеточных линиях P388/ADR, P388 и HCT-15 исследуют с использованием метода WB. ВБ также определил уровни MRP1. [2] [22] [23]
С другой стороны, поскольку вестерн-блоттинг может различать различные изоформы белка, его можно использовать для диагностики заболеваний, связанных с прионами и изоформами белка, таких как рак. Например, вестерн-блоттинг-анализ изоформ белков 14-3-3 в мозговой жидкости может идентифицировать болезнь Крейтцфельдта-Якоба. [2] [24] Кроме того, заболевание легких фермеров — это заболевание легких, вызванное вдыханием антигенных частиц, и исследования показали, что вестерн-блоттинг может быть полезным вариантом для выявления иммунореактивных белков, связанных с заболеванием легких фермеров. [2] Кроме того, вестерн-блоттинг также используется для идентификации белков в синовиальной жидкости и сыворотке крови, что позволяет диагностировать клинические симптомы остеоартрита и ревматоидного артрита. [2] [25] Вестерн-блоттинг используется для оценки уровней экспрессии белка FSTL1 у людей с остеоартритом коленного сустава, который служит потенциальным биомаркером повреждения суставов. [2] [26] Кроме того, он используется для идентификации белков в синовиальной жидкости и сыворотке крови, что позволяет диагностировать клинические симптомы остеоартрита и ревматоидного артрита. Он используется для оценки уровня экспрессии белка FSTL1 у людей с остеоартритом коленного сустава, который служит потенциальным биомаркером повреждения суставов. [2] [27] [28]
Для разработки лекарств, определения терапевтических мишеней и биологических исследований важно понять, где белки расположены внутри клетки. [2] [29] Субклеточное расположение белков внутри клетки и их функции тесно связаны. Связь между функцией белков и их локализацией позволяет предположить, что при движении белков их функции могут меняться или приобретать новые характеристики. Внутриклеточное размещение белка можно определить с помощью различных методов. Было создано множество эффективных и надежных вычислительных инструментов и стратегий, которые используются для определения субклеточной локализации белков. [30] С помощью методов субклеточного фракционирования WB продолжает оставаться важным фундаментальным методом исследования и понимания локализации белка. [2]
Благодаря разнообразию эпитопов антитела вызвали интерес как в фундаментальных, так и в клинических исследованиях. Основой характеристики и проверки антител является картирование эпитопов. Процедура идентификации сайтов связывания антитела (эпитопов) на целевом белке называется «картированием эпитопов». Поиск связывающего эпитопа антитела важен для открытия и создания новых вакцин, средств диагностики и лечения. [2] В результате были созданы различные методы картирования эпитопов антител. На данный момент специфичность вестерн-блоттинга является основной особенностью, которая отличает его от других методов картирования эпитопов. Существует несколько применений вестерн-блоттинга для картирования эпитопов на образцах кожи человека вируса геморрагической болезни. [2] [31] [32]

Метод вестерн-блоттинга состоит из гель-электрофореза для разделения нативных белков по трехмерной структуре или денатурированных белков по длине полипептида с последующим электрофоретическим переносом на мембрану (в основном из ПВДФ или нитроцеллюлозы ) и процедуру иммуноокрашивания для визуализации определенного белок на мембране блота.
Электрофорез в полиакриламидном геле с додецилсульфатом натрия (SDS-PAGE) обычно используется для денатурирующего электрофоретического разделения белков. Додецилсульфат натрия (SDS) обычно используется в качестве буфера (а также в геле), чтобы придать всем белкам одинаковый отрицательный заряд, поскольку белки могут быть положительно, отрицательно или нейтрально заряжены. Перед электрофорезом образцы белков часто кипятят, чтобы денатурировать присутствующие белки. Это гарантирует разделение белков по размеру и предотвращает разрушение образцов протеазами (ферментами, расщепляющими белки). После электрофоретического разделения белки переносятся на мембрану (обычно нитроцеллюлозу или ПВДФ). Затем мембрану часто окрашивают Ponceau S , чтобы визуализировать белки на блоте и убедиться в правильном переносе. Затем белки блокируются молоком (или другими блокирующими агентами), чтобы предотвратить связывание неспецифических антител, а затем окрашиваются антителами , специфичными к целевому белку. [7] [6] Наконец, мембрана будет окрашена вторичным антителом, которое распознает первое окрашивание антителом, которое затем можно использовать для обнаружения различными методами. Стадия гель-электрофореза включена в вестерн-блот-анализ для решения проблемы перекрестной реактивности антител.
Важным шагом в проведении вестерн-блоттинга должна быть эффективная подготовка проб, поскольку на интерпретацию этого анализа влияет подготовка белка, которая состоит из процессов экстракции и очистки белка. [33] [3] Для достижения эффективной экстракции белка необходимо выбрать правильный метод гомогенизации, поскольку он отвечает за разрыв клеточной мембраны и высвобождение внутриклеточных компонентов. [3] [34] Кроме того, идеальный буфер для лизиса необходим для получения значительных количеств целевого белка, поскольку буфер возглавляет процесс солюбилизации белка и предотвращает деградацию белка. После завершения подготовки пробы содержимое белка можно разделить с помощью гель-электрофореза. [3]

Белки образца разделяют с помощью гель-электрофореза . Разделение белков может осуществляться по изоэлектрической точке (pI), молекулярной массе , электрическому заряду или комбинации этих факторов. Характер разделения зависит от обработки образца и природы геля.
Безусловно, наиболее распространенный тип гель-электрофореза использует полиакриламидные гели и буферы, наполненные додецилсульфатом натрия (SDS). ДСН-ПААГ (электрофорез в полиакриламидном геле с ДСН) поддерживает полипептиды в денатурированном состоянии после их обработки сильными восстановителями для удаления вторичной и третичной структуры (например, дисульфидных связей [SS] с сульфгидрильными группами [SH и SH]) и, таким образом, позволяет разделение белков по их молекулярной массе . Образцы белков покрываются отрицательно заряженным ДСН, фактически становятся анионными и мигрируют к положительно заряженному (более высокое напряжение) аноду (обычно имеющему красный провод) через акриламидную сетку геля. Белки меньшего размера мигрируют через эту сетку быстрее, и таким образом белки разделяются по размеру (обычно измеряемому в килодальтонах, кДа ). Концентрация акриламида определяет разрешение геля: чем выше концентрация акриламида, тем лучше разрешение белков с более низкой молекулярной массой. Чем ниже концентрация акриламида, тем лучше разрешение белков с более высокой молекулярной массой. В большинстве блотов белки перемещаются по гелю только в одном измерении.
Образцы загружаются в лунки геля. Одна дорожка обычно отведена для маркера или лестницы , которая представляет собой коммерчески доступную смесь белков с известной молекулярной массой, обычно окрашенную так, чтобы образовывать видимые цветные полосы. Когда вдоль геля прикладывается напряжение , белки мигрируют через него с разной скоростью в зависимости от их размера. Эти разные скорости продвижения (различные электрофоретические подвижности ) разделяются на полосы внутри каждой дорожки . Затем полосы белка можно сравнить с полосами лестницы, что позволяет оценить молекулярную массу белка.
Также можно использовать двумерный гель , который распределяет белки из одного образца в двух измерениях. Белки разделяются по изоэлектрической точке ( рН , при котором они имеют нейтральный суммарный заряд) в первом измерении и по их молекулярной массе во втором измерении.

Чтобы сделать белки доступными для обнаружения антител, их перемещают из геля на мембрану, твёрдую подложку, что является важной частью процесса. Существует два типа мембран: нитроцеллюлоза (НК) или поливинилидендифторид (ПВДФ ). Мембрана NC обладает высоким сродством к белку и способностью к его удержанию. Однако NC хрупкий и не позволяет использовать блот для повторного зондирования, тогда как мембрана из ПВДФ позволяет повторно зондировать блот. [1] Наиболее часто используемый метод переноса белков называется электроблоттингом . При электроблоттинге электрический ток вытягивает отрицательно заряженные белки из геля к положительно заряженному аноду и в мембрану из ПВДФ или НК. Белки перемещаются из геля на мембрану, сохраняя при этом ту организацию, которую они имели внутри геля. Более старый метод переноса предполагает размещение мембраны поверх геля и стопки фильтровальной бумаги поверх нее. Вся стопка помещается в буферный раствор, который под действием капиллярных сил поднимает бумагу , увлекая за собой белки. На практике этот метод обычно не используется из-за длительного времени процедуры.
В результате любого процесса переноса белки оказываются на тонком слое мембраны для обнаружения. Обе разновидности мембран выбраны из-за их неспецифических свойств связывания белков (т.е. одинаково хорошо связывают все белки). Связывание с белками основано на гидрофобных взаимодействиях, а также на заряженных взаимодействиях между мембраной и белком. Нитроцеллюлозные мембраны дешевле, чем ПВДФ, но гораздо более хрупкие и не выдерживают многократных испытаний.
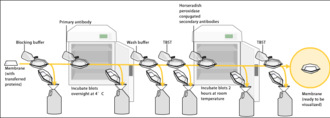
Окрашивание общего белка позволяет визуализировать общий белок, который был успешно перенесен на мембрану, что позволяет пользователю проверить равномерность переноса белка и выполнить последующую нормализацию целевого белка с фактическим количеством белка на дорожку. Нормализация с помощью так называемого «контроля нагрузки» была основана на иммуноокрашивании «домашних» белков в классической процедуре, но в последнее время движется к полному окрашиванию белков из-за множества преимуществ. [35] Для нормализации вестерн-блоттинга было описано по крайней мере семь различных подходов к окрашиванию общего белка: Ponceau S , методы без окрашивания, Sypro Ruby, Epicocconone , Coomassie R-350 , Amido Black и Cy5 . [35] Чтобы избежать шума сигнала, перед блокированием мембраны следует провести общее окрашивание белков. Тем не менее, были описаны и пост-антителые окраски. [36]
Поскольку мембрана была выбрана из-за ее способности связывать белок, а также поскольку и антитела, и мишень являются белками, необходимо предпринять шаги для предотвращения взаимодействия между мембраной и антителом, используемым для обнаружения белка-мишени. Блокирование неспецифического связывания достигается путем помещения мембраны в разбавленный раствор белка – обычно 3–5% бычьего сывороточного альбумина (BSA) или обезжиренного сухого молока (оба недорогие) в трис-солевом буфере (TBS) или I-Block с небольшим процентом (0,1%) моющего средства, такого как Tween 20 или Triton X-100 . Хотя обезжиренное сухое молоко является предпочтительным из-за его доступности, необходим соответствующий блокирующий раствор, поскольку не все белки в молоке совместимы со всеми полосами обнаружения. [1] Белок в разбавленном растворе прикрепляется к мембране во всех местах, где не прикрепились целевые белки. Таким образом, когда добавляется антитело, оно не может связываться с мембраной, и поэтому единственным доступным сайтом связывания является специфический целевой белок. Это уменьшает фон в конечном продукте вестерн-блоттинга, что приводит к более четким результатам и исключает ложноположительные результаты.

В процессе обнаружения мембрана «исследуется» на предмет интересующего белка с помощью модифицированного антитела, связанного с репортерным ферментом; при воздействии соответствующего субстрата этот фермент запускает колориметрическую реакцию и дает цвет. По ряду причин это традиционно происходит в два этапа, хотя в настоящее время для некоторых приложений доступны одноэтапные методы обнаружения.
Первичные антитела генерируются, когда вид хозяина или культура иммунных клеток подвергается воздействию интересующего белка (или его части). Обычно это часть иммунного ответа, тогда как здесь их собирают и используют в качестве чувствительных и специфичных инструментов обнаружения, которые напрямую связывают белок.
После блокирования раствор первичного антитела (обычно от 0,5 до 5 мкг/мл), разведенного в промывочном буфере PBS или TBST, инкубируют с мембраной при осторожном перемешивании обычно в течение часа при комнатной температуре или в течение ночи при 4 ° C. также можно инкубировать при разных температурах, при этом меньшие температуры связаны с большим связыванием, как специфичным (к целевому белку, «сигнал»), так и неспецифическим («шум»). После инкубации мембрану несколько раз промывают промывочным буфером для удаления несвязавшихся первичных антител и тем самым минимизируют фон. [1] Обычно промывочный буферный раствор состоит из забуференного физиологического раствора с небольшим процентом моющего средства, а иногда и из сухого молока или БСА.
После промывания мембраны для удаления несвязавшегося первичного антитела мембрана подвергается воздействию другого антитела, известного как вторичное антитело . Антитела происходят из животных источников (или культур гибридом животного происхождения ). Вторичное антитело распознает видоспецифичную часть первичного антитела и связывается с ней. Таким образом, вторичное антимышиное антитело будет связываться практически с любым первичным антителом мышиного происхождения и может называться «антивидовым» антителом (например, антимышиным, антикозлиным и т. д.). Чтобы обеспечить обнаружение целевого белка, вторичное антитело обычно связывают с биотином или репортерным ферментом , таким как щелочная фосфатаза или пероксидаза хрена . Это означает, что несколько вторичных антител будут связываться с одним первичным антителом и усиливать сигнал, позволяя обнаруживать белки в гораздо более низкой концентрации, чем можно было бы увидеть только с помощью SDS-PAGE.
Пероксидаза хрена обычно связывается со вторичными антителами, что позволяет обнаружить целевой белок с помощью хемилюминесценции . Хемилюминесцентный субстрат расщепляется пероксидазой хрена, что приводит к образованию люминесценции . Следовательно, образование люминесценции пропорционально количеству вторичных антител, конъюгированных с пероксидазой хрена, и, следовательно, косвенно измеряет присутствие целевого белка. Чувствительный лист фотопленки прикладывается к мембране, и воздействие света реакции создает изображение антител, связанных с блотом. Более дешевый, но менее чувствительный подход заключается в окрашивании 4-хлорнафтолом с 1% перекисью водорода ; реакция перекисных радикалов с 4-хлорнафтолом дает темно-фиолетовое пятно, которое можно фотографировать без использования специальной фотопленки.
Как и в процедурах ELISPOT и ELISA , фермент может быть снабжен молекулой субстрата, которая будет превращаться ферментом в окрашенный продукт реакции, который будет виден на мембране (см. рисунок ниже с синими полосами).
Другой метод обнаружения вторичных антител использует антитело, связанное с флуорофором в ближнем инфракрасном диапазоне. Свет, излучаемый при возбуждении флуоресцентного красителя, является статическим, что делает флуоресцентное обнаружение более точным и точным показателем разницы в сигнале, производимом мечеными антителами, связанными с белками при вестерн-блоттинге. Белки можно точно определить количественно, поскольку сигнал, генерируемый различными количествами белков на мембранах, измеряется в статическом состоянии, в отличие от хемилюминесценции, при которой свет измеряется в динамическом состоянии. [37]
Третья альтернатива заключается в использовании радиоактивной метки, а не фермента, связанного со вторичным антителом, например, мечение антителосвязывающего белка, такого как белок А стафилококка или стрептавидин, радиоактивным изотопом йода. Поскольку другие методы безопаснее, быстрее и дешевле, этот метод сейчас используется редко; однако преимуществом этого подхода является чувствительность визуализации на основе авторадиографии, которая обеспечивает высокоточную количественную оценку белка в сочетании с оптическим программным обеспечением (например, Optiquant).
Исторически процесс зондирования выполнялся в два этапа из-за относительной простоты получения первичных и вторичных антител в отдельных процессах. Это дает исследователям и корпорациям огромные преимущества с точки зрения гибкости, снижения затрат и добавляет этап усиления к процессу обнаружения. Однако, учитывая появление высокопроизводительного анализа белков и более низкие пределы обнаружения, возник интерес к разработке одноэтапных систем зондирования, которые позволили бы процессу происходить быстрее и с меньшим количеством расходных материалов. Для этого требуется антитело-зонд, которое распознает интересующий белок и содержит обнаруживаемую метку, зонды, которые часто доступны для известных белковых меток . Первичный зонд инкубируется с мембраной аналогично тому, как это происходит с первичным антителом, в двухэтапном процессе, а затем после серии стадий промывки он готов к прямому обнаружению.

После того, как несвязанные зонды смываются, вестерн-блоттинг готов к обнаружению зондов, которые помечены и связаны с интересующим белком. С практической точки зрения, не все вестерны обнаруживают белок только на одной полосе мембраны. Приблизительные размеры определяются путем сравнения окрашенных полос с полосами маркера или лестницы, загруженными во время электрофореза. Процесс обычно повторяется для структурного белка, такого как актин или тубулин , который не должен меняться между образцами. Количество целевого белка нормализуют по структурному белку для контроля между группами. Лучшей стратегией является нормализация общего белка, визуализируемого с помощью трихлорэтанола [38] [39] или эпикокконона . [40] Эта практика обеспечивает коррекцию количества общего белка на мембране в случае ошибок или неполного переноса. (см. нормализацию вестерн-блоттинга )
Метод колориметрического обнаружения зависит от инкубации вестерн-блоттинга с субстратом, который реагирует с репортерным ферментом (таким как пероксидаза ), который связан со вторичным антителом. При этом растворимый краситель преобразуется в нерастворимую форму другого цвета, которая осаждается рядом с ферментом и тем самым окрашивает мембрану. Затем развитие блота останавливают смыванием растворимого красителя. Уровни белка оцениваются с помощью денситометрии (насколько интенсивно пятно) или спектрофотометрии .
Методы хемилюминесцентного обнаружения зависят от инкубации вестерн-блоттинга с субстратом, который будет люминесцировать при воздействии репортера на вторичном антителе. Затем свет обнаруживается ПЗС-камерами , которые фиксируют цифровое изображение вестерн-блоттинга или фотопленки. Использование пленки для вестерн-блоттинга постепенно исчезает из-за нелинейности изображения (неточной количественной оценки). Изображение анализируется с помощью денситометрии, которая оценивает относительную степень окрашивания белка и количественно оценивает результаты с точки зрения оптической плотности. Новое программное обеспечение позволяет проводить дальнейший анализ данных, например, анализ молекулярной массы, если используются соответствующие стандарты.
Радиоактивные метки не требуют ферментных субстратов, а позволяют размещать медицинскую рентгеновскую пленку непосредственно на вестерн-блоттинге, который развивается при воздействии метки и создает темные области, соответствующие полосам интересующего белка (см. изображение выше). Важность методов радиоактивного обнаружения снижается из-за его опасного излучения , поскольку оно очень дорогое, риски для здоровья и безопасности высоки, а ECL (усиленная хемилюминесценция) представляет собой полезную альтернативу.

Флуоресцентно -меченный зонд возбуждается светом, а излучение возбуждения затем обнаруживается фотодатчиком, таким как ПЗС-камера, оснащенная соответствующими эмиссионными фильтрами, которые захватывают цифровое изображение вестерн-блоттинга и позволяют осуществлять дальнейший анализ данных, такой как анализ молекулярной массы и количественный вестерн-блот-анализ. Флуоресценция считается одним из лучших методов количественного определения, но она менее чувствительна, чем хемилюминесценция. [41]
Одно из основных различий между мембранами из нитроцеллюлозы и ПВДФ связано со способностью каждой из них поддерживать «снятие» антител и повторное использование мембраны для последующих зондов антител. Несмотря на то, что существуют хорошо зарекомендовавшие себя протоколы удаления нитроцеллюлозных мембран, более прочный ПВДФ позволяет облегчить удаление и увеличить количество повторных использований, прежде чем фоновый шум ограничит эксперименты. Еще одно отличие состоит в том, что, в отличие от нитроцеллюлозы, ПВДФ перед использованием необходимо замачивать в 95% этаноле, изопропаноле или метаноле. Мембраны из ПВДФ также имеют тенденцию быть толще и более устойчивы к повреждениям во время использования. [42]
Чтобы гарантировать воспроизводимость результатов вестерн-блоттинга, важно сообщать о различных параметрах, упомянутых выше, включая подготовку образцов, концентрацию белка, используемого для загрузки, процент геля и рабочее состояние, различные методы переноса, пытаясь условия блокады, концентрация антител, методы идентификации и количественного определения. Многие из опубликованных статей не охватывают все эти переменные. Следовательно, крайне важно описать различные экспериментальные обстоятельства или параметры, чтобы повысить повторяемость и точность ВБ. Таким образом, для повышения повторяемости ВБ требуются минимальные критерии отчетности. [2] [43]
Двумерная SDS-PAGE использует принципы и методы, изложенные выше. 2-D SDS-PAGE, как следует из названия, предполагает миграцию полипептидов в двух измерениях. Например, в первом измерении полипептиды разделяются по изоэлектрической точке , а во втором измерении полипептиды разделяются по их молекулярной массе . Изоэлектрическая точка данного белка определяется относительным количеством положительно (например, лизин, аргинин) и отрицательно (например, глутамат, аспартат) заряженных аминокислот, причем отрицательно заряженные аминокислоты способствуют низкой изоэлектрической точке, а положительно заряженные аминокислоты способствуют снижению изоэлектрической точки. до высокой изоэлектрической точки. Образцы также можно разделить сначала в невосстанавливающих условиях с использованием SDS-PAGE, а затем в восстанавливающих условиях во втором измерении, которое разрушает дисульфидные связи, удерживающие субъединицы вместе. SDS-PAGE также можно сочетать с мочевиной-PAGE для получения двумерного геля.
В принципе, этот метод позволяет разделить все клеточные белки на одном большом геле. Основным преимуществом этого метода является то, что он часто различает различные изоформы конкретного белка – например, белка, который был фосфорилирован (путем добавления отрицательно заряженной группы). Отделенные белки можно вырезать из геля, а затем проанализировать с помощью масс-спектрометрии , которая определяет их молекулярную массу.
Сигнал в полосе может быть слабым или отсутствовать по ряду причин, связанных с количеством использованных антител и антигена. Эту проблему можно решить, используя идеальные концентрации и разведения антигенов и антител, указанные в паспорте поставщика. Увеличение периода экспозиции в программном обеспечении системы обнаружения может устранить слабые полосы, вызванные более низкими концентрациями образца и антител. [2]
Когда белок расщепляется протеазами, могут появиться несколько полос, отличных от предсказанных полос с низкой молекулярной массой. Развитие многочисленных полос можно предотвратить, правильно подготовив образцы белка с достаточным количеством ингибиторов протеазы. Множественные полосы могут появиться в области высокой молекулярной массы, поскольку некоторые белки образуют димеры, тримеры и мультимеры; эту проблему можно решить, нагревая образец в течение более длительных периодов времени. Белки с посттрансляционными модификациями (ПТМ) или многочисленными изоформами вызывают появление нескольких полос в различных областях молекулярной массы. ПТМ можно удалить с образца с помощью специальных химикатов, которые также удаляют лишние полосы. [2]
Высокие концентрации антител, неадекватное блокирование, неадекватная промывка и чрезмерное время воздействия во время визуализации могут привести к высокому фону в блотах. Устранив эти проблемы, можно было бы избежать высокого фона в блотах. [2]
Утверждалось, что возникло множество странных и неравных полос, включая черные точки, белые пятна или полосы, а также изогнутые полосы. Блок-точки удаляются из блотов путем эффективного блокирования. Белые пятна появляются в результате образования пузырьков между мембраной и гелем. Белые полосы появляются на блотах, когда основные и вторичные антитела присутствуют в значительных концентрациях. Из-за высокого напряжения, используемого во время анализа геля, и быстрой миграции белков на блотах появляются улыбающиеся полосы. Странные полосы на пятне устраняются путем решения этих проблем. [2]
Во время вестерн-блоттинга может возникнуть несколько проблем, связанных с различными этапами этой процедуры. Эти проблемы могут возникнуть на этапе анализа белков, например, при обнаружении низко- или посттрансляционно модифицированных белков. Кроме того, они могут быть основаны на отборе антител, поскольку качество антител играет значительную роль именно при обнаружении белков. [3] Из-за наличия подобных проблем в области подготовки клеточного лизата и процедур блоттинга вносятся различные улучшения для получения надежных результатов. Более того, для достижения более чувствительного анализа и преодоления проблем, связанных с вестерн-блоттингом, было разработано и использовано несколько различных методов, таких как дальний вестерн-блоттинг , диффузионный блоттинг, вестерн-блоттинг с разрешением одной клетки и автоматизированный микрофлюидный вестерн-блоттинг. [3]
Исследователи используют различное программное обеспечение для обработки и выравнивания фрагментов изображений для элегантного представления результатов вестерн-блоттинга. Популярные инструменты включают Sciugo, Microsoft PowerPoint , Adobe Illustrator и GIMP .
С 1980 года вестерн-блоттинг стал наиболее используемым методом в молекулярной биологии для определения присутствия и количества определенного белка. За прошедшие годы было разработано множество «продвинутых» и «оптимизированных» систематических методов. Эти разработки обеспечивают более совершенные и более чувствительные результаты с помощью более совершенных технологий визуализации и современных методов флуоресцентной маркировки. [2]
Методом, получившим наибольшее распространение для определения ДНК-связывающих белков и взаимодействий белок-ДНК, является тест на сдвиг электрофоретической подвижности. Комплексы белок-ДНК анализируют методом сдвига-ВБ. Он создается путем переноса комплексов белок-ДНК, в которых ДНК в заряженной мембране располагается под нитроцеллюлозной мембраной, а белки удерживаются в мембране. Затем для идентификации белков используются специфические антитела, а для идентификации ДНК — радиоактивная метка. Кроме того, переданные белки и ДНК можно извлечь и изучить более детально. [2] [44]
Одноклеточный ВБ (scWB), в дополнение к традиционному ВБ, считается прорывом в изучении субклеточной локализации белка и в оценке одноклеточного белка. Он используется при измерении уровней и условий экспрессии белка от одной клетки к другой. С помощью одноклеточного WB селективность и специфичность вестерн-блоттинга были расширены и теперь включают анализ одноклеточных белков. Этот метод преодолевает ограничения точности и чувствительности антител. Кроме того, благодаря своей универсальности его можно использовать для одновременного измерения множества белков-мишеней из разных клеточных линий и отдельных клеток. [2] [45]
Разработка, известная как количественный WB на основе флуоресценции (QFWB), позволяет исследователям проводить сравнительный анализ экспрессии с большей чувствительностью и точностью, чем когда-либо прежде. Количественная оценка в QFWB означает действительно количественную оценку с повышенной чувствительностью. Этот метод используется для выявления мельчайших изменений экспрессии между различными образцами. С помощью вторичного антитела, помеченного флуоресцентной меткой, QFWB создает линейный профиль обнаружения. Современные методы QFWB позволяют одновременно наносить двойную маркировку и более чувствительны к выявлению мельчайших изменений. [2] [46]
Количественный компьютеризированный вестерн-блоттинг анализирует реактивность отдельных антител к конкретным антигенам для идентификации иммунодоминантных и иммунорецессивных детерминант с использованием двух показателей, таких как чистая интенсивность полосы и общая интенсивность полосы WB. Создание быстрых серодиагностических тестов и эффективных вакцин стало возможным благодаря идентификации определенных иммунодоминантных антигенов. Исследование ищет серологические маркеры для ранней диагностики рака, вирусных и аутоиммунных заболеваний с использованием количественного компьютеризированного вестерн-блоттинга. [2] [47]
Это метод, который сочетает в себе традиционное разделение белков с помощью SDS-PAGE с платформой микрочипов на основе шариков, которая иммобилизует белки на микросферах. Такое сочетание разделения белков, однородности и чувствительности позволяет быстро определить количество различных белков-мишеней, а также их изменений. Преимущество DigiWest заключается в том, что вестерн-блоттинг проводится с использованием микрочипов на основе шариков, что позволяет одновременно обнаруживать и анализировать сотни различных белков и их изменений с использованием широкого спектра разнообразных антител. [2] [48]
Чтобы обнаружить множество белков на одном микрофлюидном чипе, проводят микрофлюидный вестерн-блоттинг с использованием ряда процессов, включая обогащение образца, определение размера белка, осаждение белка, а затем зондирование антител in situ. Фотореактивный (УФ-свет) полиакриламидный гель и поверхность с фоторисунком (синий свет) являются основой этой многоэтапной процедуры. Благодаря улучшению аналитических характеристик теперь WB можно выполнить за 10–60 минут, сохраняя при этом высокие пределы обнаружения чувствительности (50 пикомолей) и уровни обнаружения мультиплексированных компонентов (фемтограммы). Таким образом, объединяя превосходную специфичность и преимущества мультиплексирования с высокой пропускной способностью, WB создает краеугольный камень для быстрой протеомики. [2] [49]
Усовершенствованная технология WB, называемая multistrip WB, основана на одновременном переносе различных белков с нескольких полосок полиакриламидного геля на одну мембрану из поливинилидендифторида или нитроцеллюлозы. Многополосный WB позволяет одновременно контролировать до девяти отдельных белков при одной и той же загрузке образца и до десятикратного увеличения выходных данных за один цикл WB. Системная биология, исследования клеточных сигналов и биомедицинская диагностика выиграют от использования этого метода. [2] [50]
Вестерн-блоттинг на основе капиллярного и микрочипового электрофореза был создан для уменьшения количества образцов белка и времени, необходимого для выполнения вестерн-блоттинга. Это способствует более чувствительному и точному измерению различных белков-мишеней из любого лизата одной клетки, выполняемому на микрочипе. 400 нанограммов клеточного лизата — это все, что необходимо для идентификации и количественного определения одиннадцати различных белков. [2] [51]