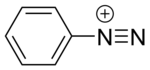
Соединения диазония или соли диазония представляют собой группу органических соединений , имеющих общую функциональную группу [R-N + ≡N]X - где R может быть любой органической группой, такой как алкил или арил , а X представляет собой неорганический или органический анион. , например, галогенид .
По данным рентгеновской кристаллографии, связь C−N + ≡N в типичных солях диазония линейна. Расстояние связи N + ≡N в тетрафторборате бензолдиазония составляет 1,083(3) Å [1] , что практически идентично таковому для молекулы диазота (N≡N).
Линейные константы свободной энергии σ m и σ p указывают на то, что диазониевая группа является сильно электроноакцепторной. Таким образом, диазониозамещенные фенолы и бензойные кислоты значительно снижают значения p K a по сравнению с их незамещенными аналогами. P K a фенольного протона 4-гидроксибензолдиазония составляет 3,4 [2] против 9,9 для самого фенола. Другими словами, диазониевая группа снижает р Ка ( повышает кислотность) в миллион раз.
Стабильность солей арендиазония очень чувствительна к противоиону. Хлорид фенилдиазония взрывоопасен, но с тетрафторборатом бензолдиазония легко справиться на рабочем столе. [ нужна цитата ]
Реакции S N 1 и S N 2 не происходят.
Соли арениазония являются универсальными реагентами, как описано в следующих разделах [3] . После электрофильного ароматического замещения химия диазония является наиболее часто применяемой стратегией для получения ароматических соединений.
Соли алканедиазония не имеют синтетического значения из-за их чрезвычайной и неконтролируемой реакционной способности в отношении замещения S N 2/S N 1/E1. Однако эти катионы представляют теоретический интерес. Кроме того, считается, что карбоксилат метилдиазония является промежуточным продуктом при метилировании карбоновых кислот диазометаном , что является обычным превращением. [4] [5]
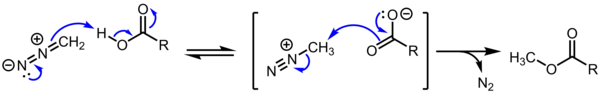
Потеря N 2 выгодна как энтальпически, так и энтропийно:
Для вторичных и третичных разновидностей алканедиазония изменение энтальпии, по расчетам, близко к нулю или отрицательное, с минимальным активационным барьером. Следовательно, вторичные и (особенно) третичные виды алканедиазония являются либо несвязанными, несуществующими видами, либо, в лучшем случае, чрезвычайно мимолетными промежуточными соединениями. [6]
По оценкам, водное значение p K a метандиазония ( [CH 3 N 2 ] + ) составляет <10. [7]
Процесс образования соединений диазония называется «диазотированием», «диазонированием» или «диазотированием». Впервые о реакции сообщил Питер Грисс в 1858 году, который впоследствии открыл несколько реакций этого нового класса соединений. Чаще всего соли диазония получают обработкой ароматических аминов азотистой кислотой и дополнительной кислотой. Обычно азотистая кислота образуется in situ (в той же колбе) из нитрита натрия и избытка минеральной кислоты (обычно водного раствора HCl, H 2 SO 4 , p - H 3 CC 6 H 4 SO 3 H или H[BF 4 ] ):

Хлоридные соли катиона диазония, традиционно получаемые из анилина, нитрита натрия и соляной кислоты , нестабильны при комнатной температуре и классически получаются при 0–5 ° C. Однако можно выделить соединения диазония в виде солей тетрафторбората или тозилата [8] , которые являются стабильными твердыми веществами при комнатной температуре. [9] Часто предпочтительно, чтобы соль диазония оставалась в растворе, но она имеет тенденцию к пересыщению . Операторы были ранены или даже убиты в результате неожиданной кристаллизации соли с последующей ее детонацией. [10]
Из-за этих опасностей соединения диазония часто не выделяются. Вместо этого они используются на месте . Этот подход проиллюстрирован на примере получения аренсульфонильного соединения: [11]
Первое использование солей диазония заключалось в производстве водостойких окрашенных тканей путем погружения ткани в водный раствор соединения диазония с последующим погружением в раствор связующего вещества (богатого электронами кольца, подвергающегося электрофильному замещению). Основное применение соединений диазония остается в красочной и пигментной промышленности. [12]
Наиболее распространенной реакцией солей диазония остается азосочетание , которое используется в производстве азокрасителей . [13] В этом процессе соединение диазония подвергается атаке, т.е. связывается с богатыми электронами субстратами. Когда партнерами сочетания являются арены, такие как анилин и фенолы, этот процесс является примером электрофильного ароматического замещения :
Другим коммерчески важным классом партнеров сочетания являются ацетоуксусные амиды, о чем свидетельствует получение пигмента желтого 12, диарилидного пигмента . [14]
Полученные азосоединения часто являются полезными красителями и фактически называются азокрасителями . [12] Глубокие цвета красителей отражают их расширенное сопряжение . Например, краситель анилиновый желтый получают путем смешивания анилина и холодного раствора соли диазония и последующего энергичного встряхивания. Анилиновый желтый получают в виде желтого твердого вещества. [15] Аналогично, холодный основной раствор нафталин-2-ола (бета-нафтола) дает интенсивно оранжево-красный осадок. [15] Метилоранж — пример азокрасителя, который используется в лаборатории в качестве индикатора pH .
Катионы арениазония подвергаются нескольким реакциям, в которых группа N 2 заменяется другой группой или ионом. Некоторые из основных из них следующие. [16] [17]
Пара катионов диазония может образовывать биарилы . Это превращение иллюстрируется сочетанием соли диазония , полученной из антраниловой кислоты, с образованием дифеновой кислоты ( (C 6 H 4 CO 2 H) 2 ). [18] В аналогичной реакции та же соль диазония теряет N 2 и CO 2 с образованием бензона . [19]
Хлорид бензолдиазония, нагреваемый с хлоридом меди или бромидом меди, растворенными соответственно в HCl или HBr, дает хлорбензол или бромбензол соответственно.
В реакции Гаттермана хлорид бензолдиазония нагревается с медным порошком и HCl или HBr с образованием хлорбензола и бромбензола соответственно. Он назван в честь немецкого химика Людвига Гаттермана . [20]
Катионы арендиазония реагируют с иодидом калия с образованием арилйодида: [21]
Фторбензол получают термическим разложением тетрафторбората бензолдиазония . Преобразование называется реакцией Бальца-Шимана . [22]
Традиционная реакция Бальца-Шимана была предметом многих мотиваций, например, использование гексафторфосфата(V) ( [PF 6 ] - ) и гексафторантимоната (V) ( [SbF 6 ] - ) вместо тетрафторбората ( [BF 4 ] - ) . Диазотирование можно осуществлять с помощью солей нитрозония, таких как гексафторантимонат(V) нитрозония [NO] + [SbF 6 ] - . [23]
Катионы арениазония, восстановленные фосфорноватистой кислотой , [24] этанолом , [25] станнитом натрия [26] или щелочным тиосульфатом натрия [27] дают бензол:
Альтернативный способ, предложенный Baeyer & Pfitzinger, заключается в замене диазогруппы на H: сначала превратить ее в гидразин путем обработки SnCl 2 , а затем окислить до углеводорода путем кипячения с раствором сульфата меди. [28]
Фенолы получают нагреванием водных растворов солей арендиазония: [29] [30] [31] [32]
Эта реакция носит немецкое название Phenolverkochung («приготовление с получением фенолов»). Образующийся фенол может реагировать с солью диазония, и поэтому реакцию проводят в присутствии кислоты, которая подавляет эту дальнейшую реакцию. [33] Гидроксилирование типа Зандмейера также возможно с использованием Cu 2 O и Cu 2+ в воде.
Нитробензол можно получить обработкой фторбората бензолдиазония нитритом натрия в присутствии меди. Альтернативно, диазотирование анилина может быть проведено в присутствии оксида меди, который образует нитрит меди на месте:
Цианогруппу обычно невозможно ввести путем нуклеофильного замещения галогенаренов , но такие соединения легко получить из солей диазония. Показательным является получение бензонитрила с использованием реагента цианида меди :
Эта реакция представляет собой особый тип реакции Зандмейера .
Две исследовательские группы сообщили о трифторметилировании солей диазония в 2013 году. Гуссен сообщил о получении комплекса CuCF 3 из CuSCN, TMSCF 3 и Cs 2 CO 3 . Напротив, Фу сообщил о трифторметилировании с использованием реагента Умемото ( S -трифторметилдибензотиофения тетрафторборат) и порошка меди (условия типа Гаттермана). Их можно описать следующим уравнением:
Скобка указывает на то, что другие лиганды меди, вероятно, присутствуют, но не указаны.
Соли диазония можно превратить в тиолы в двухэтапной процедуре. Обработка хлорида бензолдиазония этилксантогенатом калия с последующим гидролизом промежуточного эфира ксантогената дает тиофенол :
Арильную группу можно соединить с другой с помощью солей арендиазония. Например, обработка хлорида бензолдиазония бензолом (ароматическим соединением) в присутствии гидроксида натрия дает дифенил :
Эта реакция известна как реакция Гомберга-Бахмана . Аналогичная конверсия достигается также обработкой хлорида бензолдиазония этанолом и медным порошком.
Группа Bpin (пинаколатобор), используемая в реакциях кросс-сочетания Сузуки-Мияуры , может быть установлена реакцией соли диазония с бис(пинаколато)дибором в присутствии пероксида бензоила (2 моль %) в качестве инициатора: [34] Альтернативно подобное борилирование может быть достигнуто с использованием карбонильных комплексов переходных металлов, включая декакарбонил димарганца. [35]
Формильная группа –CHO может быть введена путем обработки соли арилдиазония формальдоксимом ( H 2 C=NOH ) с последующим гидролизом арилальдоксима с образованием арилальдегида. [36] Эта реакция известна как реакция Бука. [37]
Хлорид бензолдиазония реагирует с соединениями, содержащими активированные двойные связи, с образованием фенилированных продуктов. Реакция называется арилированием Меервейна :
Катионы диазония в реакциях с металлокомплексами ведут себя аналогично NO + . Например, комплексы низковалентных металлов добавляют с солями диазония. Показательными комплексами являются [Fe(CO) 2 (PPh 3 ) 2 (N 2 Ph)] + и хирально-металлический комплекс Fe(CO)(NO)(PPh 3 )(N 2 Ph) . [39]
В потенциальном применении в нанотехнологиях соли диазония 4-хлорбензолдиазония тетрафторборат очень эффективно функционализируют одностенные нанотрубки . [40] Чтобы отшелушить нанотрубки, их смешивают с ионной жидкостью в ступке пестиком . Соль диазония добавляют вместе с карбонатом калия , и после измельчения смеси при комнатной температуре поверхность нанотрубок покрывается хлорфенильными группами с эффективностью 1 на 44 атома углерода. Эти добавленные заместители не позволяют трубкам образовывать плотные пучки из-за больших сил сцепления между ними, что является постоянной проблемой в технологии нанотрубок.
Также возможно функционализировать кремниевые пластины солями диазония, образующими арильный монослой. В одном исследовании поверхность кремния промывают фтористым аммонием , оставляя ее покрытой кремний-водородными связями (гидридная пассивация). [41] Реакция поверхности с раствором соли диазония в ацетонитриле в течение 2 часов в темноте является самопроизвольным процессом по свободнорадикальному механизму : [42]

К настоящему времени прививка солей диазония к металлам осуществлена на поверхности железа , кобальта , никеля , платины , палладия , цинка , меди и золота . [43] Сообщалось также о прививке на алмазные поверхности. [44] Одним из интересных вопросов является фактическое расположение арильной группы на поверхности. Исследование in silico [45] показывает, что в периоде 4 элементов от титана до меди энергия связи уменьшается слева направо , поскольку число d-электронов увеличивается. Металлы слева от железа расположены под наклоном или плоско на поверхности, что способствует образованию пи-связи между металлом и углеродом , а металлы справа от железа расположены в вертикальном положении, что способствует образованию сигма-связи между металлом и углеродом . Это также объясняет, почему до сих пор была возможна прививка солей диазония к металлам, расположенным справа от железа в периодической таблице .
Соли диазония можно восстановить хлоридом олова ( SnCl 2 ) до соответствующих производных гидразина . Эта реакция особенно полезна при синтезе индола по Фишеру триптановых соединений и индометацина . Использование дитионита натрия является улучшением по сравнению с хлоридом олова, поскольку это более дешевый восстановитель, вызывающий меньше проблем с окружающей средой.
Ионы алканедиазония , редко встречающиеся в органической химии, считаются возбудителями канцерогенов. В частности, считается, что нитрозамины подвергаются метаболической активации с образованием разновидностей алканедиазония.

Твердые галогениды диазония часто взрывоопасны, и сообщалось о смертельных случаях и травмах. [10]
Природа анионов влияет на стабильность соли. Перхлораты арениазония, такие как перхлорат нитробензолдиазония, использовались для инициирования взрывчатых веществ.
{{cite book}}: CS1 maint: местоположение ( ссылка )