

В химии радикал , также известный как свободный радикал , представляет собой атом , молекулу или ион , имеющий по крайней мере один неспаренный валентный электрон . [1] [2] За некоторыми исключениями, эти неспаренные электроны делают радикалы высоко химически активными . Многие радикалы спонтанно димеризуются . Большинство органических радикалов имеют короткое время жизни.
Ярким примером радикала является гидроксильный радикал (HO · ), молекула, имеющая один неспаренный электрон на атоме кислорода. Двумя другими примерами являются триплет кислорода и триплет карбен ( ꞉ CH
2), которые имеют два неспаренных электрона.
Радикалы могут генерироваться разными способами, но типичные методы включают окислительно-восстановительные реакции . Известно, что ионизирующее излучение , тепло, электрические разряды и электролиз производят радикалы. Радикалы являются промежуточными продуктами во многих химических реакциях, в большей степени, чем это следует из сбалансированных уравнений.
Радикалы играют важную роль в горении , химии атмосферы , полимеризации , плазмохимии , биохимии и многих других химических процессах. Большинство натуральных продуктов производятся ферментами, генерирующими радикалы. В живых организмах радикалы супероксид и оксид азота и продукты их реакции регулируют многие процессы, например, контроль тонуса сосудов и, следовательно, артериального давления. Они также играют ключевую роль в промежуточном метаболизме различных биологических соединений. Такие радикалы могут даже быть посланниками в процессе, получившем название окислительно-восстановительной сигнализации . Радикал может быть захвачен клеткой растворителя или связан иным образом.
Радикалы либо (1) образуются из молекул со спиновыми парами, либо (2) из других радикалов. Радикалы образуются из молекул со спиновыми парами в результате гомолиза слабых связей или переноса электрона, также известного как восстановление. Радикалы образуются из других радикалов в результате реакций замещения, присоединения и отщепления.
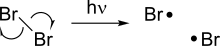
При гомолизе из молекулы со спиновой парой образуются два новых радикала путем разрыва ковалентной связи, в результате чего каждый из фрагментов остается с одним из электронов в связи. [3] Поскольку разрыв химической связи требует энергии, гомолиз происходит под воздействием тепла или света. Энергия диссоциации связи , связанная с гомолизом, зависит от стабильности данного соединения, а некоторые слабые связи способны гомолизоваться при относительно более низких температурах.
Некоторые реакции гомолиза особенно важны, поскольку служат инициатором других радикальных реакций. Одним из таких примеров является гомолиз галогенов, который происходит под действием света и служит движущей силой реакций радикального галогенирования.
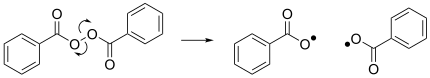
Другая примечательная реакция — гомолиз дибензоилпероксида, который приводит к образованию двух бензоилокси-радикалов и действует как инициатор многих радикальных реакций. [4]

Классически радикалы образуются в результате одноэлектронного восстановления . Обычно одноэлектронно восстановленные органические соединения нестабильны. Стабильность придается анион-радикалу, когда заряд может быть делокализован . Примеры включают нафтениды щелочных металлов , антрацениды и кетилы .

Отщепление водорода приводит к образованию радикалов. Для осуществления этой реакции связь CH донора атома водорода должна быть слабой, что редко случается в органических соединениях. Аллильные и особенно двуаллильные связи CH склонны к отрыву O 2 . Эта реакция лежит в основе высыхающих масел , таких как производные линолевой кислоты .
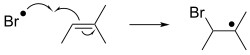
При свободнорадикальном присоединении радикал присоединяется к субстрату со спиновой парой. Применительно к органическим соединениям реакция обычно влечет за собой присоединение к алкену. Это присоединение генерирует новый радикал, который может присоединяться к еще одному алкену и т. д. Такое поведение лежит в основе радикальной полимеризации — технологии, с помощью которой производятся многие пластмассы . [5] [6]
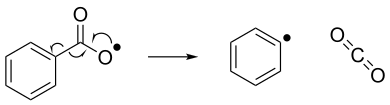
Радикальное исключение можно рассматривать как противоположность радикальному добавлению. При удалении радикала нестабильное радикальное соединение распадается на молекулу со спиновой парой и новое радикальное соединение. Ниже показан пример реакции отщепления радикала, при которой бензоилокси-радикал распадается на фенильный радикал и молекулу диоксида углерода. [7]
Хотя органические радикалы, как правило, внутренне стабильны (изолировано), на практике их существование является лишь временным, поскольку они имеют тенденцию к димеризации. Некоторые из них весьма долговечны. Обычно органические радикалы стабилизируются любым или всеми из этих факторов: наличием электроотрицательности, делокализации и стерических затруднений. [8] Соединение 2,2,6,6-тетраметилпиперидинилоксил иллюстрирует комбинацию всех трех факторов. Это коммерчески доступное твердое вещество, которое, помимо магнитных свойств, ведет себя как обычное органическое соединение.
Органические радикалы по своей природе являются электронодефицитными, поэтому чем больше электроотрицательность атома, на котором находится неспаренный электрон, тем менее устойчив радикал. [9] Например, среди углерода, азота и кислорода углерод является наиболее стабильным, а кислород — наименее стабильным.
Электроотрицательность также влияет на стабильность атомов углерода в различных гибридизациях. Больший s-характер коррелирует с более высокой электроотрицательностью атома углерода (из-за непосредственной близости s-орбиталей к ядру), а чем больше электроотрицательность, тем менее устойчив радикал. [9] sp-гибридизированные углероды (50% s-характера) образуют наименее стабильные радикалы по сравнению с sp3-гибридными углеродами (25% s-характера), которые образуют наиболее стабильные радикалы.
Делокализация электронов по структуре радикала, также известная как его способность образовывать одну или несколько резонансных структур, позволяет распределить дефицит электронов на несколько атомов, сводя к минимуму нестабильность. Делокализация обычно происходит в присутствии электронодонорных групп, таких как гидроксильные группы (-OH), простых эфиров (-OR), соседних алкенов и аминов (-NH 2 или -NR), или электроноакцепторных групп, таких как C =O или C≡N. [3]

Эффекты делокализации также можно понять, используя теорию молекулярных орбиталей в качестве линзы, более конкретно, исследуя внутримолекулярное взаимодействие неспаренного электрона с парой электронов отдающей группы или пустой π*-орбиталью электроноакцепторной группы в форме молекулярная орбитальная диаграмма. ВЗМО радикала является однозанятой, поэтому орбиталь удачно называют СОМО или однозанятой молекулярной орбиталью. Для электронодонорной группы SOMO взаимодействует с неподеленной парой с более низкой энергией, образуя новую заполненную связывающую орбиталь с более низкой энергией и новую SOMO с одинарным заполнением, более высокую по энергии, чем исходная. Хотя энергия неспаренного электрона увеличилась, уменьшение энергии неподеленной пары, образующей новую связывающую орбиталь, перевешивает увеличение энергии нового СОМО, что приводит к чистому уменьшению энергии молекулы. Следовательно, электронодонорные группы помогают стабилизировать радикалы.

С группой, которая вместо этого отбирает электроны, SOMO затем взаимодействует с пустой π*-орбиталью. Электронов, занимающих образовавшуюся орбиталь с более высокой энергией, нет, а образуется новая СОМО с более низкой энергией. Это приводит к более низкой энергии и более высокой стабильности радикальных частиц. Как группы-доноры, так и группы-отводчики стабилизируют радикалы.
Другая известная, хотя и более слабая форма делокализации — гиперконъюгация . В радикальной химии радикалы стабилизируются путем гиперконъюгации с соседними алкильными группами. Передача сигма (σ) связей CH в частично пустые радикальные орбитали помогает дифференцировать стабильность радикалов на третичном, вторичном и первичном атомах углерода. Третичные углеродные радикалы имеют три донорные связи σ CH, вторичные радикалы - только две, а первичные радикалы - только одну. Следовательно, третичные радикалы являются наиболее стабильными, а первичные радикалы — наименее стабильными.
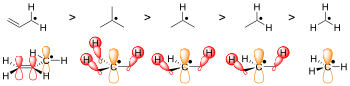

Проще говоря, чем больше стерические препятствия, тем труднее протекать реакции, и по умолчанию предпочтение отдается радикальной форме. Например, сравните абстрагированную водородом форму N -гидроксипиперидина с молекулой TEMPO . [3] TEMPO, или (2,2,6,6-тетраметилпиперидин-1-ил)оксил, слишком стерически затруднен дополнительными метильными группами, чтобы вступать в реакцию, что делает его достаточно стабильным, чтобы его можно было продавать на коммерческой основе в его радикальной форме. Однако N -гидроксипиперидин не имеет четырех метильных групп, препятствующих прохождению реагирующей молекулы, поэтому структура нестабильна. [3]
Стабильность многих (или большинства) органических радикалов выражается не в их изолируемости, а проявляется в их способности выступать в качестве доноров Н * . Это свойство отражает ослабленную связь с водородом, обычно O-H, но иногда N-H или C-H. Такое поведение важно, поскольку эти доноры H • служат антиоксидантами в биологии и торговле. Показательным является α-токоферол ( витамин Е ). Радикал токоферола сам по себе недостаточно стабилен для выделения, но исходная молекула является высокоэффективным донором атома водорода. Связь C–H ослаблена в трифенилметильных (тритильных) производных.

Большое разнообразие неорганических радикалов стабильны и фактически поддаются выделению. Примеры включают большинство комплексов переходных металлов первого ряда.
Что касается радикалов основной группы, то самый распространенный радикал во Вселенной является также самым распространенным химическим веществом во Вселенной, H • . Однако большинство радикалов основной группы невозможно изолировать , несмотря на присущую им стабильность. Например, радикалы водорода быстро объединяются с образованием H 2 . Оксид азота (NO) является хорошо известным примером изолируемого неорганического радикала. Соль Фреми (нитрозодисульфонат калия, (KSO 3 ) 2 NO) является родственным примером. Известно множество тиазильных радикалов, несмотря на ограниченную степень стабилизации π-резонанса . [10] [11]
Многие радикалы можно рассматривать как продукты разрыва ковалентных связей путем гомолиза . Энергии диссоциации гомолитической связи , обычно обозначаемые сокращенно «Δ H °», являются мерой прочности связи. Например, для расщепления H 2 на 2 H • требуется Δ H ° +435 кДж/моль , а для расщепления Cl 2 на два Cl • требуется Δ H ° +243 кДж/моль. Для слабых связей гомолиз можно вызвать термически. Прочные связи требуют фотонов высокой энергии или даже пламени, чтобы вызвать гомолиз.
Дирадикалы – это молекулы, содержащие два радикальных центра. Дикислород (O 2 ) является важным примером стабильного дирадикала. Синглетный кислород , нерадикальное состояние дикислорода с самой низкой энергией, менее стабильно, чем дирадикал, из-за правила максимальной множественности Хунда . Относительная стабильность бирадикала кислорода обусловлена прежде всего спин-запрещенным характером триплет-синглетного перехода, необходимого для его захвата электронов, т. е. « окисления ». Бирадикальное состояние кислорода также приводит к его парамагнитному характеру, о чем свидетельствует его притяжение к внешнему магниту. [12] Дирадикалы также могут встречаться в металл-оксокомплексах , что позволяет изучать спин-запрещенные реакции в химии переходных металлов . [13] Карбены в их триплетном состоянии можно рассматривать как дирадикалы с центром в одном и том же атоме, хотя обычно это высокореактивные стойкие карбены , причем наиболее распространенным примером являются N-гетероциклические карбены.
Триплетные карбены и нитрены являются дирадикалами. Их химические свойства отличаются от свойств синглетных аналогов.

Знакомая радикальная реакция – горение . Молекула кислорода представляет собой стабильный дирадикал , лучше всего представленный • O–O • . Поскольку спины электронов параллельны, эта молекула стабильна. Хотя основным состоянием кислорода является нереактивный неспаренный по спину ( триплетный ) дирадикал, доступно чрезвычайно реактивное состояние со спаренным спином ( синглетное ). Чтобы произошло горение, необходимо преодолеть энергетический барьер между ними. Этот барьер можно преодолеть с помощью тепла, требующего высоких температур. Триплет-синглетный переход также « запрещен ». Это создает дополнительный барьер для реакции. Это также означает, что молекулярный кислород относительно нереакционноспособен при комнатной температуре, за исключением присутствия каталитического тяжелого атома, такого как железо или медь.
Горение состоит из различных радикальных цепных реакций, которые может инициировать синглетный радикал. Воспламеняемость данного материала сильно зависит от концентрации радикалов, которую необходимо получить, прежде чем доминируют реакции инициирования и распространения, приводящие к горению материала . После того, как горючий материал израсходован, реакции прерывания снова преобладают, и пламя затухает. Как указано, усиление реакций распространения или прекращения реакции изменяет воспламеняемость. Например, поскольку свинец сам по себе дезактивирует радикалы в бензино-воздушной смеси, в бензин когда-то обычно добавляли тетраэтилсвинец . Это предотвращает неконтролируемое возгорание, появление несгоревших остатков ( детонация двигателя ) или преждевременное зажигание (преждевременное зажигание ).
При горении углеводорода участвует большое количество различных кислородных радикалов. Первоначально образуется гидропероксильный радикал (HOO • ). Затем они вступают в дальнейшую реакцию с образованием органических гидроперекисей , которые распадаются на гидроксильные радикалы (HO • ).
Многие реакции полимеризации инициируются радикалами. Полимеризация включает присоединение первоначального радикала к нерадикалу (обычно алкену) с образованием новых радикалов. Этот процесс лежит в основе радикальной цепной реакции. Искусство полимеризации связано с методом введения инициирующего радикала. Например, метилметакрилат (ММА) можно полимеризовать с получением поли(метилметакрилата) (ПММА – оргстекло или плексиглас) посредством повторяющейся серии стадий радикального присоединения :
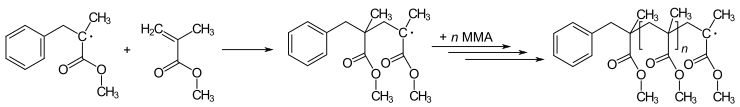
Новые методы радикальной полимеризации известны как живая радикальная полимеризация . Варианты включают обратимый перенос цепи присоединения-фрагментации ( RAFT ) и радикальную полимеризацию с переносом атома ( ATRP ).
Будучи преобладающим радикалом, O 2 реагирует со многими органическими соединениями, образуя радикалы вместе с гидропероксидным радикалом. Олифы и алкидные краски затвердевают за счет радикальной сшивки, инициируемой кислородом атмосферы.
Наиболее распространенным радикалом в нижних слоях атмосферы является молекулярный дикислород. Фотодиссоциация исходных молекул приводит к образованию других радикалов. В нижних слоях атмосферы важные радикалы образуются в результате фотодиссоциации диоксида азота на атом кислорода и оксид азота (см . уравнение 1.1 ниже), которая играет ключевую роль в образовании смога , а также фотодиссоциации озона с образованием возбужденного атома кислорода. O(1D) (см . уравнение 1.2 ниже). Также показаны чистая и обратная реакции ( уравнение 1.3 и уравнение 1.4 соответственно).
В верхних слоях атмосферы фотодиссоциация обычно нереакционноспособных хлорфторуглеродов (ХФУ) под действием солнечного ультрафиолетового излучения является важным источником радикалов (см. уравнение 1 ниже). В результате этих реакций образуется радикал хлора Cl • , который катализирует превращение озона в O 2 , способствуя тем самым истощению озона ( уравнения 2.2 – уравнения 2.4 ниже).
Такие реакции вызывают истощение озонового слоя , тем более что радикал хлора может свободно участвовать в другой реакционной цепи; следовательно, использование хлорфторуглеродов в качестве хладагентов было ограничено.

Радикалы играют важную роль в биологии. Многие из них необходимы для жизни, например, внутриклеточное уничтожение бактерий фагоцитирующими клетками, такими как гранулоциты и макрофаги . Радикалы участвуют в процессах передачи сигналов в клетках , [15] известных как окислительно-восстановительная передача сигналов . Например, радикальная атака линолевой кислоты приводит к образованию ряда 13-гидроксиоктадекадиеновых кислот и 9-гидроксиоктадекадиеновых кислот , которые могут регулировать локализованные тканевые воспалительные и/или заживляющие реакции, восприятие боли и пролиферацию злокачественных клеток. Радикальные атаки на арахидоновую кислоту и докозагексаеновую кислоту приводят к образованию аналогичного, но более широкого спектра сигнальных продуктов. [16]
Радикалы также могут быть вовлечены в болезнь Паркинсона , старческую и лекарственную глухоту , шизофрению и болезнь Альцгеймера . [17] Классический свободнорадикальный синдром, гемохроматоз болезни накопления железа , обычно связан с совокупностью симптомов, связанных со свободными радикалами, включая двигательные нарушения, психоз, пигментные нарушения меланина кожи , глухоту, артрит и сахарный диабет. Свободнорадикальная теория старения предполагает, что радикалы лежат в основе самого процесса старения . Аналогичным образом, процесс митогормезиса предполагает , что повторное воздействие радикалов может продлить продолжительность жизни.
Поскольку радикалы необходимы для жизни, в организме имеется ряд механизмов, позволяющих минимизировать вызванное радикалами повреждение и восстанавливать возникающие повреждения, например, ферменты супероксиддисмутаза , каталаза , глутатионпероксидаза и глутатионредуктаза . Кроме того, антиоксиданты играют ключевую роль в этих защитных механизмах. Часто это три витамина: витамин А , витамин С и витамин Е , а также полифенольные антиоксиданты . Кроме того, есть убедительные доказательства того, что билирубин и мочевая кислота могут действовать как антиоксиданты, помогая нейтрализовать определенные радикалы. Билирубин образуется в результате распада содержимого эритроцитов , а мочевая кислота является продуктом распада пуринов . Однако слишком много билирубина может привести к желтухе , которая в конечном итоге может повредить центральную нервную систему, а слишком много мочевой кислоты вызывает подагру . [18]
Активные формы кислорода или АФК — это такие виды, как супероксид , перекись водорода и гидроксильный радикал , которые обычно связаны с повреждением клеток. АФК образуются как естественный побочный продукт нормального метаболизма кислорода и играют важную роль в передаче сигналов в клетках. Двумя важными кислородцентрированными радикалами являются супероксид и гидроксильный радикал . Они образуются из молекулярного кислорода в восстановительных условиях. Однако из-за своей реакционной способности эти же радикалы могут участвовать в нежелательных побочных реакциях, приводящих к повреждению клеток. Чрезмерное количество этих радикалов может привести к повреждению и гибели клеток , что может способствовать развитию многих заболеваний, таких как рак , инсульт , инфаркт миокарда , диабет и серьезные расстройства. [19] Считается, что многие формы рака являются результатом реакций между радикалами и ДНК , что потенциально приводит к мутациям , которые могут отрицательно повлиять на клеточный цикл и потенциально привести к злокачественным новообразованиям. [20] Некоторые симптомы старения , такие как атеросклероз , также объясняются радикальным окислением холестерина в 7-кетохолестерин. [21] Кроме того, радикалы способствуют повреждению печени , вызванному алкоголем , возможно, больше, чем сам алкоголь. Радикалы, вырабатываемые сигаретным дымом , участвуют в инактивации альфа-1-антитрипсина в легких . Этот процесс способствует развитию эмфиземы .
Было обнаружено, что оксибензон образует радикалы под воздействием солнечного света и, следовательно, также может быть связан с повреждением клеток. Это происходило только тогда, когда его комбинировали с другими ингредиентами, обычно встречающимися в солнцезащитных кремах, такими как оксид титана и октилметоксициннамат . [22]
АФК атакуют полиненасыщенную жирную кислоту , линолевую кислоту , с образованием ряда продуктов 13-гидроксиоктадекадиеновой кислоты и 9-гидроксиоктадекадиеновой кислоты , которые служат сигнальными молекулами, которые могут запускать реакции, противодействующие повреждению тканей, вызвавшему их образование. АФК атакуют другие полиненасыщенные жирные кислоты, например арахидоновую кислоту и докозагексаеновую кислоту , с образованием аналогичного ряда сигнальных продуктов. [23]
Активные формы кислорода также используются в контролируемых реакциях с участием синглетного дикислорода, известных как реакции фотооксигенации типа II после передачи энергии Декстера ( триплет-триплетная аннигиляция ) от природного триплетного дикислорода и триплетного возбужденного состояния фотосенсибилизатора. Типичные химические превращения с этими синглетными видами дикислорода включают, среди прочего, преобразование целлюлозных биологических отходов в новые полиметиновые красители. [24]

До конца 20-го века слово «радикал» использовалось в химии для обозначения любой связанной группы атомов, такой как метильная группа или карбоксил , независимо от того, была ли она частью более крупной молекулы или молекулой сама по себе. Радикал часто называют группой R. Тогда для указания несвязанного случая потребовался квалификатор «free». После недавнего пересмотра номенклатуры часть более крупной молекулы теперь называется функциональной группой или заместителем , а «радикал» теперь означает «свободный». Однако старая номенклатура все еще может встречаться в некоторых книгах.
Термин «радикал» уже использовался, когда была разработана ныне устаревшая радикальная теория . Луи-Бернар Гайтон де Морво ввел фразу «радикальный» в 1785 году, и эта фраза была использована Антуаном Лавуазье в 1789 году в его «Элементарном трактате о химии» . Затем радикал был идентифицирован как корневое основание некоторых кислот (латинское слово «radix» означает «корень»). Исторически термин радикал в радикальной теории также использовался для связанных частей молекулы, особенно когда они остаются неизменными в реакциях. Сейчас они называются функциональными группами . Например, метиловый спирт был описан как состоящий из метилового «радикала» и гидроксильного «радикала». Не являются они и радикалами в современном химическом смысле, поскольку они постоянно связаны друг с другом и не имеют неспаренных реактивных электронов; однако их можно наблюдать как радикалы в масс-спектрометрии , когда они расщепляются облучением энергичными электронами.
В современном контексте первым идентифицированным органическим (углеродсодержащим) радикалом был трифенилметильный радикал (C 6 H 5 ) 3 C • . Этот вид был открыт Мозесом Гомбергом в 1900 году. В 1933 году Моррис С. Хараш и Фрэнк Мэйо предположили, что свободные радикалы ответственны за антимарковниковское присоединение бромистого водорода к бромистому аллилу . [25] [26]
В большинстве областей химии историческое определение радикалов утверждает, что молекулы имеют ненулевой электронный спин. Однако в таких областях, как спектроскопия и астрохимия , определение немного отличается. Герхард Герцберг , получивший Нобелевскую премию за исследования электронной структуры и геометрии радикалов, предложил более широкое определение свободных радикалов: «любые переходные (химически нестабильные) виды (атом, молекула или ион)». [27] Основная идея его предположения заключается в том, что существует множество химически нестабильных молекул, которые имеют нулевой спин, например C 2 , C 3 , CH 2 и так далее. Это определение более удобно для обсуждения переходных химических процессов и астрохимии; поэтому исследователи в этих областях предпочитают использовать это широкое определение. [28]
В химических уравнениях радикалы часто обозначаются точкой, расположенной непосредственно справа от атомного символа или молекулярной формулы, следующим образом:
В механизмах радикальных реакций используются однонаправленные стрелки для изображения движения одиночных электронов:

Гомолитический разрыв разрывающейся связи нарисован стрелкой в виде «рыболовного крючка», чтобы отличить его от обычного движения двух электронов, изображаемого стандартной фигурной стрелкой . Второй электрон разрываемой связи также движется в пару с атакующим электроном-радикалом.
Радикалы также принимают участие в радикальном присоединении и радикальном замещении в качестве реакционноспособных промежуточных продуктов . Цепные реакции с участием радикалов обычно можно разделить на три отдельных процесса. Это инициация , распространение и завершение .