
В органической химии органические пероксиды представляют собой органические соединения , содержащие пероксидную функциональную группу ( R-O-O-R' ). Если R' представляет собой водород , соединения называются гидропероксидами , которые обсуждаются в этой статье. Связь O-O в пероксидах легко разрывается, образуя свободные радикалы формы RO • (точка обозначает неспаренный электрон ). Таким образом, органические пероксиды полезны в качестве инициаторов некоторых типов полимеризации , таких как акриловые , ненасыщенные полиэфирные и винилэфирные смолы, используемые в стеклопластиках . Для этой цели обычно используются МЭКП и перекись бензоила . Однако это же свойство также означает, что органические пероксиды могут взрываться. Органические пероксиды, как и их неорганические аналоги, часто являются мощными отбеливателями . [1]
Органические пероксиды классифицируются (i) по наличию или отсутствию гидроксильного (-OH) конца и (ii) по наличию алкильных и ацильных заместителей. [2]
Одним из пробелов в классах органических пероксидов является пероксид дифенила. Квантово-химические расчеты предсказывают, что он вступает в почти безбарьерную реакцию, подобную перегруппировке бензидина . [3]
Длина связи O-O в пероксидах составляет около 1,45 Å , а углы R-O-O (R = H, C) около 110 ° (водоподобные). Характерно, что двугранные углы C-O-O-R (R = H, C) составляют около 120°. Связь O-O относительно слабая, с энергией диссоциации связи 45–50 ккал/моль (190–210 кДж/моль ), что менее половины прочности связей C-C, C-H и C-O. [4] [5]

Пероксиды играют важную роль в биологии. Известны сотни пероксидов и гидропероксидов, полученных из жирных кислот, стероидов и терпенов. [6] Простагландины биосинтезируются путем первоначального образования бициклического пероксида («эндопероксида»), полученного из арахидоновой кислоты . [7]
Многие аспекты биоразложения или старения связаны с образованием и распадом пероксидов, образующихся из кислорода воздуха. Противодействуя этим эффектам, ряд биологических и искусственных антиоксидантов разрушают перекиси.
У светлячков окисление люциферинов , катализируемое люциферазами , приводит к образованию пероксисоединения 1,2-диоксетана . Диоксетан нестабилен и самопроизвольно распадается на диоксид углерода и возбужденные кетоны , которые выделяют избыточную энергию путем испускания света ( биолюминесценция ). [8]
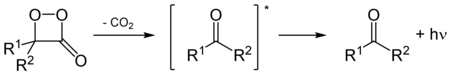
Многие пероксиды используются в качестве радикальных инициаторов , например, для обеспечения полимеризации акрилатов. Промышленные смолы на основе эфиров акриловой и/или метакриловой кислоты всегда производятся путем радикальной полимеризации с органическими пероксидами при повышенных температурах. [9] Скорость полимеризации регулируется подходящим выбором температуры и типа пероксида. [10]
Пероксид метилэтилкетона , пероксид бензоила и, в меньшей степени, пероксид ацетона используются в качестве инициаторов радикальной полимеризации некоторых термореактивных материалов , например, ненасыщенных полиэфирных и винилэфирных смол, часто встречающихся при изготовлении композитов из стекловолокна или углеродного волокна (CFRP), например, для лодок. , автофургоны, ванны, бассейны, спортивное оборудование, лопасти ветряных турбин и различные промышленные применения.
Пероксид бензоила , пероксиэфиры/пероксикетали и алкилпероксимонокарбонаты используются в производстве полистирола , пенополистирола и ударопрочного полистирола , а пероксид бензоила используется для многих клеев на основе акрилата.
Технологии производства термопластов для многих применений промышленной полимеризации включают процессы, которые осуществляются партиями в больших объемах, в растворе или в суспензии. Соответствующие полимеры включают: поливинилхлорид (ПВХ), полиэтилен низкой плотности (ПЭНП), полиэтилен высокой плотности (ПЭВП), полиметилметакрилат (ПММА), полистирол и поликарбонаты .
Перекись бензоила и перекись водорода используются в качестве отбеливающих и «созревающих» агентов для обработки муки , чтобы ее зерно легче выделяло клейковину ; Альтернативой является медленное окисление муки воздухом, что слишком медленно для индустриальной эпохи. Перекись бензоила — эффективное местное лекарство для лечения большинства форм прыщей .
Диалкилпероксиды, например дикумилпероксид , синтезируют добавлением пероксида водорода к алкенам или O-алкилированием гидропероксидов.
Диацилпероксиды обычно получают путем обработки перекиси водорода хлорангидридами кислот или ангидридами кислот в присутствии основания: [1]
Реакция конкурирует с гидролизом ацилирующего агента, но гидропероксид-анион является более сильным нуклеофилом по сравнению с гидроксидом. Несимметричные диацилпероксиды можно получить обработкой ацилхлоридов пероксикислотой.
Переэфиры , примером которых является трет -Бутилпероксибензоат , получают путем обработки ангидридов кислот или хлоридов кислот гидропероксидами.
Циклические пероксиды можно получить циклоприсоединением синглетного кислорода (генерируемого УФ-излучением) к диенам. Важным примером является рубрен . Шестичленные циклические пероксиды называются эндопероксидами. [11] Четырехчленные диоксетаны можно получить путем 2+2- циклоприсоединения кислорода к алкенам . [12] [13]
Опасность, связанная с хранением эфиров на воздухе, объясняется образованием гидропероксидов в результате прямой, хотя и медленной реакции триплетного кислорода со связями CH .
Органические пероксиды широко используются для инициирования полимеризации олефинов , например для образования полиэтилена . Ключевым этапом является гомолиз :
Склонность к гомолизу также используется для модификации полимеров путем прививки или висбрекинга , а также для сшивки полимеров для создания термореактивных материалов . При использовании для этих целей пероксид сильно разбавлен, поэтому тепло, выделяемое при экзотермическом разложении, безопасно поглощается окружающей средой (например, полимерным соединением или эмульсией ).
Органические пероксиды могут разлагаться путем самоокисления, особенно в концентрированной форме, поскольку органические пероксиды содержат как окислитель (связь OO), так и топливо (связи CH и CC). «Самоускоряющееся разложение» происходит, когда скорость разложения пероксида генерирует тепло с большей скоростью, чем оно может рассеиваться в окружающую среду. Температура является основным фактором, влияющим на скорость разложения. Самая низкая температура, при которой упакованный органический пероксид будет подвергаться самоускоряющемуся разложению в течение недели, определяется как температура самоускоряющегося разложения (ТСУР). Крупный пожар на химическом заводе Аркема в Кросби, штат Техас (США) в 2017 году был вызван разложением различных органических пероксидов после отключения электроэнергии и последующей потери систем охлаждения. [14] Это произошло из-за сильного наводнения, вызванного ураганом Харви , который разрушил основные и резервные генераторы электроэнергии на объекте. [14]
Гидропероксиды являются промежуточными продуктами или реагентами в основных коммерческих процессах. В кумоловом процессе ацетон и фенол получают разложением гидропероксида кумола (Me = метил):
Антрагидрохинон самопроизвольно реагирует с кислородом с образованием антрахинона и перекиси водорода, возможно, через какое-то органическое промежуточное соединение пероксида. После экстракции перекиси водорода антрахинон каталитически восстанавливается до антрагидрохинона и повторно используется в процессе. Есть и другие гидрохиноны, реагирующие аналогичным образом.
Органопероксиды можно восстановить до спиртов с помощью алюмогидрида лития , как описано в этом идеализированном уравнении:
Эфиры фосфита и третичные фосфины также способствуют восстановлению:
Расщепление на кетоны и спирты происходит в результате катализируемой основаниями перегруппировки Корнблюма-ДеЛаМаре , которая включает разрыв связей внутри пероксидов с образованием этих продуктов.
Некоторые пероксиды представляют собой лекарства , действие которых основано на образовании радикалов в нужных местах организма. Например, артемизинин и его производные, такие как артесунат , обладают наиболее быстрым действием из всех современных препаратов против малярии, вызванной falciparum . [15] Артесунат также эффективен в снижении яйценоскости при инфекции Schistosoma haematobium . [16]
Трет-Бутилгидропероксид используется в качестве реагентов эпоксидирования и гидроксилирования в сочетании с металлическими катализаторами. [17]

Для качественного и количественного определения пероксидов используют несколько аналитических методов. [18] Простое качественное обнаружение пероксидов осуществляется с помощью йод-крахмальной реакции . [19] Здесь пероксиды, гидроперекиси или перкислоты окисляют добавленный йодид калия в йод , который вступает в реакцию с крахмалом , образуя темно-синий цвет. Доступны индикаторы коммерческих бумаг, использующие эту реакцию. Этот метод также пригоден для количественной оценки, но он не позволяет различить разные типы пероксидных соединений. Вместо этого для этой цели используется обесцвечивание различных красителей индиго в присутствии пероксидов. [20] Например, потеря синего цвета лейкометиленового синего селективна в отношении перекиси водорода. [21]
Количественный анализ гидропероксидов можно провести с помощью потенциометрического титрования алюмогидридом лития . [22] Другим способом оценки содержания надкислот и пероксидов является объемное титрование алкоксидами, такими как этоксид натрия . [23]
Считается, что каждая пероксигруппа содержит один активный атом кислорода. Концепция содержания активного кислорода полезна для сравнения относительной концентрации пероксигрупп в рецептурах, которая связана с содержанием энергии. Как правило, содержание энергии увеличивается с увеличением содержания активного кислорода, и, следовательно, чем выше молекулярная масса органических групп, тем ниже содержание энергии и, как правило, тем ниже опасность.
Термин « активный кислород» используется для обозначения количества пероксида, присутствующего в любом составе органического пероксида. Один из атомов кислорода в каждой пероксидной группе считается «активным». Теоретическое количество активного кислорода можно описать следующим уравнением: [24]
где p — количество пероксидных групп в молекуле, а m — молекулярная масса чистого пероксида.
Органические пероксиды часто продаются в виде составов, включающих один или несколько флегматизирующих агентов . То есть из соображений безопасности или улучшения характеристик свойства состава органического пероксида обычно модифицируются путем использования добавок для флегматизации (снижения чувствительности), стабилизации или иного улучшения органического пероксида для коммерческого использования. Коммерческие составы иногда состоят из смесей органических пероксидов, которые могут быть или не быть флегматизированы.

Пероксиды также являются сильными окислителями и легко вступают в реакцию с кожей, хлопком и древесной массой. [25] В целях безопасности пероксидные соединения хранят в прохладном непрозрачном контейнере, поскольку нагревание и освещение ускоряют их химические реакции . Небольшие количества пероксидов, выходящие из резервуаров для хранения или реакторов, нейтрализуют с помощью восстановителей, таких как сульфат железа (II) . Меры безопасности на промышленных предприятиях, производящих большое количество пероксидов, включают следующее:
1) Оборудование размещается в железобетонных конструкциях с фольгированными окнами, которые сбрасывают давление и не разрушаются в случае взрыва.
2) Продукты разливают в небольшие контейнеры и сразу после синтеза перемещают в холодное место.
3) Контейнеры изготовлены из нереактивных материалов, таких как нержавеющая сталь, некоторые алюминиевые сплавы или темное стекло. [26]
Для безопасного обращения с концентрированными органическими пероксидами важным параметром является температура пробы, которую следует поддерживать ниже температуры самоускоряющегося разложения соединения. [27]
Перевозка органических пероксидов ограничена. Министерство транспорта США перечисляет ограничения на транспортировку органических пероксидов и запрещенные материалы в Таблице опасных материалов 49 CFR 172.101 в зависимости от концентрации и физического состояния материала: