Импортин — это тип кариоферина [1] , который транспортирует молекулы белка из цитоплазмы клетки в ядро . Он делает это , связываясь со специфическими последовательностями распознавания , называемыми последовательностями ядерной локализации (NLS).
Импортин имеет две субъединицы, импортин α и импортин β. Члены семейства импортинов-β могут связывать и транспортировать груз сами по себе или могут образовывать гетеродимеры с импортином-α. Как часть гетеродимера , импортин-β опосредует взаимодействия с поровым комплексом , в то время как импортин-α действует как адаптерный белок для связывания сигнала ядерной локализации (NLS) на грузе. Тример NLS-импортин α-импортин β диссоциирует после связывания с Ran GTP внутри ядра , [2] при этом два белка импортина возвращаются в цитоплазму для дальнейшего использования.
Импортин может существовать как гетеродимер импортина-α/β или как мономер импортина-β. Импортин-α был впервые выделен в 1994 году группой, включающей Энно Хартманна, из Центра молекулярной медицины Макса Дельбрюка . [1] Процесс импорта ядерного белка уже был охарактеризован в предыдущих обзорах, [3] но ключевые белки, участвующие в этом процессе, до этого момента не были выяснены. Цитозольный белок массой 60 кДа, необходимый для импорта белка в ядро, и с 44% идентичностью последовательности с SRP1p, был очищен из яиц Xenopus . Он был клонирован, секвенирован и экспрессирован в E.coli , и для того, чтобы полностью восстановить сигнал-зависимый транспорт, его пришлось объединить с Ran (TC4). В исследовании также были обнаружены другие ключевые стимулирующие факторы. [1]
Импортин-β, в отличие от импортина-α, не имеет прямых гомологов в дрожжах, но был очищен как белок 90-95 кДа и было обнаружено, что он образует гетеродимер с импортином-α в ряде различных случаев. Они включали исследование под руководством Майкла Рексаха [4] и дальнейшие исследования Дирка Гёрлиха. [5] Эти группы обнаружили, что импортину-α для функционирования требуется другой белок, импортин-β, и что вместе они образуют рецептор для сигналов ядерной локализации (NLS) , тем самым обеспечивая транспорт в ядро . С момента этих первых открытий в 1994 и 1995 годах было обнаружено множество генов импортина, таких как IPO4 и IPO7 , которые облегчают импорт немного отличающихся грузовых белков из-за их различной структуры и локализации.
Большая часть белка-адаптера импортина-α состоит из нескольких повторов броненосца (ARM), расположенных в тандеме . Эти повторы могут складываться вместе, образуя изогнутую структуру, которая облегчает связывание с NLS специфических грузовых белков. Основной сайт связывания NLS находится в направлении N-конца , а второстепенный сайт находится в C-конце . Помимо структур ARM , импортин-α также содержит 90- аминокислотную N-концевую область, ответственную за связывание с импортином-β, известную как домен связывания импортина-β (IBB). [6] Это также сайт аутоингибирования, [7] и участвует в высвобождении груза, как только импортин-α достигает ядра . [8]
Импортин-β является типичной структурой более крупного суперсемейства кариоферинов . Основой их структуры являются 18-20 тандемных повторов мотива HEAT . Каждый из этих повторов содержит две антипараллельные альфа-спирали, связанные поворотом , которые складываются вместе , образуя общую структуру белка . [ 9]
Для того, чтобы транспортировать груз в ядро , импортин-β должен ассоциироваться с комплексами ядерных пор . Он делает это, образуя слабые, временные связи с нуклеопоринами в их различных мотивах F G (Phe-Gly). Кристаллографический анализ показал, что эти мотивы связываются с импортином-β в неглубоких гидрофобных карманах, обнаруженных на его поверхности. [10]
Основная функция импортина — опосредовать транслокацию белков с сигналами ядерной локализации в ядро через комплексы ядерных пор (NPC) в процессе, известном как цикл импорта ядерного белка.
Первым шагом этого цикла является связывание груза. Импортин может выполнять эту функцию как мономерный белок импортин-β , но обычно требует присутствия импортина-α, который действует как адаптер для белков груза (через взаимодействие с NLS ). NLS представляет собой последовательность основных аминокислот , которая помечает белок как груз, предназначенный для ядра . Белок груза может содержать один или два из этих мотивов , которые будут связываться с основными и/или второстепенными сайтами связывания на импортине-α. [11]
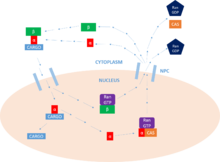
После связывания белка-груза импортин-β взаимодействует с NPC , и комплекс диффундирует в ядро из цитоплазмы . Скорость диффузии зависит как от концентрации импортина-α, присутствующего в цитоплазме, так и от связывающей способности импортина-α с грузом. Попав внутрь ядра , комплекс взаимодействует с ГТФазой семейства Ras , Ran-GTP . Это приводит к диссоциации комплекса путем изменения конформации импортина-β. Импортин-β остается связанным с Ran - GTP , готовым к переработке. [11]
Теперь, когда комплекс импортин-α/груз освободился от импортина-β, грузо-белок может быть высвобожден в ядро . N -концевой импортин-β-связывающий домен (IBB) импортина-α содержит ауторегуляторную область, которая имитирует мотив NLS . [7] Высвобождение импортина-β освобождает эту область и позволяет ему вернуться в петлю и конкурировать за связывание с грузо-белком в основном сайте связывания NLS . Эта конкуренция приводит к высвобождению белка . В некоторых случаях для высвобождения груза могут также использоваться специфические факторы высвобождения, такие как Nup2 и Nup50 . [11]
Наконец, для того, чтобы вернуться в цитоплазму , импортин-α должен связаться с комплексом Ran-GTP / CAS (ядерный фактор экспорта), который облегчает его выход из ядра . CAS (клеточный белок восприимчивости к апоптозу) является частью суперсемейства кариоферинов импортина-β и определяется как ядерный фактор экспорта. Импортин-β возвращается в цитоплазму , все еще связанный с Ran-GTP. Попав в цитоплазму, Ran-GTP гидролизуется Ran GAP , образуя Ran - GDP и высвобождая два импортина для дальнейшей активности . Именно этот гидролиз GTP обеспечивает энергию для цикла в целом. В ядре GEF заряжает Ran молекулой GTP , которая затем гидролизуется GAP в цитоплазме , как указано выше. Именно эта активность Ran обеспечивает однонаправленный транспорт белков . [11]
Существует несколько болезненных состояний и патологий, связанных с мутациями или изменениями экспрессии импортина-α и импортина-β.
Импортины являются жизненно важными регуляторными белками в процессах гаметогенеза и эмбриогенеза . В результате было показано, что нарушение паттернов экспрессии импортина-α вызывает дефекты фертильности у Drosophila melanogaster . [12]
Также были исследования, связывающие измененный импортин-α с некоторыми случаями рака . Исследования рака молочной железы выявили укороченную форму импортина-α, в которой отсутствует домен связывания NLS . [13] Кроме того, было показано, что импортин-α переносит ген-супрессор опухоли , BRCA1 (белок восприимчивости к раку молочной железы 1 типа) , в ядро . Повышенная экспрессия импортина-α также была связана с низкими показателями выживаемости, наблюдаемыми у некоторых пациентов с меланомой . [14]
Активность импортина также связана с некоторыми вирусными патологиями . Например, в пути заражения вирусом Эбола ключевым шагом является ингибирование ядерного импорта PY-STAT1 . Это достигается путем секвестрации вирусом импортина-α в цитоплазме , что означает, что он больше не может связывать свой груз в NLS . [15] В результате импортин не может функционировать, и груз-белок остается в цитоплазме.
Импортин может транспортировать в ядро множество различных грузовых белков . Часто для перемещения различных белков требуются различные комбинации α и β. Ниже приведены некоторые примеры различных грузов.
Хотя импортин-α и импортин-β используются для описания импортина в целом, на самом деле они представляют собой более крупные семейства белков , которые имеют схожую структуру и функцию. Для α и β были идентифицированы различные гены, некоторые из которых перечислены ниже. Обратите внимание, что часто кариоферин и импортин используются как взаимозаменяемые.