Иридий — химический элемент ; имеет символ Ir и атомный номер 77. Очень твердый, хрупкий, серебристо-белый переходный металл платиновой группы , считается вторым по плотности встречающимся в природе металлом (после осмия ) с плотностью 22,56 г/см 3 (0,815 фунт/куб. дюйм) [7] , как определено экспериментальной рентгеновской кристаллографией . [a] 191 Ir и 193 Ir — единственные два встречающихся в природе изотопа иридия, а также единственные стабильные изотопы ; последний более обилен. Это один из наиболее устойчивых к коррозии металлов [10] даже при температурах до 2000 °C (3630 °F).
Иридий был открыт в 1803 году среди нерастворимых примесей в природной платине . Смитсон Теннант , первооткрыватель, назвал его в честь греческой богини Ирис , олицетворения радуги, из-за ярких и разнообразных цветов ее солей. Иридий — один из самых редких элементов в земной коре , его предполагаемое годовое производство и потребление в 2018 году составит всего 7,3 тонны (16 тысяч фунтов). [11]
Преобладающими сферами применения иридия являются сам металл и его сплавы, например, в высокопроизводительных свечах зажигания , тиглях для перекристаллизации полупроводников при высоких температурах и электродах для производства хлора в хлорщелочном процессе . Важными соединениями иридия являются хлориды и иодиды в промышленном катализе . Иридий является компонентом некоторых органических светодиодов .
Иридий содержится в метеоритах в гораздо большем количестве, чем в земной коре. [12] По этой причине необычно высокое содержание иридия в слое глины на границе мела и палеогена породило гипотезу Альвареса о том, что удар массивного внеземного объекта вызвал вымирание динозавров и многих других видов 66 миллионов лет назад. , как теперь известно , образовался в результате удара , образовавшего кратер Чиксулуб . Аналогичным образом, иридиевая аномалия в образцах керна из Тихого океана позволяет предположить, что воздействие Эльтанина произошло около 2,5 миллионов лет назад. [13]
Считается, что общее количество иридия на планете Земля намного выше, чем наблюдается в горных породах земной коры, но, как и в случае с другими металлами платиновой группы, высокая плотность и склонность иридия связываться с железом привели к тому, что большая часть иридия опустилась ниже уровня ниже среднего. кора, когда планета была молодой и еще расплавленной.

Иридий , принадлежащий к металлу платиновой группы , имеет белый цвет, напоминающий платину , но с легким желтоватым оттенком. Из-за своей твердости , хрупкости и очень высокой температуры плавления твердый иридий трудно обрабатывать, формовать или обрабатывать; поэтому вместо этого обычно используется порошковая металлургия . [14] Это единственный металл, который сохраняет хорошие механические свойства на воздухе при температуре выше 1600 °C (2910 °F). [15] Он занимает 10-е место по температуре кипения среди всех элементов и становится сверхпроводником при температуре ниже 0,14 К (-273,010 ° C; -459,418 ° F). [16]
Модуль упругости иридия является вторым по величине среди металлов, уступая только осмию . [15] Это, вместе с высоким модулем сдвига и очень низким значением коэффициента Пуассона (отношение продольной и поперечной деформации ), указывает на высокую степень жесткости и устойчивости к деформации, которые сделали его изготовление полезных компонентов вопросом большая трудность. Несмотря на эти ограничения и высокую стоимость иридия, был разработан ряд применений, в которых механическая прочность является важным фактором в некоторых чрезвычайно суровых условиях, с которыми сталкиваются современные технологии. [15]
Измеренная плотность иридия лишь немного ниже (примерно на 0,12%), чем у осмия, самого плотного из известных металлов . [17] [18] Возникла некоторая двусмысленность относительно того, какой из двух элементов был более плотным, из-за небольшого размера разницы в плотности и трудностей ее точного измерения, [19] но, с повышенной точностью коэффициентов, используемых для расчета плотности, Рентгеновские кристаллографические данные дали плотности 22,56 г/см 3 (0,815 фунта/куб. дюйм) для иридия и 22,59 г/см 3 (0,816 фунта/куб. дюйм) для осмия. [20]
Иридий чрезвычайно хрупок, настолько, что его трудно сваривать из-за растрескивания зоны термического влияния, но его можно сделать более пластичным, добавив небольшие количества титана и циркония ( по-видимому, хорошо подойдет по 0,2% каждого). [21]
Твердость чистой платины по Виккерсу составляет 56 HV, тогда как платина с 50% иридия может достигать более 500 HV. [22] [23]
Иридий — наиболее устойчивый к коррозии из известных металлов: [24] он не подвергается воздействию кислот , включая царскую водку . В присутствии кислорода реагирует с цианидными солями. [25] Традиционные окислители, в том числе галогены и кислород , также реагируют [26] при более высоких температурах. [27] Иридий также напрямую реагирует с серой при атмосферном давлении с образованием дисульфида иридия . [28]
Иридий имеет два встречающихся в природе стабильных изотопа : 191 Ir и 193 Ir, с естественным содержанием 37,3% и 62,7% соответственно. [29] Также было синтезировано по меньшей мере 37 радиоизотопов с массовым числом от 164 до 202. 192 Ir , который находится между двумя стабильными изотопами, является наиболее стабильным радиоизотопом с периодом полураспада 73,827 дней и находит применение. в брахитерапии [30] и в промышленной радиографии , в частности при неразрушающем контроле сварных швов стали в нефтегазовой промышленности; Источники иридия-192 стали причиной ряда радиационных аварий. Три других изотопа имеют период полураспада не менее суток — 188 Ir, 189 Ir и 190 Ir. [29] Изотопы с массой ниже 191 распадаются в результате некоторой комбинации β + -распада , α-распада и (редкой) эмиссии протонов , за исключением 189 Ir, который распадается в результате захвата электронов . Синтетические изотопы тяжелее, чем 191, распадаются путем β - распада , хотя 192 Ir также имеет незначительный путь распада с захватом электронов. [29] Все известные изотопы иридия были открыты в период с 1934 по 2008 год, причем самые последние открытия составили 200–202 Ir. [31]
Охарактеризовано как минимум 32 метастабильных изомера с массовым числом от 164 до 197. Наиболее стабильным из них является 192m2 Ir, который распадается путем изомерного перехода с периодом полураспада 241 год, [29] что делает его более стабильным, чем любой другой изомер. синтетических изотопов иридия в основном состоянии. Наименее стабильный изомер – 190м3 Ir с периодом полураспада всего 2 мкс. [29] Изотоп 191 Ir был первым элементом, который продемонстрировал мессбауэровский эффект . Это делает его полезным для мессбауэровской спектроскопии для исследований в области физики, химии, биохимии, металлургии и минералогии. [32]
Иридий образует соединения со степенями окисления от -3 до +9, но наиболее распространенными степенями окисления являются +1, +2, +3 и +4. [14] Хорошо изученные соединения, содержащие иридий в степени окисления +6, включают IrF 6 и оксиды Sr 2 MgIrO 6 и Sr 2 CaIrO 6 . [14] [33] Оксид иридия(VIII) ( IrO 4 ) был получен в условиях матричной изоляции при 6 К в аргоне . [34] Самая высокая степень окисления (+9), которая также является самой высокой зарегистрированной для любого элемента, обнаружена в газообразном [IrO 4 ] + . [3]
Иридий не образует бинарных гидридов . Хорошо охарактеризован только один бинарный оксид : диоксид иридия , IrO.
2. Это сине-черное твердое вещество, имеющее структуру флюорита . [14 ] Полуторный оксид Ir
2О
3, был описан как сине-черный порошок, который окисляется до IrO.
2от HNO
3. [26] Известны соответствующие дисульфиды, диселениды, сесквисульфиды и сесквиселениды, а также IrS
3. [14]
Бинарные тригалогениды, IrX
3, известны для всех галогенов. [14] Для степеней окисления +4 и выше известны только тетрафторид , пентафторид и гексафторид . [14] Гексафторид иридия, IrF
6, представляет собой летучее желтое твердое вещество, состоящее из октаэдрических молекул. Разлагается в воде и восстанавливается до IrF .
4. [14] Пентафторид иридия также является сильным окислителем, но представляет собой тетрамер Ir .
4Ф
20, образованный четырьмя октаэдрами, имеющими общие вершины. [14]
x.jpg/440px-IrCl3(aq)x.jpg)
Иридий имеет обширную координационную химию .
Иридий в своих комплексах всегда низкоспиновый . Ir(III) и Ir(IV) обычно образуют октаэдрические комплексы . [14] Известны полигидридные комплексы со степенями окисления +5 и +3. [35] Одним из примеров является IrH 5 (P i Pr 3 ) 2 . [36] Тройной гидрид Mg
6ИК
2ЧАС
11считается, что он содержит как IrH4−
5и 18-электронный IrH5−
4анион. [37]
Иридий также образует оксианионы со степенями окисления +4 и +5. К
2ИрО
3и КИРО
3можно получить реакцией оксида или супероксида калия с иридием при высоких температурах. Такие твердые вещества не растворяются в обычных растворителях. [38]
Как и многие элементы, иридий образует важные хлоридные комплексы. Гексахлориридовая (IV) кислота, H
2IrCl
6, и его аммониевая соль являются наиболее распространенными соединениями иридия как с промышленной, так и с препаративной точки зрения. [39] Они являются промежуточными продуктами очистки иридия и используются в качестве прекурсоров для большинства других соединений иридия, а также при приготовлении анодных покрытий. ИРКл _2−
6Ион имеет интенсивный темно-коричневый цвет и легко восстанавливается до более светлого IrCl.3−
6и наоборот. [39] Трихлорид иридия , IrCl
3, который можно получить в безводной форме прямым окислением иридиевого порошка хлором при 650 °С [39] или в гидратированной форме путем растворения Ir
2О
3в соляной кислоте часто используется в качестве исходного материала для синтеза других соединений Ir(III). [14] Другим соединением, используемым в качестве исходного материала, является гексахлориридат(III) аммония (NH
4)
3IrCl
6. [ нужна цитата ]
В присутствии воздуха металлический иридий растворяется в расплавленных цианидах щелочных металлов с образованием Ir (CN).3−
6(гексацианоиридата) и при окислении образует наиболее стабильный оксид. [ нужна цитата ]

Иридийорганические соединения содержат связи иридий– углерод . Ранние исследования выявили очень стабильный додекакарбонил тетраиридия Ir .
4(Колорадо)
12. [14] В этом соединении каждый из атомов иридия связан с тремя другими, образуя тетраэдрический кластер. Открытие комплекса Васьки ( IrCl(CO)[P(C
6ЧАС
5)
3]
2) открыл дверь для реакций окислительного присоединения — процесса, фундаментального для полезных реакций. Например, катализатор Крэбтри — гомогенный катализатор реакций гидрирования . [40] [41]

Комплексы иридия сыграли ключевую роль в развитии активации связи углерод-водород (активация C-H), которая обещает позволить функционализировать углеводороды, которые традиционно считаются нереакционноспособными. [44]

Открытие иридия переплетается с открытием платины и других металлов платиновой группы. Первое европейское упоминание о платине появляется в 1557 году в трудах итальянского гуманиста Юлия Цезаря Скалигера как описание неизвестного благородного металла, найденного между Дарьеном и Мексикой, «который ни огонь, ни какое-либо испанское изобретение еще не смогли превратить в жидкость». [45] С момента своих первых встреч с платиной испанцы обычно рассматривали этот металл как своего рода примесь к золоту и относились к нему соответственно. Его часто просто выбрасывали, а существовало официальное постановление, запрещающее фальсификацию золота примесями платины. [46]


В 1735 году Антонио де Уллоа и Хорхе Хуан-и-Сантасилия видели, как коренные американцы добывали платину, в то время как испанцы в течение восьми лет путешествовали по Колумбии и Перу. Уллоа и Хуан нашли мины с белесыми металлическими самородками и привезли их домой в Испанию. Антонио де Уллоа вернулся в Испанию и основал первую минералогическую лабораторию в Испании и был первым, кто систематически изучал платину, что произошло в 1748 году. Его исторический отчет об экспедиции включал описание платины как не поддающейся ни отделению, ни обжигу . Уллоа также предвидел открытие платиновых рудников. После публикации отчета в 1748 году Уллоа не продолжил исследования нового металла. В 1758 году его направили руководить работами по добыче ртути в Уанкавелике . [45]
В 1741 году Чарльз Вуд, [47] британский металлург , нашел на Ямайке различные образцы колумбийской платины, которые он отправил Уильяму Браунриггу для дальнейшего исследования.
В 1750 году, после изучения платины, присланной ему Вудом, Браунригг представил Королевскому обществу подробный отчет о металле , заявив, что он не видел упоминания о ней ни в каких предыдущих отчетах об известных минералах. [48] Браунригг также отметил чрезвычайно высокую температуру плавления платины и тугоплавкое металлоподобное поведение по отношению к буре . Другие химики по всей Европе вскоре начали изучать платину, в том числе Андреас Сигизмунд Маргграф , [49] Торберн Бергман , Йонс Якоб Берцелиус , Уильям Льюис и Пьер Маккер . В 1752 году Хенрик Шеффер опубликовал подробное научное описание металла, который он назвал «белым золотом», включая отчет о том, как ему удалось плавить платиновую руду с помощью мышьяка . Шеффер описал платину как менее податливую, чем золото, но обладающую такой же устойчивостью к коррозии. [45]
Химики, изучавшие платину, растворяли ее в царской водке (смесь соляной и азотной кислот ) для получения растворимых солей. Они всегда наблюдали небольшое количество темного нерастворимого остатка. [15] Жозеф Луи Пруст считал, что остаток представляет собой графит . [15] Французские химики Виктор Колле-Дескотильс , Антуан Франсуа, граф де Фуркруа и Луи Николя Воклен также наблюдали черный остаток в 1803 году, но не получили достаточного количества для дальнейших экспериментов. [15]
В 1803 году британский учёный Смитсон Теннант (1761–1815) проанализировал нерастворимый остаток и пришел к выводу, что он должен содержать новый металл. Воклен обработал порошок попеременно щелочью и кислотами [24] и получил новый летучий оксид, который, как он полагал, принадлежал этому новому металлу, который он назвал птеном , от греческого слова πτηνός ptēnós , «крылатый». [50] [51] Теннант, который имел преимущество в виде гораздо большего количества остатка, продолжил свои исследования и идентифицировал два ранее неоткрытых элемента в черном остатке: иридий и осмий. [15] [24] Он получил темно-красные кристаллы (вероятно, Na
2[IrCl
6]· н Ч
2О ) путем последовательной реакции с гидроксидом натрия и соляной кислотой . [51] Он назвал иридий в честь Ириды ( Ἶρις ), греческой крылатой богини радуги и посланницы олимпийских богов, потому что многие из полученных им солей были сильно окрашены. [c] [52] Открытие новых элементов было задокументировано в письме Королевскому обществу от 21 июня 1804 года. [15] [53]
Британский ученый Джон Джордж Чайлдс первым расплавил образец иридия в 1813 году с помощью «величайшей гальванической батареи, которая когда-либо была построена» (на тот момент). [15] Первым, кто получил иридий высокой чистоты, был Роберт Хэйр в 1842 году. Он обнаружил, что его плотность составляет около 21,8 г/см 3 (0,79 фунта на кубический дюйм), и отметил, что этот металл практически нековкий и очень твердый. Первую плавку в заметном количестве осуществили Анри Сент-Клер Девиль и Жюль Анри Дебре в 1860 году. Для этого потребовалось сжечь более 300 литров (79 галлонов США) чистого O.
2и Х
2газа на каждый 1 килограмм (2,2 фунта) иридия. [15]
Эти крайние трудности с плавлением металла ограничивали возможности обращения с иридием. Джон Исаак Хокинс искал тонкое и твердое острие для перьев перьевой ручки, и в 1834 году ему удалось создать золотую ручку с иридиевым наконечником. В 1880 году Джон Холланд и Уильям Лофланд Дадли смогли расплавить иридий, добавив фосфор , и запатентовали этот процесс в Соединенных Штатах; Британская компания Johnson Matthey позже заявила, что использует аналогичный процесс с 1837 года и уже представляла плавленый иридий на ряде всемирных выставок . [15] Впервые сплав иридия с рутением в термопарах был использован Отто Фойсснером в 1933 году. Они позволили измерять высокие температуры в воздухе до 2000 °C (3630 °F). [15]
В Мюнхене, Германия, в 1957 году Рудольф Мёссбауэр в ходе так называемого одного из «знаковых экспериментов в физике двадцатого века» [54] обнаружил резонансное испускание и поглощение гамма-лучей без отдачи атомами в твердом металлическом образце. содержащий всего 191 Ir. [55] Это явление, известное как эффект Мессбауэра, привело к присуждению Нобелевской премии по физике в 1961 году, в возрасте 32 лет, всего через три года после публикации своего открытия. [56]
Наряду со всеми элементами, имеющими атомный вес выше, чем у железа , иридий естественным образом образуется только в результате r-процесса (быстрого захвата нейтронов) при слиянии сверхновых и нейтронных звезд . [57] [58]
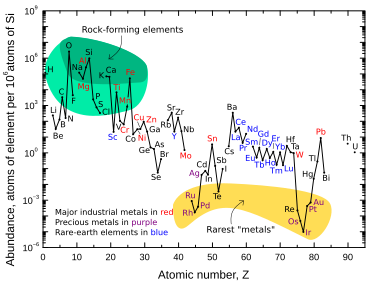

Иридий - один из девяти наименее распространенных стабильных элементов в земной коре, его средняя массовая доля в породах земной коры составляет 0,001 частей на миллион ; платины в 10 раз больше, золота в 40 раз больше, серебра и ртути в 80 раз больше. [14] Теллур примерно так же распространен, как иридий. [14] В отличие от его низкого содержания в земной коре, иридий относительно часто встречается в метеоритах с концентрацией 0,5 частей на миллион и более. [60] Считается, что общая концентрация иридия на Земле намного выше, чем наблюдается в породах земной коры, но из-за плотности и сидерофильного («железолюбивого») характера иридия он опустился под кору и в земные слои. ядро , когда планета еще была расплавленной. [39]
Иридий встречается в природе в виде несвязанного элемента или в природных сплавах , особенно в сплавах иридия и осмия осмиридии (богатом осмием) и иридосмии (богатом иридием). [24] В месторождениях никеля и меди металлы платиновой группы встречаются в виде сульфидов , теллуридов , антимонидов и арсенидов . Во всех этих соединениях платина может быть заменена небольшим количеством иридия или осмия. Как и все металлы платиновой группы, иридий в природе можно найти в сплавах с необработанным никелем или медью . [61] Известен ряд минералов с преобладанием иридия, в которых иридий является видообразующим элементом. Они чрезвычайно редки и часто представляют собой иридиевые аналоги приведенных выше. Примерами могут служить ирарсит и купроиридсит. [62] [63] [64] В земной коре иридий встречается в самых высоких концентрациях в трех типах геологических структур: магматических отложениях (вторжениях земной коры снизу), ударных кратерах и отложениях, образовавшихся из одной из бывших структур. Крупнейшие известные первичные запасы находятся в магматическом комплексе Бушвельд в Южной Африке [65] ( около крупнейшей известной ударной структуры, ударной структуры Вредефорт ), а также в крупных медно-никелевых месторождениях вблизи Норильска в России и в бассейне Садбери (также ударный кратер) в Канаде также являются важными источниками иридия. Меньшие запасы находятся в США. [65] Иридий также встречается во вторичных месторождениях в сочетании с платиной и другими металлами платиновой группы в россыпных месторождениях. Россыпные месторождения, использовавшиеся людьми доколумбовой эпохи в департаменте Чоко в Колумбии , до сих пор являются источником металлов платиновой группы. По состоянию на 2003 год мировые запасы не были оценены. [24]
Иридий содержится в морских организмах, отложениях и толще воды. Содержание иридия в морской воде [66] и организмах [67] относительно невелико, поскольку он с трудом образует хлоридные комплексы . [67] Численность в организмах составляет около 20 частей на триллион, что примерно на пять порядков меньше, чем в осадочных породах на границе мела и палеогена (К–Т) . [67] Концентрация иридия в морской воде и морских отложениях чувствительна к насыщению морской кислородом , температуре морской воды и различным геологическим и биологическим процессам. [68]
Иридий в отложениях может поступать из космической пыли , вулканов, осадков из морской воды, микробных процессов или гидротермальных источников , [68] , и его содержание может строго указывать на источник. [69] [68] Он имеет тенденцию связываться с другими черными металлами в марганцевых конкрециях . [66] Иридий является одним из характерных элементов внеземных пород и, наряду с осмием, может использоваться в качестве элемента-индикатора для метеоритного материала в осадках. [70] [71] Например, образцы керна из Тихого океана с повышенным уровнем иридия предполагают воздействие Эльтанина около 2,5 миллионов лет назад. [13]
Некоторые массовые вымирания , такие как меловое вымирание , можно определить по аномально высоким концентрациям иридия в отложениях, и это может быть связано с крупными ударами астероидов . [72]

Граница мела и палеогена 66 миллионов лет назад, обозначающая временную границу между меловым и палеогеновым периодами геологического времени , была определена тонким слоем богатой иридием глины . [73] В 1980 году группа под руководством Луиса Альвареса предположила внеземное происхождение этого иридия, приписывая его удару астероида или кометы . [73] Их теория, известная как гипотеза Альвареса , в настоящее время широко признана для объяснения вымирания нептичьих динозавров . Позже под нынешним полуостровом Юкатан ( кратер Чиксулуб ) была обнаружена большая погребенная ударная кратерная структура, возраст которой оценивается примерно в 66 миллионов лет . [74] [75] Дьюи М. Маклин и другие утверждают, что иридий мог иметь вулканическое происхождение, поскольку ядро Земли богато иридием, а действующие вулканы, такие как Питон-де-ла-Фурнез на острове Реюньон , до сих пор выпускают иридий. [76] [77]
В 2018 году мировое производство иридия составило около 7300 кг (16 100 фунтов). [11] Цена высока и варьируется (см. таблицу). Показательными факторами, влияющими на цену, являются переизбыток ириевых тиглей [78] [79] и изменения в светодиодной технологии. [80]
Платиновые металлы встречаются вместе в виде разбавленных руд. Иридий — один из самых редких платиновых металлов: на каждые 190 тонн платины, полученной из руд, выделяется лишь 7,5 тонны иридия. [81] Чтобы разделить металлы, их необходимо сначала перевести в раствор . Двумя методами придания растворимости Ir-содержащим рудам являются (i) сплавление твердого вещества с пероксидом натрия с последующей экстракцией полученного стекла в царской водке и (ii) экстракция твердого вещества смесью хлора с соляной кислотой . [39] [65] Из растворимых экстрактов иридий отделяют осаждением твердого гексахлориридата аммония ( (NH
4)
2IrCl
6) или путем извлечения IrCl2−
6с органическими аминами. [82] Первый метод аналогичен процедуре, которую Теннант и Волластон использовали для первоначального разделения. Второй метод можно спланировать как непрерывную жидкостно-жидкостную экстракцию , и поэтому он больше подходит для производства в промышленных масштабах. В любом случае продукт, соль хлорида иридия, восстанавливается водородом, получая металл в виде порошка или губки , который можно использовать методами порошковой металлургии . [83] [84] Иридий также получают в коммерческих целях как побочный продукт добычи и переработки никеля и меди . Во время электрорафинирования меди и никеля благородные металлы, такие как серебро, золото и металлы платиновой группы, а также селен и теллур оседают на дно электролизера в виде анодного шлама , который является отправной точкой для их извлечения. [78]
Благодаря устойчивости иридия к коррозии он находит промышленное применение. Основными областями использования являются электроды для производства хлора и других агрессивных продуктов, светодиоды OLED , тигли, катализаторы (например, уксусная кислота ) и наконечники зажигания для свечей зажигания. [81]
Устойчивость к нагреву и коррозии являются основой нескольких применений иридия и его сплавов.
Благодаря высокой температуре плавления, твердости и коррозионной стойкости иридий используется для изготовления тиглей. Такие тигли используются в процессе Чохральского для производства монокристаллов оксидов (таких как сапфиры ) для использования в устройствах компьютерной памяти и в твердотельных лазерах. [86] [87] Кристаллы, такие как гадолиний-галлиевый гранат и иттрий-галлиевый гранат, выращиваются путем плавления предварительно спеченных зарядов смешанных оксидов в окислительных условиях при температуре до 2100 ° C (3810 ° F). [15]
Некоторые детали авиационных двигателей с длительным сроком службы изготавливаются из иридиевого сплава, а иридий- титановый сплав используется для глубоководных труб из-за его коррозионной стойкости. [24] Иридий используется для изготовления многопористых фильер , через которые расплав пластикового полимера экструдируется с образованием волокон, таких как вискоза . [88] Осмий-иридий используется для подшипников компаса и весов. [15]
Из-за своей устойчивости к дуговой эрозии некоторые производители используют иридиевые сплавы для электрических контактов для свечей зажигания , [86] [89] , а свечи зажигания на основе иридия особенно используются в авиации.
Соединения иридия используются в качестве катализаторов в процессе карбонилирования метанола с получением уксусной кислоты Cativa . [90] [91]
Комплексы иридия часто активны при асимметричном гидрировании , как при традиционном гидрировании . [92] и трансферное гидрирование . [93] Это свойство лежит в основе промышленного пути получения хирального гербицида (S)-метолахлора. Как практикуется компанией Syngenta в масштабах 10 000 тонн/год, комплекс [[ [Ir(COD)Cl] 2 в присутствии лигандов иозифоса . [94]
Радиоизотоп иридий-192 — один из двух наиболее важных источников энергии, используемых в промышленной γ-радиографии для неразрушающего контроля металлов . [95] [96] Кроме того,192
ИК
используется в качестве источника гамма-излучения для лечения рака с помощью брахитерапии — формы лучевой терапии, при которой закрытый радиоактивный источник размещается внутри или рядом с областью, требующей лечения. Специфические методы лечения включают высокодозную брахитерапию простаты, брахитерапию желчных протоков и внутриполостную брахитерапию шейки матки. [24] Иридий-192 обычно производится нейтронной активацией изотопа иридия-191 в природном металлическом иридии. [97]
Комплексы иридия являются ключевыми компонентами белых органических светодиодов . Подобные комплексы используются в фотокатализе . [98]

Сплав, состоящий из 90% платины и 10% иридия, был использован в 1889 году для создания Международного прототипа метра и килограммовой массы, хранившегося в Международном бюро мер и весов недалеко от Парижа . [24] Метровый стержень в качестве определения фундаментальной единицы длины в 1960 году был заменен линией в атомном спектре криптона , [d] [ 99] , но прототип килограмма оставался международным стандартом массы до 20 мая 2019 года . когда килограмм был переопределен через постоянную Планка . [100]

В наконечниках перьев перьевых ручек использовались иридий-осмиевые сплавы . Первое крупное использование иридия произошло в 1834 году в перьях, закрепленных на золоте. [15] С 1944 года знаменитая перьевая ручка Parker 51 оснащалась пером с наконечником из сплава рутения и иридия (с содержанием иридия 3,8%). Материал наконечника современных перьевых ручек до сих пор условно называют «иридием», хотя иридий в нем редко встречается; его место заняли другие металлы, такие как рутений , осмий и вольфрам . [101]
Для сенсорных отверстий или вентиляционных частей пушки использовался иридий-платиновый сплав . Согласно отчету Парижской выставки 1867 года , одна из частей, выставленных Джонсоном и Матти, «была использована в ружье Уитворта более 3000 выстрелов и пока почти не проявляет признаков износа. Те, кто знает постоянные проблемы и расходы, вызванные ношением вентиляционных частей пушки во время действительной службы, оценят это важное приспособление». [102]
Пигмент черный иридий , состоящий из очень мелкодисперсного иридия, используется для окраски фарфора в интенсивный черный цвет; было сказано, что «все остальные фарфоровые черные цвета рядом с ним кажутся серыми». [103]
Иридий в объемной металлической форме не является биологически важным и опасным для здоровья из-за отсутствия реакции с тканями; в тканях человека содержится всего около 20 частей на триллион иридия. [24] Как и большинство металлов, мелкодисперсный порошок иридия может быть опасен в обращении, так как он вызывает раздражение и может воспламениться на воздухе. [65] К 2015 году о токсичности соединений иридия известно очень мало, [104] в первую очередь потому, что оно используется настолько редко, что мало кто контактирует с ним, и те, кто контактирует только с очень небольшими количествами. Однако растворимые соли, такие как галогениды иридия, могут быть опасными из-за элементов, отличных от иридия, или из-за самого иридия. [30] В то же время большинство соединений иридия нерастворимы, что затрудняет всасывание в организм. [24]
Радиоизотоп иридия,192
Ir опасен, как и другие радиоактивные изотопы. Единственные зарегистрированные травмы, связанные с иридием, касаются случайного воздействия радиации от192
Используется в брахитерапии . [30] Высокоэнергетическое гамма-излучение от192
Ir может увеличить риск развития рака. Внешнее облучение может вызвать ожоги, радиационное отравление и смерть. Проглатывание 192 Ir может привести к ожогу слизистой оболочки желудка и кишечника. [105] 192 Ir, 192m Ir и 194m Ir имеют тенденцию откладываться в печени и могут представлять опасность для здоровья как от гамма-, так и от бета- излучения. [60]