Сердечная мышца (также называемая сердечной мышцей или миокардом ) является одним из трех типов мышечных тканей позвоночных , остальные - скелетные мышцы и гладкие мышцы . Это непроизвольная поперечнополосатая мышца , которая составляет основную ткань стенки сердца . Сердечная мышца (миокард) образует толстый средний слой между внешним слоем стенки сердца ( перикардом ) и внутренним слоем ( эндокардом ), с кровоснабжением через коронарное кровообращение . Она состоит из отдельных клеток сердечной мышцы, соединенных вставочными дисками и заключенных в оболочку из коллагеновых волокон и других веществ, которые образуют внеклеточный матрикс .
Сердечная мышца сокращается аналогично скелетной мышце , хотя и с некоторыми важными отличиями. Электрическая стимуляция в форме сердечного потенциала действия запускает высвобождение кальция из внутреннего хранилища кальция клетки, саркоплазматического ретикулума . Повышение уровня кальция заставляет миофиламенты клетки скользить друг мимо друга в процессе, называемом сопряжением возбуждения и сокращения . Заболевания сердечной мышцы, известные как кардиомиопатии, имеют большое значение. К ним относятся ишемические состояния, вызванные ограниченным кровоснабжением мышцы, такие как стенокардия и инфаркт миокарда .




Сердечная мышечная ткань или миокард составляет основную часть сердца. Стенка сердца представляет собой трехслойную структуру с толстым слоем миокарда, зажатым между внутренним эндокардом и наружным эпикардом (также известным как висцеральный перикард). Внутренний эндокард выстилает сердечные камеры, покрывает сердечные клапаны и соединяется с эндотелием , который выстилает кровеносные сосуды, соединяющиеся с сердцем. На внешней стороне миокарда находится эпикард , который образует часть перикардиальной сумки , которая окружает, защищает и смазывает сердце. [1]
Внутри миокарда есть несколько слоев сердечных мышечных клеток или кардиомиоцитов. Слои мышц, которые обертывают левый желудочек, ближайшие к эндокарду, ориентированы перпендикулярно слоям, ближайшим к эпикарду. Когда эти слои сокращаются скоординированно, они позволяют желудочку сжиматься в нескольких направлениях одновременно – продольно (становясь короче от верхушки к основанию), радиально (становясь уже из стороны в сторону) и скручивающим движением (похожим на выжимание влажной ткани), чтобы выжать максимально возможное количество крови из сердца с каждым ударом сердца. [2]
Сокращение сердечной мышцы требует большого количества энергии, поэтому необходим постоянный приток крови для обеспечения кислородом и питательными веществами. Кровь поступает в миокард по коронарным артериям . Они берут начало в корне аорты и лежат на внешней или эпикардиальной поверхности сердца. Затем кровь отводится по коронарным венам в правое предсердие . [1]
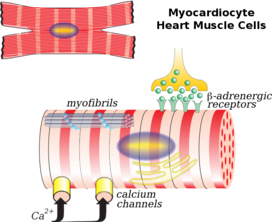
Клетки сердечной мышцы (также называемые кардиомиоцитами ) являются сократительными миоцитами сердечной мышцы. Клетки окружены внеклеточным матриксом , вырабатываемым поддерживающими фибробластными клетками. Специализированные модифицированные кардиомиоциты, известные как клетки-водители ритма , задают ритм сердечных сокращений. Клетки-водители ритма слабо сократимы без саркомеров и соединены с соседними сократительными клетками через щелевые контакты . [3] Они расположены в синоатриальном узле (первичный водитель ритма), расположенном на стенке правого предсердия , около входа в верхнюю полую вену . [4] Другие клетки-водители ритма находятся в атриовентрикулярном узле (вторичный водитель ритма).
Пейсмекерные клетки переносят импульсы, которые отвечают за биение сердца. Они распределены по всему сердцу и отвечают за несколько функций. Во-первых, они отвечают за возможность спонтанно генерировать и посылать электрические импульсы . Они также должны быть способны получать и отвечать на электрические импульсы от мозга. Наконец, они должны быть способны передавать электрические импульсы от клетки к клетке. [5] Пейсмекерные клетки в синоатриальном узле и атриовентрикулярном узле меньше и проводят с относительно низкой скоростью между клетками. Специализированные проводящие клетки в пучке Гиса и волокнах Пуркинье больше в диаметре и проводят сигналы с высокой скоростью. [6]
Волокна Пуркинье быстро проводят электрические сигналы: коронарные артерии — для доставки питательных веществ к мышечным клеткам, а вены и капиллярная сеть — для удаления продуктов жизнедеятельности. [7]
Клетки сердечной мышцы — это сокращающиеся клетки, которые позволяют сердцу качать кровь. Каждый кардиомиоцит должен сокращаться в координации с соседними клетками — известными как функциональный синцитий — работая над тем, чтобы эффективно качать кровь из сердца, и если эта координация нарушается, то — несмотря на сокращение отдельных клеток — сердце может вообще не качать кровь, что может происходить при аномальных сердечных ритмах , таких как фибрилляция желудочков . [8]
При рассмотрении под микроскопом клетки сердечной мышцы имеют приблизительно прямоугольную форму, размером 100–150 мкм на 30–40 мкм. [9] Отдельные клетки сердечной мышцы соединены на концах вставными дисками , образуя длинные волокна. Каждая клетка содержит миофибриллы , специализированные белковые сократительные волокна актина и миозина , которые скользят друг мимо друга. Они организованы в саркомеры , основные сократительные единицы мышечных клеток. Регулярная организация миофибрилл в саркомеры придает клеткам сердечной мышцы полосатый или исчерченный вид при рассмотрении под микроскопом, похожий на скелетные мышцы. Эти полосы вызваны более светлыми полосами I, состоящими в основном из актина, и более темными полосами A, состоящими в основном из миозина. [7]
Кардиомиоциты содержат Т-трубочки , мешочки клеточной мембраны , которые идут от поверхности клетки к ее внутренней части, что помогает повысить эффективность сокращения. Большинство этих клеток содержат только одно ядро (некоторые могут иметь два центральных ядра), в отличие от клеток скелетных мышц, которые содержат много ядер . Клетки сердечной мышцы содержат много митохондрий , которые обеспечивают необходимую для клетки энергию в форме аденозинтрифосфата (АТФ), что делает их очень устойчивыми к усталости. [9] [7]
T-трубочки — это микроскопические трубки, которые идут от поверхности клетки вглубь клетки. Они являются продолжением клеточной мембраны, состоят из того же фосфолипидного бислоя и открыты на поверхности клетки для внеклеточной жидкости , которая окружает клетку. T-трубочки в сердечной мышце больше и шире, чем в скелетной мышце , но их меньше по количеству. [9] В центре клетки они соединяются, проходя внутрь и вдоль клетки как поперечно-осевая сеть. Внутри клетки они лежат близко к внутреннему кальциевому депо клетки, саркоплазматическому ретикулуму . Здесь одиночная трубочка спаривается с частью саркоплазматического ретикулума, называемой терминальной цистерной, в комбинации, известной как диада . [10]
Функции Т-трубочек включают быструю передачу электрических импульсов, известных как потенциалы действия, от поверхности клетки к ее ядру, а также помощь в регулировании концентрации кальция внутри клетки в процессе, известном как сопряжение возбуждения и сокращения . [9] Они также участвуют в механо-электрической обратной связи, [11] как это видно из вызванного сокращением клетки обмена содержимым Т-трубочек (диффузия с помощью адвекции), [12] что было подтверждено наблюдениями с помощью конфокальной и трехмерной электронной томографии. [13]

Сердечный синцитий представляет собой сеть кардиомиоцитов, соединенных вставочными дисками , которые обеспечивают быструю передачу электрических импульсов через сеть, позволяя синцитию действовать в скоординированном сокращении миокарда. Существует предсердный синцитий и желудочковый синцитий , которые соединены сердечными соединительными волокнами. [14] Электрическое сопротивление через вставочные диски очень низкое, что обеспечивает свободную диффузию ионов. Легкость движения ионов вдоль осей сердечных мышечных волокон такова, что потенциалы действия способны перемещаться от одной клетки сердечной мышцы к другой, встречая лишь небольшое сопротивление. Каждый синцитий подчиняется закону « все или ничего» . [15]
Вставные диски представляют собой сложные адгезивные структуры, которые соединяют отдельные кардиомиоциты с электрохимическим синцитием (в отличие от скелетной мышцы, которая становится многоклеточным синцитием во время эмбрионального развития ). Диски отвечают в основном за передачу силы во время сокращения мышц. Вставные диски состоят из трех различных типов межклеточных соединений: актиновых нитей, закрепляющих соединения fascia adhesivens , промежуточных нитей, закрепляющих десмосомы , и щелевых соединений . [16] Они позволяют потенциалам действия распространяться между сердечными клетками, позволяя ионам проходить между клетками, вызывая деполяризацию сердечной мышцы. Три типа соединений действуют вместе как единая составная область . [16] [17] [18] [19]
Под световым микроскопом вставочные диски выглядят как тонкие, обычно темноокрашенные линии, разделяющие соседние клетки сердечной мышцы. Вставочные диски идут перпендикулярно направлению мышечных волокон. Под электронным микроскопом путь вставочного диска выглядит более сложным. При низком увеличении это может выглядеть как извилистая электронно-плотная структура, покрывающая местоположение скрытой Z-линии. При высоком увеличении путь вставочного диска выглядит еще более извилистым, причем в продольном сечении появляются как продольные, так и поперечные области. [20]
Сердечные фибробласты являются жизненно важными поддерживающими клетками в сердечной мышце. Они не способны обеспечивать сильные сокращения, как кардиомиоциты , но вместо этого в значительной степени отвечают за создание и поддержание внеклеточного матрикса, который окружает кардиомиоциты. [7] Фибробласты играют решающую роль в реагировании на травму, такую как инфаркт миокарда . После травмы фибробласты могут активироваться и превращаться в миофибробласты — клетки, которые демонстрируют поведение где-то между фибробластом (генерирующим внеклеточный матрикс) и гладкомышечной клеткой (способностью сокращаться). В этом качестве фибробласты могут восстанавливать травму, создавая коллаген, при этом осторожно сокращаясь, чтобы стянуть края травмированной области вместе. [21]
Фибробласты меньше, но более многочисленны, чем кардиомиоциты, и несколько фибробластов могут быть прикреплены к кардиомиоциту одновременно. При прикреплении к кардиомиоциту они могут влиять на электрические токи, проходящие через поверхностную мембрану мышечной клетки, и в контексте упоминаются как электрически связанные, [22] как первоначально было показано in vitro в 1960-х годах, [23] и в конечном итоге подтверждено в нативной сердечной ткани с помощью оптогенетических методов. [24] Другие потенциальные роли фибробластов включают электрическую изоляцию сердечной проводящей системы и способность трансформироваться в другие типы клеток, включая кардиомиоциты и адипоциты . [21]
Внеклеточный матрикс (ВКМ) окружает кардиомиоциты и фибробласты. ВКМ состоит из белков, включая коллаген и эластин, а также полисахаридов (сахарных цепей), известных как гликозаминогликаны . [7] Вместе эти вещества обеспечивают поддержку и прочность мышечных клеток, создают эластичность сердечной мышцы и поддерживают мышечные клетки гидратированными, связывая молекулы воды.
Матрикс, непосредственно контактирующий с мышечными клетками, называется базальной мембраной , в основном состоящей из коллагена типа IV и ламинина . Кардиомиоциты связаны с базальной мембраной посредством специализированных гликопротеинов, называемых интегринами . [25]
Люди рождаются с определенным количеством клеток сердечной мышцы, или кардиомиоцитов, которые увеличиваются в размерах по мере того, как сердце увеличивается в течение развития в детстве. Данные свидетельствуют о том, что кардиомиоциты медленно обновляются в процессе старения, но менее 50% кардиомиоцитов, присутствующих при рождении, заменяются в течение нормальной продолжительности жизни. [26] Рост отдельных кардиомиоцитов происходит не только во время нормального развития сердца, он также происходит в ответ на интенсивные упражнения ( синдром спортивного сердца ), заболевания сердца или повреждение сердечной мышцы, например, после инфаркта миокарда. Здоровый взрослый кардиомиоцит имеет цилиндрическую форму длиной приблизительно 100 мкм и диаметром 10–25 мкм. Гипертрофия кардиомиоцитов происходит посредством саркомерогенеза, создания новых единиц саркомера в клетке. Во время перегрузки сердца объемом кардиомиоциты растут посредством эксцентрической гипертрофии. [27] Кардиомиоциты вытягиваются в длину, но имеют тот же диаметр, что приводит к расширению желудочков. При перегрузке сердца давлением кардиомиоциты растут за счет концентрической гипертрофии. [27] Кардиомиоциты увеличиваются в диаметре, но имеют ту же длину, что приводит к утолщению стенки сердца.
Физиология сердечной мышцы имеет много общего с физиологией скелетных мышц . Основная функция обоих типов мышц — сокращение, и в обоих случаях сокращение начинается с характерного потока ионов через клеточную мембрану, известного как потенциал действия . Потенциал действия сердца впоследствии запускает сокращение мышцы, увеличивая концентрацию кальция в цитозоле.
Сердечный цикл — это работа человеческого сердца от начала одного сердечного сокращения до начала следующего. Он состоит из двух периодов: один, во время которого сердечная мышца расслабляется и наполняется кровью, называется диастолой , после периода сильного сокращения и перекачивания крови, называемого систолой . После опорожнения сердце немедленно расслабляется и расширяется, чтобы получить еще один приток крови, возвращающейся из легких и других систем организма, прежде чем снова сократиться, чтобы перекачать кровь в легкие и эти системы. Нормально работающее сердце должно полностью расшириться, прежде чем оно сможет снова эффективно перекачивать кровь.
Фаза покоя считается поляризованной. Потенциал покоя во время этой фазы сокращения разделяет ионы, такие как натрий, калий и кальций. Клетки миокарда обладают свойством автоматизма или спонтанной деполяризации . Это прямой результат мембраны, которая позволяет ионам натрия медленно проникать в клетку, пока не будет достигнут порог деполяризации. Ионы кальция следуют за ними и продолжают деполяризацию еще дальше. Как только кальций перестает двигаться внутрь, ионы калия медленно выходят наружу, вызывая реполяризацию. Очень медленная реполяризация мембраны КМЦ отвечает за длительный рефрактерный период. [28] [29]
Однако механизм, посредством которого концентрация кальция в цитозоле повышается, отличается в скелетных и сердечных мышцах. В сердечной мышце потенциал действия включает в себя внутренний поток как ионов натрия, так и ионов кальция. Поток ионов натрия быстрый, но очень кратковременный, в то время как поток кальция поддерживается и дает фазу плато, характерную для потенциалов действия сердечной мышцы. Сравнительно небольшой поток кальция через кальциевые каналы L-типа вызывает гораздо большее высвобождение кальция из саркоплазматического ретикулума в феномене, известном как высвобождение кальция, вызванное кальцием . Напротив, в скелетных мышцах минимальный поток кальция поступает в клетку во время потенциала действия, и вместо этого саркоплазматический ретикулум в этих клетках напрямую связан с поверхностной мембраной. Это различие можно проиллюстрировать наблюдением, что волокнам сердечной мышцы требуется присутствие кальция в растворе, окружающем клетку, чтобы сокращаться, в то время как волокна скелетных мышц будут сокращаться без внеклеточного кальция.
Во время сокращения клетки сердечной мышцы длинные белковые миофиламенты , ориентированные вдоль длины клетки, скользят друг по другу в так называемой теории скользящих нитей . Существует два типа миофиламентов: толстые нити, состоящие из белка миозина , и тонкие нити, состоящие из белков актина , тропонина и тропомиозин . Когда толстые и тонкие нити скользят друг мимо друга, клетка становится короче и толще. В механизме, известном как циклирование с поперечными мостиками , ионы кальция связываются с белком тропонином, который затем вместе с тропомиозином открывает ключевые сайты связывания на актине. Затем миозин в толстом филаменте может связываться с актином, вытягивая толстые нити вдоль тонких нитей. Когда концентрация кальция внутри клетки падает, тропонин и тропомиозин снова покрывают сайты связывания на актине, заставляя клетку расслабиться.

Обычно считалось, что клетки сердечной мышцы не могут быть регенерированы. Однако это противоречит отчету, опубликованному в 2009 году. [30] Олаф Бергманн и его коллеги из Каролинского института в Стокгольме протестировали образцы сердечной мышцы людей, родившихся до 1955 года, у которых было очень мало сердечной мышцы вокруг сердца, многие из которых имели инвалидность из-за этой аномалии. Используя образцы ДНК из многих сердец, исследователи подсчитали, что у 4-летнего ребенка ежегодно обновляется около 20% клеток сердечной мышцы, а около 69% клеток сердечной мышцы 50-летнего человека были сгенерированы после его рождения. [30]
Одним из способов регенерации кардиомиоцитов является деление уже существующих кардиомиоцитов в ходе нормального процесса старения. [31]
В 2000-х годах было сообщено об открытии взрослых эндогенных сердечных стволовых клеток, и были опубликованы исследования, в которых утверждалось, что различные линии стволовых клеток, включая стволовые клетки костного мозга , способны дифференцироваться в кардиомиоциты и могут использоваться для лечения сердечной недостаточности . [32] [33] Однако другие группы не смогли повторить эти результаты, и многие из оригинальных исследований были позже отозваны за научное мошенничество. [34] [35]

Сердечная мышца образует как предсердия, так и желудочки сердца. Хотя эта мышечная ткань очень похожа между камерами сердца, существуют некоторые различия. Миокард, обнаруженный в желудочках, толстый, чтобы обеспечить сильные сокращения, в то время как миокард в предсердиях намного тоньше. Отдельные миоциты, составляющие миокард, также различаются между камерами сердца. Желудочковые кардиомиоциты длиннее и шире, с более плотной сетью Т-трубочек . Хотя основные механизмы обработки кальция схожи между желудочковыми и предсердными кардиомиоцитами, кальциевый транзит меньше и быстрее затухает в предсердных миоцитах, с соответствующим увеличением буферной емкости кальция. [36] Набор ионных каналов различается между камерами, что приводит к более длительным длительностям потенциала действия и эффективным рефрактерным периодам в желудочках. Определенные ионные токи, такие как I K(UR), высокоспецифичны для предсердных кардиомиоцитов, что делает их потенциальной мишенью для лечения мерцательной аритмии . [37]
Заболевания, поражающие сердечную мышцу, известные как кардиомиопатии , являются основной причиной смерти в развитых странах . [38] Наиболее распространенным заболеванием является ишемическая болезнь сердца , при которой снижается приток крови к сердцу . Коронарные артерии сужаются из-за образования атеросклеротических бляшек . [39] Если эти сужения становятся достаточно серьезными, чтобы частично ограничить приток крови, может возникнуть синдром стенокардии . [39] Это обычно вызывает боль в груди при нагрузке, которая облегчается в покое. Если коронарная артерия внезапно становится очень суженной или полностью заблокированной, прерывая или значительно уменьшая поток крови через сосуд, происходит инфаркт миокарда или сердечный приступ. [40] Если закупорка не устраняется быстро с помощью лекарств , чрескожного коронарного вмешательства или хирургического вмешательства , то область сердечной мышцы может стать постоянно рубцовой и поврежденной. [41] Конкретные кардиомиопатии включают: увеличенную массу левого желудочка ( гипертрофическая кардиомиопатия ), [42] аномально большую ( дилатационная кардиомиопатия ), [43] или аномально жесткую ( рестриктивная кардиомиопатия ). [44] Некоторые из этих состояний вызваны генетическими мутациями и могут передаваться по наследству. [45]
Сердечная мышца также может быть повреждена, несмотря на нормальное кровоснабжение. Сердечная мышца может воспалиться при состоянии, называемом миокардитом , [46] чаще всего вызываемом вирусной инфекцией [47], но иногда вызываемом собственной иммунной системой организма . [48] Сердечная мышца также может быть повреждена такими препаратами, как алкоголь, длительным повышенным кровяным давлением или гипертонией , или постоянным ненормальным сердечным ритмом . [49] Многие из этих состояний, если они достаточно серьезны, могут повредить сердце настолько, что насосная функция сердца снижается. Если сердце больше не способно перекачивать достаточно крови для удовлетворения потребностей организма, это описывается как сердечная недостаточность . [49]
Значительное повреждение клеток сердечной мышцы называется миоцитолизом , который считается типом клеточного некроза, определяемого как коагуляционный или колликвационный. [50] [51]
{{cite book}}: CS1 maint: несколько имен: список авторов ( ссылка ){{cite journal}}: Цитировать журнал требует |journal=( помощь ){{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка ){{cite book}}: CS1 maint: несколько имен: список авторов ( ссылка ){{cite book}}: CS1 maint: другие ( ссылка ){{cite book}}: CS1 maint: несколько имен: список авторов ( ссылка )