Берлинская лазурь (также известная как берлинская лазурь , бранденбургская лазурь , парижская лазурь и парижская лазурь ) — тёмно- синий пигмент , получаемый путём окисления солей ферроцианида железа . Имеет химическую формулу FeIII
4[ФеII
( КН )
6]
3Синий Тернбулла химически идентичен, но производится из других реагентов , а его немного отличающийся цвет обусловлен разными примесями и размерами частиц.
Берлинская лазурь была создана в начале 18 века и является первым современным синтетическим пигментом. Она готовится как очень тонкая коллоидная дисперсия , поскольку соединение не растворяется в воде. Она содержит переменные количества [2] других ионов, и ее внешний вид чувствительно зависит от размера коллоидных частиц. Пигмент используется в красках , он стал заметным в японских гравюрах на дереве айзури-э (藍摺り絵) 19 века , и это традиционный «синий» в технических чертежах .
В медицине берлинская лазурь, принимаемая внутрь, используется как противоядие при отравлениях некоторыми видами тяжелых металлов , например, таллием(I) и радиоактивными изотопами цезия . Терапия использует ионообменные свойства берлинской лазури и ее высокое сродство к определенным « мягким » катионам металлов . Она включена в Список основных лекарственных средств Всемирной организации здравоохранения , наиболее важных лекарств, необходимых в базовой системе здравоохранения . [3]
Берлинская лазурь дала свое название синильной кислоте (цианистому водороду), полученной из нее. На немецком языке цианистый водород называется Blausäure ('синяя кислота'). Цианид также получил свое название от этой связи.

Пигмент берлинской лазури имеет важное значение, поскольку он был первым стабильным и относительно светостойким синим пигментом, который широко использовался после утраты знаний о синтезе египетской сини . Европейские художники ранее использовали ряд пигментов, таких как краситель индиго , смальта и тирский пурпур , а также чрезвычайно дорогой ультрамарин, изготавливаемый из лазурита . Японские художники и художники гравюры на дереве также не имели доступа к долговечному синему пигменту, пока они не начали импортировать берлинскую лазурь из Европы. [4]
берлинская лазурь Fe
7( КН )
18(также ( Фе
4[Fe(CN)
6]
3) · х Н
2O ) был, вероятно, впервые синтезирован производителем красок Иоганном Якобом Дисбахом в Берлине около 1706 года. [5] [6] Считается, что пигмент был создан случайно, когда Дисбах использовал поташ , испорченный кровью , чтобы создать краситель красного цвета кошениль . Для оригинального красителя требовались поташ, сульфат железа и высушенная кошениль. Вместо этого кровь, поташ и сульфат железа вступили в реакцию, создав соединение, известное как ферроцианид железа, который, в отличие от желаемого красного пигмента, имеет очень отчетливый синий оттенок. [7] Он был назван Preußisch blau и Berlinisch blau в 1709 году его первым торговцем. [8] [9] [10]
Пигмент легко заменил дорогостоящий ультрамарин, полученный из лазурита, и был важной темой в письмах, которыми обменивались Иоганн Леонард Фриш и президент Прусской академии наук Готфрид Вильгельм Лейбниц в период с 1708 по 1716 год. [8] Впервые он упоминается в письме Фриша Лейбницу от 31 марта 1708 года. Не позднее 1708 года Фриш начал продвигать и продавать пигмент по всей Европе. К августу 1709 года пигмент был назван Preussisch blau ; к ноябрю 1709 года немецкое название Berlinisch Blau было впервые использовано Фришем. Сам Фриш является автором первой известной публикации о берлинской лазури в газете Notitia Coerulei Berolinensis nuper inventi в 1710 году, как можно вывести из его писем. Дисбах работал на Фриша примерно с 1701 года.

На сегодняшний день « Погребение Христа» , датированное 1709 годом Питером ван дер Верффом (Картинная галерея Сан-Суси , Потсдам), является старейшей известной картиной, где использовалась берлинская лазурь. Около 1710 года художники при прусском дворе уже использовали этот пигмент. Примерно в то же время берлинская лазурь прибыла в Париж, где Антуан Ватто , а позднее его последователи Николя Ланкре и Жан-Батист Патер использовали ее в своих картинах. [5] [11] Франсуа Буше широко использовал этот пигмент как для синего, так и для зеленого. [12]
В 1731 году Георг Эрнст Шталь опубликовал отчет о первом синтезе берлинской лазури. [13] В этой истории участвует не только Дисбах, но и Иоганн Конрад Диппель . Дисбах пытался создать красный пигмент из кошенили, но вместо этого получил синий в результате использования загрязненного поташа. Он позаимствовал поташ у Диппеля, который использовал его для производства своего животного масла . Ни один другой известный исторический источник не упоминает Диппеля в этом контексте. Поэтому сегодня трудно судить о надежности этой истории. В 1724 году рецепт был наконец опубликован Джоном Вудвордом. [14] [15] [16]
В 1752 году французский химик Пьер Ж. Макер сделал важный шаг, показав, что берлинскую лазурь можно восстановить до соли железа и новой кислоты, которую можно использовать для восстановления красителя. [17] Новая кислота, цианистый водород , впервые выделенная из берлинской лазури в чистом виде и охарактеризованная в 1782 году шведским химиком Карлом Вильгельмом Шееле , [18] в конечном итоге получила название Blausäure (буквально «синяя кислота») из-за ее происхождения от берлинской лазури, и в английском языке стала широко известна как синильная кислота. Цианид , бесцветный анион, который образуется в процессе получения берлинской лазури, получил свое название от греческого слова, обозначающего темно-синий цвет.
В конце 1800-х годов раввин Гершон Генох Лейнер , хасидский раввин Радзина , красил цициёт прусской синей, сделанной с сепией , полагая, что это был настоящий краситель техейлес . Хотя некоторые подвергали сомнению его идентичность как техейлес из-за его искусственного производства и утверждали , что если бы раввин Лейнер знал об этом, он бы отказался от своей позиции, что его краситель был техейлес, [19] другие оспаривали это и утверждали, что раввин Лейнер не отказался бы от своей позиции. [20]

С начала XVIII века прусский синий был преобладающим цветом мундира, который носили пехотные и артиллерийские полки прусской армии . [21] Как Dunkelblau (тёмно-синий), этот оттенок приобрёл символическое значение и продолжал носиться большинством немецких солдат в церемониальных и внеслужебных случаях вплоть до начала Первой мировой войны , когда его заменил зеленовато-серый полевой серый ( Feldgrau ). [22]
Берлинская лазурь получается путем окисления солей ферроцианида железа. Эти белые твердые вещества имеют формулу M
2Fe[Fe(CN)
6] где М+
= На+
или К+
. Железо в этом материале полностью двухвалентное, отсюда и отсутствие глубокого цвета, связанного со смешанной валентностью. Окисление этого белого твердого вещества перекисью водорода или хлоратом натрия дает феррицианид и дает берлинскую лазурь. [23]
«Растворимая» форма KFe III [Fe II (CN)
6] , который на самом деле является коллоидным , можно получить из ферроцианида калия и железа(III):
Аналогичная реакция феррицианида калия и железа(II) приводит к получению того же коллоидного раствора, поскольку [Fe III (CN)
6]3−
превращается в ферроцианид.
«Нерастворимая» берлинская лазурь получается, если в приведенных выше реакциях избыток Fe3+
добавлено:
Несмотря на то, что он готовится из цианистых солей, берлинская лазурь не токсична, поскольку цианидные группы прочно связаны с железом. [25] Как ферроцианид ((Fe II (CN) 6 ) 4− ), так и феррицианид ((Fe III (CN) 6 ) 3− ) являются особенно стабильными и нетоксичными полимерными цианометаллатами из-за сильной координации железа с цианид-ионами. Хотя цианид хорошо связывается с переходными металлами в целом, такими как хром, эти нежелезные координационные соединения не так стабильны, как цианиды железа, поэтому увеличивается риск высвобождения ионов CN − и, следовательно, сравнительной токсичности. [26]
В прежние времена считалось, что добавление солей железа(II) к раствору феррицианида дает материал, отличный от берлинской лазури. Продукт традиционно назывался синью Тернбулла (TB). Однако методы рентгеновской дифракции и электронной дифракции показали, что структуры PB и TB идентичны. [27] [28] Различия в цветах для TB и PB отражают тонкие различия в методах осаждения, которые сильно влияют на размер частиц и содержание примесей.
Берлинская белизна, также известная как берлинская белизна или соль Эверетта , является натриевым конечным членом полностью восстановленной формы берлинской лазури, в которой все железо присутствует в виде Fe II . Это гексацианоферрат натрия Fe(II) с формулой Na 2 Fe[Fe(CN) 6 ] . [29] Его значение молекулярной массы составляет 314 г/моль . [29]
Более общая формула, допускающая замену катионов Na + катионами K + , имеет вид A (2−x) B x Fe 2 (CN) 6 (в которой A или B = Na + или K + ).
Берлинская белизна тесно связана с берлинской лазурью, но существенно отличается кристаллографической структурой, размером пор молекулярного каркаса и цветом. Кубическая натриевая берлинская белизна, Na (2−x) K x Fe 2 (CN) 6 ·yH 2 O , и калиевая берлинская белизна, K (2−x) Na x Fe 2 (CN) 6 ·yH 2 O , являются кандидатами в качестве катодных материалов для Na-ионных аккумуляторов . [30] Введение катионов Na + и K + в каркас калиевой берлинской белил обеспечивает благоприятные синергетические эффекты, улучшая долгосрочную стабильность аккумулятора и увеличивая количество возможных циклов перезарядки, продлевая срок его службы. [30] Крупногабаритная рама берлинской белил, легко вмещающая катионы Na + и K + , облегчает их интеркаляцию и последующее извлечение во время циклов заряда/разряда. Просторная и жесткая структура кристалла-хозяина способствует его объемной стабильности против внутреннего напряжения набухания и деформации, возникающих в натриевых батареях после многих циклов. [29] Материал также предлагает перспективы высокой плотности энергии (Ач/кг), обеспечивая при этом высокую скорость перезарядки даже при низкой температуре. [29]
Берлинская лазурь — это микрокристаллический синий порошок. Он нерастворим, но кристаллиты имеют тенденцию образовывать коллоид. Такие коллоиды могут проходить через тонкие фильтры. [2] Несмотря на то, что это одно из старейших известных синтетических соединений, состав берлинской лазури оставался неопределенным в течение многих лет. Его точная идентификация была осложнена тремя факторами:
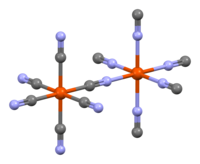


Химическая формула нерастворимой берлинской лазури — Fe
7(CN)
18 · х Н
2O , где x = 14–16. Структура была определена с помощью ИК-спектроскопии , мёссбауэровской спектроскопии , рентгеновской кристаллографии и нейтронной кристаллографии . Поскольку рентгеновская дифракция не может легко отличить углерод от азота в присутствии более тяжёлых элементов, таких как железо, местоположение этих более лёгких элементов выводится спектроскопическими средствами, а также путём наблюдения за расстояниями от центров атомов железа. Нейтронная дифракция может легко отличить атомы N и C, и она использовалась для определения детальной структуры берлинской лазури и её аналогов. [31] [32] [33] [34] [35] [36] [37] [38] [39] [40] [41]
PB имеет гранецентрированную кубическую решетку с четырьмя ионами железа (III) на элементарную ячейку. «Растворимые» кристаллы PB содержат междоузельный K+
ионы; нерастворимый PB имеет интерстициальную воду, вместо этого. В идеальных нерастворимых кристаллах PB кубический каркас построен из последовательностей Fe(II)–C–N–Fe(III) с расстояниями Fe(II)–углерод 1,92 Å и расстояниями Fe(III)–азот 2,03 Å. Четверть позиций Fe(CN)
6субъединицы (предположительно случайные) являются вакантными (пустыми), оставляя три такие группы в среднем на элементарную ячейку. [42] Пустые азотные позиции вместо этого заполнены молекулами воды, которые координируются с Fe(III).

Центры Fe(II), которые являются низкоспиновыми , окружены шестью углеродными лигандами в октаэдрической конфигурации. Центры Fe(III), которые являются высокоспиновыми , октаэдрически окружены в среднем 4,5 атомами азота и 1,5 атомами кислорода (кислород из шести координированных молекул воды). Около восьми (междоузельных) молекул воды присутствуют в элементарной ячейке, либо в виде изолированных молекул, либо водородно связанных с координированной водой. Стоит отметить, что в растворимых гексацианоферратах Fe(II или III) всегда координируется с атомом углерода цианида , тогда как в кристаллической берлинской лазури ионы Fe координируются как с C, так и с N. [43]
Состав, как известно, изменчив из-за наличия дефектов решетки, что позволяет ему гидратироваться в различной степени, поскольку молекулы воды включаются в структуру, чтобы занять катионные вакансии. Изменчивость состава берлинской лазури объясняется ее низкой растворимостью , что приводит к ее быстрому осаждению без времени для достижения полного равновесия между твердым телом и жидкостью. [42] [44]
Берлинская лазурь имеет интенсивную окраску и имеет тенденцию к черному и темно-синему цвету при смешивании с масляными красками . Точный оттенок зависит от способа приготовления, который диктует размер частиц. Интенсивный синий цвет берлинской лазури связан с энергией переноса электронов от Fe(II) к Fe(III). Многие такие соединения со смешанной валентностью поглощают определенные длины волн видимого света в результате интервального переноса заряда . В этом случае поглощается оранжево-красный свет с длиной волны около 680 нанометров , и отраженный свет в результате кажется синим.
Как и большинство пигментов с высокой хроматичностью , берлинская лазурь не может быть точно отображена на дисплее компьютера. Берлинская лазурь является электрохромной — она меняет цвет с синего на бесцветный при восстановлении . Это изменение вызвано восстановлением Fe(III) до Fe(II), что исключает интервальный перенос заряда , который обуславливает цвет берлинской лазури.

Поскольку он легко изготавливается, дешев, нетоксичен и имеет интенсивный цвет, берлинская лазурь нашла множество применений. Она была принята в качестве пигмента вскоре после своего изобретения и почти сразу же стала широко использоваться в масляных красках, акварели и крашении. [46] Доминирующее применение — пигменты: ежегодно производится около 12 000 тонн берлинской лазури для использования в черных и голубоватых чернилах . Множество других пигментов также содержат этот материал. [23] Инженерная синяя и пигмент, образующийся на цианотипах , — что дало им общее название «синьки» . Некоторые мелки когда-то были окрашены берлинской лазурью (позже переименованной в полуночную синь ). Аналогичным образом, берлинская синяя является основой для подсинивания белья .
По данным Европейской обсерватории по наноматериалам, наночастицы берлинской лазури используются в качестве пигментов в некоторых косметических ингредиентах.
Способность берлинской лазури включать одновалентные металлические катионы (Me + ) делает ее полезной в качестве связывающего агента для некоторых токсичных тяжелых металлов . В частности, фармацевтическая берлинская лазурь используется для людей, которые проглотили таллий (Tl + ) или радиоактивный цезий ( 134 Cs + , 137 Cs + ). По данным Международного агентства по атомной энергии (МАГАТЭ), взрослый мужчина может съедать не менее 10 г берлинской лазури в день без серьезного вреда. Управление по контролю за продуктами и лекарствами США (FDA) определило, что «капсулы берлинской лазури по 500 мг, произведенные в условиях одобренной заявки на новый препарат, могут быть признаны безопасной и эффективной терапией» в некоторых случаях отравления. [47] [48] Радиогардаза (нерастворимые капсулы берлинской лазури [49] ) — коммерческий продукт для удаления цезия-137 из кишечника , а значит, и из кровотока , путем вмешательства в энтерогепатическую циркуляцию цезия-137, [50] сокращая время внутреннего пребывания (и воздействие) примерно на две трети. В частности, он использовался для адсорбции и удаления137
Cs+
от отравления в результате аварии в Гоянии в Бразилии. [2]
Берлинская лазурь — это распространенное гистопатологическое окрашивание, используемое патологами для обнаружения железа в образцах биопсии , например, в образцах костного мозга . Первоначальная формула окрашивания, известная исторически (1867) как « берлинская лазурь Перлза » по имени ее изобретателя, немецкого патолога Макса Перлза (1843–1881), использовала отдельные растворы ферроцианида калия и кислоты для окрашивания тканей (теперь они используются вместе, непосредственно перед окрашиванием). Отложения железа в тканях затем образуют на месте пурпурный краситель берлинская лазурь и визуализируются как синие или фиолетовые отложения. [51]
Инженерная синяя , берлинская лазурь на масляной основе, является традиционным материалом, используемым для точечного нанесения на металлические поверхности, такие как поверхностные пластины и подшипники для ручного шабрения . Тонкий слой невысыхающей пасты наносится на контрольную поверхность и переносится на высокие точки заготовки. Затем изготовитель инструментов скоблит, обрабатывает камнями или иным образом удаляет отмеченные высокие точки. Берлинская лазурь предпочтительнее, поскольку она не будет истирать чрезвычайно точные контрольные поверхности, как это могут делать многие грунтовые пигменты. Другие области применения включают маркировку зубьев шестерен во время сборки для определения их характеристик интерфейса.
Берлинская лазурь образуется в анализе берлинской лазури на общие фенолы . Образцы и фенольные стандарты подвергаются воздействию кислого хлорида железа и феррицианида, который восстанавливается до ферроцианида фенолами. Хлорид железа и ферроцианид реагируют, образуя берлинскую лазурь. Сравнение поглощения при 700 нм образцов со стандартами позволяет определить общие фенолы или полифенолы . [52] [53]
Берлинская лазурь присутствует в некоторых препаратах для подсинивания белья , таких как «Подсинивание миссис Стюарт» . [54]
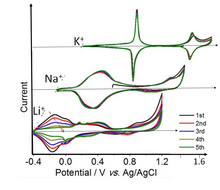
Берлинская лазурь (PB) изучается на предмет ее применения в электрохимическом хранении энергии с 1978 года. [55] Собственно берлинская лазурь (твердое тело Fe-Fe) показывает два четко определенных обратимых окислительно-восстановительных перехода в растворах K + . Слабо сольватированные ионы калия (а также Rb + и Cs + , не показаны) имеют сольватированный радиус, который соответствует структуре берлинской лазури. С другой стороны, размеры сольватированных Na + и Li + слишком велики для полости PB, и интеркаляция этих ионов затруднена и происходит гораздо медленнее. Низко- и высоковольтные наборы пиков в циклической вольтамперометрии соответствуют 1 и ⅔ электрона на атом Fe соответственно. [56] Высоковольтный набор обусловлен переходом Fe 3+ /Fe 2+ при низкоспиновых ионах Fe, координированных с атомами C. Низковольтный набор обусловлен высокоспиновым ионом Fe, координированным с атомами N. [57] [58] [59]
Можно заменить центры металла Fe в PB ионами других металлов, таких как Mn, Co, Ni, Zn и т. д., чтобы сформировать электрохимически активные аналоги берлинской лазури (PBA). PB/PBA и их производные также были оценены как электродные материалы для обратимой вставки и извлечения щелочных ионов в литий-ионных аккумуляторах , натрий-ионных аккумуляторах и калий-ионных аккумуляторах .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка )