Меланома — самый опасный тип рака кожи ; она развивается из клеток, вырабатывающих меланин , известных как меланоциты . [1] Обычно она возникает на коже, но иногда может возникнуть во рту, кишечнике или глазах ( увеальная меланома ). [1] [2]
У женщин меланомы чаще всего возникают на ногах, а у мужчин — на спине. [2] Меланому часто называют злокачественной меланомой . Однако медицинское сообщество подчеркивает, что не существует такого понятия, как «доброкачественная меланома», и рекомендует избегать термина «злокачественная меланома» как избыточного . [7] [8] [9]
Около 25% меланом развиваются из родинок . [2] Изменения в родинке, которые могут указывать на меланому, включают увеличение — особенно быстрое — размера, неровные края, изменение цвета, зуд или разрушение кожи . [1]
Основной причиной меланомы является воздействие ультрафиолетового света (УФ) на людей с низким уровнем пигмента кожи меланина . [2] [10] УФ-излучение может исходить от солнца или других источников, таких как солярии . [2] Люди с большим количеством родинок, историей пораженных членов семьи и слабой иммунной функцией подвергаются большему риску. [1] Ряд редких генетических заболеваний , таких как пигментная ксеродерма , также увеличивают риск. [11] Диагноз ставится на основании биопсии и анализа любого поражения кожи, имеющего признаки потенциального рака. [1]
Избегание ультрафиолетового излучения и использование солнцезащитного крема в условиях яркого ультрафиолетового излучения может предотвратить меланому. [2] Лечение обычно заключается в хирургическом удалении меланомы и потенциально пораженной прилегающей ткани, граничащей с меланомой. [1] У тех, у кого рак немного больше, близлежащие лимфатические узлы могут быть проверены на распространение ( метастазы ). [1] Большинство людей излечиваются, если метастазы не возникли. [1] Для тех, у кого меланома распространилась, иммунотерапия , биологическая терапия , лучевая терапия или химиотерапия могут улучшить выживаемость. [1] [12] При лечении пятилетняя выживаемость в Соединенных Штатах составляет 99% среди тех, у кого заболевание локализовано, 65%, когда заболевание распространилось на лимфатические узлы, и 25% среди тех, у кого заболевание распространилось на отдаленные органы. [4] Вероятность того, что меланома возникнет повторно или распространится, зависит от ее толщины , скорости деления клеток и того, разрушилась ли покрывающая ее кожа. [2]
Меланома — самый опасный тип рака кожи. [2] В 2012 году во всем мире она впервые возникла у 232 000 человек. [2] В 2015 году у 3,1 миллиона человек была активная форма заболевания, что привело к 59 800 смертям. [5] [6] В Австралии и Новой Зеландии самые высокие показатели заболеваемости меланомой в мире. [2] Высокие показатели также наблюдаются в Северной Европе и Северной Америке, в то время как в Азии, Африке и Латинской Америке она встречается реже. [2] В Соединенных Штатах меланома встречается примерно в 1,6 раза чаще у мужчин, чем у женщин. [13] Меланома стала более распространенной с 1960-х годов в районах, в основном населенных людьми европейского происхождения . [2] [11]
Ранние признаки меланомы — это изменение формы или цвета существующих родинок или, в случае узловой меланомы , появление новой опухоли в любом месте кожи. На более поздних стадиях родинка может чесаться , изъязвляться или кровоточить. Ранние признаки меланомы суммируются мнемоническим кодом «ABCDEEFG»: [14] [15]
Эта классификация не применима к узловой меланоме, которая имеет свои собственные классификации: [16]
Метастатическая меланома может вызывать неспецифические паранеопластические симптомы , включая потерю аппетита, тошноту , рвоту и усталость. Метастазы (распространение) ранней меланомы возможны, но относительно редки; менее пятой части меланом, диагностированных на ранней стадии, становятся метастатическими. Метастазы в мозг особенно распространены у пациентов с метастатической меланомой. [17] Она также может распространяться на печень, кости, брюшную полость или отдаленные лимфатические узлы. [ необходима цитата ]
Меланомы обычно вызваны повреждением ДНК в результате воздействия ультрафиолетового излучения солнца. Генетика также играет свою роль. [18] [19] Меланома также может возникнуть на участках кожи, которые мало подвергаются воздействию солнца (например, рот, подошвы ног, ладони рук, области гениталий). [20] Люди с синдромом диспластического невуса , также известным как семейная атипичная меланома множественных родинок, подвержены повышенному риску развития меланомы. [21]
Наличие более 50 родинок указывает на повышенный риск меланомы. Ослабленная иммунная система облегчает развитие рака из-за ослабленной способности организма бороться с раковыми клетками. [18]
Воздействие ультрафиолетового излучения от соляриев увеличивает риск развития меланомы. [22] Международное агентство по изучению рака обнаружило, что солярии являются «канцерогенными для человека» и что люди, которые начинают использовать устройства для загара до тридцати лет, на 75% более склонны к развитию меланомы. [23]
Те, кто работает в самолетах, также, по-видимому, подвержены повышенному риску, что, как полагают, связано с более интенсивным воздействием ультрафиолета. [24]
UVB- свет, исходящий от солнца на длинах волн от 315 до 280 нм, поглощается непосредственно ДНК в клетках кожи, что приводит к типу прямого повреждения ДНК , называемому циклобутановыми пиримидиновыми димерами . Тимин , цитозин или цитозин-тиминовые димеры образуются путем соединения двух соседних пиримидиновых оснований в цепи ДНК. UVA- свет присутствует на длинах волн, превышающих UVB (от 400 до 315 нм); и он также может поглощаться непосредственно ДНК в клетках кожи, но с более низкой эффективностью — примерно от 1/100 до 1/1000 UVB. [25]
Воздействие радиации (UVA и UVB) является основным фактором, способствующим развитию меланомы. [26] Периодическое сильное воздействие солнца, которое приводит к « солнечным ожогам » на участках человеческого тела, причинно связано с меланомой; [27] и такие области только периодического воздействия, по-видимому, объясняют, почему меланома чаще встречается на спине у мужчин и на ногах у женщин. Риск, по-видимому, сильно зависит от социально-экономических условий, а не от работы в помещении или на открытом воздухе; он чаще встречается у профессиональных и административных работников, чем у неквалифицированных рабочих. [28] [29] Другими факторами являются мутации (или полная потеря) генов-супрессоров опухолей . Использование соляриев с их глубоко проникающими лучами UVA было связано с развитием рака кожи, включая меланому. [30]
Возможные значимые элементы в определении риска включают интенсивность и продолжительность воздействия солнца, возраст, в котором происходит воздействие солнца, и степень пигментации кожи . Показатели меланомы, как правило, самые высокие в странах, заселенных мигрантами из Северной Европы, где много прямого, интенсивного солнечного света, к которому кожа поселенцев не адаптирована, особенно в Австралии. Воздействие в детстве является более важным фактором риска, чем воздействие во взрослом возрасте. Это видно из исследований миграции в Австралии. [31]
Получение множественных серьезных солнечных ожогов увеличивает вероятность того, что будущие солнечные ожоги перерастут в меланому из-за кумулятивного повреждения. [18] Солнечный свет с высокой интенсивностью ультрафиолетового излучения и солярии являются основными источниками ультрафиолетового излучения, которые увеличивают риск развития меланомы [32] , а проживание вблизи экватора увеличивает воздействие ультрафиолетового излучения. [18]
Ряд редких мутаций, которые часто встречаются в семьях, значительно увеличивают восприимчивость к меланоме. [33] Несколько генов увеличивают риск. Некоторые редкие гены имеют относительно высокий риск возникновения меланомы; некоторые более распространенные гены, такие как ген MC1R , который вызывает рыжие волосы, имеют относительно более низкий повышенный риск. Генетическое тестирование может быть использовано для поиска мутаций. [ необходима цитата ]
Один класс мутаций влияет на ген CDKN2A . Альтернативная мутация рамки считывания в этом гене приводит к дестабилизации p53 , фактора транскрипции, участвующего в апоптозе и в 50% случаев рака у человека. Другая мутация в том же гене приводит к нефункциональному ингибитору CDK4 , циклин -зависимой киназы , которая способствует делению клеток . Мутации, вызывающие состояние кожи пигментную ксеродерму (XP), также увеличивают восприимчивость к меланоме. Разбросанные по всему геному, эти мутации снижают способность клеток восстанавливать ДНК. Мутации CDKN2A и XP обладают высокой пенетрантностью (вероятность того, что носитель выразит фенотип, высока). [ необходима цитата ]
Семейная меланома генетически неоднородна, [19] и локусы для семейной меланомы появляются на плечах хромосом 1p, 9p и 12q. Множественные генетические события были связаны с патогенезом меланомы (развитием заболевания). [34] Ген множественного супрессора опухолей 1 (CDKN2A/MTS1) кодирует p16INK4a — низкомолекулярный белковый ингибитор циклинзависимых протеинкиназ (CDK), который был локализован в области p21 человеческой хромосомы 9. [ 35] FAMMM обычно характеризуется наличием 50 или более комбинированных родинок в дополнение к семейному анамнезу меланомы. [20] Он передается аутосомно-доминантно и в основном связан с мутациями CDKN2A . [20] У людей, у которых FAMMM связана с мутацией CDKN2A, риск рака поджелудочной железы повышен в 38 раз. [36]
Другие мутации дают меньший риск, но более распространены в популяции. Люди с мутациями в гене MC1R в два-четыре раза более склонны к развитию меланомы, чем те, у кого есть две копии дикого типа (типичный незатронутого типа). Мутации MC1R очень распространены, и у всех рыжеволосых людей есть мутировавшая копия. [ необходима цитата ] Мутация гена MDM2 SNP309 связана с повышенным риском для молодых женщин. [37]
Повышенный риск наблюдается у светловолосых и рыжеволосых людей, лиц с множественными атипичными невусами или диспластическими невусами , а также у лиц, родившихся с гигантскими врожденными меланоцитарными невусами . [38]
Семейный анамнез меланомы значительно увеличивает риск для человека, поскольку мутации в нескольких генах были обнаружены в семьях, склонных к меланоме. [39] [18] Люди с анамнезом одной меланомы имеют повышенный риск развития второй первичной опухоли. [40]
Светлая кожа является результатом меньшего содержания меланина в коже, что означает меньшую защиту от ультрафиолетового излучения. [18]


Самая ранняя стадия меланомы начинается, когда меланоциты начинают неконтролируемый рост. Меланоциты находятся между внешним слоем кожи (эпидермисом ) и следующим слоем ( дермой ). Эта ранняя стадия заболевания называется радиальной фазой роста, когда толщина опухоли составляет менее 1 мм, и она распространяется на уровне базального эпидермиса. [41] Поскольку раковые клетки еще не достигли кровеносных сосудов, расположенных глубже в коже, очень маловероятно, что эта меланома на ранней стадии распространится на другие части тела. Если меланому обнаруживают на этой стадии, то ее обычно можно полностью удалить хирургическим путем. [ необходима цитата ]
Когда опухолевые клетки начинают двигаться в другом направлении — вертикально вверх в эпидермис и в сосочковый слой дермы — поведение клеток резко меняется. [42]
Следующим шагом в эволюции является инвазивная радиальная фаза роста, в которой отдельные клетки начинают приобретать инвазивный потенциал. С этого момента меланома способна распространяться. [ необходима цитата ] Глубина поражения по Бреслоу обычно составляет менее 1 мм (0,04 дюйма ), тогда как уровень Кларка обычно составляет 2.
Фаза вертикального роста (VGP) следует за инвазивной меланомой. Опухоль становится способной прорастать в окружающие ткани и может распространяться по всему телу через кровеносные или лимфатические сосуды . Толщина опухоли обычно составляет более 1 мм (0,04 дюйма ), и опухоль затрагивает более глубокие части дермы.
Хозяин вызывает иммунологическую реакцию против опухоли во время VGP, [43] которая оценивается по наличию и активности инфильтрирующих опухоль лимфоцитов (TIL). Эти клетки иногда полностью уничтожают первичную опухоль; это называется регрессией, которая является последней стадией развития. В некоторых случаях первичная опухоль полностью уничтожается и обнаруживается только метастатическая опухоль. Около 40% человеческих меланом содержат активирующие мутации, влияющие на структуру белка B-Raf , что приводит к конститутивной сигнализации через путь Raf- MAP-киназы . [44]
Общей причиной большинства видов рака является повреждение ДНК. [45] УФА-излучение в основном вызывает образование тиминовых димеров . [46] УФА-излучение также производит активные формы кислорода , которые вызывают другие повреждения ДНК, в первую очередь одноцепочечные разрывы, окисленные пиримидины и окисленный пурин 8-оксогуанин (мутагенное изменение ДНК) с частотой 1/10, 1/10 и 1/3 от частоты образования тиминовых димеров, вызванного УФА-излучением, соответственно.
Если не отремонтировать, фотопродукты димера циклобутана пиримидина (CPD) могут привести к мутациям из-за неточного синтеза транслезии во время репликации или репарации ДНК. Наиболее частыми мутациями из-за неточного синтеза после CPD являются мутации перехода цитозина в тимин (C>T) или CC>TT . Их обычно называют мутациями УФ-отпечатков пальцев, так как они являются наиболее специфичными мутациями, вызванными УФ, часто обнаруживаясь в коже, подвергающейся воздействию солнца, но редко обнаруживаясь во внутренних органах. [47] Ошибки в репарации ДНК фотопродуктов УФ или неточный синтез после этих фотопродуктов также могут приводить к делециям, вставкам и хромосомным транслокациям .
Были секвенированы все геномы 25 меланом. [48] В среднем на геном меланомы было обнаружено около 80 000 мутировавших оснований (в основном переходы C>T) и около 100 структурных перестроек. Это намного больше, чем примерно 70 мутаций в поколениях (от родителя к ребенку). [49] [50] Среди 25 меланом около 6000 генов, кодирующих белки, имели миссенс- , нонсенс-мутации или мутации сайта сплайсинга . Транскриптомы более 100 меланом также были секвенированы и проанализированы. Почти 70% всех генов, кодирующих белки человека, экспрессируются в меланоме. Большинство из этих генов также экспрессируются в других нормальных и раковых тканях, при этом около 200 генов демонстрируют более специфичный паттерн экспрессии в меланоме по сравнению с другими формами рака. Примерами генов, специфичных для меланомы, являются тирозиназа , MLANA и PMEL . [51] [52]
УФ-излучение вызывает повреждение ДНК клеток, обычно димеризацию тимина, которая, если ее не восстановить, может создавать мутации в генах клетки. Этот сильный мутагенный фактор делает кожную меланому типом опухоли с наибольшим количеством мутаций. [53] Когда клетка делится , эти мутации распространяются на новые поколения клеток. Если мутации происходят в протоонкогенах или генах-супрессорах опухолей , скорость митоза в клетках, несущих мутацию, может стать неконтролируемой, что приведет к образованию опухоли . Данные от пациентов показывают, что аномальные уровни активирующего фактора транскрипции в ядре клеток меланомы связаны с повышенной метастатической активностью клеток меланомы; [54] [ 55] [56] исследования на мышах по раку кожи, как правило, подтверждают роль активации фактора транскрипции-2 в прогрессировании рака. [57] [58]
Раковые стволовые клетки также могут быть вовлечены. [59]
Масштабные исследования, такие как The Cancer Genome Atlas , охарактеризовали повторяющиеся соматические изменения , вероятно, приводящие к возникновению и развитию кожной меланомы. Исследование Cancer Genome Atlas установило четыре подтипа: мутант BRAF , мутант RAS , мутант NF1 и тройной дикий тип. [60]
Наиболее частая мутация происходит в 600-м кодоне BRAF (50% случаев). BRAF обычно участвует в росте клеток, и эта специфическая мутация делает белок конститутивно активным и независимым от нормальной физиологической регуляции, тем самым способствуя росту опухоли. [61] Гены RAS ( NRAS , HRAS и KRAS ) также периодически мутируют (30% случаев TCGA), а мутации в 61-м или 12-м кодонах запускают онкогенную активность. Мутации потери функции часто затрагивают гены-супрессоры опухолей, такие как NF1 , TP53 и CDKN2A . Другие онкогенные изменения включают слияния, включающие различные киназы, такие как BRAF, [62] RAF1, [63] ALK, RET, ROS1, NTRK1., [64] NTRK3 [65] и MET [66] Мутации и слияния BRAF, RAS и NF1 являются удивительно взаимоисключающими, поскольку они встречаются у разных подгрупп пациентов. Оценка статуса мутации может, таким образом, улучшить стратификацию пациентов и информировать о целевой терапии с использованием определенных ингибиторов. [ необходима цитата ]
В некоторых случаях (3–7%) мутировавшие версии BRAF и NRAS подвергаются амплификации числа копий . [60]
Исследование, проведенное командой Сарны, доказало, что сильно пигментированные клетки меланомы имеют модуль Юнга около 4,93, тогда как у непигментированных он был всего 0,98. [67] В другом эксперименте они обнаружили, что эластичность клеток меланомы важна для ее метастазирования и роста: непигментированные опухоли были больше пигментированных, и им было намного легче распространяться. Они показали, что в опухолях меланомы есть как пигментированные, так и непигментированные клетки , поэтому они оба могут быть устойчивыми к лекарствам и метастатическими. [67]

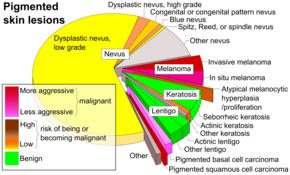
Осмотр или визуальный осмотр рассматриваемой области является наиболее распространенным методом подозрения на меланому. [68] Родинки, которые имеют неправильный цвет или форму, обычно рассматриваются как кандидаты. Чтобы обнаружить меланомы (и повысить показатели выживаемости), рекомендуется научиться распознавать их (см. мнемонику «ABCDE»), регулярно осматривать родинки на предмет изменений (формы, размера, цвета, зуда или кровотечения) и консультироваться с квалифицированным врачом при появлении кандидата. [69] [70] Личный осмотр подозрительных поражений кожи более точен, чем визуальный осмотр изображений подозрительных поражений кожи. [71]
При использовании квалифицированными специалистами дерматоскопия более полезна для выявления злокачественных новообразований, чем использование только невооруженного глаза. [72] Отражательная конфокальная микроскопия может иметь лучшую чувствительность и специфичность, чем дерматоскопия, при диагностике кожной меланомы, но для подтверждения этого результата необходимы дополнительные исследования. [73]
Однако многие меланомы представляют собой поражения диаметром менее 6 мм, и все меланомы являются злокачественными, когда они впервые появляются как маленькая точка. Врачи обычно осматривают все родинки, включая те, которые менее 6 мм в диаметре. Себорейный кератоз может соответствовать некоторым или всем критериям ABCD и может привести к ложным тревогам . Врачи обычно могут отличить себорейный кератоз от меланомы при осмотре или с помощью дерматоскопии . [ необходима цитата ]
Некоторые выступают за замену «увеличение» на «развитие»: родинки, которые меняются и развиваются, вызывают беспокойство. В качестве альтернативы некоторые специалисты предпочитают «возвышение». Возвышение может помочь идентифицировать меланому, но отсутствие возвышения не означает, что поражение не является меланомой. Большинство меланом в США обнаруживаются до того, как они становятся возвышенными. К тому времени, когда возвышение становится заметным, они могут перейти в более опасную инвазивную стадию. [ необходима цитата ]
Одним из методов является « знак гадкого утенка ». [74] Проводится корреляция общих характеристик поражений. Поражения, которые отклоняются от общих характеристик, маркируются как «гадкий утенок», и требуется дальнейшее профессиональное обследование. Знак « Красной Шапочки » [74] предполагает, что у людей со светлой кожей и светлыми волосами могут быть трудно диагностируемые амеланотические меланомы . При обследовании таких людей требуется особая осторожность, так как у них могут быть множественные меланомы и сильно диспластические невусы. Для обнаружения «гадких утят» необходимо использовать дерматоскоп, так как многие меланомы у этих людей напоминают немеланомы или считаются « волками в овечьей шкуре ». [75]
У этих светлокожих людей часто встречаются слегка пигментированные или беспигментные меланомы, которые не дают легко заметных изменений и вариаций цвета. Их границы часто нечеткие, что затрудняет визуальную идентификацию без дерматоскопа.
Амеланотические меланомы и меланомы, возникающие у людей со светлой кожей, очень трудно обнаружить, поскольку они не обладают многими характеристиками правила ABCD, нарушают признак «гадкого утенка» и их трудно отличить от рубцов после угревой сыпи , укусов насекомых, дерматофибром или лентиго .
После визуального осмотра и дерматоскопического обследования [75] или диагностических инструментов in vivo , таких как конфокальный микроскоп, врач может провести биопсию подозрительной родинки. Биопсия кожи, проводимая под местной анестезией , часто требуется для помощи в постановке или подтверждении диагноза и определении степени тяжести. Эллиптическая эксцизионная биопсия может удалить опухоль с последующим гистологическим анализом и оценкой по шкале Бреслоу. Инцизионная биопсия, такая как пункционная биопсия , обычно противопоказана при подозрении на меланому из-за возможности ошибки выборки [76] или локальной имплантации, вызывающей неправильную оценку толщины опухоли. [77] [78] Однако опасения, что такие биопсии могут увеличить риск метастатического заболевания, кажутся необоснованными. [79] [80]
Фотографирование всего тела, которое включает фотографическую документацию как можно большей поверхности тела, часто используется во время наблюдения за пациентами с высоким риском. Сообщается, что этот метод позволяет проводить раннее обнаружение и обеспечивает экономически эффективный подход (с любой цифровой камерой), но его эффективность была поставлена под сомнение из-за его неспособности обнаруживать макроскопические изменения. [68] Метод диагностики следует использовать в сочетании с дерматоскопической визуализацией (а не в качестве ее замены), при этом сочетание обоих методов, по-видимому, дает чрезвычайно высокие показатели обнаружения.
Меланома — это тип нейроэктодермальной опухоли . [81] Существует четыре основных типа меланомы: [82]
Другие гистопатологические типы:

Меланома in situ не проникла за пределы базальной мембраны , тогда как инвазивная меланома распространилась за ее пределы.
Некоторые гистопатологические типы меланомы по своей природе инвазивны, включая узловую меланому и меланому лентиго малигну , где аналогом меланомы лентиго малигну in situ является лентиго малигну . [85] Лентиго малигну иногда классифицируют как очень раннюю меланому, [86] а иногда как предшественника меланомы. [87]
Поверхностно распространяющиеся меланомы и акральные лентигинозные меланомы могут быть как in situ , так и инвазивными, [88] но акральные лентигинозные меланомы почти всегда инвазивные. [89]
Дополнительную информацию о стадировании рака можно найти на сайте TNM .

Метастатические меланомы можно обнаружить с помощью рентгена, КТ, МРТ, ПЭТ и ПЭТ/КТ, ультразвука, LDH-тестирования и фотоакустического обнаружения. [90] Однако отсутствуют доказательства точности определения стадии меланомы у людей с помощью различных методов визуализации. [91]
Стадии меланомы согласно AJCC , 8-е издание: [92]
Для стадий 1 и 2 требуется класс N (лимфатические узлы):
Для стадий 1, 2 и 3 требуется M (статус метастазов):
Более старые системы включают « уровень Кларка » и « глубину Бреслоу », количественно определяющие микроскопическую глубину инвазии опухоли.

Тесты на лактатдегидрогеназу (ЛДГ) часто используются для скрининга метастазов , хотя у многих пациентов с метастазами (даже на терминальной стадии) ЛДГ имеет нормальный уровень; чрезвычайно высокий уровень ЛДГ часто указывает на метастатическое распространение заболевания в печень.
Пациентам с диагнозом меланома обычно делают рентген грудной клетки и тест ЛДГ, а в некоторых случаях — КТ , МРТ и/или ПЭТ . Хотя это и спорно, пациентам также проводят биопсию сторожевого лимфатического узла и обследование лимфатических узлов для оценки распространения на лимфатические узлы. Диагноз меланомы подтверждается наличием маркера белка S-100 .
HMB-45 — это моноклональное антитело, которое реагирует на антиген, присутствующий в меланоцитарных опухолях, таких как меланомы. Оно используется в анатомической патологии в качестве маркера таких опухолей. Антитело было создано для экстракта меланомы. Оно положительно реагирует на меланоцитарные опухоли, но не на другие опухоли, тем самым демонстрируя специфичность и чувствительность. Антитело также положительно реагирует на клетки соединительного невуса, но не на внутридермальные невусы, и на фетальные меланоциты, но не на нормальные взрослые меланоциты.
HMB-45 не реагирует практически со всеми немеланомными злокачественными новообразованиями человека, за исключением редких опухолей, демонстрирующих признаки меланогенеза (например, пигментированная шваннома, светлоклеточная саркома) или опухолей, связанных с комплексом туберозного склероза (ангиомиолипома и лимфангиомиома).
Нет никаких доказательств, подтверждающих или опровергающих необходимость скрининга взрослого населения на меланому. [93]
Минимизация воздействия источников ультрафиолетового излучения (солнца и соляриев) [94] , соблюдение мер защиты от солнца и ношение солнцезащитной одежды (рубашек с длинными рукавами, длинных брюк и широкополых шляп) могут обеспечить защиту.
Раньше считалось, что использование искусственного света для загара помогает предотвратить рак кожи, но на самом деле это может привести к увеличению заболеваемости меланомой. [95]
Ультрафиолетовые лампы для ногтей, которые используются в маникюрных салонах для сушки лака для ногтей, являются еще одним распространенным источником УФ-излучения, которого можно было бы избежать. [96] [97] Хотя риск развития рака кожи при использовании УФ-ламп для ногтей невелик, все равно рекомендуется надевать перчатки без пальцев и/или наносить на руки солнцезащитный крем с фактором защиты SPF 30 или выше перед использованием УФ-лампы для ногтей. [96] [97]
Тело использует ультрафиолетовый свет для выработки витамина D , поэтому необходимо сбалансировать получение достаточного количества солнечного света для поддержания здорового уровня витамина D и снижения риска меланомы; организму требуется около получаса солнечного света, чтобы выработать витамин D в течение дня, и это примерно то же самое время, которое требуется светлокожим людям, чтобы получить солнечный ожог. Воздействие солнечного света может быть прерывистым, а не все за один раз. [98]
Солнцезащитный крем, по-видимому, эффективен в профилактике меланомы. [2] [10] В прошлом рекомендовалось использовать солнцезащитные кремы с солнцезащитным фактором (SPF) 50 или выше на открытых участках кожи, поскольку старые солнцезащитные кремы более эффективно блокировали UVA с более высоким SPF. [99] В настоящее время новые солнцезащитные ингредиенты ( авобензон , оксид цинка и диоксид титана ) эффективно блокируют как UVA, так и UVB даже при более низких SPF. Солнцезащитный крем также защищает от плоскоклеточного рака , другого вида рака кожи. [100]
Высказывались опасения, что солнцезащитный крем может создать ложное чувство защищенности от вредного воздействия солнца. [101]
Обзор 2005 года обнаружил предварительные доказательства того, что статины и фибраты могут снижать риск меланомы. [102] Однако обзор 2006 года не подтвердил никаких преимуществ. [103]

Подтверждение клинического диагноза осуществляется с помощью биопсии кожи . Обычно за этим следует более широкое иссечение рубца или опухоли. В зависимости от стадии может быть выполнена биопсия сторожевого лимфатического узла . Существуют разногласия относительно доказательств испытаний биопсии сторожевого лимфатического узла; [104] с неясными доказательствами пользы по состоянию на 2015 год. [105] Лечение запущенной меланомы проводится с использованием междисциплинарного подхода.
Эксцизионная биопсия может удалить опухоль, но для снижения риска рецидива часто требуется дополнительная операция. Стандартным является полное хирургическое иссечение с адекватными хирургическими краями и оценкой наличия обнаруживаемого метастатического заболевания вместе с краткосрочным и долгосрочным наблюдением. Часто это делается с помощью широкого локального иссечения (WLE) с краями 1–2 см (0,4–0,8 дюйма). Меланома in situ и злокачественное лентиго лечатся с более узкими хирургическими краями, обычно 0,2–0,5 см (0,1–0,2 дюйма). Многие хирурги считают 0,5 см (0,2 дюйма) стандартом лечения для стандартного иссечения меланомы in situ, [106] но край 0,2 см (0,1 дюйма) может быть приемлемым для контролируемой хирургии края ( операция Мооса или двухлезвийная техника с контролем края). Широкое иссечение направлено на снижение частоты рецидива опухоли на месте исходного поражения. Это распространенная модель неудачного лечения меланомы. Значительные исследования были направлены на выяснение соответствующих границ для иссечения с общей тенденцией к менее агрессивному лечению в течение последних десятилетий. [107] Метаанализ рандомизированных контролируемых испытаний 2009 года обнаружил небольшую разницу в показателях выживаемости в пользу широкого иссечения первичных кожных меланом, но эти результаты не были статистически значимыми. [108]
Сообщается, что при использовании хирургии Мооса частота излечения составляет всего 77% [109] и достигает 98,0% при меланоме in situ. [110] CCPDMA и периферическая краевая контролируемая хирургия «двойным скальпелем» эквивалентны хирургии Мооса по эффективности при этом «внутриэпителиальном» типе меланомы.
Меланомы, которые распространяются, обычно поражают лимфатические узлы в области опухоли, прежде чем распространяться в других местах. Попытки улучшить выживаемость путем хирургического удаления лимфатических узлов ( лимфаденэктомия ) были связаны со многими осложнениями, но не дали общего преимущества в выживании. Недавно была разработана методика биопсии сторожевого лимфатического узла , чтобы уменьшить осложнения хирургии лимфатических узлов, позволяя при этом оценить вовлеченность узлов в опухоль. [111]
Биопсия сторожевых лимфатических узлов является широко используемой процедурой при лечении кожной меланомы. [112] [113]
Ни биопсия сторожевого лимфатического узла, ни другие диагностические тесты не должны проводиться для оценки ранней, тонкой меланомы, включая меланому in situ, меланому T1a или меланому T1b ≤ 0,5 мм. [114] У людей с этими состояниями маловероятно, что рак распространится на их лимфатические узлы или куда-либо еще, и 5-летняя выживаемость составляет 97%. [114] Из-за этих соображений биопсия сторожевого лимфатического узла считается для них ненужной медицинской помощью . [114] Кроме того, базовые анализы крови и рентгенологические исследования не должны проводиться только на основе выявления этого вида меланомы, поскольку существуют более точные тесты для выявления рака, и эти тесты имеют высокий уровень ложноположительных результатов. [114] Для потенциальной коррекции ложноположительных результатов профилирование экспрессии генов может использоваться в качестве вспомогательного тестирования для неоднозначных и небольших поражений. [115] [116]
Часто выполняется биопсия сторожевого лимфатического узла, особенно при опухолях T1b/T2+, опухолях слизистой оболочки, меланоме глаза и опухолях конечностей. [ необходима цитата ] Проводится процесс, называемый лимфосцинтиграфией , при котором радиоактивный индикатор вводится в место опухоли для локализации сторожевого узла(ов). Дальнейшая точность обеспечивается с помощью синего красителя-индикатора , а для биопсии узла(ов) выполняется хирургическое вмешательство. Рутинное окрашивание гематоксилином и эозином (H&E) и иммунопероксидазой будет достаточным для исключения поражения узла. Тесты полимеразной цепной реакции (ПЦР) на узлах, обычно проводимые для проверки на включение в клинические испытания, теперь показывают, что у многих пациентов с отрицательным сторожевым лимфатическим узлом на самом деле было небольшое количество положительных клеток в их узлах. В качестве альтернативы может быть выполнена тонкоигольная аспирационная биопсия, которая часто используется для проверки масс.
Если лимфатический узел положительный, в зависимости от степени распространения лимфатического узла, часто будет проводиться радикальная диссекция лимфатического узла. Если заболевание полностью резецировано, пациент будет рассмотрен для адъювантной терапии. Эксцизионная биопсия кожи является методом выбора. В этом случае подозреваемое поражение полностью удаляется с адекватным (но минимальным, обычно 1 или 2 мм) эллипсом окружающей кожи и ткани. [117] Чтобы избежать нарушения местного лимфатического дренажа, предпочтительный хирургический край для первоначальной биопсии должен быть узким (1 мм). Биопсия должна включать эпидермальный, дермальный и подкожный слои кожи. Это позволяет гистопатологу определить толщину меланомы с помощью микроскопического исследования. Это описывается толщиной Бреслоу (измеряется в миллиметрах). Однако для крупных поражений, таких как подозрение на злокачественное лентиго, или для поражений в хирургически сложных областях (лицо, пальцы ног, руки, веки), небольшая пункционная биопсия в репрезентативных областях даст адекватную информацию и не нарушит окончательное стадирование или определение глубины. Ни при каких обстоятельствах начальная биопсия не должна включать конечный хирургический край (0,5 см, 1,0 см или 2 см), так как неправильный диагноз может привести к чрезмерному рубцеванию и заболеваемости от процедуры. Большое начальное иссечение нарушит местный лимфатический дренаж и может повлиять на дальнейшую лимфангиограмму-направленную диссекцию лимфоузлов. Небольшая пункционная биопсия может использоваться в любое время, когда по логистическим и личным причинам пациент отказывается от более инвазивной эксцизионной биопсии. Небольшие пункционные биопсии являются минимально инвазивными и быстро заживают, обычно без заметных рубцов.
Адъювантное лечение после операции может снизить риск рецидива после операции, особенно при меланомах с высоким риском. Процедуры различаются в разных странах, но сегодня (2024) наиболее распространенным адъювантным лечением является лечение ингибиторами иммунных контрольных точек в течение года после операции. [118]
В начале 2000-х годов относительно распространенной стратегией было лечение пациентов с высоким риском рецидива с помощью высокодозной терапии интерфероном в течение года , что имеет серьезные побочные эффекты, но может немного улучшить прогноз для пациента. [119] Метаанализ 2013 года показал, что добавление интерферона альфа увеличило безрецидивную и общую выживаемость у людей с кожной меланомой II-III стадии TNM по AJCC. [120] Метаанализ 2011 года показал, что интерферон может продлить время до рецидива меланомы, но увеличил выживаемость всего на 3% за 5 лет. Неприятные побочные эффекты также значительно снижают качество жизни. [121] В Европейском союзе интерферон обычно не используется за пределами клинических испытаний. [122] [123]
Химиотерапевтические препараты, такие как дакарбазин, стали основой лечения метастатической меланомы с момента одобрения FDA в 1975 году; однако их эффективность с точки зрения выживаемости никогда не была доказана в рандомизированных контролируемых исследованиях . [124] После одобрения ингибиторов иммунных контрольных точек дакарбазин и его пероральный аналог темозоломид представляют собой потенциальные варианты лечения в более поздних линиях терапии. [125]
Пациентам доступно множество препаратов для уменьшения размера опухоли. Уменьшая размер опухоли, можно облегчить некоторые симптомы; однако это не обязательно приводит к ремиссии. Некоторые из этих препаратов — дакарбазин , темозоломид и фотемустин . Также используются комбинации препаратов, и в некоторых случаях они дают более высокие показатели ремиссии. Эти комбинации лекарств могут иметь вредные побочные эффекты. Для поддержания качества жизни пациентам требуются вспомогательные методы лечения и наблюдение. Хотя комбинации препаратов увеличивают показатели ремиссии, показатель выживаемости не увеличивается. [126]
Было установлено, что у людей с местнораспространенными кожными злокачественными новообразованиями и саркомой изолированная инфузия конечностей (ILI) является минимально инвазивной и хорошо переносимой процедурой для проведения регионарной химиотерапии. [127] [128]
Клетки меланомы имеют мутации, которые позволяют им выживать и расти неограниченно долго в организме. [124] Терапия с использованием малых молекул работает, блокируя гены, участвующие в путях пролиферации и выживания опухоли. [124] Основными методами лечения являются ингибиторы BRAF, C-Kit и NRAS . [129] Эти ингибиторы работают, ингибируя нисходящие пути, участвующие в пролиферации клеток и развитии опухоли из-за определенных мутаций генов. [130] Людей можно лечить с помощью малых молекул, направленных на ингибиторы, если они положительны по конкретной мутации. [124] Ингибиторы BRAF , такие как вемурафениб и дабрафениб , а также ингибитор MEK траметиниб, являются наиболее эффективными, одобренными методами лечения меланомы с положительным геном BRAF. [131] [124] Опухоли меланомы могут развить резистентность во время терапии, что может сделать терапию неэффективной, но совместное использование ингибиторов BRAF и MEK может создать быстрый и продолжительный ответ на терапию меланомы. [132]
Ряд методов лечения улучшают выживаемость по сравнению с традиционной химиотерапией. [124] Биохимиотерапия (химиотерапия с цитокинами IL-2 и IFN-α) в сочетании с ингибиторами BRAF улучшает выживаемость людей с BRAF-положительной меланомой. [124] Биохимиотерапия сама по себе не улучшает общую выживаемость и имеет более высокую токсичность, чем химиотерапия. [124] Сочетание нескольких химиотерапевтических агентов (полихимиотерапия) не улучшает выживаемость по сравнению с монохимиотерапией. [124] Таргетная терапия приводит к относительно короткому времени выживаемости без прогрессирования (PFS). Терапевтическая комбинация дабрафениба и траметиниба имеет 3-летнюю PFS 23% и 5-летнюю PFS 13%. [133]
Lifileucel (Amtagvi) — это аутологичная Т-клеточная иммунотерапия, полученная из опухоли, которая была одобрена для медицинского применения в Соединенных Штатах в феврале 2024 года. [134] [135]
Иммунотерапия направлена на стимуляцию иммунной системы человека против опухоли, путем повышения собственной способности организма распознавать и убивать раковые клетки. [136] Текущий подход к лечению меланомы с помощью иммунотерапии включает три широкие категории методов лечения, включая цитокины , ингибиторы иммунных контрольных точек и адаптивный перенос клеток . [136] Эти варианты лечения чаще всего используются у людей с метастатической меланомой и значительно улучшают общую выживаемость. [124] Однако эти методы лечения часто являются дорогостоящими. Например, один курс лечения ингибитором иммунных контрольных точек, пембролизумабом , стоит от 10 000 до 12 000 долларов США за одну дозу, вводимую каждые 3 недели. [137]
Цитокиновая терапия, используемая для лечения меланомы, включает IFN-a и IL-2 . [138] IL-2 ( пролейкин ) был первой новой терапией, одобренной (1990 ЕС, 1992 США) для лечения метастатической меланомы за 20 лет. [139] IL-2 может обеспечить возможность полной и длительной ремиссии при этом заболевании у небольшого процента людей с меланомой. [140] Внутриочаговый IL-2 для транзитных метастазов имеет высокий уровень полного ответа, варьирующийся от 40 до 100%. [131] Аналогично, IFN-a показал лишь скромные преимущества в плане выживаемости и высокую токсичность, что ограничивает его использование в качестве самостоятельной терапии. [124] [138]
Ингибиторы иммунных контрольных точек включают моноклональные антитела к CTLA-4 ( ипилимумаб и тремелимумаб ), агонисты толл-подобных рецепторов (TLR), агонисты CD40 , антитела к PD-1 ( пембролизумаб , пидилизумаб и ниволумаб ) и PD-L1 . [136] [138] Данные свидетельствуют о том, что антитела к PD-1 более эффективны, чем антитела к CTLA4, с меньшей системной токсичностью. [124] Пятилетняя выживаемость без прогрессирования при иммунотерапии пембролизумабом составляет 21%. [133] Терапевтический подход, включающий комбинацию различных методов лечения, улучшает общую выживаемость и выживаемость без прогрессирования по сравнению с лечением отдельными иммунотерапевтическими препаратами по отдельности. [124]
Текущие исследования изучают лечение с помощью адоптивного переноса клеток . [141] Адоптивный перенос клеток относится к применению предварительно стимулированных, модифицированных Т-клеток или дендритных клеток и в настоящее время используется для минимизации осложнений от реакции «трансплантат против хозяина» . [138] [142]
Комбинация ниволумаба/релатлимаба (Опдуалаг) была одобрена для медицинского применения в США в марте 2022 года. [143]
Стандартное иссечение все еще выполняется большинством хирургов. К сожалению, частота рецидивов чрезвычайно высока (до 50%). Это связано с плохо определенным видимым хирургическим краем и расположением поражений на лице (что часто вынуждает хирурга использовать узкий хирургический край). Узкий хирургический край, используемый в сочетании с ограничением стандартной техники «bread-loafing» фиксированной тканевой гистологии, приводит к высокому уровню «ложноотрицательных» ошибок и частым рецидивам. Контроль края (периферийных краев) необходим для устранения ложноотрицательных ошибок. Если используется bread loafing , расстояния от срезов должны приближаться к 0,1 мм, чтобы гарантировать, что метод приближается к полному контролю края. Метаанализ литературы в 2014 году не обнаружил рандомизированных контролируемых испытаний хирургических вмешательств для лечения лентиго злокачественного или меланомы in situ, хотя хирургия является наиболее широко используемым методом лечения. [144]
Операция Мооса была проведена с показателем излечения, который, по сообщениям другого автора, составлял всего 77% [109] и 95% [110] . Метод контролируемой периферической границы иссечения «двойным скальпелем» приближается к методу Мооса в плане контроля края, но требует, чтобы патолог был хорошо знаком со сложностью управления вертикальным краем на тонких периферических срезах и методами окрашивания. [145]
Некоторые меланоцитарные невусы и меланома in situ ( лентиго злокачественное ) разрешились с помощью экспериментального лечения, местного крема имиквимод (Алдара), иммуностимулирующего средства. Некоторые дерматохирурги комбинируют два метода: хирургическое иссечение рака и последующее лечение области кремом Алдара после операции в течение трех месяцев. Хотя некоторые исследования предполагали адъювантное использование местного тазаротена, текущих данных недостаточно, чтобы рекомендовать его, и предполагается, что он усиливает местное воспаление, что приводит к снижению приверженности пациентов. [144]
Лучевая терапия часто используется после хирургической резекции для пациентов с локально или регионально распространенной меланомой или для пациентов с неоперабельными отдаленными метастазами. Киловольтные рентгеновские лучи часто используются для этих видов лечения и обладают свойством максимальной дозы облучения, возникающей близко к поверхности кожи. [146] Это может снизить частоту местных рецидивов, но не продлевает выживаемость. [147] Радиоиммунотерапия метастатической меланомы в настоящее время изучается. Лучевая терапия играет роль в паллиативном лечении метастатической меланомы. [148]
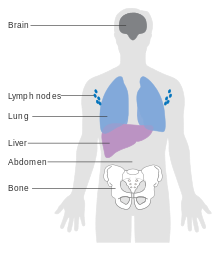

Факторы, влияющие на прогноз, включают:
Некоторые типы меланомы имеют худший прогноз, но это объясняется их толщиной . Менее инвазивные меланомы даже с метастазами в лимфатические узлы имеют лучший прогноз, чем глубокие меланомы без региональных метастазов на момент стадирования. Местные рецидивы, как правило, ведут себя так же, как и первичные, если только они не находятся в месте широкого локального иссечения (в отличие от поэтапного иссечения или иссечения методом punch/shave), поскольку эти рецидивы, как правило, указывают на лимфатическую инвазию.
Когда меланомы распространились на лимфатические узлы , одним из наиболее важных факторов является количество узлов со злокачественностью. Степень злокачественности в узле также важна; микрометастазы , в которых злокачественность только микроскопическая, имеют более благоприятный прогноз, чем макрометастазы. В некоторых случаях микрометастазы можно обнаружить только с помощью специального окрашивания, а если злокачественность можно обнаружить только с помощью редко используемого теста, известного как полимеразная цепная реакция (ПЦР), прогноз лучше. Макрометастазы, в которых злокачественность клинически очевидна (в некоторых случаях рак полностью замещает узел), имеют гораздо худший прогноз, а если узлы спутаны или если есть экстракапсулярное расширение, прогноз еще хуже. В дополнение к этим переменным, уровни экспрессии и вариации числа копий ряда соответствующих генов могут использоваться для поддержки оценки прогноза меланомы. [115] [116]
Меланома IV стадии, при которой она метастазирует, является самой смертельной злокачественной опухолью кожи: пятилетняя выживаемость составляет 22,5%. [133] При наличии отдаленных метастазов рак обычно считается неизлечимым. Пятилетняя выживаемость составляет менее 10%. [150] Медиана выживаемости составляет 6–12 месяцев. Лечение паллиативное , с упором на продление жизни и качество жизни . В некоторых случаях пациенты могут жить много месяцев или даже лет с метастатической меланомой (в зависимости от агрессивности лечения). Метастазы в кожу и легкие имеют лучший прогноз. Метастазы в мозг, кости и печень связаны с худшим прогнозом. Выживаемость лучше при метастазах, при которых местоположение первичной опухоли неизвестно. [151]
Недостаточно точных доказательств для адекватной стадии и, таким образом, прогноза для глазной меланомы и меланомы мягких тканей или меланомы слизистой оболочки (например, ректальной меланомы), хотя они, как правило, метастазируют легче. Несмотря на то, что регрессия может увеличить выживаемость, когда меланома регрессирует, невозможно узнать ее первоначальный размер, и, таким образом, исходная опухоль часто хуже, чем может показать отчет о патологии .
Около 200 генов являются прогностическими в меланоме, как неблагоприятные гены, где высокая экспрессия коррелирует с плохой выживаемостью, так и благоприятные гены, где высокая экспрессия связана с более длительным временем выживания. Примерами неблагоприятных генов являются MCM6 и TIMELESS ; примером благоприятного гена является WIPI1 . [51] [52]
Повышенное соотношение нейтрофилов и лимфоцитов связано с худшими результатами. [152] [153] [154]
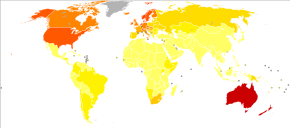
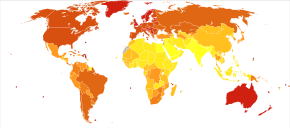
В 2012 году во всем мире меланома была выявлена у 232 000 человек и привела к 55 000 смертей. [2] В Австралии и Новой Зеландии самые высокие показатели заболеваемости меланомой в мире. [2] За последние 20 лет она стала более распространенной в районах, где преобладает европеоидная раса . [2]
За последние годы уровень заболеваемости меланомой увеличился, но неясно, в какой степени это связано с изменениями в поведении, окружающей среде или ранней диагностикой. [156]
В Австралии очень высокий и растущий уровень заболеваемости меланомой. В 2012 году смертность от меланомы составила 7,3–9,8 на 100 000 населения. В Австралии меланома является третьим по распространенности видом рака среди мужчин и женщин; действительно, ее заболеваемость выше, чем у рака легких , хотя последний является причиной большего количества смертей. По оценкам, в 2012 году более 12 000 австралийцев были диагностированы с меланомой: учитывая скромное население Австралии, это лучше выразить как 59,6 новых случаев на 100 000 населения в год; >1 из 10 всех новых случаев рака были меланомами. [157] Заболеваемость меланомой в Австралии имеет важное значение по следующим причинам:
В Соединенных Штатах от меланомы ежегодно умирает около 9000 человек. [159] В 2011 году ею заболели 19,7 человек из 100 000, и 2,7 из 100 000 умерли. [159]
В 2013 году:
Оценки заболеваемости меланомой в США за 2017 год, сделанные Американским онкологическим обществом, таковы:
Меланома встречается более чем в 20 раз чаще у белых, чем у афроамериканцев. В целом, риск заболеть меланомой в течение жизни составляет около 2,5% (1 из 40) для белых, 0,1% (1 из 1000) для афроамериканцев и 0,5% (1 из 200) для мексиканцев.
Риск меланомы увеличивается с возрастом. Средний возраст людей, у которых диагностируют это заболевание, составляет 63 года. [161]
Хотя меланома не является новым заболеванием, свидетельства о ее появлении в древности довольно скудны. Однако одним из примеров является исследование в 1960-х годах девяти перуанских мумий, радиоуглеродный анализ которых показал, что им около 2400 лет, и которые показали явные признаки меланомы: меланотические массы на коже и диффузные метастазы в костях. [162]
Сообщается, что Джон Хантер был первым, кто прооперировал метастатическую меланому в 1787 году. Хотя он не знал точно, что это было, он описал ее как «раковый грибковый нарост». Вырезанная опухоль была сохранена в Хантеровском музее Королевского колледжа хирургов Англии . Только в 1968 году микроскопическое исследование образца показало, что это пример метастатической меланомы. [163]
Французский врач Рене Лаэннек был первым, кто описал меланому как заболевание. Его доклад был первоначально представлен во время лекции на Медицинском факультете Парижа в 1804 году, а затем опубликован в виде бюллетеня в 1806 году. [164]
Первый англоязычный отчет о меланоме был представлен английским врачом общей практики из Стаурбриджа Уильямом Норрисом в 1820 году. [165] В своей более поздней работе в 1857 году он отметил, что существует семейная предрасположенность к развитию меланомы ( Восемь случаев меланоза с патологическими и терапевтическими замечаниями об этой болезни ). Норрис также был пионером, предположившим связь между невусами и меланомой и возможность связи между меланомой и воздействием окружающей среды, заметив, что у большинства его пациентов был бледный цвет лица. [166] Он также описал, что меланомы могут быть беспигментными, и позже показал метастатическую природу меланомы, заметив, что они могут распространяться в другие внутренние органы.
Первое официальное признание запущенной меланомы как неизлечимой было сделано Сэмюэлем Купером в 1840 году. Он заявил, что единственный шанс на излечение зависит от раннего удаления заболевания (т. е. раннего удаления злокачественной родинки)...' [167]
Более полутора столетий спустя эта ситуация остается практически неизменной.
Слово меланома пришло в английский язык из неолатыни 19 века [168] и использует комбинированные формы, полученные из древнегреческих корней: melano- (обозначает меланин ) + -oma (обозначает массу ткани и особенно неоплазму ), в свою очередь, от греческого μέλας melas , «темный», [169] и -ωμα oma , «процесс». Слово меланома имеет долгую историю использования в более широком смысле для обозначения любой меланоцитарной опухоли , как правило, но не всегда злокачественной, [170] [171], но сегодня более узкий смысл, относящийся только к злокачественным типам, стал настолько доминирующим, что доброкачественные опухоли обычно больше не называют меланомами, и слово меланома теперь обычно используется для обозначения злокачественной меланомы, если не указано иное. Такие термины, как «доброкачественная меланоцитарная опухоль », однозначно обозначают доброкачественные типы, а современные гистопатологические классификации опухолей, используемые в медицине, не используют этот термин для обозначения доброкачественных опухолей.
Продолжаются исследования фармакотерапии неоперабельной или метастатической меланомы. [172]
В клинических исследованиях тестируются адаптивная клеточная терапия и генная терапия . [173]
Два вида экспериментального лечения, разработанные в Национальном институте рака (NCI), применялись при метастатической меланоме с предварительным успехом. [42]
Первое лечение включает в себя адаптивную клеточную терапию (ACT) с использованием иммунных клеток TIL (опухолеинфильтрирующих лимфоцитов), выделенных из собственной меланомы человека. [131] Эти клетки выращиваются в больших количествах в лаборатории и возвращаются пациенту после лечения, которое временно снижает нормальные Т-клетки в организме пациента. Терапия TIL после лимфодеплеции может привести к длительному полному ответу в различных установках. [174] [175]
Второе лечение, адаптивный перенос генетически измененных аутологичных лимфоцитов, зависит от доставки генов, кодирующих так называемые рецепторы Т-клеток (TCR), в лимфоциты пациента. [131] После этой манипуляции лимфоциты распознают и связываются с определенными молекулами, обнаруженными на поверхности клеток меланомы, и убивают их. [176]
Вакцина от рака показала скромную эффективность на поздней стадии испытаний в 2009 году против меланомы. [177] [178]
Около 60% меланом содержат мутацию в гене B-Raf . Ранние клинические испытания показали, что ингибиторы B-Raf, включая вемурафениб Plexxicon, могут привести к существенной регрессии опухоли у большинства пациентов, если их опухоль содержит мутацию B-Raf. [179] В июне 2011 года крупное клиническое испытание подтвердило положительные результаты этих более ранних испытаний. [180] [181]
В августе 2011 года Вемурафениб получил одобрение FDA для лечения меланомы поздней стадии. В мае 2013 года FDA США одобрило дабрафениб в качестве единственного агента для лечения пациентов с прогрессирующей меланомой, положительной по мутации BRAF V600E. [182]
Некоторые исследователи полагают, что комбинированная терапия, которая одновременно блокирует несколько путей, может повысить эффективность, затрудняя мутацию опухолевых клеток перед их уничтожением. В октябре 2012 года исследование показало, что сочетание дабрафениба с ингибитором MEK траметинибом привело к еще лучшим результатам. По сравнению с дабрафенибом в отдельности, выживаемость без прогрессирования увеличилась с 9% до 41%, а медианная выживаемость без прогрессирования увеличилась с 5,8 до 9,4 месяцев. Однако некоторые побочные эффекты были увеличены в комбинированном исследовании. [183] [184]
В январе 2014 года FDA одобрило комбинацию дабрафениба и траметиниба для лечения людей с метастатической меланомой с мутацией BRAF V600E/K. [185] В июне 2018 года FDA одобрило комбинацию ингибитора BRAF энкорафениба и ингибитора MEK биниметиниба для лечения неоперабельной или метастатической меланомы с мутацией BRAF V600E или V600K. [186]
Возможная резистентность к ингибиторам BRAF и MEK может быть обусловлена белком клеточной поверхности, известным как EphA2 , который в настоящее время исследуется. [187]
На конференции Американского общества клинической онкологии в июне 2010 года фармацевтическая компания Bristol Myers Squibb сообщила о клинических результатах своего препарата ипилимумаб . Исследование показало увеличение медианной выживаемости с 6,4 до 10 месяцев у пациентов с запущенной меланомой, лечившихся моноклональным ипилимумабом, по сравнению с экспериментальной вакциной. Также был выявлен однолетний уровень выживаемости 25% в контрольной группе, использовавшей вакцину, 44% в группе вакцины и ипилимумаба и 46% в группе, лечившейся только ипилимумабом. [188] Однако некоторые выразили обеспокоенность по поводу этого исследования из-за использования нетрадиционной контрольной группы вместо сравнения препарата с плацебо или стандартным лечением. [189] [190] Критика заключалась в том, что, хотя ипилимумаб показал себя лучше вакцины, вакцина ранее не тестировалась и может вызывать токсичность, из-за чего препарат выглядит лучше в сравнении.
Ипилимумаб был одобрен FDA в марте 2011 года для лечения пациентов с меланомой на поздней стадии, которая распространилась или не может быть удалена хирургическим путем. [191] [192] [193]
В июне 2011 года клиническое исследование ипилимумаба плюс дакарбазин объединило этот усилитель иммунной системы со стандартным химиотерапевтическим препаратом, который нацелен на деление клеток. Оно показало увеличение медианной выживаемости для этих пациентов на поздней стадии до 11 месяцев вместо обычных 9 месяцев. Исследователи также надеялись улучшить пятилетнюю выживаемость, хотя у некоторых пациентов наблюдались серьезные побочные эффекты. Курс лечения стоит 120 000 долларов. Торговая марка препарата — Yervoy. [180] [194]
Достижения в области ультразвукового сканирования с высоким разрешением позволили осуществлять наблюдение за метастатической нагрузкой на сторожевые лимфатические узлы. [195] Испытание «Скрининг и наблюдение за ультразвуком при меланоме» (SUNMEL) оценивает ультразвук как альтернативу инвазивным хирургическим методам. [196]
В некоторых странах изучаются и применяются методы онколитической виротерапии для лечения меланомы. Онколитическая виротерапия является перспективным направлением виротерапии , где онколитические вирусы используются для лечения заболеваний; вирусы могут усиливать метаболизм, снижать противоопухолевый иммунитет и дезорганизовывать сосудистую сеть. [197] Талимоген лахерпарепвек (T-VEC) (который является онколитической иммунотерапией, полученной из вируса простого герпеса типа 1), был показан полезным против метастатической меланомы в 2015 году с увеличением выживаемости на 4,4 месяца. [198] [12]
Антиретровирусные препараты были протестированы in vitro против меланомы. Обоснованием этого является их потенциал ингибировать эндогенные ретровирусы человека, активность которых связана с развитием меланомы. [199] [200] Результаты на злокачественных клетках показали умеренную эффективность, и ожидаются дальнейшие разработки посредством испытаний на животных моделях.
Термин «меланома» в медицине человека обозначает злокачественную опухоль; приставка «злокачественная» излишняя.
Термин «злокачественная меланома» становится устаревшим, поскольку слово «злокачественная» является избыточным, поскольку доброкачественных меланом не существует.
избыточной фразы злокачественная меланома.
{{cite journal}}: CS1 maint: DOI неактивен по состоянию на август 2024 г. ( ссылка )выбрать "меланома"
Сообщалось о частоте излечения до 98% для небольшой меланомы in situ и до 95% для варианта меланозы in situ lentigo maligna при
хирургии Мооса
.