Микробиом человека — это совокупность всей микробиоты , которая находится на тканях и биологических жидкостях человека или внутри них , а также соответствующие анатомические участки, в которых она находится, [1] [2] включая желудочно-кишечный тракт , кожу , молочные железы , семенную жидкость , матку , фолликулы яичников , легкие , слюну , слизистую оболочку полости рта , конъюнктиву и желчные пути . Типы микробиоты человека включают бактерии , археи , грибы , простейшие и вирусы . Хотя микроживотные также могут жить на теле человека, они, как правило, исключаются из этого определения. В контексте геномики термин «микробиом человека» иногда используется для обозначения коллективных геномов резидентных микроорганизмов; [3] однако термин «метагеном человека» имеет то же значение. [1]
В организме человека обитает множество микроорганизмов, причем количество нечеловеческих клеток примерно того же порядка, что и количество человеческих клеток. [4] Некоторые микроорганизмы, которые являются хозяевами человека, являются комменсальными , то есть они сосуществуют, не причиняя вреда людям; другие имеют мутуалистические отношения со своими хозяевами-людьми. [3] : 700 [5] И наоборот, некоторые непатогенные микроорганизмы могут наносить вред хозяевам-людям через производимые ими метаболиты , такие как триметиламин , который организм человека преобразует в N-оксид триметиламина посредством окисления, опосредованного FMO3 . [6] [7] Некоторые микроорганизмы выполняют задачи, которые, как известно, полезны для хозяина-человека, но роль большинства из них не совсем понятна. Те, которые, как ожидается, присутствуют и которые при нормальных обстоятельствах не вызывают заболевания, иногда считаются нормальной флорой или нормальной микробиотой . [3]
В раннем возрасте формирование разнообразной и сбалансированной микробиоты человека играет решающую роль в формировании долгосрочного здоровья человека. [8] Исследования показали, что на состав микробиоты кишечника в младенчестве влияют различные факторы, включая способ родов, грудное вскармливание и воздействие факторов окружающей среды. [9] В грудном молоке присутствует несколько полезных видов бактерий и потенциальных пробиотиков . [10] Исследования выявили полезные эффекты здоровой микробиоты в раннем возрасте, такие как содействие развитию иммунной системы, регуляция обмена веществ и защита от патогенных микроорганизмов. [11] Понимание сложного взаимодействия между микробиотой человека и здоровьем в раннем возрасте имеет решающее значение для разработки вмешательств и стратегий, направленных на поддержку оптимального развития микробиоты и улучшение общих показателей здоровья у людей. [12]
Проект «Микробиом человека» (HMP) взялся за проект по секвенированию генома микробиоты человека, уделяя особое внимание микробиоте, которая обычно обитает на коже, во рту, носу, пищеварительном тракте и влагалище. [3] Он достиг важной вехи в 2012 году, когда были опубликованы его первые результаты. [13]
Хотя широко известно как флора или микрофлора , это неправильное название в технических терминах, поскольку слово корневая флора относится к растениям, а биота относится к общей совокупности организмов в определенной экосистеме. В последнее время применяется более подходящий термин микробиота , хотя его использование не затмило укоренившееся использование и признание флоры в отношении бактерий и других микроорганизмов. Оба термина используются в различной литературе. [5]
Число бактериальных клеток в организме человека оценивается примерно в 38 триллионов, в то время как число человеческих клеток оценивается примерно в 30 триллионов. [14] [15] [16] [17] Число бактериальных генов оценивается в 2 миллиона, что в 100 раз больше числа приблизительно 20 000 человеческих генов . [18] [19] [20]

Проблема выяснения человеческого микробиома по сути заключается в идентификации членов микробного сообщества, которое включает бактерии, эукариоты и вирусы. [21] Это делается в первую очередь с использованием исследований на основе дезоксирибонуклеиновой кислоты (ДНК), хотя также проводятся исследования на основе рибонуклеиновой кислоты (РНК), белков и метаболитов. [21] [22] Исследования микробиома на основе ДНК обычно можно разделить на целевые исследования ампликонов или, в последнее время, метагеномные исследования методом дробовика . Первый фокусируется на определенных известных генах-маркерах и является в первую очередь информативным таксономически, в то время как последний представляет собой полный метагеномный подход, который также может быть использован для изучения функционального потенциала сообщества. [21] Одной из проблем, которая присутствует в исследованиях человеческого микробиома, но не в других метагеномных исследованиях, является необходимость избегать включения ДНК хозяина в исследование. [23]
Помимо простого выяснения состава человеческого микробиома, один из основных вопросов, связанных с человеческим микробиомом, заключается в том, существует ли «ядро», то есть существует ли подмножество сообщества, которое является общим для большинства людей. [24] [25] Если есть ядро, то можно было бы связать определенные составы сообщества с состояниями болезни, что является одной из целей HMP. Известно, что человеческий микробиом (например, микробиота кишечника) сильно варьируется как в пределах одного субъекта, так и среди разных людей, явление, которое также наблюдается у мышей. [5]
13 июня 2012 года директор Национального института здравоохранения (NIH) Фрэнсис Коллинз объявил о важном событии в истории HMP . [13] Объявление сопровождалось серией скоординированных статей, опубликованных в Nature [26] [27] и нескольких журналах в Публичной научной библиотеке (PLoS) в тот же день. Картографируя нормальный микробный состав здоровых людей с использованием методов секвенирования генома, исследователи HMP создали справочную базу данных и границы нормальной микробной изменчивости у людей. У 242 здоровых добровольцев из США было собрано более 5000 образцов из тканей из 15 (мужчины) до 18 (женщины) участков тела, таких как рот, нос, кожа, нижняя часть кишечника (стул) и влагалище. Вся ДНК, человеческая и микробная, была проанализирована с помощью машин для секвенирования ДНК. Данные о микробном геноме были извлечены путем идентификации специфической для бактерий рибосомальной РНК, 16S рРНК . Исследователи подсчитали, что в экосистеме человека обитает более 10 000 видов микроорганизмов, и они идентифицировали 81–99% родов . [ 28]
Статистический анализ необходим для подтверждения полученных результатов ( ANOVA можно использовать для оценки различий между группами); если он сочетается с графическими инструментами, результат легко визуализируется и понимается. [29]
После сборки метагенома можно сделать вывод о функциональном потенциале микробиома. Вычислительные задачи для этого типа анализа сложнее, чем для отдельных геномов, поскольку обычно ассемблеры метагеномов имеют худшее качество, а многие восстановленные гены неполные или фрагментированные. После этапа идентификации генов данные можно использовать для проведения функциональной аннотации посредством множественного выравнивания целевых генов по базам данных ортологов . [30]
Это метод, который использует праймеры для нацеливания на определенный генетический регион и позволяет определять микробные филогении . Генетический регион характеризуется высоковариабельным регионом, который может обеспечить детальную идентификацию; он ограничен консервативными регионами, которые функционируют как сайты связывания для праймеров, используемых в ПЦР . Основным геном, используемым для характеристики бактерий и архей , является ген 16S рРНК , в то время как идентификация грибов основана на внутреннем транскрибируемом спейсере (ITS). Метод быстрый и не очень дорогой и позволяет получить классификацию микробного образца с низким разрешением; он оптимален для образцов, которые могут быть загрязнены ДНК хозяина. Сродство праймера различается среди всех последовательностей ДНК, что может привести к смещению во время реакции амплификации; действительно, образцы с низким содержанием подвержены ошибкам переамплификации, поскольку другие загрязняющие микроорганизмы оказываются перепредставленными в случае увеличения циклов ПЦР. Таким образом, оптимизация выбора праймеров может помочь уменьшить такие ошибки, хотя для этого требуются полные знания о микроорганизмах, присутствующих в образце, и их относительной распространенности. [31]
Анализ маркерного гена может зависеть от выбора праймера; в этом типе анализа желательно использовать хорошо проверенный протокол (например, тот, который используется в проекте Earth Microbiome Project ). Первое, что нужно сделать при анализе ампликона маркерного гена, — это удалить ошибки секвенирования; многие платформы секвенирования очень надежны, но большая часть видимого разнообразия последовательностей по-прежнему обусловлена ошибками в процессе секвенирования. Чтобы уменьшить это явление, первым подходом является кластеризация последовательностей в операционную таксономическую единицу (OTU): этот процесс объединяет похожие последовательности (обычно принимается порог сходства 97%) в один признак, который можно использовать на дальнейших этапах анализа; однако этот метод отбрасывает SNP , поскольку они будут кластеризованы в одну OTU. Другой подход — олиготипирование , которое включает позиционно-специфическую информацию из секвенирования 16s рРНК для обнаружения небольших нуклеотидных вариаций и различения близкородственных отдельных таксонов. Эти методы дают в качестве выходных данных таблицу последовательностей ДНК и количество различных последовательностей на образец, а не OTU. [31]
Другим важным шагом в анализе является присвоение таксономического названия микробным последовательностям в данных. Это можно сделать с помощью подходов машинного обучения , которые могут достигать точности на уровне рода около 80%. Другие популярные пакеты анализа обеспечивают поддержку таксономической классификации с использованием точных совпадений со справочными базами данных и должны обеспечивать большую специфичность, но плохую чувствительность. Неклассифицированные микроорганизмы должны быть дополнительно проверены на наличие последовательностей органелл. [31]
Многие методы, которые используют филогенетический вывод, используют ген 16SRNA для архей и бактерий и ген 18SRNA для эукариот. Филогенетические сравнительные методы (PCS) основаны на сравнении нескольких признаков среди микроорганизмов; принцип заключается в следующем: чем ближе они связаны, тем больше признаков они разделяют. Обычно PCS сочетаются с филогенетическим обобщенным наименьшим квадратом (PGLS) или другим статистическим анализом для получения более значимых результатов. Реконструкция предкового состояния используется в исследованиях микробиома для вменения значений признаков для таксонов, чьи признаки неизвестны. Это обычно выполняется с помощью PICRUSt , который опирается на доступные базы данных. Филогенетические переменные выбираются исследователями в соответствии с типом исследования: путем выбора некоторых переменных со значимой биологической информацией можно уменьшить размерность данных для анализа. [32]
Филогенетическое осознанное расстояние обычно выполняется с помощью UniFrac или подобных инструментов, таких как индекс Соресена или D Рао, для количественной оценки различий между различными сообществами. На все эти методы отрицательно влияет горизонтальная передача генов (ГПГ), поскольку она может генерировать ошибки и приводить к корреляции отдаленных видов. Существуют различные способы уменьшения негативного влияния ГПГ: использование нескольких генов или вычислительных инструментов для оценки вероятности предполагаемых событий ГПГ. [32]
Микробные сообщества развиваются в очень сложной динамике, которую можно рассматривать и анализировать как экосистему. Экологические взаимодействия между микробами управляют ее изменением, равновесием и стабильностью и могут быть представлены в виде популяционной динамической модели. [33] Текущее изучение экологических особенностей микробиома быстро растет и позволяет понять фундаментальные свойства микробиома. Понимание основных правил микробного сообщества может помочь в лечении заболеваний, связанных с нестабильными микробными сообществами. Очень простой вопрос заключается в том, имеют ли разные люди, которые разделяют разные микробные сообщества, одинаковую базовую микробную динамику. [34] Все больше доказательств и указаний показывают, что динамика действительно универсальна. [35] Этот вопрос является основным шагом, который позволит ученым разрабатывать стратегии лечения, основанные на сложной динамике человеческих микробных сообществ. Существуют более важные свойства, соображения по которым следует учитывать при разработке стратегий вмешательства для контроля человеческой микробной динамики. [36] Контроль микробных сообществ может привести к решению очень тяжелых и вредных заболеваний.

Популяции микробов (таких как бактерии и дрожжи ) обитают на коже и слизистых оболочках в различных частях тела. Их роль является частью нормальной, здоровой физиологии человека, однако, если количество микробов превышает их типичные пределы (часто из-за ослабленной иммунной системы) или если микробы заселяют (например, из-за плохой гигиены или травмы) области тела, которые обычно не колонизируются или не являются стерильными (например, кровь, или нижние дыхательные пути, или брюшная полость), может возникнуть заболевание (вызывающее, соответственно, бактериемию/сепсис, пневмонию и перитонит). [37]
Проект «Микробиом человека» обнаружил, что у людей обитают тысячи типов бактерий, причем на разных участках тела существуют свои собственные отличительные сообщества. Кожа и вагинальные участки показали меньшее разнообразие, чем рот и кишечник, которые показали наибольшее богатство. Бактериальный состав определенного участка на теле различается от человека к человеку не только по типу, но и по численности. Бактерии одного и того же вида, обнаруженные во рту, относятся к нескольким подтипам, предпочитая обитать в совершенно разных местах во рту. Даже энтеротипы в кишечнике человека, которые ранее считались хорошо изученными, происходят из широкого спектра сообществ с размытыми границами таксонов. [38] [39]
По оценкам, в кишечнике человека обитает от 500 до 1000 видов бактерий, но они принадлежат всего к нескольким типам: доминируют Bacillota и Bacteroidota , но также есть Pseudomonadota , Verrucomicrobiota , Actinobacteriota , Fusobacteriota и « Cyanobacteria ». [40]
Ряд типов бактерий, таких как Actinomyces viscosus и A. naeslundii , живут во рту, где они являются частью липкого вещества, называемого зубным налетом . Если его не удалить щеткой, он затвердевает в зубной камень (также называемый зубным камнем). Те же бактерии также выделяют кислоты, которые растворяют зубную эмаль , вызывая кариес . [ требуется ссылка ]
Вагинальная микрофлора в основном состоит из различных видов лактобацилл . Долгое время считалось, что наиболее распространенным из этих видов является Lactobacillus acidophilus , но позже было показано, что L. iners на самом деле является наиболее распространенным, за ним следует L. crispatus . Другие лактобациллы, обнаруженные во влагалище, это L. jensenii, L. delbruekii и L. gasseri . Нарушение вагинальной флоры может привести к таким инфекциям, как бактериальный вагиноз и кандидоз. [41]
Археи присутствуют в кишечнике человека, но, в отличие от огромного разнообразия бактерий в этом органе, количество видов архей гораздо более ограничено. [42] Доминирующей группой являются метаногены , в частности Methanobrevibacter smithii и Methanosphaera stadtmanae . [43] Однако колонизация метаногенами изменчива, и только около 50% людей имеют легко обнаруживаемые популяции этих организмов. [44]
По состоянию на 2007 год не было известно ни одного четкого примера архейных патогенов , [45] [46] хотя была предложена связь между присутствием некоторых метаногенов и заболеванием пародонта у человека . [47] Избыточный бактериальный рост тонкого кишечника с доминированием метана (SIBO) также преимущественно вызывается метаногенами, и в частности Methanobrevibacter smithii . [48]
Грибы, в частности дрожжи , присутствуют в кишечнике человека. [49] [50] [51] [52] Наиболее изученными из них являются виды Candida из-за их способности становиться патогенными у людей с ослабленным иммунитетом и даже у здоровых хозяев. [50] [51] [52] Дрожжи также присутствуют на коже, [49] например, виды Malassezia , где они потребляют масла, выделяемые сальными железами . [53] [54]
Вирусы, особенно бактериальные вирусы ( бактериофаги ), колонизируют различные участки тела. Эти колонизируемые участки включают кожу, [55] кишечник, [56] легкие, [57] и ротовую полость. [58] Сообщества вирусов связаны с некоторыми заболеваниями и не просто отражают бактериальные сообщества. [59] [60] [61]
В январе 2024 года биологи сообщили об открытии « обелисков », нового класса вироидоподобных элементов , и «облинов», родственной им группы белков, в микробиоме человека. [62] [63]
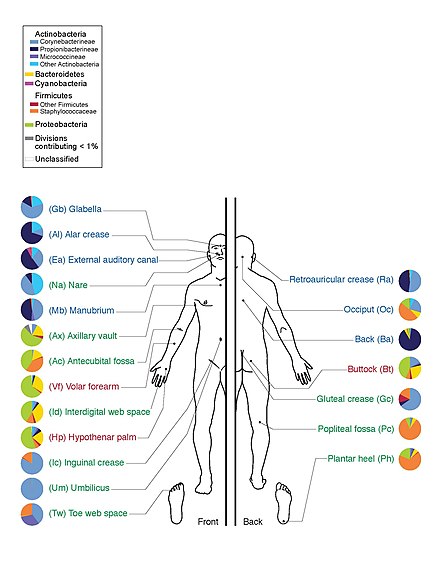
Исследование 20 участков кожи у каждого из десяти здоровых людей выявило 205 идентифицированных родов в 19 бактериальных типах, при этом большинство последовательностей было отнесено к четырем типам: Actinomycetota (51,8%), Bacillota (24,4%), Pseudomonadota (16,5%) и Bacteroidota (6,3%). [64] Большое количество родов грибов присутствует на здоровой коже человека, с некоторой изменчивостью по регионам тела; однако при патологических состояниях определенные роды, как правило, доминируют в пораженном регионе. [49] Например, Malassezia доминирует при атопическом дерматите , а Acremonium доминирует на коже головы, пораженной перхотью. [49]
Кожа действует как барьер, сдерживающий вторжение патогенных микробов. Человеческая кожа содержит микробы, которые находятся либо в коже, либо на ней и могут быть постоянными или транзитными. Типы резидентных микроорганизмов различаются в зависимости от типа кожи на теле человека. Большинство микробов находятся на поверхностных клетках кожи или предпочитают ассоциироваться с железами. Эти железы, такие как сальные или потовые железы, снабжают микробы водой, аминокислотами и жирными кислотами. Кроме того, резидентные бактерии, которые ассоциированы с сальными железами, часто являются грамположительными и могут быть патогенными. [3]
Небольшое количество бактерий и грибков обычно присутствует в конъюнктиве . [49] [65] Классы бактерий включают грамположительные кокки (например, Staphylococcus и Streptococcus ) и грамотрицательные палочки и кокки (например, Haemophilus и Neisseria ). [65] Роды грибов включают Candida , Aspergillus и Penicillium . [49] Слезные железы непрерывно секретируют, поддерживая конъюнктиву влажной, в то время как прерывистое моргание смазывает конъюнктиву и смывает инородный материал. Слезы содержат бактерициды, такие как лизоцим , поэтому микроорганизмам трудно выживать в лизоциме и селиться на эпителиальных поверхностях.
У людей состав желудочно-кишечного микробиома устанавливается во время рождения. [70] Рождение путем кесарева сечения или вагинальных родов также влияет на микробный состав кишечника. Дети, рожденные через вагинальный канал, имеют непатогенную, полезную микробиоту кишечника, похожую на ту, что обнаружена у матери. [71] Однако микробиота кишечника детей, рожденных путем кесарева сечения, содержит больше патогенных бактерий, таких как Escherichia coli и Staphylococcus , и для развития непатогенной, полезной микробиоты кишечника требуется больше времени. [72]
Отношения между некоторыми видами кишечной микробиоты и людьми не просто комменсальные (безвредное сосуществование), а скорее мутуалистические отношения. [3] Некоторые микроорганизмы кишечника человека приносят пользу хозяину, ферментируя пищевые волокна в короткоцепочечные жирные кислоты (SCFA), такие как уксусная кислота и масляная кислота , которые затем усваиваются хозяином. [5] [73] Кишечные бактерии также играют роль в синтезе витамина B и витамина K, а также в метаболизме желчных кислот , стеринов и ксенобиотиков . [3] [73] Системное значение SCFA и других соединений, которые они производят, подобно гормонам , а сама кишечная флора, по-видимому, функционирует как эндокринный орган , [73] а нарушение регуляции кишечной флоры коррелирует с множеством воспалительных и аутоиммунных состояний. [5] [74]
Состав микробиоты кишечника человека меняется со временем, когда меняется рацион питания и общее состояние здоровья. [5] [74] Систематический обзор 15 рандомизированных контролируемых испытаний на людях , проведенный в июле 2016 года, показал, что некоторые коммерчески доступные штаммы пробиотических бактерий из родов Bifidobacterium и Lactobacillus ( B. longum , B. breve , B. infantis , L. helveticus , L. rhamnosus , L. plantarum и L. casei ) при приеме внутрь в суточных дозах 10 9 –10 10 колониеобразующих единиц (КОЕ) в течение 1–2 месяцев обладают эффективностью лечения (т. е. улучшают поведенческие результаты) при определенных расстройствах центральной нервной системы , включая тревожность , депрессию , расстройства аутистического спектра и обсессивно-компульсивное расстройство , а также улучшают определенные аспекты памяти . [75]
Мочеполовая система, по-видимому, имеет микробиоту, [76] [77] что является неожиданным открытием в свете длительного использования стандартных клинических методов микробиологического культивирования для обнаружения бактерий в моче , когда у людей проявляются признаки инфекции мочевыводящих путей ; эти тесты обычно не показывают наличия бактерий. [78] Похоже, что обычные методы культивирования не обнаруживают многие виды бактерий и других микроорганизмов , которые обычно присутствуют. [78] По состоянию на 2017 год методы секвенирования использовались для идентификации этих микроорганизмов, чтобы определить, есть ли различия в микробиоте между людьми с проблемами мочевыводящих путей и здоровыми людьми. [76] [77] [79] Чтобы правильно оценить микробиом мочевого пузыря в отличие от мочеполовой системы, образец мочи следует собирать непосредственно из мочевого пузыря, что часто делается с помощью катетера . [80]
Вагинальная микробиота относится к тем видам и родам, которые колонизируют влагалище. Эти организмы играют важную роль в защите от инфекций и поддержании здоровья влагалища. [81] Наиболее распространенные вагинальные микроорганизмы, обнаруженные у женщин в пременопаузе, принадлежат к роду Lactobacillus , которые подавляют патогены, вырабатывая перекись водорода и молочную кислоту. [51] [81] [82] Состав и соотношение видов бактерий варьируются в зависимости от стадии менструального цикла . [83] [84] [ требуется обновление ] Этническая принадлежность также влияет на вагинальную флору. Встречаемость лактобацилл, вырабатывающих перекись водорода, ниже у афроамериканских женщин, а pH влагалища выше. [85] Другие влиятельные факторы, такие как половой акт и антибиотики, были связаны с потерей лактобацилл. [82] Более того, исследования показали, что половой акт с презервативом, по-видимому, изменяет уровень лактобацилл и увеличивает уровень Escherichia coli во вагинальной флоре. [82] Изменения в нормальной, здоровой микробиоте влагалища являются признаком инфекций, [86] таких как кандидоз или бактериальный вагиноз . [82] Candida albicans подавляет рост видов Lactobacillus , в то время как виды Lactobacillus , которые вырабатывают перекись водорода, подавляют рост и вирулентность Candida albicans как во влагалище, так и в кишечнике. [49] [51] [52]
Грибковые роды, которые были обнаружены во влагалище, включают Candida , Pichia , Eurotium , Alternaria , Rhodotorula и Cladosporium , среди прочих. [49]
До недавнего времени плацента считалась стерильным органом, но были идентифицированы комменсальные, непатогенные виды и роды бактерий, которые находятся в плацентарной ткани. [87] [88] [89] Однако существование микробиома в плаценте является спорным, поскольку подвергается критике в нескольких исследованиях. Так называемый «плацентарный микробиом», вероятно, произошел от загрязнения регентов, поскольку образцы с низкой биомассой легко загрязняются. [90] [91] [92]
До недавнего времени верхние половые пути женщин считались стерильной средой. В матке здоровых, бессимптомных женщин репродуктивного возраста обитает множество микроорганизмов. Микробиом матки существенно отличается от микробиома влагалища и желудочно-кишечного тракта. [93]
Среда, присутствующая во рту человека, позволяет расти характерным микроорганизмам, которые там находятся. Она обеспечивает источник воды и питательных веществ, а также умеренную температуру. [3] Резидентные микробы рта прилипают к зубам и деснам, чтобы противостоять механическому смыву изо рта в желудок, где чувствительные к кислоте микробы уничтожаются соляной кислотой . [3] [51]
Анаэробные бактерии в полости рта включают: Actinomyces , Arachnia , Bacteroides , Bifidobacterium , Eubacterium , Fusobacterium , Lactobacillus , Leptotrichia , Peptococcus , Peptostreptococcus , Propionibacterium , Selenomonas , Treponema и Veillonella . [94] [ требуется обновление ] Роды грибов, которые часто встречаются во рту, включают Candida , Cladosporium , Aspergillus , Fusarium , Glomus , Alternaria , Penicillium и Cryptococcus , среди прочих. [49]
Бактерии накапливаются как на твердых, так и на мягких тканях полости рта в биопленке, что позволяет им прилипать и бороться в среде полости рта, будучи защищенными от факторов окружающей среды и противомикробных агентов. [95] Слюна играет ключевую гомеостатическую роль биопленки, позволяя бактериям повторно колонизировать для формирования и контролировать рост путем отсоединения накоплений биопленки. [96] Она также обеспечивает средства для питательных веществ и регулирования температуры. Расположение биопленки определяет тип получаемых ею открытых питательных веществ. [97]
Бактерии полости рта выработали механизмы, позволяющие им чувствовать окружающую среду и избегать или изменять хозяина. Однако высокоэффективная врожденная система защиты хозяина постоянно отслеживает бактериальную колонизацию и предотвращает бактериальное вторжение в местные ткани. Между бактериями зубного налета и врожденной системой защиты хозяина существует динамическое равновесие. [98]
Эта динамика между полостью рта хозяина и микробами полости рта играет ключевую роль в здоровье и заболевании, поскольку она обеспечивает проникновение в организм. [99] Здоровое равновесие представляет собой симбиотические отношения, в которых микробы полости рта ограничивают рост и прилипание патогенов, в то время как хозяин обеспечивает среду для их процветания. [99] [95] Экологические изменения, такие как изменение иммунного статуса, смещение резидентных микробов и доступности питательных веществ, смещают взаимные отношения к паразитарным, в результате чего хозяин становится склонным к оральным и системным заболеваниям. [95] Системные заболевания, такие как диабет и сердечно-сосудистые заболевания, коррелируют с плохим здоровьем полости рта. [99] Особый интерес представляет роль микроорганизмов полости рта в двух основных стоматологических заболеваниях: кариесе зубов и заболеваниях пародонта . [98] Колонизация патогенов в пародонте вызывает чрезмерный иммунный ответ, что приводит к образованию пародонтального кармана — углубленного пространства между зубом и десной. [95] Это действует как защищенный богатый кровью резервуар с питательными веществами для анаэробных патогенов. [95] Системные заболевания в различных частях тела могут быть результатом попадания микробов полости рта в кровь, минуя пародонтальные карманы и слизистую оболочку полости рта. [99]
Постоянная правильная гигиена полости рта является основным методом профилактики заболеваний полости рта и системных заболеваний. [99] Она снижает плотность биопленки и чрезмерный рост потенциально патогенных бактерий, приводящих к заболеванию. [97] Однако правильной гигиены полости рта может быть недостаточно, поскольку микробиом полости рта, генетика и изменения иммунного ответа играют роль в развитии хронических инфекций. [97] Использование антибиотиков может лечить уже распространяющуюся инфекцию, но неэффективно против бактерий внутри биопленок. [97]
Здоровый носовой микробиом доминирует над Corynebacterium и Staphylococcus. Слизистый микробиом играет важную роль в регуляции вирусной инфекции. [100]
Подобно полости рта, верхняя и нижняя дыхательная система обладают механическими сдерживающими факторами для удаления микробов. Бокаловидные клетки вырабатывают слизь, которая улавливает микробы и выводит их из дыхательной системы с помощью непрерывно движущихся мерцательных эпителиальных клеток. [3] Кроме того, бактерицидный эффект оказывает носовая слизь, содержащая фермент лизоцим. [3] Верхние и нижние дыхательные пути, по-видимому, имеют свой собственный набор микробиоты. [101] Легочная бактериальная микробиота принадлежит к 9 основным родам бактерий: Prevotella , Sphingomonas , Pseudomonas , Acinetobacter , Fusobacterium , Megasphaera , Veillonella , Staphylococcus и Streptococcus . Некоторые из бактерий, считающихся «нормальной биотой» в дыхательных путях, могут вызывать серьезные заболевания, особенно у людей с ослабленным иммунитетом; К ним относятся Streptococcus pyogenes , Haemophilus influenzae , Streptococcus pneumoniae , Neisseria meningitidis и Staphylococcus aureus . [ требуется ссылка ] Роды грибов, которые составляют легочный микобиом, включают Candida , Malassezia , Neosartorya , Saccharomyces и Aspergillus , среди прочих. [49]
У людей с муковисцидозом наблюдается необычное распределение бактериальных и грибковых родов в дыхательных путях . [49] [102] Их бактериальная флора часто содержит устойчивые к антибиотикам и медленно растущие бактерии, а частота этих патогенов меняется в зависимости от возраста. [102]
Традиционно желчные пути считались обычно стерильными, а наличие микроорганизмов в желчи является маркером патологического процесса. Это предположение было подтверждено неудачей в выделении бактериальных штаммов из нормального желчного протока. Статьи начали появляться в 2013 году, показывая, что нормальная желчная микробиота представляет собой отдельный функциональный слой, который защищает желчные пути от колонизации экзогенными микроорганизмами. [103]
Человеческие тела полагаются на бесчисленные бактериальные гены как на источник необходимых питательных веществ. [104] Как метагеномные, так и эпидемиологические исследования указывают на жизненно важную роль микробиома человека в профилактике широкого спектра заболеваний, от диабета 2 типа и ожирения до воспалительных заболеваний кишечника, болезни Паркинсона и даже психических расстройств, таких как депрессия. [105] Симбиотическая связь между микробиотой кишечника и различными бактериями может влиять на иммунный ответ человека. [106] Метаболиты, вырабатываемые микробами кишечника, по-видимому, являются причинными факторами диабета 2 типа. [107] Хотя в зачаточном состоянии лечение на основе микробиома также показывает многообещающие результаты, особенно в лечении лекарственно-устойчивого C. difficile Архивировано 7 декабря 2019 г. в Wayback Machine infection [108] и в лечении диабета. [109]
Подавляющее присутствие бактерий C. difficile приводит к инфекции желудочно-кишечного тракта, обычно связанной с дисбактериозом с микробиотой, которая, как полагают, была вызвана приемом антибиотиков. Использование антибиотиков уничтожает полезную кишечную флору в желудочно-кишечном тракте, что обычно не позволяет патогенным бактериям установить доминирование. [110] Традиционное лечение инфекций C. difficile включает дополнительный режим антибиотиков, однако показатели эффективности в среднем составляют от 20 до 30%. [111] Осознавая важность здоровых кишечных бактерий, исследователи обратились к процедуре, известной как трансплантация фекальной микробиоты (FMT), при которой пациенты, страдающие желудочно-кишечными заболеваниями, такими как инфекция C. difficile (CDI), получают фекальное содержимое от здорового человека в надежде восстановить нормально функционирующую кишечную микробиоту. [112] Трансплантация фекальной микробиоты эффективна примерно на 85–90% у людей с CDI, которым антибиотики не помогли или у которых болезнь рецидивирует после приема антибиотиков. [113] [114] Большинство людей с CDI выздоравливают после одного сеанса FMT. [115] [110] [116]
Хотя рак, как правило, является заболеванием генетики хозяина и факторов окружающей среды, микроорганизмы участвуют в около 20% случаев рака у человека. [117] В частности, что касается потенциальных факторов рака толстой кишки , плотность бактерий в миллион раз выше, чем в тонкой кишке , и примерно в 12 раз больше случаев рака возникает в толстой кишке по сравнению с тонкой кишкой, что, возможно, устанавливает патогенную роль микробиоты при раке толстой и прямой кишки . [118] Микробную плотность можно использовать в качестве прогностического инструмента при оценке колоректального рака. [118]
Микробиота может влиять на канцерогенез тремя основными способами: (i) изменяя баланс пролиферации и гибели опухолевых клеток, (ii) регулируя функцию иммунной системы и (iii) влияя на метаболизм факторов, продуцируемых хозяином, продуктов питания и фармацевтических препаратов. [117] Опухоли, возникающие на пограничных поверхностях, таких как кожа, ротоглотка и дыхательные, пищеварительные и мочеполовые тракты, содержат микробиоту. Существенное присутствие микробов в месте опухоли не устанавливает ассоциации или причинно-следственных связей. Вместо этого микробы могут считать напряжение кислорода в опухоли или профиль питательных веществ поддерживающими. Уменьшение популяции определенных микробов или вызванный окислительный стресс также могут увеличивать риски. [117] [118] Из примерно 10 30 микробов на Земле десять обозначены Международным агентством по изучению рака как канцерогены для человека. [117] Микробы могут секретировать белки или другие факторы, напрямую стимулирующие пролиферацию клеток у хозяина, или могут повышать или понижать иммунную систему хозяина, в том числе вызывая острое или хроническое воспаление способами, которые способствуют канцерогенезу. [117]
Что касается взаимосвязи иммунной функции и развития воспаления, барьеры слизистой оболочки подвержены экологическим рискам и должны быстро восстанавливаться для поддержания гомеостаза . Нарушенная устойчивость хозяина или микробиоты также снижает устойчивость к злокачественным новообразованиям, возможно, вызывая воспаление и рак. После нарушения барьеров микробы могут вызывать провоспалительные или иммуносупрессивные программы различными путями. [117] Например, микробы, ассоциированные с раком, по-видимому, активируют сигнализацию NF-κΒ в микроокружении опухоли. Другие рецепторы распознавания образов, такие как члены семейства нуклеотидсвязывающих доменов олигомеризации (NLR) NOD-2 , NLRP3 , NLRP6 и NLRP12 , могут играть роль в опосредовании колоректального рака. [117] Аналогично, Helicobacter pylori , по-видимому, увеличивает риск рака желудка из-за того, что он вызывает хроническую воспалительную реакцию в желудке. [117] [118]
Воспалительное заболевание кишечника состоит из двух различных заболеваний: язвенного колита и болезни Крона, и оба эти заболевания сопровождаются нарушениями в микробиоте кишечника (также известными как дисбактериоз ). Этот дисбактериоз проявляется в форме снижения микробного разнообразия в кишечнике, [119] [120] и коррелирует с дефектами в генах хозяина, которые изменяют врожденный иммунный ответ у людей. [119]
Прогрессирование заболевания ВИЧ влияет на состав и функцию микробиоты кишечника, при этом наблюдаются заметные различия между ВИЧ-отрицательными, ВИЧ-положительными и ВИЧ-положительными популяциями после АРТ . [ необходима ссылка ] ВИЧ снижает целостность барьерной функции эпителия кишечника, влияя на плотные контакты . Это разрушение позволяет транслокации через эпителий кишечника, что, как полагают, способствует увеличению воспаления, наблюдаемого у людей с ВИЧ. [121]
Вагинальная микробиота играет роль в инфекционности ВИЧ, с повышенным риском заражения и передачи, когда у женщины бактериальный вагиноз , состояние, характеризующееся ненормальным балансом вагинальных бактерий. [122] Повышенная инфекционность наблюдается при увеличении провоспалительных цитокинов и клеток CCR5 + CD4+ во влагалище. Однако снижение инфекционности наблюдается при повышении уровня вагинальных Lactobacillus, что способствует противовоспалительному состоянию. [121]
Люди в возрасте 100 лет и старше, называемые долгожителями , имеют особый микробиом кишечника. Этот микробиом характерно обогащен микроорганизмами , которые способны синтезировать новые вторичные желчные кислоты . [123] Эти вторичные желчные кислоты включают различные изоформы литохолевой кислоты , которые могут способствовать здоровому старению. [123]
Со смертью микробиом живого тела разрушается, и другой состав микроорганизмов, называемый некробиомом, утверждает себя как важный активный компонент сложного процесса физического разложения. Его предсказуемые изменения с течением времени считаются полезными для определения времени смерти. [124] [125]
Исследования 2009 года поставили под сомнение, может ли сокращение биоты (включая микрофауну ) в результате вмешательства человека повлиять на здоровье человека, процедуры безопасности в больницах, дизайн продуктов питания и лечение заболеваний. [126]

Гигиена , [128] пробиотики , [127] пребиотики , [129] синбиотики , [130] светотерапия , [131] трансплантация микробиоты ( фекальной [132] или кожной [133] ), антибиотики , [134] физические упражнения , [135] [136] диета , [137] грудное вскармливание , [138] старение [139] могут изменить микробиом человека в различных анатомических системах или областях, таких как кожа и кишечник.
Микробиом человека передается от матери к ребенку , а также между людьми, живущими в одном доме . [140] [141]
Первичные исследования показывают, что немедленные изменения в микробиоте могут происходить, когда человек мигрирует из одной страны в другую, например, когда тайские иммигранты поселились в Соединенных Штатах [142] или когда латиноамериканцы иммигрировали в Соединенные Штаты. [143] Потери разнообразия микробиоты были больше у людей с ожирением и детей иммигрантов . [142] [143]
Исследование 2024 года показывает, что в микробиоме человека можно обнаружить кишечную микробиоту , способную переваривать целлюлозу , и она менее многочисленна у людей, живущих в индустриальных обществах . [144] [145]
Микробиом
Этот термин относится ко всей среде обитания, включая микроорганизмы (бактерии, археи, низшие и высшие эукариоты и вирусы), их геномы (т. е. гены) и окружающие условия окружающей среды. Это определение основано на определении "биома", биотических и абиотических факторов данной среды. Другие в этой области ограничивают определение микробиома набором генов и геномов членов микробиоты. Утверждается, что это определение метагенома
,
который в сочетании с окружающей средой составляет микробиом.
мы рассматриваем литературу по триметиламину (ТМА), метаболиту, вырабатываемому микробиотой и связанному с развитием атеросклероза.
L-карнитин) из обычного рациона, из которого, по-видимому, возникают два заболевания: триметиламинурия (или синдром запаха рыбы) и сердечно-сосудистое заболевание из-за проатерогенного свойства его окисленной формы, получаемой из печени.
Candida
и другие микроорганизмы участвуют в этой сложной грибковой инфекции, но
Candida albicans
продолжает оставаться наиболее распространенным. За последние два десятилетия наблюдался аномальный чрезмерный рост в желудочно-кишечном, мочевыводящем и дыхательном тракте не только у пациентов с ослабленным иммунитетом, но также связанный с внутрибольничными инфекциями и даже у здоровых людей. Существует множество причинных факторов, способствующих возникновению дрожжевой инфекции, поэтому кандидоз является хорошим примером многофакторного синдрома.
Кроме того, грибковая инфекция ЖКТ регистрируется даже среди пациентов с нормальным иммунным статусом. Грибковые инфекции, связанные с пищеварительной системой, могут быть вызваны как комменсальными условно-патогенными грибами, так и экзогенными патогенными грибами. ...
Candida
sp. также является наиболее часто идентифицируемым видом среди пациентов с желудочной ИФИ. ... Когда-то считалось, что желудочная кислота может убивать микробы, попадающие в желудок, и что уникальная экологическая среда желудка не подходит для микробной колонизации или инфицирования. Однако несколько исследований с использованием методов, не зависящих от культуры, подтвердили, что в желудке существует большое количество кислотоустойчивых бактерий, относящихся к восьми типам и до 120 видам, таких как
Streptococcus
sp.,
Neisseria
sp. и
Lactobacillus
sp. и т. д.
26, 27
Кроме того,
Candida albicans
может хорошо расти в очень кислой среде,
28
а некоторые генотипы могут усиливать тяжесть поражений слизистой оболочки желудка.
29
Избыточный рост грибков в тонком кишечнике (SIFO) характеризуется наличием чрезмерного количества грибковых организмов в тонком кишечнике, что связано с желудочно-кишечными (ЖК) симптомами. Известно, что кандидоз вызывает желудочно-кишечные симптомы, особенно у пациентов с ослабленным иммунитетом или у тех, кто получает стероиды или антибиотики. Однако только недавно появилась литература о том, что избыточный рост грибков в тонком кишечнике у лиц без ослабленного иммунитета может вызывать необъяснимые желудочно-кишечные симптомы. Два недавних исследования показали, что 26 % (24/94) и 25,3 % (38/150) из серии пациентов с необъяснимыми симптомами ЖКТ имели SIFO. Наиболее распространенными симптомами, наблюдаемыми у этих пациентов, были отрыжка, вздутие живота, расстройство желудка, тошнота, диарея и газы. ... Взаимодействие грибков и бактерий может действовать по-разному и может быть либо синергетическим, либо антагонистическим, либо симбиотическим [29]. Некоторые бактерии, такие как виды
Lactobacillus,
могут взаимодействовать и подавлять как вирулентность, так и рост видов
Candida
в кишечнике, вырабатывая перекись водорода [30]. Любое повреждение слизистого барьера или нарушение микробиоты ЖКТ при химиотерапии или использовании антибиотиков, воспалительных процессах, активации иммунных молекул и нарушении восстановления эпителия могут вызвать избыточный рост грибков [27].
Lactobacillus
spp. преобразуют триптофан в индол-3-альдегид (I3A) с помощью неидентифицированных ферментов [125].
Clostridium sporogenes
преобразуют триптофан в IPA [6], вероятно, с помощью триптофандезаминазы. ... IPA также эффективно удаляет гидроксильные радикалы
Было показано, что производство ИПА полностью зависит от присутствия микрофлоры кишечника и может быть установлено путем колонизации бактерией
Clostridium sporogenes
.
[Индол-3-пропионовая кислота (ИПК)] ранее была обнаружена в плазме и спинномозговой жидкости людей, но ее функции неизвестны. ... В экспериментах по кинетической конкуренции с использованием агентов, улавливающих свободные радикалы, способность IPA удалять гидроксильные радикалы превысила способность мелатонина, индоламина, который считается самым мощным естественным поглотителем свободных радикалов. В отличие от других антиоксидантов, IPA не был преобразован в реактивные промежуточные продукты с прооксидантной активностью.
Эти пробиотики показали эффективность в улучшении поведения, связанного с психиатрическими расстройствами, включая тревожность, депрессию, расстройство аутистического спектра (РАС), обсессивно-компульсивное расстройство и способности к запоминанию, включая пространственную и непространственную память. Поскольку многие из фундаментальных научных исследований показали некоторую эффективность пробиотиков в отношении функции центральной нервной системы, этот фон может направлять и способствовать дальнейшим доклиническим и клиническим исследованиям. ... Согласно качественному анализу текущих исследований, мы можем предварительно сделать вывод, что B. longum, B. breve, B. infantis, L. helveticus, L. rhamnosus, L. plantarum и L. casei были наиболее эффективны в улучшении функции ЦНС, включая функции, связанные с психиатрическими заболеваниями (тревожность, депрессия, настроение, реакция на стресс) и способности к запоминанию.
{{cite web}}: CS1 maint: numeric names: authors list (link)