Аксон (от греч. ἄξων áxōn , ось) или нервное волокно (или нервное волокно : см. различия в написании ) — это длинный, тонкий отросток нервной клетки или нейрона у позвоночных , который обычно проводит электрические импульсы, известные как потенциалы действия, от тела нервной клетки . Функция аксона заключается в передаче информации различным нейронам, мышцам и железам. В некоторых сенсорных нейронах ( псевдоуниполярных нейронах ), таких как нейроны прикосновения и тепла, аксоны называются афферентными нервными волокнами , и электрический импульс проходит по ним от периферии к телу клетки и от тела клетки к спинному мозгу по другой ветви того же аксона. Дисфункция аксона может быть причиной многих наследственных и приобретенных неврологических расстройств , которые поражают как периферические , так и центральные нейроны . Нервные волокна классифицируются на три типа — нервные волокна группы A , нервные волокна группы B и нервные волокна группы C. Группы A и B миелинизированы , а группа C — немиелинизированы. Эти группы включают как сенсорные, так и моторные волокна. Другая классификация группирует только сенсорные волокна как Тип I, Тип II, Тип III и Тип IV.
Аксон — один из двух типов цитоплазматических выростов из тела клетки нейрона; другой тип — дендрит . Аксоны отличаются от дендритов несколькими особенностями, включая форму (дендриты часто сужаются, в то время как аксоны обычно сохраняют постоянный радиус), длину (дендриты ограничены небольшой областью вокруг тела клетки, в то время как аксоны могут быть намного длиннее) и функцию (дендриты получают сигналы, тогда как аксоны передают их). Некоторые типы нейронов не имеют аксона и передают сигналы от своих дендритов. У некоторых видов аксоны могут исходить из дендритов, известных как дендриты, несущие аксон. [1] Ни один нейрон никогда не имеет более одного аксона; однако у беспозвоночных, таких как насекомые или пиявки, аксон иногда состоит из нескольких областей, которые функционируют более или менее независимо друг от друга. [2]
Аксоны покрыты мембраной, известной как аксолемма ; цитоплазма аксона называется аксоплазмой . Большинство аксонов ветвятся, в некоторых случаях очень обильно. Конечные ветви аксона называются телодендриями . Раздутый конец телодендрона известен как терминаль аксона или конечная ножка, которая присоединяется к дендриту или телу клетки другого нейрона, образуя синаптическую связь. Аксоны обычно контактируют с другими нейронами в соединениях, называемых синапсами , но также могут контактировать с мышечными или железистыми клетками. В некоторых обстоятельствах аксон одного нейрона может образовывать синапс с дендритами того же нейрона, что приводит к аутапсису . В синапсе мембрана аксона тесно прилегает к мембране клетки-мишени, и специальные молекулярные структуры служат для передачи электрических или электрохимических сигналов через щель. Некоторые синаптические соединения появляются по всей длине аксона по мере его расширения; Они называются en passant boutons («проходящие бутоны») и могут быть сотнями или даже тысячами вдоль одного аксона. [3] Другие синапсы появляются как терминалы на концах аксональных ветвей.
Один аксон, со всеми его ветвями, взятыми вместе, может быть нацелен на несколько частей мозга и генерировать тысячи синаптических окончаний. Пучок аксонов образует нервный тракт в центральной нервной системе , [4] и пучок в периферической нервной системе . У плацентарных млекопитающих крупнейшим трактом белого вещества в мозге является мозолистое тело , образованное примерно из 200 миллионов аксонов в человеческом мозге . [4]

Аксоны являются основными линиями передачи нервной системы , и как пучки они образуют нервы . Некоторые аксоны могут простираться до одного метра и более, в то время как другие простираются всего на один миллиметр. Самые длинные аксоны в организме человека — это аксоны седалищного нерва , которые проходят от основания спинного мозга до большого пальца каждой ноги. Диаметр аксонов также варьируется. Большинство отдельных аксонов имеют микроскопический диаметр (обычно около одного микрометра (мкм) в поперечнике). Самые большие аксоны млекопитающих могут достигать диаметра до 20 мкм. Гигантский аксон кальмара , который специализирован на очень быстром проведении сигналов, имеет диаметр около 1 миллиметра, что соответствует размеру небольшого карандашного грифеля. Количество аксональных телодендриев (разветвляющихся структур на конце аксона) также может различаться от одного нервного волокна к другому. Аксоны в центральной нервной системе (ЦНС) обычно показывают множественные телодендрии с множеством синаптичных конечных точек. Для сравнения, аксон мозжечковых гранулярных клеток характеризуется одним Т-образным узлом разветвления, от которого отходят два параллельных волокна . Сложное разветвление позволяет одновременно передавать сообщения большому количеству целевых нейронов в пределах одной области мозга.
В нервной системе существует два типа аксонов: миелинизированные и немиелинизированные . [5] Миелин — это слой жирового изолирующего вещества, который образован двумя типами глиальных клеток : шванновскими клетками и олигодендроцитами . В периферической нервной системе шванновские клетки образуют миелиновую оболочку миелинизированного аксона. Олигодендроциты образуют изолирующий миелин в ЦНС. Вдоль миелинизированных нервных волокон на равном расстоянии друг от друга располагаются промежутки в миелиновой оболочке, известные как перехваты Ранвье . Миелинизация обеспечивает особенно быстрый режим распространения электрических импульсов, называемый скачкообразной проводимостью .
Миелинизированные аксоны от корковых нейронов образуют основную часть нервной ткани, называемой белым веществом в мозге. Миелин придает ткани белый вид в отличие от серого вещества коры головного мозга, которое содержит тела нейронных клеток. Аналогичное расположение наблюдается в мозжечке . Пучки миелинизированных аксонов составляют нервные тракты в ЦНС. Там, где эти тракты пересекают среднюю линию мозга, чтобы соединить противоположные области, они называются комиссурами . Самым большим из них является мозолистое тело , которое соединяет два полушария головного мозга , и оно имеет около 20 миллионов аксонов. [4]
Структура нейрона, как полагают, состоит из двух отдельных функциональных областей, или отсеков: тело клетки вместе с дендритами составляет одну область, а аксональная область — другую.
Аксональная область или компартмент включает аксонный холмик, начальный сегмент, остальную часть аксона, телодендрии аксона и терминали аксона. Она также включает миелиновую оболочку. Тельца Ниссля , которые производят нейрональные белки, отсутствуют в аксональной области. [3] Белки, необходимые для роста аксона и удаления отходов, нуждаются в каркасе для транспорта. Этот аксональный транспорт обеспечивается в аксоплазме расположением микротрубочек и промежуточных нитей типа IV, известных как нейрофиламенты .

Аксонный холмик — это область, образованная из тела клетки нейрона, когда оно расширяется, чтобы стать аксоном. Он предшествует начальному сегменту. Полученные потенциалы действия , которые суммируются в нейроне, передаются в аксонный холмик для генерации потенциала действия из начального сегмента.
Начальный сегмент аксона ( AIS) представляет собой структурно и функционально отдельный микродомен аксона. [6] [7] Одна из функций начального сегмента заключается в отделении основной части аксона от остальной части нейрона; другая функция заключается в помощи в инициировании потенциалов действия. [8] Обе эти функции поддерживают полярность нейронных клеток , при которой дендриты (и, в некоторых случаях, сома ) нейрона получают входные сигналы в базальной области, а в апикальной области аксон нейрона обеспечивает выходные сигналы. [9]
Начальный сегмент аксона не миелинизирован и содержит специализированный комплекс белков. Он имеет длину приблизительно от 20 до 60 мкм и функционирует как место инициации потенциала действия. [10] [11] Как положение на аксоне, так и длина AIS могут меняться, демонстрируя степень пластичности, которая может точно настраивать нейронный выход. [10] [12] Более длинный AIS связан с большей возбудимостью. [12] Пластичность также наблюдается в способности AIS изменять свое распределение и поддерживать активность нейронной цепи на постоянном уровне. [13]
AIS высоко специализирован для быстрой передачи нервных импульсов . Это достигается за счет высокой концентрации потенциалзависимых натриевых каналов в начальном сегменте, где инициируется потенциал действия. [13] Ионные каналы сопровождаются большим количеством молекул клеточной адгезии и каркасных белков , которые прикрепляют их к цитоскелету. [10] Взаимодействия с анкирином-G важны, поскольку он является основным организатором в AIS. [10]
Аксоплазма является эквивалентом цитоплазмы в клетке. Микротрубочки образуются в аксоплазме на аксонном холмике. Они расположены вдоль длины аксона, в перекрывающихся секциях, и все направлены в одном направлении – к терминалям аксона. [14] Это отмечено положительными окончаниями микротрубочек. Это перекрывающееся расположение обеспечивает пути для транспортировки различных материалов из тела клетки. [14] Исследования аксоплазмы показали движение многочисленных везикул всех размеров, которые можно увидеть вдоль цитоскелетных нитей – микротрубочек и нейрофиламентов , в обоих направлениях между аксоном и его терминалями и телом клетки.
Исходящий антероградный транспорт из тела клетки вдоль аксона переносит митохондрии и мембранные белки, необходимые для роста, в окончание аксона. Входящий ретроградный транспорт переносит отходы клеток из окончания аксона в тело клетки. [15] Исходящие и входящие пути используют разные наборы моторных белков . [14] Исходящий транспорт обеспечивается кинезином , а входящий обратный трафик обеспечивается динеином . Динеин направлен на минус-конец. [15] Существует много форм моторных белков кинезина и динеина, и считается, что каждый из них переносит разный груз. [14] Исследования транспорта в аксоне привели к названию кинезина. [14]
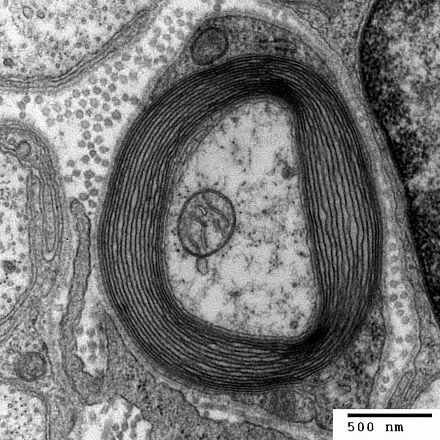

В нервной системе аксоны могут быть миелинизированными или немиелинизированными. Это обеспечивает изолирующий слой, называемый миелиновой оболочкой. Миелиновая мембрана уникальна своим относительно высоким соотношением липидов к белкам. [16]
В периферической нервной системе аксоны миелинизируются глиальными клетками, известными как клетки Шванна . В центральной нервной системе миелиновая оболочка обеспечивается другим типом глиальных клеток, олигодендроцитами . Клетки Шванна миелинизируют один аксон. Олигодендроцит может миелинизировать до 50 аксонов. [17]
Состав миелина различается в двух типах. В ЦНС основным белком миелина является протеолипидный белок , а в ПНС — основной белок миелина .
Перехваты Ранвье (также известные как промежутки миелиновой оболочки ) представляют собой короткие немиелинизированные сегменты миелинового аксона , которые периодически встречаются между сегментами миелиновой оболочки. Поэтому в точке перехвата Ранвье диаметр аксона уменьшается. [18] Эти узлы являются областями, где могут генерироваться потенциалы действия. При скачкообразной проводимости электрические токи, производимые в каждом узле Ранвье, проводятся с небольшим затуханием к следующему узлу в линии, где они остаются достаточно сильными, чтобы генерировать другой потенциал действия. Таким образом, в миелинизированном аксоне потенциалы действия эффективно «прыгают» от узла к узлу, обходя миелинизированные участки между ними, в результате чего скорость распространения намного выше, чем может выдержать даже самый быстрый немиелинизированный аксон.
Аксон может разделяться на множество ветвей, называемых телодендриями (греч. 'конец дерева'). На конце каждого телодендрона находится терминал аксона (также называемый терминальным бутоном или синаптическим бутоном, или конечным основанием). [19] Терминалы аксона содержат синаптические пузырьки , которые хранят нейротрансмиттер для высвобождения в синапсе . Это делает возможными множественные синаптические связи с другими нейронами. Иногда аксон нейрона может синапсировать на дендриты того же нейрона, когда это известно как аутапса . Некоторые синаптические соединения появляются вдоль длины аксона по мере его расширения; они называются en passant boutons («проходящие бутонами») и могут быть сотнями или даже тысячами вдоль одного аксона. [3]
В нормально развитом мозге вдоль ствола некоторых аксонов расположены пресинаптические бутоны, также известные как аксональные варикозы , и они были обнаружены в областях гиппокампа , которые функционируют при высвобождении нейротрансмиттеров. [20] Однако аксональные варикозы также присутствуют при нейродегенеративных заболеваниях, где они мешают проведению потенциала действия. Аксональные варикозы также являются отличительной чертой травматических повреждений мозга . [20] [21] Аксональное повреждение обычно касается цитоскелета аксона, нарушающего транспорт. В результате этого накопления белков, таких как белок-предшественник бета-амилоида, могут накапливаться в отеке, что приводит к ряду варикозов вдоль аксона. [20] [21]


Большинство аксонов переносят сигналы в форме потенциалов действия, которые представляют собой дискретные электрохимические импульсы, которые быстро перемещаются по аксону, начиная с тела клетки и заканчивая в точках, где аксон устанавливает синаптический контакт с целевыми клетками. Определяющей характеристикой потенциала действия является то, что он является «все или ничего» — каждый потенциал действия, который генерирует аксон, имеет по существу одинаковый размер и форму. Эта характеристика «все или ничего» позволяет потенциалам действия передаваться с одного конца длинного аксона на другой без какого-либо уменьшения размера. Однако существуют некоторые типы нейронов с короткими аксонами, которые переносят градуированные электрохимические сигналы переменной амплитуды.
Когда потенциал действия достигает пресинаптического окончания, он активирует процесс синаптической передачи. Первым шагом является быстрое открытие каналов ионов кальция в мембране аксона, что позволяет ионам кальция течь внутрь через мембрану. Результирующее увеличение внутриклеточной концентрации кальция заставляет синаптические пузырьки (крошечные контейнеры, заключенные в липидную мембрану), заполненные химическим веществом нейротрансмиттера, сливаться с мембраной аксона и опорожнять свое содержимое во внеклеточное пространство. Нейротрансмиттер высвобождается из пресинаптического нерва посредством экзоцитоза . Затем химический нейротрансмиттер диффундирует к рецепторам, расположенным на мембране целевой клетки. Нейротрансмиттер связывается с этими рецепторами и активирует их. В зависимости от типа активированных рецепторов воздействие на целевую клетку может заключаться в возбуждении целевой клетки, ее ингибировании или изменении ее метаболизма каким-либо образом. Вся эта последовательность событий часто происходит менее чем за тысячную долю секунды. После этого внутри пресинаптического терминала новый набор везикул перемещается в положение рядом с мембраной, готовый к высвобождению при поступлении следующего потенциала действия. Потенциал действия является последним электрическим шагом в интеграции синаптических сообщений в масштабе нейрона. [5]
Внеклеточные записи распространения потенциала действия в аксонах были продемонстрированы у свободно движущихся животных. В то время как внеклеточные соматические потенциалы действия использовались для изучения клеточной активности у свободно движущихся животных, таких как клетки места , также может быть зарегистрирована аксональная активность как в белом, так и в сером веществе . Внеклеточные записи распространения потенциала действия аксонов отличаются от соматических потенциалов действия тремя способами: 1. Сигнал имеет более короткую длительность пика-впадины (~150 мкс), чем у пирамидальных клеток (~500 мкс) или интернейронов (~250 мкс). 2. Изменение напряжения является трехфазным. 3. Активность, зарегистрированная на тетроде, видна только на одном из четырех записывающих проводов. В записях от свободно движущихся крыс аксональные сигналы были изолированы в трактах белого вещества, включая альвеус и мозолистое тело, а также серое вещество гиппокампа. [22]
Фактически, генерация потенциалов действия in vivo является последовательной по своей природе, и эти последовательные спайки представляют собой цифровые коды в нейронах. Хотя предыдущие исследования указывают на аксональное происхождение одиночного спайка, вызванного кратковременными импульсами, физиологические сигналы in vivo запускают инициацию последовательных спайков в телах клеток нейронов. [23] [24]
В дополнение к распространению потенциалов действия к аксональным терминалам, аксон способен усиливать потенциалы действия, что обеспечивает безопасное распространение последовательных потенциалов действия к аксональному терминалу. С точки зрения молекулярных механизмов, потенциалзависимые натриевые каналы в аксонах обладают более низким порогом и более коротким рефрактерным периодом в ответ на кратковременные импульсы. [25]
Развитие аксона до его цели является одним из шести основных этапов в общем развитии нервной системы . [26] Исследования, проведенные на культивируемых нейронах гиппокампа, показывают, что нейроны изначально производят несколько нейритов , которые эквивалентны, но только один из этих нейритов предназначен стать аксоном. [27] Неясно, предшествует ли спецификация аксона удлинению аксона или наоборот, [28] хотя недавние данные указывают на последнее. Если перерезать аксон, который не полностью развит, полярность может измениться, и другие нейриты потенциально могут стать аксоном. Это изменение полярности происходит только тогда, когда аксон перерезан по крайней мере на 10 мкм короче других нейритов. После того, как сделан надрез, самый длинный нейрит станет будущим аксоном, а все остальные нейриты, включая исходный аксон, превратятся в дендриты. [29] Приложение внешней силы к нейриту, заставляющее его удлиняться, превратит его в аксон. [30] Тем не менее, развитие аксона достигается посредством сложного взаимодействия между внеклеточной сигнализацией, внутриклеточной сигнализацией и динамикой цитоскелета .
Внеклеточные сигналы, которые распространяются через внеклеточный матрикс, окружающий нейроны, играют важную роль в развитии аксонов. [31] Эти сигнальные молекулы включают белки, нейротрофические факторы , а также внеклеточный матрикс и молекулы адгезии. Нетрин (также известный как UNC-6), секретируемый белок, участвует в формировании аксонов. Когда рецептор нетрина UNC-5 мутирует, несколько нейритов нерегулярно проецируются из нейронов, и в конечном итоге один аксон удлиняется вперед. [32] [33] [34] [35] Нейротрофические факторы - фактор роста нервов (NGF), нейротрофический фактор мозга (BDNF) и нейротрофин-3 (NTF3) также участвуют в развитии аксонов и связываются с рецепторами Trk . [36]
Ганглиозид - превращающий фермент плазматической мембраны ганглиозидсиалидаза ( PMGS), который участвует в активации TrkA на кончике нейтритов, необходим для удлинения аксонов. PMGS асимметрично распределяется на кончике нейрита, которому суждено стать будущим аксоном. [37]
Во время развития аксона активность PI3K увеличивается на кончике аксона. Нарушение активности PI3K подавляет развитие аксона. Активация PI3K приводит к образованию фосфатидилинозитол (3,4,5)-трифосфата (PtdIns), который может вызвать значительное удлинение нейрита, превращая его в аксон. Таким образом, сверхэкспрессия фосфатаз, которые дефосфорилируют PtdIns, приводит к нарушению поляризации. [31]
Нейрит с самым низким содержанием актиновых филаментов станет аксоном. Концентрация PGMS и содержание f-актина обратно коррелируют; когда PGMS обогащается на кончике нейрита, его содержание f-актина существенно уменьшается. [37] Кроме того, воздействие актин-деполимеризующих препаратов и токсина B (который инактивирует Rho-сигнализацию ) вызывает образование множественных аксонов. Следовательно, прерывание актиновой сети в конусе роста будет способствовать тому, что его нейрит станет аксоном. [38]

Растущие аксоны перемещаются через окружающую среду через конус роста , который находится на кончике аксона. Конус роста имеет широкое листообразное расширение, называемое ламеллиподием, которое содержит выступы, называемые филоподиями . Филоподии являются механизмом, с помощью которого весь процесс прилипает к поверхностям и исследует окружающую среду. Актин играет важную роль в подвижности этой системы. Среды с высоким уровнем молекул клеточной адгезии (CAM) создают идеальную среду для роста аксонов. Это, по-видимому, обеспечивает «липкую» поверхность для роста аксонов. Примерами CAM, специфичных для нейронных систем, являются N-CAM , TAG-1 — аксональный гликопротеин [39] — и MAG , все из которых являются частью суперсемейства иммуноглобулинов . Другой набор молекул, называемых внеклеточным матриксом — молекулами адгезии, также обеспечивает липкий субстрат для роста аксонов. Примерами этих молекул являются ламинин , фибронектин , тенасцин и перлекан . Некоторые из них поверхностно связаны с клетками и, таким образом, действуют как аттрактанты или репелленты ближнего действия. Другие являются диффундирующими лигандами и, таким образом, могут иметь эффекты дальнего действия.
Клетки, называемые направляющими клетками, помогают в управлении ростом нейронных аксонов. Эти клетки, которые помогают в управлении аксонами , обычно являются другими нейронами, которые иногда незрелые. Когда аксон завершает свой рост в месте соединения с целью, диаметр аксона может увеличиться до пяти раз, в зависимости от требуемой скорости проводимости . [40]
Также в ходе исследований было обнаружено, что если аксоны нейрона были повреждены, то при условии, что сома (тело клетки нейрона) не повреждена, аксоны регенерируют и воссоздают синаптические связи с нейронами с помощью направляющих клеток . Это также называется нейрорегенерацией . [41]
Nogo-A — это тип компонента, ингибирующего рост нейритов, который присутствует в миелиновых мембранах центральной нервной системы (обнаруживается в аксоне). Он играет решающую роль в ограничении регенерации аксонов в центральной нервной системе взрослых млекопитающих. В недавних исследованиях, если Nogo-A блокируется и нейтрализуется, можно вызвать регенерацию аксонов на большом расстоянии, что приводит к улучшению функционального восстановления у крыс и спинного мозга мышей. Это еще предстоит сделать на людях. [42] Недавнее исследование также показало, что макрофаги, активированные через определенный воспалительный путь, активируемый рецептором Dectin-1, способны способствовать восстановлению аксонов, также вызывая нейротоксичность в нейроне. [43]
Длина аксонов значительно варьируется от нескольких микрометров до метров у некоторых животных. Это подчеркивает, что должен существовать клеточный механизм регуляции длины, позволяющий нейронам как ощущать длину своих аксонов, так и контролировать их рост соответствующим образом. Было обнаружено, что моторные белки играют важную роль в регуляции длины аксонов. [44] На основе этого наблюдения исследователи разработали явную модель роста аксонов, описывающую, как моторные белки могут влиять на длину аксонов на молекулярном уровне. [45] [46] [47] [48] Эти исследования предполагают, что моторные белки переносят сигнальные молекулы из сомы в конус роста и наоборот, концентрация которых колеблется во времени с частотой, зависящей от длины.
Аксоны нейронов в периферической нервной системе человека можно классифицировать на основе их физических характеристик и свойств проводимости сигнала. Известно, что аксоны имеют различную толщину (от 0,1 до 20 мкм) [3] , и считалось, что эти различия связаны со скоростью, с которой потенциал действия может перемещаться по аксону — скоростью его проводимости . Эрлангер и Гассер доказали эту гипотезу и выделили несколько типов нервных волокон, установив связь между диаметром аксона и скоростью его проводимости по нерву. Они опубликовали свои выводы в 1941 году, дав первую классификацию аксонов.
Аксоны классифицируются по двум системам. Первая, введенная Эрлангером и Гассером, группировала волокна в три основные группы, используя буквы A, B и C. Эти группы, группа A , группа B и группа C, включают как сенсорные волокна ( афференты ), так и двигательные волокна ( эфференты ). Первая группа A подразделялась на альфа-, бета-, гамма- и дельта-волокна — Aα, Aβ, Aγ и Aδ. Двигательные нейроны различных двигательных волокон были нижними двигательными нейронами — альфа-мотонейрон , бета-мотонейрон и гамма-мотонейрон , имеющими нервные волокна Aα, Aβ и Aγ соответственно.
Более поздние открытия других исследователей выявили две группы волокон Аа, которые были сенсорными волокнами. Затем они были введены в систему (классификация Ллойда), которая включала только сенсорные волокна (хотя некоторые из них были смешанными нервами и также были двигательными волокнами). Эта система называет сенсорные группы типами и использует римские цифры: тип Ia, тип Ib, тип II, тип III и тип IV.
Нижние двигательные нейроны имеют два типа волокон:
Различные сенсорные рецепторы иннервируются различными типами нервных волокон. Проприорецепторы иннервируются сенсорными волокнами типов Ia, Ib и II, механорецепторы — сенсорными волокнами типов II и III, а ноцицепторы и терморецепторы — сенсорными волокнами типов III и IV.
Вегетативная нервная система имеет два вида периферических волокон:
В порядке степени тяжести повреждение нерва в периферической нервной системе можно описать как неврапраксию , аксонотмезис или невротмезис . Сотрясение мозга считается легкой формой диффузного аксонального повреждения . [52] Аксональное повреждение также может вызвать центральный хроматолиз . Дисфункция аксонов в нервной системе является одной из основных причин многих наследственных и приобретенных неврологических расстройств , которые поражают как периферические, так и центральные нейроны. [5]
Когда аксон раздавливается, активный процесс аксональной дегенерации происходит в части аксона, наиболее удаленной от тела клетки. Эта дегенерация происходит быстро после травмы, при этом часть аксона запечатывается мембранами и разрушается макрофагами. Это известно как валлеровская дегенерация . [53] Отмирание аксона также может иметь место при многих нейродегенеративных заболеваниях , особенно когда аксональный транспорт нарушен, это известно как валлеровская дегенерация. [54] Исследования показывают, что дегенерация происходит в результате того, что аксональный белок NMNAT2 не может достичь всего аксона. [55]
Демиелинизация аксонов вызывает множество неврологических симптомов, обнаруживаемых при заболевании рассеянным склерозом .
Дисмиелинизация — это аномальное образование миелиновой оболочки. Это связано с несколькими лейкодистрофиями , а также с шизофренией . [56] [57] [58]
Тяжелая травматическая травма головного мозга может привести к обширным поражениям нервных путей, повреждая аксоны в состоянии, известном как диффузная аксональная травма . Это может привести к стойкому вегетативному состоянию . [59] Исследования на крысах показали , что аксональное повреждение от одной легкой травматической травмы головного мозга может оставить восприимчивость к дальнейшему повреждению после повторных легких травматических травм головного мозга. [60]
Нервный направляющий канал — это искусственное средство управления ростом аксонов для обеспечения нейрорегенерации и один из многих методов лечения, используемых при различных видах повреждений нервов .
Некоторые общие словари определяют «нервное волокно» как любой нейронный процесс , включая как аксоны, так и дендриты . [61] [62] Однако медицинские источники обычно используют термин «нервное волокно» для обозначения только аксона. [63] [64]
Немецкому анатому Отто Фридриху Карлу Дайтерсу обычно приписывают открытие аксона, поскольку он отделил его от дендритов. [5] Швейцарец Рудольф Альберт фон Кёлликер и немец Роберт Ремак были первыми, кто идентифицировал и охарактеризовал начальный сегмент аксона. Кёлликер дал аксону название в 1896 году. [65] Луи-Антуан Ранвье был первым, кто описал промежутки или узлы, обнаруженные на аксонах, и за этот вклад эти аксональные особенности теперь обычно называют узлами Ранвье . Сантьяго Рамон-и-Кахаль , испанский анатом, предположил, что аксоны являются выходными компонентами нейронов, описывая их функциональность. [5] Джозеф Эрлангер и Герберт Гассер ранее разработали систему классификации периферических нервных волокон, [66] основанную на скорости аксональной проводимости, миелинизации , размере волокна и т. д. Алан Ходжкин и Эндрю Хаксли также использовали гигантский аксон кальмара (1939), и к 1952 году они получили полное количественное описание ионной основы потенциала действия, что привело к формулировке модели Ходжкина-Хаксли . Ходжкин и Хаксли были совместно удостоены Нобелевской премии за эту работу в 1963 году. Формулы, описывающие аксональную проводимость, были распространены на позвоночных в уравнениях Франкенхойзера-Хаксли. Понимание биохимической основы распространения потенциала действия продвинулось дальше и включает в себя множество деталей об отдельных ионных каналах .
Аксоны беспозвоночных были тщательно изучены. Длинноплавниковый прибрежный кальмар , часто используемый в качестве модельного организма, имеет самый длинный известный аксон. [67] Гигантский кальмар имеет самый большой известный аксон. Его размер колеблется от 0,5 (обычно) до 1 мм в диаметре и используется для управления его реактивной двигательной системой. Самая высокая зарегистрированная скорость проводимости 210 м/с обнаружена в покрытых оболочкой аксонах некоторых пелагических креветок Penaeid [68] , а обычный диапазон составляет от 90 до 200 метров/с [69] ( ср. 100–120 м/с для самого быстрого миелинизированного аксона позвоночных.)
В других случаях, как видно из исследований на крысах, аксон берет начало из дендрита; такие аксоны, как говорят, имеют «дендритное происхождение». Некоторые аксоны с дендритным происхождением также имеют «проксимальный» начальный сегмент, который начинается непосредственно в аксонном начале, в то время как другие имеют «дистальный» начальный сегмент, заметно отделенный от аксонного начала. [70] У многих видов некоторые нейроны имеют аксоны, которые исходят из дендрита, а не из тела клетки, и они известны как дендриты, несущие аксон. [1] Во многих случаях аксон берет начало в аксонном холмике на соме; такие аксоны, как говорят, имеют «соматическое происхождение». Некоторые аксоны с соматическим происхождением имеют «проксимальный» начальный сегмент, прилегающий к аксонному холмику, в то время как другие имеют «дистальный» начальный сегмент, отделенный от сомы расширенным аксонным холмиком. [70]
дал «аксону» его название.