Окисление спирта — это набор реакций окисления в органической химии , которые превращают спирты в альдегиды , кетоны , карбоновые кислоты и эфиры . Реакция в основном применяется к первичным и вторичным спиртам. Вторичные спирты образуют кетоны, тогда как первичные спирты образуют альдегиды или карбоновые кислоты. [1]
Можно использовать различные окислители.

Почти во всех промышленных процессах окисления в качестве окислителя используется кислород или воздух. [2]
Удаление эквивалента гидрида посредством различных механизмов преобразует первичный или вторичный спирт в альдегид или кетон соответственно. Окисление первичных спиртов в карбоновые кислоты обычно происходит через соответствующий альдегид, который преобразуется через альдегидгидрат ( гем - диол, R-CH(OH) 2 ) в результате реакции с водой. Таким образом, окисление первичного спирта на уровне альдегида без дальнейшего окисления до карбоновой кислоты возможно при проведении реакции в отсутствие воды, так что альдегидгидрат не может быть образован.

Крупнейшие операции включают метанол и этанол в формальдегид и ацетальдегид , которые производятся в масштабах миллионов тонн ежегодно. Другие крупномасштабные альдегиды и кетоны производятся путем автоокисления углеводородов: бензальдегид из толуола , акролеин из пропилена , ацетон из кумола , циклогексанон из циклогексанола . [2]
В учебных лабораториях и на малых предприятиях было разработано много реагентов для окисления вторичных спиртов в кетоны и первичных спиртов в альдегиды. Аллиловые и бензиловые спирты особенно склонны к окислению. Альдегиды подвержены переокислению в карбоновые кислоты.

Для этих окислений обычно используются реагенты хрома(VI). Одно семейство реагентов Cr(VI) использует комплекс CrO 3 (пиридин) 2 . [3]
Второе семейство реагентов Cr(VI) — это соли , содержащие катион пиридиния (C 5 H 5 NH + ).
Эти соли менее реакционноспособны, более просты в обращении и более селективны, чем реагент Коллинза при окислении спиртов.
Вышеуказанные реагенты представляют собой усовершенствования старого реагента Джонса — раствора триоксида хрома в водной серной кислоте .
Периодинан Десса -Мартина является мягким окислителем для превращения спиртов в альдегиды или кетоны. [5] Реакция проводится в стандартных условиях, при комнатной температуре, чаще всего в дихлорметане . Реакция занимает от получаса до двух часов. Затем продукт отделяется от отработанного периодинана. [6] Было разработано много окислителей на основе иодозила, например IBX .
В процессе окисления по методу Сверна используются оксалилхлорид , диметилсульфоксид и органическое основание, например, триэтиламин .
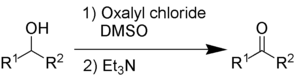
Побочными продуктами являются диметилсульфид (Me2S ) , оксид углерода (CO), диоксид углерода (CO2 ) и – при использовании триэтиламина в качестве основания – хлорид триэтиламмония (C6H15NHCl ) .
Этот редко используемый метод позволяет преобразовывать спирты и карбонилы друг в друга.
В процессе окисления Лея в качестве стехиометрического окислителя используется NMO , а в качестве катализатора — перрутенат тетрапропиламмония .
Окисление Фетизона , также редко используемый метод, использует карбонат серебра, нанесенный на целит. Этот реагент работает посредством одноэлектронного окисления катионами серебра.
Другой метод — окисление, катализируемое оксоаммонием .
Кроме того, сообщалось , что гипохлорит натрия (или бытовой отбеливатель) в ацетоне эффективно преобразует вторичные спирты в присутствии первичных спиртов (окисление Стивенса). [7]
Растворимые комплексы переходных металлов катализируют окисление спиртов в присутствии дикислорода или другого конечного окислителя. [8]

Крупнейшее окисление 1,2-диолов дает глиоксаль из этиленгликоля. Для преобразования используется воздух или иногда азотная кислота . [2]
В лабораторных условиях вицинальные диолы подвергаются окислительному разрыву связи углерод-углерод с некоторыми окислителями, такими как периодат натрия (NaIO 4 ), (диацетоксииод)бензол (PhI(OAc) 2 ) [9] или тетраацетат свинца (Pb(OAc) 4 ), что приводит к образованию двух карбонильных групп. Реакция также известна как расщепление гликоля .

Окисление первичных спиртов в карбоновые кислоты может быть осуществлено с использованием различных реагентов, но в коммерческих масштабах в качестве окислителей доминируют O 2 /воздух и азотная кислота. Крупномасштабные окисления этого типа используются для превращения циклогексанола отдельно или в смеси с циклогексаноном в адипиновую кислоту . Аналогично циклододеканол преобразуется в 12-углеродную дикарбоновую кислоту. 3,5,5-Триметилциклогексанол аналогично окисляется до триметиладипиновой кислоты. [2]
Разработано множество специальных реагентов для лабораторного окисления спиртов в карбоновые кислоты.
Перманганат калия (KMnO 4 ) очень эффективно окисляет первичные спирты до карбоновых кислот. Эта реакция, впервые подробно описанная Фурнье [10] [11], обычно проводится путем добавления KMnO 4 к раствору или суспензии спирта в щелочном водном растворе. Для эффективного протекания реакции спирт должен быть хотя бы частично растворен в водном растворе. Этому может способствовать добавление органического сорастворителя, такого как диоксан , пиридин , ацетон или t -BuOH . KMnO 4 реагирует со многими функциональными группами , такими как вторичные спирты, 1,2-диолы, альдегиды, алкены, оксимы, сульфиды и тиолы, а также двойные связи углерод-углерод. Таким образом, селективность является проблемой.

Так называемый реагент Джонса , приготовленный из триоксида хрома (CrO 3 ) и водной серной кислоты , окисляет спирты до карбоновой кислоты. Протокол часто дает значительные количества эфиров . [13] Проблемы заключаются в токсичности и небезопасности реагента для окружающей среды. Описан каталитический вариант, включающий обработку избытком иодной кислоты (H 5 IO 6 ). [14]

Поскольку многие из вышеупомянутых условий для окисления первичных спиртов в кислоты являются жесткими и несовместимыми с обычными защитными группами, органические химики часто используют двухэтапную процедуру для окисления в кислоты. Спирт окисляется до альдегида с использованием одной из многочисленных процедур, описанных выше. Эта последовательность часто используется в синтезе природных продуктов, как в их синтезе платенцина. [16]
Тетроксид рутения — агрессивный, редко используемый реагент, допускающий мягкие условия реакции.
Окисление Хейнса. [17]
Использование хлоритов в качестве конечных окислителей в сочетании с гипохлоритами и ТЕМПО дает карбоновые кислоты без побочных продуктов хлорирования. [18] Реакция обычно проводится в два этапа в одном и том же котле: частичное окисление осуществляется с ТЕМПО и гипохлоритом, затем добавляется хлорит для завершения окисления. Наблюдается только окисление первичного спирта. В сочетании с дигидроксилированием Шарплесса этот метод может быть использован для получения энантиомерно чистых α-гидроксикислот. [19]
В методе окисления Пинника используется хлорит натрия . [20]