
Дистилляция , также классическая дистилляция , представляет собой процесс разделения компонентов жидкой смеси двух или более химически дискретных веществ; процесс разделения осуществляется путем избирательного кипения смеси и конденсации паров в перегонном кубе .
Сухая перегонка ( термолиз и пиролиз ) — это нагревание твердых материалов для получения газов, которые конденсируются либо в жидкие продукты, либо в твердые продукты. Термин «сухая перегонка» включает в себя процессы разделения деструктивной перегонки и химического крекинга , разбивающие большие молекулы углеводородов на более мелкие молекулы углеводородов. Более того, частичная перегонка приводит к частичному разделению компонентов смеси, что дает почти чистые компоненты; частичная перегонка также реализует частичное разделение смеси для увеличения концентрации выбранных компонентов. В любом из методов процесс разделения перегонки использует различия в относительной летучести компонентов веществ нагретой смеси.
В промышленных применениях классической дистилляции термин « дистилляция» используется как единица операции , которая определяет и обозначает процесс физического разделения, а не химическую реакцию ; таким образом, промышленная установка, которая производит дистиллированные напитки , является дистилляцией спирта . Вот некоторые применения процесса химического разделения, который называется дистилляцией:
Ранние свидетельства дистилляции были найдены на аккадских табличках, датированных ок. 1200 г. до н. э., описывающих парфюмерные операции. Таблички предоставили текстовые доказательства того, что ранняя, примитивная форма дистилляции была известна вавилонянам древней Месопотамии . [ 5]
По словам британского химика Т. Фэрли, ни у греков, ни у римлян не было термина для современной концепции дистилляции. Такие слова, как «дистилляция», могли бы относиться к чему-то другому, в большинстве случаев к части какого-то процесса, не связанного с тем, что сейчас известно как дистилляция. По словам Фэрли и немецкого инженера-химика Норберта Кокмана соответственно:
Латинское «distillo», от de-stillo, от stilla, капля, относилось к каплепадению жидкости человеческими или искусственными средствами и применялось к любому процессу, в котором жидкость разделялась на капли. Перегонять в современном смысле можно было только окольным путем. [6]
В древности и средневековье дистилляция имела более широкое значение, поскольку под термином « дистилляция» понимались почти все операции по очистке и разделению , такие как фильтрация, кристаллизация, экстракция, сублимация или механическое прессование масла. [7]
По словам голландского историка химии Роберта Дж. Форбса , слово distillare (капать), когда его использовали римляне, например, Сенека и Плиний Старший , «никогда не использовалось в нашем смысле». [8]
Аристотель знал, что вода, конденсирующаяся при испарении морской воды, является пресной: [9]
Я доказал экспериментально, что соленая вода, испаряясь, образует пресную, и пар, конденсируясь, не конденсируется снова в морскую воду.
Испарение морской воды и ее конденсация в пресную воду не может называться «дистилляцией», поскольку дистилляция подразумевает кипение, но эксперимент мог стать важным шагом на пути к дистилляции. [10]

Ранние свидетельства дистилляции были обнаружены в связи с работой алхимиков в Александрии в Римском Египте в I веке н. э. [14] : 57, 89
Дистиллированная вода использовалась по крайней мере с 200 г. н. э. , когда Александр Афродисийский описал этот процесс. [15] [16] Работа по дистилляции других жидкостей продолжалась в раннем византийском Египте под руководством Зосимы из Панополиса в III веке.
Дистилляция практиковалась на древнем индийском субконтиненте , что очевидно из реторт и приемников из обожженной глины, найденных в Таксиле , Шайхан Дхери и Чарсадде в Пакистане и Ранг Махале в Индии , датируемых первыми веками нашей эры . [17] [18] [19] Фрэнк Рэймонд Оллчин говорит, что эти терракотовые дистилляционные трубки были «сделаны для имитации бамбука». [20] Эти « перегонные кубы Гандхары » были способны производить только очень слабый напиток , поскольку не было эффективных средств сбора паров при низком нагреве. [21]
Дистилляция в Китае, возможно, началась самое раннее во времена династии Восточная Хань (I–II вв. н. э.) [22] .
Средневековые мусульманские химики , такие как Джабир ибн Хайян (лат. Geber, девятый век) и Абу Бакр ар-Рази (лат. Rhazes, ок. 865–925 ), много экспериментировали с перегонкой различных веществ. Фракционная перегонка органических веществ играет важную роль в работах, приписываемых Джабиру, таких как Kitāb al-Sabʿīn («Книга семидесяти»), переведенная на латынь Герардом Кремонским ( ок. 1114–1187 ) под названием Liber de septuaginta . [23] Джабирские эксперименты с фракционной перегонкой животных и растительных веществ, а также в меньшей степени минеральных веществ, являются главной темой De anima in arte alkimiae , изначально арабского труда, ошибочно приписываемого Авицене , который был переведен на латынь и впоследствии стал важнейшим алхимическим источником для Роджера Бэкона ( ок. 1220–1292 ). [24]
Перегонка вина засвидетельствована в арабских трудах, приписываемых аль-Кинди ( ок. 801–873 гг. н. э. ) и аль-Фараби ( ок. 872–950 гг .), а также в 28-й книге Kitāb al-Taṣrīf аз-Захрави (лат. Abulcasis, 936–1013 гг.) (позже переведенной на латынь как Liber servatoris ). [25] В двенадцатом веке рецепты производства aqua ardens («горящей воды», т. е. этанола) путем перегонки вина с солью начали появляться в ряде латинских трудов, и к концу тринадцатого века он стал широко известным веществом среди западноевропейских химиков. [26] В работах Таддео Альдеротти (1223–1296) описывается метод концентрирования спирта, включающий повторную перегонку через охлаждаемый водой перегонный куб, с помощью которого можно было получить чистоту спирта 90%. [27]
Согласно археологическим данным, дистилляция напитков началась в эпоху династий Южная Сун (10–13 века) и Цзинь (12–13 века). [22] На археологических раскопках в Цинлуне, провинция Хэбэй , Китай, был найден перегонный аппарат, датируемый 12 веком. Дистиллированные напитки были распространены во времена династии Юань (13–14 века). [22]
В 1500 году немецкий алхимик Иероним Бруншвиг опубликовал Liber de arte distillandi de simplicibus ( Книгу об искусстве перегонки из простых ингредиентов ) [28] , первую книгу, полностью посвященную теме перегонки, за которой в 1512 году последовала значительно расширенная версия. Сразу после этого, в 1518 году, была основана старейшая сохранившаяся винокурня в Европе — The Green Tree Distillery . [29]
В 1651 году Джон Френч опубликовал «Искусство дистилляции » [30], первый крупный английский сборник по этой практике, но утверждалось [31] , что большая его часть происходит из работы Бруншвига. Это включает диаграммы с людьми на них, показывающие промышленный, а не лабораторный масштаб операции.


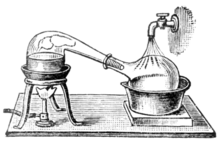


По мере того, как алхимия развивалась в науку химии , сосуды, называемые ретортами, стали использоваться для дистилляции. И алембики , и реторты представляют собой формы стеклянной посуды с длинными горлышками, направленными в сторону под углом вниз, чтобы действовать как конденсаторы с воздушным охлаждением для конденсации дистиллята и его стекания вниз для сбора. Позже были изобретены медные алембики. Заклепочные соединения часто сохраняли герметичность с помощью различных смесей, например, теста из ржаной муки. [32] Эти алембики часто имели систему охлаждения вокруг клюва, например, с использованием холодной воды, что делало конденсацию алкоголя более эффективной. Их называли перегонными кубами . Сегодня реторты и перегонные кубы в значительной степени вытеснены более эффективными методами дистилляции в большинстве промышленных процессов. Тем не менее, перегонный куб по-прежнему широко используется для производства некоторых изысканных спиртов, таких как коньяк , шотландский виски , ирландский виски , текила , ром , кашаса и некоторые водки . Перегонные кубы из различных материалов (дерево, глина, нержавеющая сталь) также используются бутлегерами в разных странах. Небольшие перегонные кубы также продаются для использования в домашнем производстве [33] цветочной воды или эфирных масел .
Ранние формы дистилляции включали пакетные процессы с использованием одного испарения и одной конденсации. Чистота улучшалась путем дальнейшей дистилляции конденсата. Большие объемы обрабатывались путем простого повторения дистилляции. Сообщается, что химики проводили от 500 до 600 дистилляций, чтобы получить чистое соединение. [34]
В начале 19 века были разработаны основы современных технологий, включая предварительный нагрев и орошение . [34] В 1822 году Энтони Перье разработал один из первых непрерывных дистилляторов, а затем, в 1826 году, Роберт Штайн усовершенствовал эту конструкцию, чтобы создать свой патентный дистиллятор . В 1830 году Эней Коффи получил патент на дальнейшее улучшение конструкции. [35] Непрерывный дистиллятор Коффи можно считать архетипом современных нефтехимических установок. Французский инженер Арман Саваль разработал свой паровой регулятор около 1846 года. [14] : 323 В 1877 году Эрнест Сольвей получил патент США на тарельчатую колонну для перегонки аммиака , [36] и в те же и последующие годы наблюдались разработки в этой области для масел и спиртов.
С появлением химической инженерии как дисциплины в конце 19-го века можно было применять научные, а не эмпирические методы. Развивающаяся нефтяная промышленность в начале 20-го века дала толчок к разработке точных методов проектирования, таких как метод МакКейба-Тиле Эрнеста Тиле и уравнение Фенске . Первый промышленный завод в Соединенных Штатах, использующий дистилляцию в качестве средства опреснения океана, открылся в Фрипорте, штат Техас, в 1961 году с надеждой на обеспечение водной безопасности в регионе. [37] Наличие мощных компьютеров позволило проводить прямое компьютерное моделирование дистилляционных колонн.
Применение дистилляции можно условно разделить на четыре группы: лабораторная, промышленная, дистилляция трав для парфюмерии и лекарственных средств ( травяной дистиллят ) и переработка пищевых продуктов. Последние два существенно отличаются от первых двух тем, что дистилляция не используется как истинный метод очистки, а скорее для переноса всех летучих веществ из исходных материалов в дистиллят при обработке напитков и трав.
Основное различие между лабораторной и промышленной дистилляцией заключается в том, что лабораторная дистилляция часто выполняется партиями, тогда как промышленная дистилляция часто происходит непрерывно. При периодической дистилляции состав исходного материала, паров дистиллируемых соединений и дистиллята изменяются во время дистилляции. При периодической дистилляции в перегонный куб загружается (подается) партия исходной смеси, которая затем разделяется на составляющие ее фракции, которые последовательно собираются от наиболее летучих к менее летучим, а кубовые остатки — оставшаяся наименее или нелетучая фракция — удаляются в конце. Затем перегонный куб можно перезагрузить, и процесс повторить.
При непрерывной дистилляции исходные материалы, пары и дистиллят поддерживаются в постоянном составе путем тщательного пополнения исходного материала и удаления фракций как из пара, так и из жидкости в системе. Это приводит к более детальному контролю процесса разделения.
Температура кипения жидкости — это температура, при которой давление паров жидкости равно давлению вокруг жидкости, что позволяет пузырькам образовываться, не разрушаясь. Особым случаем является нормальная температура кипения , при которой давление паров жидкости равно давлению окружающей атмосферы .
Ошибочно полагать, что в жидкой смеси при заданном давлении каждый компонент кипит при температуре кипения, соответствующей заданному давлению, что позволяет парам каждого компонента собираться отдельно и в чистом виде. Однако этого не происходит даже в идеализированной системе. Идеализированные модели дистилляции по сути подчиняются закону Рауля и закону Дальтона и предполагают, что достигается равновесие пар-жидкость .
Закон Рауля гласит, что давление пара раствора зависит от 1) давления пара каждого химического компонента в растворе и 2) доли раствора, которую составляет каждый компонент, также известной как мольная доля . Этот закон применим к идеальным растворам или растворам, которые имеют разные компоненты, но чьи молекулярные взаимодействия такие же или очень похожи на чистые растворы.
Закон Дальтона гласит, что общее давление является суммой парциальных давлений каждого отдельного компонента в смеси. При нагревании многокомпонентной жидкости давление пара каждого компонента будет расти, тем самым вызывая рост общего давления пара. Когда общее давление пара достигает давления, окружающего жидкость, происходит кипение , и жидкость превращается в газ по всему объему жидкости. Смесь с заданным составом имеет одну точку кипения при заданном давлении, когда компоненты взаимно растворимы. Смесь постоянного состава не имеет нескольких точек кипения.
Следствием одной точки кипения является то, что более легкие компоненты никогда не «кипят первыми». В точке кипения все летучие компоненты кипят, но для компонента его процент в паре такой же, как его процент от общего давления пара. Более легкие компоненты имеют более высокое парциальное давление и, таким образом, концентрируются в паре, но более тяжелые летучие компоненты также имеют (меньшее) парциальное давление и обязательно также испаряются, хотя и при более низкой концентрации в паре. Действительно, периодическая перегонка и фракционирование достигаются путем изменения состава смеси. При периодической перегонке партия испаряется, что меняет ее состав; при фракционировании жидкость выше в ректификационной колонне содержит больше легких компонентов и кипит при более низких температурах. Поэтому, начиная с данной смеси, она, по-видимому, имеет интервал кипения вместо точки кипения, хотя это происходит из-за изменения ее состава: каждая промежуточная смесь имеет свою собственную, единственную точку кипения.
Идеализированная модель точна в случае химически подобных жидкостей, таких как бензол и толуол . В других случаях наблюдаются серьезные отклонения от закона Рауля и закона Дальтона, наиболее известные из которых наблюдаются в смеси этанола и воды. Эти соединения при нагревании вместе образуют азеотроп , то есть когда паровая фаза и жидкая фаза содержат одинаковый состав. Хотя существуют вычислительные методы , которые можно использовать для оценки поведения смеси произвольных компонентов, единственный способ получить точные данные о равновесии пар-жидкость — это измерение.
Невозможно полностью очистить смесь компонентов путем перегонки, так как для этого потребуется, чтобы каждый компонент в смеси имел нулевое парциальное давление . Если целью являются сверхчистые продукты, то необходимо применять дальнейшее химическое разделение . Когда бинарная смесь испаряется, а другой компонент, например соль, имеет нулевое парциальное давление для практических целей, процесс упрощается.
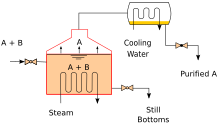
Нагревание идеальной смеси двух летучих веществ, A и B, где A имеет более высокую летучесть или более низкую температуру кипения, в установке для периодической перегонки (например, в аппарате, изображенном на начальном рисунке) до тех пор, пока смесь не закипит, приводит к образованию пара над жидкостью, содержащего смесь A и B. Соотношение между A и B в паре будет отличаться от соотношения в жидкости. Соотношение в жидкости будет определяться тем, как была приготовлена исходная смесь, в то время как соотношение в паре будет обогащено более летучим соединением A (из-за закона Рауля, см. выше). Пар проходит через конденсатор и удаляется из системы. Это, в свою очередь, означает, что соотношение соединений в оставшейся жидкости теперь отличается от начального соотношения (т. е. более обогащено B, чем в исходной жидкости).
В результате соотношение в жидкой смеси меняется, становясь богаче компонентом B. Это приводит к повышению температуры кипения смеси, что приводит к повышению температуры в паре, что приводит к изменению соотношения A : B в газовой фазе (по мере продолжения дистилляции увеличивается доля B в газовой фазе). Это приводит к медленному изменению соотношения A : B в дистилляте.
Если разница в давлении паров между двумя компонентами А и В велика (обычно выражаемая разницей в температурах кипения), то в начале перегонки смесь сильно обогащена компонентом А, а после отгонки компонента А кипящая жидкость обогащается компонентом В.
Непрерывная дистилляция — это непрерывная дистилляция, при которой жидкая смесь непрерывно (без перерыва) подается в процесс, а разделенные фракции непрерывно удаляются по мере того, как выходные потоки возникают с течением времени в ходе операции. Непрерывная дистилляция производит минимум две выходные фракции, включая по крайней мере одну летучую фракцию дистиллята, которая выкипела и была отдельно захвачена в виде пара, а затем сконденсирована в жидкость. Всегда есть фракция кубового остатка (или остатка), которая является наименее летучим остатком, который не был отдельно захвачен в виде конденсированного пара.
Непрерывная перегонка отличается от периодической тем, что концентрации не должны меняться с течением времени. Непрерывная перегонка может проводиться в устойчивом состоянии в течение произвольного периода времени. Для любого исходного материала определенного состава основными переменными, которые влияют на чистоту продуктов при непрерывной перегонке, являются флегмовое число и число теоретических равновесных стадий, на практике определяемых числом тарелок или высотой насадки. Флегмовое число — это поток из конденсатора обратно в колонну, который создает рециркуляцию, которая обеспечивает лучшее разделение при заданном числе тарелок. Равновесные стадии — это идеальные стадии, на которых составы достигают равновесия пар-жидкость, повторяя процесс разделения и обеспечивая лучшее разделение при заданном флегмовом числе. Колонна с высоким флегмовым числом может иметь меньше стадий, но она возвращает большое количество жидкости, что дает широкую колонну с большой задержкой. Наоборот, колонна с низким флегмовым числом должна иметь большое количество стадий, поэтому требуется более высокая колонна.
Как периодическая, так и непрерывная дистилляция может быть улучшена путем использования фракционирующей колонны наверху дистилляционной колбы. Колонна улучшает разделение, предоставляя большую площадь поверхности для контакта пара и конденсата. Это помогает ему оставаться в равновесии как можно дольше. Колонна может даже состоять из небольших подсистем («тарелок» или «тарелок»), которые все содержат обогащенную, кипящую жидкую смесь, все со своим собственным равновесием пара и жидкости.
Между лабораторными и промышленными ректификационными колоннами есть различия, но принципы одинаковы. Примеры лабораторных ректификационных колонн (по повышению эффективности) включают:
Лабораторные дистилляции почти всегда проводятся как периодические дистилляции. Устройство, используемое при дистилляции, иногда называемое перегонным кубом , состоит как минимум из ребойлера или горшка , в котором нагревается исходный материал, конденсатора, в котором нагретый пар охлаждается до жидкого состояния , и приемника, в котором собирается концентрированная или очищенная жидкость, называемая дистиллятом. Существует несколько методов лабораторной дистилляции (см. также типы дистилляции ).
Полностью герметичный дистилляционный аппарат может испытывать экстремальное и быстро меняющееся внутреннее давление, что может привести к его разрыву в местах соединения. Поэтому обычно оставляют открытым некоторый путь (например, в приемной колбе), чтобы внутреннее давление могло уравняться с атмосферным давлением. В качестве альтернативы можно использовать вакуумный насос , чтобы поддерживать давление в аппарате ниже атмосферного. Если вовлеченные вещества чувствительны к воздуху или влаге, соединение с атмосферой можно осуществить через одну или несколько осушительных трубок, заполненных материалами, которые удаляют нежелательные компоненты воздуха, или через барботеры , которые обеспечивают подвижный барьер для жидкости. Наконец, попадание нежелательных компонентов воздуха можно предотвратить, закачивая в аппарат слабый, но постоянный поток подходящего инертного газа, например азота .

При простой перегонке пар сразу направляется в конденсатор. Следовательно, дистиллят не является чистым, но его состав идентичен составу паров при данной температуре и давлении. Эта концентрация следует закону Рауля .
В результате простая перегонка эффективна только тогда, когда температуры кипения жидкостей сильно различаются (правило 25 °C) [38] или при отделении жидкостей от нелетучих твердых веществ или масел. В этих случаях давления паров компонентов обычно достаточно различны, чтобы дистиллят мог быть достаточно чистым для своего предполагаемого использования.
Справа показана схема в разрезе простой операции дистилляции. Исходная жидкость 15 в кипящей колбе 2 нагревается комбинированной плиткой и магнитной мешалкой 13 через баню с силиконовым маслом (оранжевый, 14). Пар протекает через короткую колонну Вигре 3, затем через холодильник Либиха 5, охлаждается водой (синий), которая циркулирует через порты 6 и 7. Конденсированная жидкость капает в приемную колбу 8, находящуюся в охлаждающей бане (синий, 16). Адаптер 10 имеет соединение 9, которое может быть установлено на вакуумный насос. Компоненты соединены шлифованными соединениями .
Во многих случаях точки кипения компонентов в смеси будут достаточно близки, поэтому необходимо учитывать закон Рауля . Поэтому для разделения компонентов путем повторных циклов испарения-конденсации в насадочной ректификационной колонне необходимо использовать фракционную перегонку. Это разделение путем последовательных перегонок также называется ректификацией. [39]
По мере нагревания очищаемого раствора его пары поднимаются в ректификационную колонну . Поднимаясь, он охлаждается, конденсируясь на стенках конденсатора и поверхностях насадочного материала. Здесь конденсат продолжает нагреваться поднимающимися горячими парами; он снова испаряется. Однако состав свежих паров снова определяется законом Рауля. Каждый цикл испарения-конденсации (называемый теоретической тарелкой ) даст более чистый раствор более летучего компонента. [40] В действительности каждый цикл при данной температуре не происходит в точно таком же положении в ректификационной колонне; теоретическая тарелка, таким образом, является концепцией, а не точным описанием.
Больше теоретических тарелок приводит к лучшему разделению. Система дистилляции с вращающейся лентой использует вращающуюся ленту из тефлона или металла, чтобы заставить восходящие пары вступить в тесный контакт с нисходящим конденсатом, увеличивая количество теоретических тарелок. [41]
Как и вакуумная перегонка , паровая перегонка является методом перегонки соединений, чувствительных к теплу. [1] : 151–153 Температуру пара легче контролировать, чем поверхность нагревательного элемента , и она обеспечивает высокую скорость теплопередачи без нагрева при очень высокой температуре. Этот процесс включает барботирование пара через нагретую смесь сырья. По закону Рауля часть целевого соединения испаряется (в соответствии с его парциальным давлением). Паровая смесь охлаждается и конденсируется, обычно давая слой масла и слой воды.
Паровая дистилляция различных ароматических трав и цветов может привести к двум продуктам: эфирному маслу , а также водному травяному дистилляту . Эфирные масла часто используются в парфюмерии и ароматерапии, в то время как водные дистилляты имеют множество применений в ароматерапии , пищевой промышленности и уходе за кожей .


Некоторые соединения имеют очень высокие температуры кипения. Чтобы закипятить такие соединения, часто лучше понизить давление, при котором они кипят, вместо того, чтобы повышать температуру. Как только давление понижается до давления паров соединения (при данной температуре), можно начинать кипение и оставшуюся часть процесса дистилляции. Этот метод называется вакуумной дистилляцией и обычно встречается в лаборатории в виде роторного испарителя .
Этот метод также очень полезен для соединений, которые кипят выше температуры разложения при атмосферном давлении и которые, следовательно, разложились бы при любой попытке вскипятить их при атмосферном давлении.
Молекулярная дистилляция — это вакуумная дистилляция ниже давления 0,01 торр . 0,01 торр на порядок выше высокого вакуума , где жидкости находятся в режиме свободного молекулярного течения , т. е. длина свободного пробега молекул сопоставима с размером оборудования. Газообразная фаза больше не оказывает значительного давления на испаряемое вещество, и, следовательно, скорость испарения больше не зависит от давления. То есть, поскольку предположения о непрерывности динамики жидкости больше не применяются, массоперенос регулируется молекулярной динамикой, а не динамикой жидкости. Таким образом, необходим короткий путь между горячей поверхностью и холодной поверхностью, обычно путем подвешивания горячей пластины, покрытой пленкой сырья, рядом с холодной пластиной с прямой видимостью между ними. Молекулярная дистилляция используется в промышленности для очистки масел.
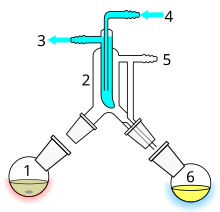
Короткая дистилляция — это метод дистилляции, при котором дистиллят проходит короткое расстояние, часто всего несколько сантиметров, и обычно выполняется при пониженном давлении. [1] : 150 Классическим примером может служить дистилляция, при которой дистиллят проходит из одной стеклянной колбы в другую, без необходимости в конденсаторе, разделяющем две камеры. Этот метод часто используется для соединений, которые нестабильны при высоких температурах, или для очистки небольших количеств соединения. Преимущество заключается в том, что температура нагрева может быть значительно ниже (при пониженном давлении), чем точка кипения жидкости при стандартном давлении, и дистилляту нужно пройти только короткое расстояние перед конденсацией. Короткий путь гарантирует, что мало соединения будет потеряно на стенках аппарата. Аппарат Кугельрора — это своего рода метод короткой дистилляции, который часто содержит несколько камер для сбора фракций дистиллята.
Некоторые соединения имеют высокие температуры кипения, а также чувствительны к воздуху . Можно использовать простую систему вакуумной дистилляции, как показано выше, в которой вакуум заменяется инертным газом после завершения дистилляции. Однако это менее удовлетворительная система, если требуется собирать фракции при пониженном давлении. Для этого можно добавить адаптер «корова» или «свинья» к концу конденсатора, или для лучших результатов или для очень чувствительных к воздуху соединений можно использовать аппарат треугольника Перкина .
Треугольник Перкина имеет средства с помощью ряда стеклянных или тефлоновых кранов, которые позволяют изолировать фракции от остальной части дистиллята , без удаления основного тела дистилляции из вакуума или источника тепла, и, таким образом, может оставаться в состоянии рефлюкса . Для этого образец сначала изолируется от вакуума с помощью кранов, затем вакуум над образцом заменяется инертным газом (таким как азот или аргон ), а затем может быть закупорен и удален. Затем в систему можно добавить новый сосуд для сбора, вакуумировать и снова подключить к системе дистилляции через краны для сбора второй фракции, и так далее, пока все фракции не будут собраны.
Зонная перегонка – это процесс перегонки в длинной емкости с частичным плавлением очищаемого вещества в движущейся жидкой зоне и конденсацией паров в твердой фазе при вытягивании конденсата в холодную зону. Процесс отработан в теории. При перемещении нагревателя зоны сверху вниз емкости образуется твердый конденсат с неравномерным распределением примесей. Затем наиболее чистую часть конденсата можно выделить в качестве продукта. Процесс можно повторять многократно, перемещая (без оборота) полученный конденсат в нижнюю часть емкости на место очищаемого вещества. Неравномерность распределения примесей в конденсате (т.е. эффективность очистки) увеличивается с числом итераций. Зонная перегонка – это дистилляционный аналог зонной перекристаллизации. Распределение примесей в конденсате описывается известными уравнениями зонной перекристаллизации – с заменой коэффициента распределения кристаллизации k – на фактор разделения перегонки α. [42] [43] [44]
Неконденсирующийся газ может быть вытеснен из аппарата паром относительно летучего сорастворителя, который самопроизвольно испаряется во время первоначальной откачки, и этого можно добиться с помощью обычного масляного или мембранного насоса. [45] [46]
Единичный процесс испарения можно также назвать «дистилляцией»:
Другие применения:
Взаимодействие между компонентами раствора создает свойства, уникальные для раствора, поскольку большинство процессов подразумевают неидеальные смеси, где закон Рауля не выполняется. Такие взаимодействия могут привести к образованию азеотропа с постоянной температурой кипения , который ведет себя так, как если бы он был чистым соединением (т. е. кипит при одной температуре, а не в диапазоне). В азеотропе раствор содержит заданный компонент в той же пропорции, что и пар, так что испарение не изменяет чистоту, а перегонка не приводит к разделению. Например, 95,6% этанола (по массе) в воде образует азеотроп при 78,1 °C.
Если азеотроп не считается достаточно чистым для использования, существуют некоторые методы разрушения азеотропа для получения более чистого дистиллята. Эти методы известны как азеотропная перегонка . Некоторые методы достигают этого путем «перепрыгивания» через азеотропный состав (путем добавления другого компонента для создания нового азеотропа или путем изменения давления). Другие работают путем химического или физического удаления или секвестрации примесей. Например, для очистки этанола свыше 95% можно добавить осушающий агент (или десикант , такой как карбонат калия ) для преобразования растворимой воды в нерастворимую воду кристаллизации . Молекулярные сита часто используются для этой цели.
Несмешивающиеся жидкости, такие как вода и толуол , легко образуют азеотропы. Обычно эти азеотропы называют низкокипящими азеотропами, поскольку температура кипения азеотропа ниже температуры кипения любого из чистых компонентов. Температуру и состав азеотропа легко предсказать по давлению паров чистых компонентов, без использования закона Рауля. Азеотроп легко разрушается в дистилляционной установке с помощью сепаратора жидкость-жидкость (декантера) для разделения двух жидких слоев, которые конденсируются сверху. Только один из двух жидких слоев орошается в дистилляционной установке.
Существуют также азеотропы с высокой температурой кипения, например, 20-процентная по весу смесь соляной кислоты в воде. Как следует из названия, температура кипения азеотропа выше, чем температура кипения любого из чистых компонентов.
Точки кипения компонентов в азеотропе перекрываются, образуя полосу. Подвергая азеотроп воздействию вакуума или положительного давления, можно сместить точку кипения одного компонента относительно другого, используя различные кривые давления паров каждого из них; кривые могут перекрываться в азеотропной точке, но вряд ли останутся идентичными далее по оси давления по обе стороны от азеотропной точки. Когда смещение достаточно велико, две точки кипения больше не перекрываются, и поэтому азеотропная полоса исчезает.
Этот метод может устранить необходимость добавления других химикатов в процесс дистилляции, но у него есть два потенциальных недостатка.
При отрицательном давлении требуется мощность для источника вакуума, а пониженные точки кипения дистиллятов требуют, чтобы конденсатор работал в более холодном режиме, чтобы предотвратить потерю паров дистиллята в источник вакуума. Повышенные требования к охлаждению часто потребуют дополнительной энергии и, возможно, нового оборудования или замены охлаждающей жидкости.
В качестве альтернативы, если требуется положительное давление, стандартную стеклянную посуду использовать нельзя, для создания давления необходимо использовать энергию, а также существует более высокая вероятность возникновения побочных реакций в процессе дистилляции, таких как разложение, из-за более высоких температур, необходимых для осуществления кипения.
Однонаправленная дистилляция будет основываться на изменении давления в одном направлении, как положительном, так и отрицательном.
Перегонка с переменным давлением по сути то же самое, что и однонаправленная перегонка, используемая для разделения азеотропных смесей, но здесь можно использовать как положительное, так и отрицательное давление .
Это улучшает селективность дистилляции и позволяет химику оптимизировать дистилляцию, избегая экстремальных значений давления и температуры, которые приводят к потере энергии. Это особенно важно в коммерческих приложениях.
Одним из примеров применения перегонки с переменным давлением является промышленная очистка этилацетата после его каталитического синтеза из этанола .

Крупномасштабные промышленные применения дистилляции включают как периодическую, так и непрерывную фракционную, вакуумную, азеотропную, экстрактивную и паровую дистилляцию. Наиболее широко используемые промышленные применения непрерывной, стационарной фракционной дистилляции находятся на нефтеперерабатывающих заводах , нефтехимических и химических заводах и заводах по переработке природного газа .
Для контроля и оптимизации такой промышленной дистилляции установлен стандартизированный лабораторный метод ASTM D86. Этот метод испытаний распространяется на атмосферную дистилляцию нефтепродуктов с использованием лабораторной периодической дистилляционной установки для количественного определения характеристик диапазона кипения нефтепродуктов.
Промышленная дистилляция [39] [47] обычно выполняется в больших вертикальных цилиндрических колоннах, известных как дистилляционные башни или дистилляционные колонны, с диаметром от 0,65 до 16 метров (от 2 футов 2 дюйма до 52 футов 6 дюймов) и высотой от 6 до 90 метров (от 20 до 295 футов) или более. Когда технологическое сырье имеет разнообразный состав, как при дистилляции сырой нефти , выпускные отверстия для жидкости с интервалами вверх по колонне позволяют отводить различные фракции или продукты с различными точками кипения или диапазонами кипения. Самые «легкие» продукты (с самой низкой точкой кипения) выходят из верхней части колонн, а самые «тяжелые» продукты (с самой высокой точкой кипения) выходят из нижней части колонны и часто называются кубовыми остатками.
Промышленные башни используют обратный поток для достижения более полного разделения продуктов. Обратная флегма относится к части конденсированного жидкого продукта верхнего погона из дистилляционной или фракционирующей башни, которая возвращается в верхнюю часть башни, как показано на принципиальной схеме типичной крупной промышленной дистилляционной башни. Внутри башни нисходящая флегма обеспечивает охлаждение и конденсацию восходящих паров, тем самым увеличивая эффективность дистилляционной башни. Чем больше обратный поток, который обеспечивается для заданного числа теоретических тарелок , тем лучше разделение башней низкокипящих материалов от высококипящих материалов. С другой стороны, чем больше обратный поток, который обеспечивается для заданного желаемого разделения, тем меньше требуется теоретических тарелок. Инженеры-химики должны выбрать, какое сочетание скорости обратного потока и числа тарелок является как экономически, так и физически осуществимым для продуктов, очищаемых в дистилляционной колонне.
Такие промышленные ректификационные башни также используются в криогенном разделении воздуха , производя жидкий кислород , жидкий азот и аргон высокой чистоты . Дистилляция хлорсиланов также позволяет производить высокочистый кремний для использования в качестве полупроводника .
Конструкция и работа дистилляционной колонны зависят от сырья и желаемых продуктов. При наличии простого бинарного компонента сырья можно использовать аналитические методы, такие как метод МакКейба–Тиля [39] [48] или уравнение Фенске [39] . Для многокомпонентного сырья имитационные модели используются как для проектирования, так и для работы. Более того, эффективность устройств для контакта пара и жидкости (называемых «тарелками» или «тарелок»), используемых в дистилляционных колоннах, обычно ниже, чем у теоретической 100% эффективной ступени равновесия . Следовательно, для дистилляционной колонны требуется больше тарелок, чем количество теоретических ступеней равновесия пара и жидкости. Было постулировано множество моделей для оценки эффективности тарелок.
В современных промышленных применениях вместо тарелок в колонне используется насадочный материал, когда требуются низкие перепады давления в колонне. Другими факторами, благоприятствующими набивке, являются: вакуумные системы, колонны меньшего диаметра, коррозионные системы, системы, склонные к пенообразованию, системы, требующие низкого удержания жидкости, и периодическая перегонка. И наоборот, факторами, благоприятствующими тарельчатым колоннам, являются: наличие твердых веществ в сырье, высокие скорости жидкости, большие диаметры колонн, сложные колонны, колонны с широкими вариациями состава сырья, колонны с химической реакцией, абсорбционные колонны, колонны, ограниченные допуском веса основания, низкая скорость жидкости, большой диапазон регулирования и те процессы, которые подвержены скачкам процесса.
Этот материал насадки может быть случайной или сбрасываемой насадкой (шириной 25–76 миллиметров (1–3 дюйма)), такой как кольца Рашига или структурированный листовой металл . Жидкости имеют тенденцию смачивать поверхность насадки, и пары проходят через эту смоченную поверхность, где происходит массоперенос . В отличие от обычной тарельчатой дистилляции, в которой каждая тарелка представляет собой отдельную точку равновесия пар-жидкость, кривая равновесия пар-жидкость в насадочной колонне непрерывна. Однако при моделировании насадочных колонн полезно вычислить ряд «теоретических стадий», чтобы обозначить эффективность разделения насадочной колонны по сравнению с более традиционными тарелками. Насадки разной формы имеют разные площади поверхности и пустое пространство между насадками. Оба эти фактора влияют на производительность насадки.
Другим фактором, помимо формы насадки и площади поверхности, который влияет на производительность случайной или структурированной насадки, является распределение жидкости и пара, поступающих в насадочный слой. Количество теоретических ступеней, необходимых для выполнения заданного разделения, рассчитывается с использованием определенного соотношения пара и жидкости. Если жидкость и пар неравномерно распределены по поверхности колонны при входе в насадочный слой, соотношение жидкости и пара в насадочном слое будет неправильным, и требуемое разделение не будет достигнуто. Насадка будет работать неправильно. Высота, эквивалентная теоретической тарелке (HETP), будет больше ожидаемой. Проблема заключается не в самой насадке, а в неправильном распределении жидкостей, поступающих в насадочный слой. Неправильное распределение жидкости является проблемой чаще, чем пар. Конструкция распределителей жидкости, используемых для подачи сырья и орошения в насадочный слой, имеет решающее значение для обеспечения максимальной эффективности насадки. Методы оценки эффективности распределителя жидкости для равномерного распределения жидкости, поступающей в насадочный слой, можно найти в ссылках. [50] [51] Значительная работа по этой теме была проделана компанией Fractionation Research, Inc. (широко известной как FRI). [52]
Целью многоэффектной дистилляции является повышение энергоэффективности процесса для использования в опреснении или, в некоторых случаях, в качестве одной стадии производства сверхчистой воды . Количество эффектов обратно пропорционально показателю кВт·ч/м 3 восстановленной воды и относится к объему восстановленной воды на единицу энергии по сравнению с одноэффектной дистилляцией. Один эффект составляет примерно 636 кВт·ч/м 3 :
Существует множество других типов процессов многоэффектной дистилляции, включая процесс, называемый просто многоэффектной дистилляцией (МД), в котором используются несколько камер с промежуточными теплообменниками.
Углеводсодержащие растительные материалы подвергаются брожению, в результате чего получается разбавленный раствор этанола. Такие спиртные напитки, как виски и ром, готовятся путем перегонки этих разбавленных растворов этанола. Компоненты, отличные от этанола, включая воду, эфиры и другие спирты, собираются в конденсате, который и определяет вкус напитка. Некоторые из этих напитков затем хранятся в бочках или других емкостях для приобретения большего количества вкусовых соединений и характерных ароматов.
Как уже упоминалось, текстовые свидетельства шумеро-вавилонской дистилляции обнаружены в группе аккадских табличек, описывающих парфюмерные операции, датируемых примерно 1200 г. до н.э.
Самый ранний возможный период, по-видимому, относится к династии Восточная Хань... наиболее вероятным периодом начала настоящей дистилляции спиртных напитков для питья в Китае является период династий Цзинь и Южная Сун.