В клеточной биологии меристема — это тип ткани , встречающийся в растениях. Он состоит из недифференцированных клеток ( меристематических клеток ), способных к клеточному делению . Клетки меристемы могут развиваться во все другие ткани и органы растений. Эти клетки продолжают делиться, пока не станут дифференцированными и не потеряют способность делиться.
Дифференцированные растительные клетки обычно не могут делиться или производить клетки другого типа. Меристематические клетки недифференцированы или неполностью дифференцированы. Они тотипотентны и способны к продолжению клеточного деления . Деление меристематических клеток обеспечивает появление новых клеток для разрастания и дифференцировки тканей и зарождения новых органов, обеспечивающих основную структуру тела растения. Клетки мелкие, с небольшими вакуолями или без них, протоплазма полностью заполняет клетку. Пластиды ( хлоропласты или хромопласты ) недифференцированы, но присутствуют в рудиментарной форме ( пропластиды ) . Меристематические клетки плотно прилегают друг к другу, без межклеточных пространств. Клеточная стенка представляет собой очень тонкую первичную клеточную стенку.
Термин меристема впервые был использован в 1858 году швейцарским ботаником Карлом Вильгельмом фон Нэгели (1817–1891) в его книге Beiträge zur Wissenschaftlichen Botanik («Вклад в научную ботанику»). [1] Оно происходит от греческого μερίζειν (меризеин) «разделять» в знак признания присущей ему функции. [ нужна цитата ]
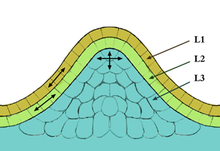
Существует три типа меристематических тканей: апикальные (на кончиках), интеркалярные или базальные (в середине) и латеральные (по бокам, также известные как камбий). На вершине меристемы находится небольшая группа медленно делящихся клеток, которую принято называть центральной зоной. Клетки этой зоны выполняют функцию стволовых клеток и необходимы для поддержания меристемы. Скорость пролиферации и роста на вершине меристемы обычно значительно отличается от таковой на периферии.
Апикальные меристемы дают начало первичному телу растения и отвечают за первичный рост или увеличение длины или высоты. [2] [3] Апикальные меристемы могут дифференцироваться на три типа первичной меристемы:
После первичного роста боковые меристемы развиваются как вторичный рост растения. Этот рост увеличивает диаметр растения по сравнению с укоренившимся стеблем, но не все растения демонстрируют вторичный рост. Различают два типа вторичных меристем: сосудистый камбий и пробковый камбий.
Апикальные меристемы — это совершенно недифференцированные (индетерминантные) меристемы растения. Они различаются на три типа первичных меристем. Первичные меристемы, в свою очередь, производят два типа вторичных меристем. Эти вторичные меристемы также известны как латеральные меристемы, поскольку они участвуют в латеральном росте.

Существует два типа ткани апикальной меристемы: апикальная меристема побега ( SAM ), которая дает начало таким органам, как листья и цветы, и апикальная меристема корня ( RAM ), которая обеспечивает меристематические клетки для будущего роста корня. Клетки SAM и RAM быстро делятся и считаются неопределенными, поскольку они не обладают каким-либо определенным конечным статусом. В этом смысле меристематические клетки часто сравнивают со стволовыми клетками животных, которые имеют аналогичное поведение и функции.
Апикальные меристемы многослойные, количество слоев варьируется в зависимости от типа растения. Обычно самый внешний слой называется оболочкой , а самые внутренние слои — телом . У однодольных растений оболочка определяет физические характеристики края и края листа. У двудольных второй слой корпуса определяет характеристики края листа. Тело и оболочка играют важную роль в физическом облике растения, поскольку все растительные клетки образуются из меристем. Апикальные меристемы встречаются в двух местах: в корне и стебле. Некоторые арктические растения имеют апикальную меристему в нижней/средней части растения. Считается, что такая меристема возникла потому, что она выгодна в арктических условиях. [ нужна цитата ]

Апикальные меристемы побега являются источником всех надземных органов, таких как листья и цветы. Клетки на вершине апикальной меристемы побега служат стволовыми клетками для окружающей периферической области, где они быстро пролиферируют и включаются в дифференцирующиеся зачатки листьев или цветков.
Апикальная меристема побега является местом большей части эмбриогенеза цветковых растений. [ нужна цитация ] Зачатки листьев, чашелистиков, лепестков, тычинок и завязей закладываются здесь со скоростью один каждый интервал времени, называемый пластохроном . Именно здесь проявляются первые признаки развития цветка. Одним из этих признаков может быть потеря апикального доминирования и высвобождение спящих клеток для развития в качестве вспомогательных меристем побега у некоторых видов в пазухах зачатков, расположенных на расстоянии двух или трех от апикального купола.
Апикальная меристема побега состоит из четырех отдельных групп клеток:
Эти четыре отдельные зоны поддерживаются сложным сигнальным путем. У Arabidopsis thaliana 3 взаимодействующих гена CLAVATA необходимы для регулирования размера резервуара стволовых клеток в апикальной меристеме побега путем контроля скорости клеточного деления . [5] Предполагается, что CLV1 и CLV2 образуют рецепторный комплекс (семейства рецептороподобных киназ LRR), лигандом которого является CLV3 . [6] [7] [8] CLV3 имеет некоторую гомологию с белками ESR кукурузы, при этом между белками сохраняется короткая область из 14 аминокислот . [9] [10] Белки, содержащие эти консервативные области, были сгруппированы в семейство белков CLE. [9] [10]
Было показано, что CLV1 взаимодействует с несколькими цитоплазматическими белками, которые, скорее всего, участвуют в последующей передаче сигналов . Например, было обнаружено, что комплекс CLV связан с небольшими белками, родственными ГТФазе Rho/Rac . [5] Эти белки могут выступать в качестве промежуточного звена между комплексом CLV и митоген-активируемой протеинкиназой (MAPK), которая часто участвует в сигнальных каскадах. [11] KAPP представляет собой киназу-ассоциированную протеинфосфатазу, которая, как было показано, взаимодействует с CLV1. [12] Считается, что KAPP действует как негативный регулятор CLV1, дефосфорилируя его. [12]
Другим важным геном в поддержании меристемы растений является WUSCHEL (сокращенно WUS ), который является мишенью передачи сигналов CLV в дополнение к положительной регуляции CLV, образуя таким образом петлю обратной связи. [13] WUS экспрессируется в клетках ниже стволовых клеток меристемы, и его присутствие предотвращает дифференцировку стволовых клеток. [13] CLV1 способствует клеточной дифференцировке, подавляя активность WUS за пределами центральной зоны, содержащей стволовые клетки. [5]
Функция WUS в апикальной меристеме побега связана с фитогормоном цитокинином . Цитокинин активирует гистидинкиназы , которые затем фосфорилируют белки-фосфопереносчики гистидина. [14] Впоследствии фосфатные группы переносятся на два типа регуляторов ответа арабидопсиса (ARR): ARRS типа B и ARR типа A. ARR типа B действуют как факторы транскрипции, активируя гены, расположенные ниже цитокинина , включая A-ARR. A-ARR по структуре аналогичны B-ARR; однако A-ARR не содержат ДНК-связывающих доменов, которые есть у B-ARR и которые необходимы для функционирования в качестве факторов транскрипции. [15] Следовательно, A-ARR не способствуют активации транскрипции и, конкурируя за фосфаты с белками-фосфопереносчиками, ингибируют функцию B-ARR. [16] В SAM B-ARR индуцируют экспрессию WUS , который индуцирует идентичность стволовых клеток. [17] Затем WUS подавляет A-ARR. [18] В результате B-ARR больше не ингибируются, вызывая устойчивую передачу сигналов цитокининов в центре апикальной меристемы побега. Вместе с сигнализацией CLAVATA эта система работает как петля отрицательной обратной связи . Передача сигналов цитокинина положительно усиливается WUS, чтобы предотвратить ингибирование передачи сигналов цитокинина, в то время как WUS способствует развитию собственного ингибитора в форме CLV3, который в конечном итоге удерживает передачу сигналов WUS и цитокинина под контролем. [19]
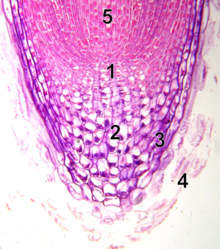
В отличие от апикальной меристемы побега, апикальная меристема корня производит клетки в двух измерениях. Он содержит два пула стволовых клеток вокруг организующего центра, называемого клетками покоящегося центра (QC), и вместе производит большую часть клеток взрослого корня. [20] [21] На вершине корневая меристема покрыта корневым чехликом, который защищает и направляет траекторию ее роста. Клетки постоянно отслаиваются от внешней поверхности корневого чехлика . Клетки ПЦ характеризуются низкой митотической активностью. Имеющиеся данные свидетельствуют о том, что QC поддерживает окружающие стволовые клетки, предотвращая их дифференцировку с помощью сигналов, которые еще предстоит обнаружить. Это обеспечивает постоянный приток новых клеток в меристему, необходимый для непрерывного роста корня. Недавние открытия показывают, что КК также может выступать в качестве резервуара стволовых клеток для восполнения всего, что было потеряно или повреждено. [22] Апикальная меристема корня и структура ткани устанавливаются у эмбриона в случае первичного корня и в новом зачатке бокового корня в случае вторичных корней.
У покрытосеменных вставочные (иногда называемые базальными) меристемы встречаются в стеблях однодольных (в частности, травяных ) у основания узлов и листовых пластинок. Хвощи и вельвичия также демонстрируют вставочный рост. Интеркалярные меристемы способны к делению клеток и обеспечивают быстрый рост и возобновление роста многих однодольных растений. Интеркалярные меристемы в узлах бамбука обеспечивают быстрое удлинение стебля, а меристемы у основания большинства листовых пластинок травы позволяют поврежденным листьям быстро отрастать. Такое возобновление роста листьев трав развилось в ответ на ущерб, нанесенный травоядными животными и/или лесными пожарами.
Когда растения начинают цвести, апикальная меристема побега преобразуется в меристему соцветия, из которой образуется цветочная меристема, из которой образуются чашелистики, лепестки, тычинки и плодолистики цветка.
В отличие от вегетативных апикальных меристем и некоторых меристем цветения, цветочные меристемы не могут продолжать расти бесконечно. Их рост ограничивается цветком определенного размера и формы. Для перехода от меристемы побега к меристеме цветка необходимы гены, идентифицирующие меристему цветка, которые одновременно определяют цветочные органы и вызывают прекращение производства стволовых клеток. AGAMOUS ( AG ) – это цветочный гомеотический ген, необходимый для терминации меристемы цветка и необходимый для правильного развития тычинок и плодолистиков . [5] AG необходим для предотвращения превращения цветочных меристем в меристемы побегов соцветия, но является идентичным геном LEAFY ( LFY ) и WUS и ограничен центром цветочной меристемы или двумя внутренними мутовками. [23] Таким образом достигается цветочная идентичность и региональная специфика. WUS активирует AG путем связывания с консенсусной последовательностью во втором интроне AG, а LFY связывается с соседними сайтами узнавания. [23] Как только AG активируется, он подавляет экспрессию WUS, что приводит к прекращению меристемы. [23]
На протяжении многих лет ученые манипулировали цветочными меристемами по экономическим причинам. Примером может служить мутантное растение табака «Мэрилендский мамонт». В 1936 году департамент сельского хозяйства Швейцарии провел с этим растением несколько научных испытаний. «Мэрилендский мамонт» необычен тем, что растет гораздо быстрее других табачных растений.
Апикальное доминирование – это когда одна меристема предотвращает или подавляет рост других меристем. В результате у растения будет один четко выраженный главный ствол. Например, у деревьев верхушка основного ствола несет доминантную меристему побега. Поэтому кончик ствола быстро растет и не затеняется ветвями. Если доминантную меристему отрезать, один или несколько кончиков ветвей возьмут на себя доминирование. Филиал начнет расти быстрее, и новый рост будет вертикальным. С годами ветвь может начать все больше напоминать продолжение основного ствола. Часто такое поведение наблюдается в нескольких ветвях после удаления апикальной меристемы, что приводит к густому росту.
Механизм апикального доминирования основан на ауксинах — регуляторах роста растений. Они производятся в апикальной меристеме и транспортируются к корням в камбии . Если апикальное доминирование полное, они предотвращают образование ветвей, пока апикальная меристема активна. Если доминирование неполное, будут развиваться боковые ветви. [ нужна цитата ]
Недавние исследования апикального доминирования и контроля ветвления выявили новое семейство растительных гормонов, названное стриголактонами . Ранее было известно, что эти соединения участвуют в прорастании семян и взаимодействии с микоризными грибами , а теперь показано, что они участвуют в ингибировании ветвления. [24]
SAM содержит популяцию стволовых клеток , которые также производят боковые меристемы, пока стебель удлиняется. Оказывается, механизм регуляции количества стволовых клеток может быть эволюционно консервативным. Ген CLAVATA CLV2, ответственный за поддержание популяции стволовых клеток Arabidopsis thaliana , очень тесно связан с геном кукурузы FASCIATED EAR 2 ( FEA2 ), также участвующим в той же функции. [25] Аналогичным образом, у риса система FON1-FON2 , по-видимому, имеет тесную связь с сигнальной системой CLV у Arabidopsis thaliana . [26] Эти исследования показывают, что регуляция количества, идентичности и дифференциации стволовых клеток может быть эволюционно консервативным механизмом у однодольных , если не у покрытосеменных . Рис также содержит еще одну генетическую систему, отличную от FON1-FON2 , которая участвует в регуляции количества стволовых клеток . [26] Этот пример подчеркивает инновации , которые постоянно происходят в живом мире.


Генетический скрининг выявил гены, принадлежащие к семейству KNOX , выполняющие эту функцию. Эти гены по существу поддерживают стволовые клетки в недифференцированном состоянии. Семейство KNOX претерпело значительную эволюционную диверсификацию, сохранив при этом общий механизм более или менее схожим. Члены семейства KNOX были обнаружены в таких разнообразных растениях, как Arabidopsis thaliana , рис, ячмень и томаты. KNOX-подобные гены также присутствуют в некоторых водорослях , мхах, папоротниках и голосеменных растениях . Неправильная экспрессия этих генов приводит к формированию интересных морфологических особенностей. Например, среди представителей Antirrineae только виды рода Antirhinum лишены структуры, называемой шпорой, в цветочной области. Шпора считается эволюционной инновацией , поскольку она определяет специфичность и привлекательность опылителей . Исследователи провели мутагенез транспозонов у Antirhinum majus и увидели, что некоторые вставки приводили к образованию шпор, которые были очень похожи на шпоры других представителей Antirhineae , [ 27] что указывает на то, что потеря шпоры в диких популяциях Antirhinum majus , вероятно, могла быть эволюционной инновацией. .
Семейство KNOX также принимало участие в эволюции формы листьев (более подробное обсуждение см. ниже) . В одном исследовании изучался характер экспрессии гена KNOX у A. thaliana , имеющего простые листья, и Cardamine hirsuta , растения со сложными листьями . У A. thaliana гены KNOX полностью отключаются в листьях, но у C.hirsuta экспрессия продолжается, образуя сложные листья. [28] Также было высказано предположение, что механизм действия гена KNOX консервативен для всех сосудистых растений , поскольку существует тесная корреляция между экспрессией KNOX и сложной морфологией листьев. [29]
Хотя каждое растение растет по определенному набору правил, каждый новый корень и меристема побега могут продолжать расти, пока они живы. У многих растений меристематический рост потенциально неопределенен , поэтому общая форма растения не определена заранее. Это основной рост . Первичный рост приводит к удлинению тела растения и формированию органов. Все органы растения в конечном итоге возникают в результате деления клеток апикальной меристемы с последующим расширением и дифференцировкой клеток. Первичный рост дает начало верхушечной части многих растений.
Рост азотфиксирующих корневых клубеньков на бобовых растениях, таких как соя и горох, может быть детерминантным или индетерминантным. Таким образом, соя (или фасоль и лотос японский) образуют детерминированные клубеньки (сферические) с разветвленной сосудистой системой, окружающей центральную зону заражения. Часто клетки, инфицированные Rhizobium, имеют лишь небольшие вакуоли. Напротив, клубеньки на горохе, клевере и Medicago truncatula являются недетерминированными, чтобы поддерживать (по крайней мере, в течение некоторого времени) активную меристему, которая дает новые клетки для заражения Rhizobium. Таким образом, в клубеньке существуют зоны зрелости. Инфицированные клетки обычно имеют большую вакуоль. Сосудистая система растения разветвленная и периферическая.
При соответствующих условиях каждая меристема побега может развиться в полноценное новое растение или клон . Такие новые растения можно вырастить из черенков побегов, содержащих апикальную меристему. Однако апикальные меристемы корня клонировать нелегко. Такое клонирование называется бесполым размножением или вегетативным размножением и широко практикуется в садоводстве для массового производства растений желаемого генотипа . Было показано, что этот процесс, известный как мериклонирование, уменьшает или устраняет вирусы, присутствующие в родительском растении у многих видов растений. [30] [31]
Размножение черенками - это еще одна форма вегетативного размножения, которая инициирует образование корней или побегов из вторичных меристематических камбиальных клеток. Это объясняет, почему базальное «ранение» побеговых черенков часто способствует образованию корней. [32]
Меристемы также могут индуцироваться в корнях бобовых, таких как соя , Lotus japonicus , горох и Medicago truncatula , после заражения почвенными бактериями, обычно называемыми ризобиями . [ нужна цитация ] Клетки внутренней или внешней коры головного мозга в так называемом «окне узелков» сразу за развивающимся кончиком корня вынуждены делиться. Критическим сигнальным веществом является липололигосахарид Nod -фактор , украшенный боковыми группами, обеспечивающими специфичность взаимодействия. Белки рецептора Nod-фактора NFR1 и NFR5 были клонированы из нескольких бобовых, включая Lotus japonicus , Medicago truncatula и соевые бобы ( Glycine max ). Регуляция меристем клубеньков использует регуляцию на расстоянии, известную как авторегуляция клубеньков (АОН). Этот процесс включает в себя киназы рецепторов LRR , локализованные в сосудистой ткани листа (LjHAR1, GmNARK и MtSUNN), передачу сигналов пептида CLE и взаимодействие KAPP, подобное тому, которое наблюдается в системе CLV1,2,3. LjKLAVIER также демонстрирует фенотип регуляции узелков, хотя пока неизвестно, как это связано с другими киназами рецептора AON.
Боковые меристемы, форма вторичного роста растений, увеличивают диаметр растений. Прежде всего это наблюдается у многолетних двудольных растений, которые выживают из года в год. Различают два типа латеральных меристем: сосудистый камбий и пробковый камбий.
В сосудистом камбии первичная флоэма и ксилема образуются апикальной меристемой. После этого первоначального развития латеральная меристема образует вторичную флоэму и ксилему. Они соединены тонким слоем паренхиматозных клеток, которые дифференцируются в пучок камбия. Пучок камбия делится, образуя новую вторичную флоэму и ксилему. Вслед за этим кортикальная паренхима между сосудистыми цилиндрами дифференцирует межпучковый камбий. Этот процесс повторяется для неопределенного роста. [33]
Пробковый камбий создает защитное покрытие вокруг растения снаружи. Это происходит после того, как вторичная ксилема и флоэма уже разрослись. Кортикальные паренхиматозные клетки дифференцируются в пробковый камбий вблизи эпидермиса, который образует новые клетки, называемые феллодермой и пробковыми клетками. Эти пробковые клетки непроницаемы для воды и газов из-за вещества под названием суберин, которое их покрывает. [34]
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка )