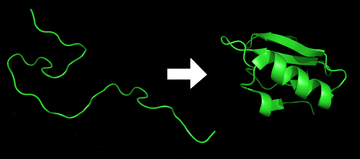

Сворачивание белка — это физический процесс , посредством которого белок после синтеза рибосомой в виде линейной цепи аминокислот превращается из нестабильного случайного клубка в более упорядоченную трехмерную структуру . Эта структура позволяет белку стать биологически функциональным. [1]
Сворачивание многих белков начинается еще во время трансляции полипептидной цепи. Аминокислоты взаимодействуют друг с другом, образуя четко определенную трехмерную структуру, известную как нативное состояние белка . Эта структура определяется аминокислотной последовательностью или первичной структурой . [2]
Правильная трехмерная структура необходима для функционирования, хотя некоторые части функциональных белков могут оставаться развернутыми , что указывает на важность динамики белков . Неспособность свернуться в нативную структуру обычно приводит к образованию неактивных белков, но в некоторых случаях неправильно свернутые белки обладают модифицированной или токсичной функциональностью. Считается, что некоторые нейродегенеративные и другие заболевания возникают в результате накопления амилоидных фибрилл , образованных неправильно свернутыми белками, инфекционные разновидности которых известны как прионы . [4] Многие аллергии вызваны неправильным сворачиванием некоторых белков, поскольку иммунная система не вырабатывает антитела к определенным белковым структурам. [5]
Денатурация белков — это процесс перехода из свернутого состояния в развернутое . Это происходит при приготовлении пищи , ожогах , протеинопатиях и других ситуациях. Остаточная структура, присутствующая, если таковая имеется, в предположительно развернутом состоянии, может образовывать место инициации сворачивания и направлять последующие реакции сворачивания. [6]
Продолжительность процесса сворачивания резко варьируется в зависимости от интересующего белка. При изучении вне клетки самые медленные сворачивающиеся белки требуют многих минут или часов для сворачивания, в первую очередь из-за изомеризации пролина , и должны пройти ряд промежуточных состояний, таких как контрольные точки, прежде чем процесс завершится. [7] С другой стороны, очень маленькие однодоменные белки с длиной до ста аминокислот обычно сворачиваются за один этап. [8] Время в миллисекундах является нормой, а самые быстрые из известных реакций сворачивания белка завершаются в течение нескольких микросекунд. [9] Время сворачивания белка зависит от его размера, порядка контактов и топологии цепи . [10]
Понимание и моделирование процесса сворачивания белков было важной задачей вычислительной биологии с конца 1960-х годов.
Первичная структура белка , его линейная аминокислотная последовательность, определяет его нативную конформацию. [11] Конкретные аминокислотные остатки и их положение в полипептидной цепи являются определяющими факторами, благодаря которым части белка плотно складываются вместе и образуют его трехмерную конформацию. Аминокислотный состав не так важен, как последовательность. [12] Однако существенным фактом сворачивания остается то, что аминокислотная последовательность каждого белка содержит информацию, которая определяет как нативную структуру, так и путь достижения этого состояния. Это не означает, что почти идентичные аминокислотные последовательности всегда складываются одинаково. [13] Телосложение также различается в зависимости от факторов окружающей среды; подобные белки складываются по-разному в зависимости от того, где они находятся.


Формирование вторичной структуры — это первый шаг в процессе сворачивания белка, который он принимает, чтобы принять свою нативную структуру. Характерной чертой вторичной структуры являются структуры, известные как альфа-спирали и бета-листы , которые быстро сворачиваются, поскольку они стабилизированы внутримолекулярными водородными связями , как это было впервые охарактеризовано Лайнусом Полингом . Образование внутримолекулярных водородных связей вносит еще один важный вклад в стабильность белка. [14] α-спирали образуются за счет водородных связей основной цепи с образованием спиральной формы (см. рисунок справа). [12] β-складчатый лист представляет собой структуру, в которой основная цепь изгибается сама по себе, образуя водородные связи (как показано на рисунке слева). Водородные связи находятся между амидным водородом и карбонильным кислородом пептидной связи . Существуют антипараллельные β-складчатые листы и параллельные β-складчатые листы, где стабильность водородных связей выше в антипараллельном β-листе, поскольку он образует водородные связи с идеальным углом 180 градусов по сравнению с наклонными водородными связями, образованными параллельными листами. [12]
α-Спирали и β-листы обычно амфипатические, то есть имеют гидрофильную и гидрофобную части. Эта способность помогает формировать третичную структуру белка, в которой происходит сворачивание так, что гидрофильные стороны обращены к водной среде, окружающей белок, а гидрофобные стороны обращены к гидрофобному ядру белка. [15] Вторичная структура иерархически уступает место образованию третичной структуры. Как только третичная структура белка сформирована и стабилизирована за счет гидрофобных взаимодействий, также может возникнуть ковалентная связь в виде дисульфидных мостиков , образующихся между двумя остатками цистеина . Эти нековалентные и ковалентные контакты принимают специфическое топологическое расположение в нативной структуре белка. Третичная структура белка включает одну полипептидную цепь; однако дополнительные взаимодействия свернутых полипептидных цепей приводят к образованию четвертичной структуры. [16]
Третичная структура может уступить место образованию четвертичной структуры в некоторых белках, которая обычно включает «сборку» или «совместную сборку» уже свернутых субъединиц; другими словами, несколько полипептидных цепей могут взаимодействовать с образованием полностью функционального четвертичного белка. [12]

Складывание — это спонтанный процесс , который в основном направляется гидрофобными взаимодействиями, образованием внутримолекулярных водородных связей , силами Ван-дер-Ваальса и ему противостоит конформационная энтропия . [ 17] Процесс сворачивания часто начинается котрансляционно , так что N-конец белка начинает сворачиваться, в то время как С-концевая часть белка все еще синтезируется рибосомой ; однако молекула белка может самопроизвольно сворачиваться во время или после биосинтеза . [18] Хотя эти макромолекулы можно рассматривать как « складывающиеся », этот процесс также зависит от растворителя ( воды или липидного бислоя ), [19] концентрации солей , pH , температуры , возможного присутствия кофакторов и молекулярные шапероны .
Белки будут иметь ограничения на свою способность к складыванию из-за ограниченных углов изгиба или возможных конформаций. Эти допустимые углы сворачивания белка описываются с помощью двумерного графика, известного как график Рамачандрана , изображенного с углами допустимого вращения в фунтах на квадратный дюйм и фи. [20]

Чтобы реакция сворачивания белка была спонтанной, она должна быть термодинамически благоприятной внутри клетки. Поскольку известно, что сворачивание белка является спонтанной реакцией, то оно должно предполагать отрицательное значение свободной энергии Гиббса . Свободная энергия Гиббса при сворачивании белка напрямую связана с энтальпией и энтропией . [12] Чтобы возникла отрицательная дельта G и чтобы сворачивание белка стало термодинамически выгодным, тогда либо энтальпия, либо энтропия, либо оба условия должны быть благоприятными.
Минимизация количества гидрофобных боковых цепей, подвергающихся воздействию воды, является важной движущей силой процесса сворачивания. [21] Гидрофобный эффект — это явление, при котором гидрофобные цепи белка коллапсируют в ядро белка (вдали от гидрофильной среды). [12] В водной среде молекулы воды имеют тенденцию агрегироваться вокруг гидрофобных областей или боковых цепей белка, создавая водные оболочки упорядоченных молекул воды. [22] Упорядочение молекул воды вокруг гидрофобной области увеличивает порядок в системе и, следовательно, способствует отрицательному изменению энтропии (уменьшению энтропии в системе). Молекулы воды фиксируются в этих водных клетках, что приводит к гидрофобному коллапсу или сворачиванию внутрь гидрофобных групп. Гидрофобный коллапс возвращает энтропию в систему за счет разрушения водных клеток, что освобождает упорядоченные молекулы воды. [12] Множество гидрофобных групп, взаимодействующих внутри ядра глобулярного свернутого белка, в значительной степени способствует стабильности белка после сворачивания из-за значительного накопления сил Ван-дер-Ваальса (в частности, лондонских дисперсионных сил ). [12] Гидрофобный эффект существует как движущая сила в термодинамике только при наличии водной среды с амфифильной молекулой, содержащей большую гидрофобную область. [23] Прочность водородных связей зависит от их окружения; таким образом, Н-связи, заключенные в гидрофобное ядро, вносят больший вклад в стабильность нативного состояния, чем Н-связи, находящиеся в водной среде. [24]
В белках с глобулярными складками гидрофобные аминокислоты имеют тенденцию располагаться вдоль первичной последовательности, а не распределяться случайным образом или группироваться вместе. [25] [26] Однако белки, которые недавно родились de novo и имеют тенденцию быть внутренне неупорядоченными , [27] [28] демонстрируют противоположную картину кластеризации гидрофобных аминокислот вдоль первичной последовательности. [29]

Молекулярные шапероны представляют собой класс белков, которые способствуют правильному сворачиванию других белков in vivo . Шапероны существуют во всех клеточных компартментах и взаимодействуют с полипептидной цепью, обеспечивая формирование нативной трехмерной конформации белка; однако сами шапероны не включены в окончательную структуру белка, в котором они участвуют. [30] Шапероны могут способствовать сворачиванию, даже когда образующийся полипептид синтезируется рибосомой. [31] Молекулярные шапероны действуют путем связывания и стабилизируют нестабильную структуру белка на пути его сворачивания, но шапероны не содержат необходимой информации для определения правильной нативной структуры белка, которому они помогают; скорее, шапероны предотвращают неправильные складывающиеся конформации. [31] Таким образом, шапероны фактически не увеличивают скорость отдельных этапов, участвующих в пути сворачивания к нативной структуре; вместо этого они работают за счет уменьшения возможных нежелательных агрегаций полипептидной цепи, которые в противном случае могли бы замедлить поиск подходящего промежуточного продукта, и обеспечивают более эффективный путь для принятия полипептидной цепью правильных конформаций. [30] Шапероны не следует путать с белками -катализаторами сворачивания , которые катализируют химические реакции, ответственные за медленные этапы путей сворачивания. Примерами катализаторов сворачивания являются белково- дисульфид-изомеразы и пептидил-пролилизомеразы , которые могут участвовать в образовании дисульфидных связей или взаимном превращении между цис- и транс-стереоизомерами пептидной группы. [31] Показано, что шапероны играют решающую роль в процессе сворачивания белка in vivo , поскольку они обеспечивают белку помощь, необходимую для принятия правильного выравнивания и конформации достаточно эффективно, чтобы стать «биологически значимым». [32] Это означает, что полипептидная цепь теоретически может сворачиваться в свою нативную структуру без помощи шаперонов, как продемонстрировали эксперименты по сворачиванию белков, проведенные in vitro ; [32] однако этот процесс оказывается слишком неэффективным или слишком медленным для существования в биологических системах; следовательно, шапероны необходимы для сворачивания белков in vivo. Показано, что помимо своей роли в формировании нативной структуры, шапероны участвуют в различных ролях, таких как транспорт белков, деградация, и даже позволяют денатурированным белкам , подвергшимся воздействию определенных внешних денатурирующих факторов, возможность повторно свернуться в свои правильные нативные структуры. [33]
Полностью денатурированный белок лишен как третичной, так и вторичной структуры и существует в виде так называемой случайной спирали . При определенных условиях некоторые белки могут повторно сворачиваться; однако во многих случаях денатурация необратима. [34] Клетки иногда защищают свои белки от денатурирующего воздействия тепла с помощью ферментов , известных как белки теплового шока (разновидность шаперонов), которые помогают другим белкам как сворачиваться, так и оставаться в свернутом состоянии. Белки теплового шока были обнаружены у всех исследованных видов, от бактерий до человека, что позволяет предположить, что они развились очень рано и выполняют важную функцию. Некоторые белки вообще никогда не сворачиваются в клетках, кроме как с помощью шаперонов, которые либо изолируют отдельные белки так, что их сворачивание не прерывается взаимодействиями с другими белками, либо помогают развернуть неправильно свернутые белки, позволяя им повторно свернуться в правильную нативную структуру. [35] Эта функция имеет решающее значение для предотвращения риска осаждения нерастворимых аморфных агрегатов. Внешние факторы, участвующие в денатурации белка или нарушении нативного состояния, включают температуру, внешние поля (электрические, магнитные), [36] скученность молекул, [37] и даже ограничение пространства (т.е. ограничение), которые могут иметь большое влияние. о сворачивании белков. [38] Высокие концентрации растворенных веществ , экстремальные значения pH , механические силы и присутствие химических денатурантов также могут способствовать денатурации белка. Эти отдельные факторы классифицируются как стрессы. Показано, что шапероны существуют в возрастающих концентрациях во время клеточного стресса и помогают правильному сворачиванию новых, а также денатурированных или неправильно свернутых белков. [30]
При некоторых условиях белки не сворачиваются в свои биохимически функциональные формы. Температуры выше или ниже диапазона, в котором обычно живут клетки, заставят термически нестабильные белки развернуться или денатурировать (именно поэтому кипячение делает яичный белок непрозрачным). Однако термическая стабильность белков далека от постоянной; например, были обнаружены гипертермофильные бактерии , которые растут при температурах до 122 °C, [39] что, конечно, требует, чтобы их полный набор жизненно важных белков и белковых сборок был стабильным при этой температуре или выше.
Бактерия E. coli является хозяином бактериофага Т4 , а кодируемый фагом белок gp31 ( P17313 ), по-видимому, структурно и функционально гомологичен белку- шаперону E. coli GroES и способен замещать его при сборке вирусных частиц бактериофага Т4 во время инфекционное заболевание. [40] Как и GroES, gp31 образует стабильный комплекс с шаперонином GroEL , который абсолютно необходим для сворачивания и сборки in vivo основного капсидного белка gp23 бактериофага Т4. [40]
Некоторые белки имеют несколько нативных структур и меняют свою структуру в зависимости от некоторых внешних факторов. Например, белок KaiB переключается в течение дня , действуя как часы для цианобактерий. Было подсчитано, что около 0,5–4% белков PDB ( банка белковых данных ) меняют складку. [41]
Белок считается неправильно свернутым , если он не может достичь своего нормального нативного состояния. Это может быть связано с мутациями аминокислотной последовательности или нарушением нормального процесса сворачивания внешними факторами. [42] Неправильно свернутый белок обычно содержит β-листы , которые организованы в надмолекулярную структуру, известную как перекрестная β-структура. Эти богатые β-листами сборки очень стабильны, очень нерастворимы и, как правило, устойчивы к протеолизу. [43] Структурная стабильность этих фибриллярных сборок обусловлена обширными взаимодействиями между мономерами белка, образованными водородными связями основной цепи между их β-нитями. [43] Неправильное сворачивание белков может спровоцировать дальнейшее неправильное сворачивание и накопление других белков в агрегаты или олигомеры. Повышенный уровень агрегированных белков в клетке приводит к образованию амилоидных структур, которые могут вызывать дегенеративные нарушения и гибель клеток. [42] Амилоиды представляют собой фибриллярные структуры, которые содержат межмолекулярные водородные связи, которые очень нерастворимы и состоят из преобразованных белковых агрегатов. [42] Следовательно, протеасомный путь может оказаться недостаточно эффективным для разрушения неправильно свернутых белков перед агрегацией. Неправильно свернутые белки могут взаимодействовать друг с другом, образовывать структурированные агрегаты и приобретать токсичность за счет межмолекулярных взаимодействий. [42]
Агрегированные белки связаны с прионными заболеваниями, такими как болезнь Крейтцфельдта-Якоба , губчатая энцефалопатия крупного рогатого скота (коровье бешенство), амилоидные заболевания, такие как болезнь Альцгеймера и семейная амилоидная кардиомиопатия или полинейропатия , [44] , а также заболевания внутриклеточной агрегации, такие как как болезнь Гентингтона и Паркинсона . [4] [45] Эти возрастные дегенеративные заболевания связаны с агрегацией неправильно свернутых белков в нерастворимые внеклеточные агрегаты и/или внутриклеточные включения, включая перекрестные β- амилоидные фибриллы . Не совсем ясно, являются ли агрегаты причиной или просто отражением потери гомеостаза белка, баланса между синтезом, сворачиванием, агрегацией и оборотом белка. Недавно Европейское агентство по лекарственным средствам одобрило использование Тафамидиса или Виндакеля (кинетического стабилизатора тетрамерного транстиретина) для лечения заболеваний, связанных с транстиретиновым амилоидом. Это позволяет предположить, что процесс образования амилоидных фибрилл (а не сами фибриллы) вызывает дегенерацию постмитотической ткани при амилоидных заболеваниях человека. [46] Неправильное сворачивание и чрезмерная деградация вместо сворачивания и функции приводят к ряду протеопатий , таких как антитрипсин -ассоциированная эмфизема , муковисцидоз и лизосомальные болезни накопления , где потеря функции является причиной расстройства. Хотя для коррекции последних нарушений исторически использовалась белково-заместительная терапия, новый подход заключается в использовании фармацевтических шаперонов для сворачивания мутировавших белков и придания им функциональности.
Хотя выводы о сворачивании белков можно сделать с помощью исследований мутаций , обычно экспериментальные методы изучения сворачивания белков основаны на постепенном разворачивании или сворачивании белков и наблюдении конформационных изменений с использованием стандартных некристаллографических методов.

Рентгеновская кристаллография — один из наиболее эффективных и важных методов расшифровки трехмерной конфигурации свернутого белка. [47] Чтобы иметь возможность проводить рентгеновскую кристаллографию, исследуемый белок должен находиться внутри кристаллической решетки. Чтобы поместить белок в кристаллическую решетку, необходимо иметь подходящий растворитель для кристаллизации, получить чистый белок при перенасыщенном уровне в растворе и осадить кристаллы в растворе. [48] После кристаллизации белка рентгеновские лучи могут концентрироваться через кристаллическую решетку, которая будет преломлять лучи или рассылать их наружу в различных направлениях. Эти выходящие лучи коррелируют с конкретной трехмерной конфигурацией белка, заключенного внутри. Рентгеновские лучи специфически взаимодействуют с электронными облаками, окружающими отдельные атомы внутри кристаллической решетки белка, и создают заметную дифракционную картину. [15] Только связав облака электронной плотности с амплитудой рентгеновских лучей, можно прочитать эту картину и привести к предположениям о фазах или фазовых углах, которые усложняют этот метод. [49] Без связи, установленной с помощью математической основы, известной как преобразование Фурье , « фазовая проблема » сделала бы предсказание дифракционных картин очень трудным. [15] Новые методы, такие как множественное изоморфное замещение, используют присутствие иона тяжелого металла для дифракции рентгеновских лучей более предсказуемым образом, уменьшая количество задействованных переменных и решая фазовую проблему. [47]
Флуоресцентная спектроскопия — высокочувствительный метод изучения состояния сворачивания белков. Три аминокислоты: фенилаланин (Phe), тирозин (Tyr) и триптофан (Trp) обладают собственными флуоресцентными свойствами, но экспериментально используются только Tyr и Trp, поскольку их квантовые выходы достаточно высоки, чтобы давать хорошие сигналы флуоресценции. И Trp, и Tyr возбуждаются длиной волны 280 нм, тогда как только Trp возбуждается длиной волны 295 нм. Из-за своего ароматического характера остатки Trp и Tyr часто обнаруживаются полностью или частично скрытыми в гидрофобном ядре белков, на границе раздела двух белковых доменов или на границе раздела субъединиц олигомерных белков. В этой аполярной среде они имеют высокие квантовые выходы и, следовательно, высокую интенсивность флуоресценции. При разрушении третичной или четвертичной структуры белка эти боковые цепи становятся более подверженными воздействию гидрофильного окружения растворителя, и их квантовый выход снижается, что приводит к низкой интенсивности флуоресценции. Для остатков Trp длина волны максимальной флуоресценции также зависит от их окружения.
Флуоресцентная спектроскопия может использоваться для характеристики равновесного разворачивания белков путем измерения изменения интенсивности флуоресцентного излучения или длины волны максимального излучения в зависимости от денатурирующего значения. [50] [51] Денатурирующим агентом может быть химическая молекула (мочевина, гидрохлорид гуанидиния), температура, pH, давление и т. д. Равновесие между различными, но дискретными состояниями белка, то есть нативным состоянием, промежуточными состояниями, развернутым состоянием, зависит от денатурирующая ценность; следовательно, глобальный сигнал флуоресценции их равновесной смеси также зависит от этой величины. Таким образом, можно получить профиль, связывающий глобальный сигнал белка со значением денатуранта. Профиль равновесного разворачивания может позволить обнаружить и идентифицировать промежуточные соединения разворачивания. [52] [53] Общие уравнения были разработаны Хьюгом Бедуэлем для получения термодинамических параметров, которые характеризуют равновесие разворачивания гомомерных или гетеромерных белков, вплоть до тримеров и потенциально тетрамеров, из таких профилей. [50] Флуоресцентную спектроскопию можно комбинировать с устройствами быстрого перемешивания, такими как остановленный поток , для измерения кинетики сворачивания белка, [54] создания шевронной диаграммы и проведения анализа значений Фи .
Круговой дихроизм — один из наиболее общих и основных инструментов для изучения сворачивания белков. Спектроскопия кругового дихроизма измеряет поглощение света с круговой поляризацией . В белках такие структуры, как альфа-спирали и бета-листы , являются хиральными и, таким образом, поглощают такой свет. Поглощение этого света действует как маркер степени свернутости белкового ансамбля. Этот метод использовался для измерения равновесного разворачивания белка путем измерения изменения этого поглощения в зависимости от концентрации денатуранта или температуры . Денатурирующий расплав измеряет свободную энергию разворачивания, а также значение m белка или денатурирующую зависимость. Температура плавления измеряет температуру денатурации (Tm) белка. [50] Что касается флуоресцентной спектроскопии, спектроскопию кругового дихроизма можно комбинировать с устройствами быстрого перемешивания, такими как останавливаемый поток , для измерения кинетики сворачивания белка и создания шевронных графиков .
Более поздние разработки методов колебательного кругового дихроизма (VCD) для белков, в настоящее время использующие инструменты преобразования Фурье (FT), предоставляют мощные средства для определения конформаций белка в растворе даже для очень больших белковых молекул. Такие исследования белков с помощью VCD можно сочетать с данными дифракции рентгеновских лучей для кристаллов белков, данными FT-IR для растворов белков в тяжелой воде (D 2 O) или квантовыми вычислениями .
Ядерный магнитный резонанс белков (ЯМР) позволяет собирать структурные данные белков, индуцируя магнитное поле через образцы концентрированного белка. В ЯМР, в зависимости от химической среды, определенные ядра поглощают определенные радиочастоты. [55] [56] Поскольку структурные изменения белка происходят во временном масштабе от нс до мс, ЯМР особенно приспособлен для изучения промежуточных структур во временных масштабах от пс до с. [57] Некоторые из основных методов изучения структуры белков и структурных изменений несворачивающихся белков включают COSY , TOCSY , HSQC , временную релаксацию (T1 и T2) и NOE . [55] NOE особенно полезен, поскольку можно наблюдать перенос намагниченности между пространственно близкими водородами. [55] Различные эксперименты ЯМР имеют разную степень чувствительности временной шкалы, которая подходит для различных структурных изменений белка. NOE может улавливать колебания связей или вращения боковой цепи, однако NOE слишком чувствителен, чтобы улавливать сворачивание белка, поскольку оно происходит в более длительных временных масштабах. [57]

Поскольку сворачивание белка происходит примерно за 50–3000 с -1 , релаксационная дисперсия CPMG и перенос насыщения химическим обменом стали одними из основных методов ЯМР-анализа сворачивания. [56] Кроме того, оба метода используются для выявления возбужденных промежуточных состояний в ландшафте сворачивания белков. [58] Для этого дисперсия релаксации CPMG использует явление спинового эха . Этот метод подвергает целевые ядра воздействию 90 импульсов, за которыми следует один или несколько 180 импульсов. [59] Когда ядра перефокусируются, широкое распределение указывает на то, что ядра-мишени находятся в промежуточном возбужденном состоянии. Анализируя графики дисперсии релаксации, можно получить информацию о термодинамике и кинетике между возбужденным и основным. [59] [58] Передача насыщения измеряет изменения сигнала от основного состояния по мере возмущения возбужденных состояний. Он использует слабое радиочастотное излучение для насыщения возбужденного состояния определенного ядра, которое переводит его насыщение в основное состояние. [56] Этот сигнал усиливается за счет уменьшения намагниченности (и сигнала) основного состояния. [56] [58]
Основными ограничениями ЯМР является то, что его разрешение снижается с белками размером более 25 кДа и не так детально, как рентгеновская кристаллография . [56] Кроме того, ЯМР-анализ белков довольно сложен и может предложить несколько решений на основе одного и того же ЯМР-спектра. [55]
В исследовании, посвященном сворачиванию бокового амиотрофического склероза с участием белка SOD1 , возбужденные промежуточные соединения изучались с помощью релаксационной дисперсии и переноса насыщения. [60] SOD1 ранее был связан со многими вызывающими заболевания мутантами, которые, как предполагалось, участвуют в агрегации белков, однако механизм все еще был неизвестен. С помощью экспериментов по релаксационной дисперсии и переносу насыщения было обнаружено, что многие возбужденные промежуточные состояния неправильно сворачиваются у мутантов SOD1. [60]
Интерферометрия двойной поляризации — это поверхностный метод измерения оптических свойств молекулярных слоев. При использовании для характеристики сворачивания белка он измеряет конформацию путем определения общего размера монослоя белка и его плотности в реальном времени с субангстремным разрешением [61] , хотя измерение кинетики сворачивания белка в реальном времени ограничено. к процессам, протекающим медленнее ~10 Гц. Подобно круговому дихроизму , стимулом для сворачивания может быть денатурирующая добавка или температура .
В последние годы изучение сворачивания белков значительно продвинулось благодаря разработке быстрых методов с временным разрешением. Экспериментаторы быстро вызывают сворачивание образца развернутого белка и наблюдают результирующую динамику . Используемые быстрые методы включают рассеяние нейтронов , [62] сверхбыстрое смешивание растворов, фотохимические методы и спектроскопию лазерного скачка температуры . Среди многих ученых, внесших свой вклад в разработку этих методов, — Джереми Кук, Генрих Родер, Гарри Грей , Мартин Грубеле , Брайан Дайер, Уильям Итон, Шина Рэдфорд , Крис Добсон , Алан Фершт , Бенгт Нолтинг и Ларс Конерманн.
Протеолиз обычно используется для исследования фракции, развернутой в широком диапазоне условий растворения (например , быстрый параллельный протеолиз (FASTpp)) . [63] [64]
Методы одиночных молекул, такие как оптический пинцет и АСМ, использовались для понимания механизмов сворачивания изолированных белков, а также белков с шаперонами. [65] Оптические пинцеты использовались для растягивания отдельных молекул белка с их C- и N-концев и их разворачивания, чтобы можно было изучить последующую рефолдинг. [66] Этот метод позволяет измерять скорость сворачивания на уровне одиночных молекул; например, оптический пинцет недавно был применен для изучения сворачивания и разворачивания белков, участвующих в свертывании крови. Фактор фон Виллебранда (vWF) представляет собой белок, играющий важную роль в процессе образования тромбов. С помощью измерения оптическим пинцетом одной молекулы было обнаружено, что связанный с кальцием фактор Виллебранда действует как датчик силы сдвига в крови. Сдвиговая сила приводит к разворачиванию домена А2 фактора Виллебранда, скорость рефолдинга которого резко увеличивается в присутствии кальция. [67] Недавно было также показано, что простой домен src SH3 под действием силы получает доступ к множеству путей разворачивания. [68]
Биотиновая окраска позволяет получать клеточные снимки (не)свернутых белков в зависимости от состояния. «Картина» биотина демонстрирует предвзятость к предсказанным белкам с внутренней неупорядоченностью . [69]
Компьютерные исследования сворачивания белков включают три основных аспекта, связанных с предсказанием стабильности, кинетики и структуры белка. В обзоре 2013 года обобщены доступные вычислительные методы сворачивания белков. [70]
В 1969 году Сайрус Левинталь заметил, что из-за очень большого числа степеней свободы в развернутой полипептидной цепи молекула имеет астрономическое количество возможных конформаций. В одной из его статей была сделана оценка в 3 300 или 10 143 . [71] Парадокс Левинталя — это мысленный эксперимент, основанный на наблюдении, что если бы белок был свернут путем последовательного отбора всех возможных конформаций, это заняло бы астрономическое количество времени, даже если бы конформации отбирались с высокой скоростью ( в наносекундном или пикосекундном масштабе). [72] Основываясь на наблюдении, что белки сворачиваются гораздо быстрее, чем это, Левинталь затем предположил, что случайный конформационный поиск не происходит, и, следовательно, белок должен сворачиваться через ряд метастабильных промежуточных состояний .
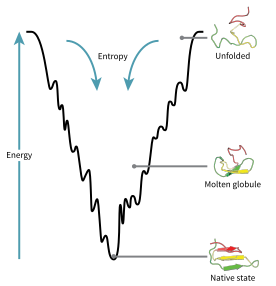
Конфигурационное пространство белка во время сворачивания можно представить как энергетический ландшафт . По мнению Джозефа Брингельсона и Питера Волайнса , белки следуют принципу минимального разочарования , что означает, что естественно эволюционировавшие белки оптимизировали свои энергетические ландшафты сворачивания [73] и что природа выбрала аминокислотные последовательности так, чтобы свернутое состояние белка было достаточно стабильным. . Кроме того, приобретение свернутого состояния должно было стать достаточно быстрым процессом. Хотя природа и снизила уровень разочарования в белках, некоторая его степень сохраняется до сих пор, что можно наблюдать по наличию локальных минимумов в энергетическом ландшафте белков.
Следствием этих эволюционно выбранных последовательностей является то, что обычно считается, что белки имеют глобально «направленные энергетические ландшафты» (термин, придуманный Хосе Онучиком ) [74] , которые в основном направлены к нативному состоянию. Этот ландшафт « складной воронки » позволяет белку сворачиваться в нативное состояние посредством любого из большого количества путей и промежуточных продуктов, а не ограничиваться одним механизмом. Теория подтверждается как компьютерным моделированием модельных белков , так и экспериментальными исследованиями [73] , и она использовалась для улучшения методов прогнозирования и проектирования структуры белков . [73] Описание сворачивания белка с помощью выравнивающего ландшафта свободной энергии также согласуется со 2-м законом термодинамики. [75] С физической точки зрения представление о ландшафтах с точки зрения визуализируемого потенциала или поверхностей полной энергии просто с максимумами, седловыми точками, минимумами и воронками, как и о географических ландшафтах, возможно, немного вводит в заблуждение. Соответствующее описание на самом деле представляет собой многомерное фазовое пространство, в котором многообразия могут принимать множество более сложных топологических форм. [76]
Развернутая полипептидная цепь начинается в верхней части воронки, где она может принять наибольшее количество развернутых вариаций и находится в наивысшем энергетическом состоянии. Подобные энергетические ландшафты указывают на то, что существует большое количество начальных возможностей, но возможно только одно исходное состояние; однако он не выявляет многочисленные возможные пути сворачивания. Различные молекулы одного и того же белка могут следовать незначительно отличающимся путям сворачивания в поисках других промежуточных продуктов с более низкой энергией, пока достигается та же самая нативная структура. [77] Различные пути могут иметь разную частоту использования в зависимости от термодинамической благоприятности каждого пути. Это означает, что если один путь окажется термодинамически более выгодным, чем другой, он, вероятно, будет использоваться чаще для поиска нативной структуры. [77] Когда белок начинает сворачиваться и принимать различные конформации, он всегда ищет более термодинамически выгодную структуру, чем раньше, и, таким образом, продолжает двигаться по энергетической воронке. Образование вторичных структур является убедительным признаком повышенной стабильности белка, и только одна комбинация вторичных структур, предполагаемая основной цепью полипептида, будет иметь наименьшую энергию и, следовательно, присутствовать в нативном состоянии белка. [77] Среди первых структур, образующихся после того, как полипептид начинает сворачиваться, являются альфа-спирали и бета-повороты, где альфа-спирали могут образовываться всего за 100 наносекунд, а бета-повороты - за 1 микросекунду. [30]
В ландшафте энергетической воронки существует седловая точка, где находится переходное состояние для конкретного белка. [30] Переходное состояние на диаграмме энергетической воронки — это конформация, которую должна принять каждая молекула этого белка, если белок желает, наконец, принять нативную структуру. Ни один белок не может принять нативную структуру, не пройдя сначала переходное состояние. [30] Переходное состояние можно назвать вариантом или преждевременной формой исходного состояния, а не просто еще одним промежуточным шагом. [78] Показано, что сворачивание переходного состояния определяет скорость, и хотя оно существует в более высокоэнергетическом состоянии, чем нативная складка, оно очень напоминает нативную структуру. В переходном состоянии существует ядро, вокруг которого белок может сворачиваться, образующееся в результате процесса, называемого «конденсацией нуклеации», когда структура начинает разрушаться на ядре. [78]

Методы вычислительного предсказания структуры белка de novo или ab initio могут использоваться для моделирования различных аспектов сворачивания белка. Молекулярная динамика (МД) использовалась при моделировании сворачивания и динамики белков in silico . [79] Первое моделирование складывания равновесия было выполнено с использованием модели неявного растворителя и зонтичной выборки . [80] Из-за вычислительных затрат моделирование ab initio MD с явной водой ограничено пептидами и очень маленькими белками. [81] [82] МД-моделирование более крупных белков по-прежнему ограничивается динамикой экспериментальной структуры или ее высокотемпературным разворачиванием. Длительные процессы сворачивания (более 1 миллисекунды), такие как сворачивание белков небольшого размера (около 50 остатков) или более, можно оценить с помощью крупнозернистых моделей . [83] [84] [85]
Несколько крупномасштабных вычислительных проектов, таких как Rosetta@home , [86] Folding@home [87] и Foldit , [88] нацелены на сворачивание белков.
Моделирование длительных непрерывных траекторий было выполнено на Антоне , суперкомпьютере с массовым параллелизмом, спроектированном и построенном на основе специальных ASIC и межсоединений компанией DE Shaw Research . Самый длинный опубликованный результат моделирования, выполненного с использованием Anton, - это моделирование NTL9 за 2,936 миллисекунды при 355 К. [89] В настоящее время моделирование позволяет разворачивать и рефолдировать небольшие (<150 аминокислотных остатков) белки и предсказывать, как мутации влияют на кинетику сворачивания и стабильность. [90]
В 2020 году команда исследователей, использовавшая AlphaFold , программу искусственного интеллекта (ИИ), разработанную DeepMind, заняла первое место в рейтинге CASP . [91] Команда достигла гораздо более высокого уровня точности, чем любая другая группа. [92] Он набрал более 90 баллов примерно для двух третей белков в глобальном дистанционном тесте CASP (GDT) , тесте, который измеряет степень, в которой предсказанная вычислительной программой структура похожа на структуру, определенную в лабораторном эксперименте, причем 100 — это полное совпадение в пределах расстояния, используемого для расчета GDT. [93]
Результаты предсказания структуры белка AlphaFold в CASP были описаны как «трансформационные» и «поразительные». [94] [95] Некоторые исследователи отметили, что точность недостаточно высока для трети его предсказаний и что она не раскрывает механизм или правила сворачивания белка, чтобы проблему сворачивания белка можно было считать решенной. [96] Тем не менее, это считается значительным достижением в вычислительной биологии [93] и большим прогрессом в решении великой задачи биологии, которая существует уже несколько десятилетий. [94]