
В химии сераорганических соединений органосульфаты представляют собой класс органических соединений , имеющих общую функциональную группу со структурой R−O−SO−3. Ядро SO 4 представляет собой сульфатную группу, а группа R представляет собой любой органический остаток . Все органосульфаты формально являются эфирами, полученными из спиртов и серной кислоты ( H 2 SO 4 ), хотя многие из них не готовятся таким образом. Многие сульфатные эфиры используются в моющих средствах , а некоторые являются полезными реагентами . Алкилсульфаты состоят из гидрофобной углеводородной цепи, полярной сульфатной группы (содержащей анион) и либо катиона, либо амина для нейтрализации сульфатной группы. Примеры включают: лаурилсульфат натрия (также известный как натриевая соль монододецилового эфира серной кислоты) и родственные соли калия и аммония.
Алкилсульфаты обычно используются в качестве анионных поверхностно-активных веществ в жидких мылах и моющих средствах, используемых для чистки шерсти, в качестве очистителей поверхностей и в качестве активных ингредиентов в моющих средствах для стирки, шампунях и кондиционерах. Их также можно найти в бытовых продуктах, таких как зубная паста, антациды, косметика и продукты питания. Обычно они встречаются в потребительских товарах в концентрациях от 3 до 20%. В 2003 году в США было использовано около 118 000 т/год алкилсульфатов [1].
Распространенным примером является лаурилсульфат натрия с формулой CH 3 (CH 2 ) 11 OSO 3 Na. Также в потребительских товарах распространены сульфатные эфиры этоксилированных жирных спиртов, такие как полученные из лаурилового спирта . Примером является лауретсульфат натрия , ингредиент некоторых косметических средств . [2]
Алкилсульфат может быть получен из спиртов, которые в свою очередь получаются путем гидрогенизации животных или растительных масел и жиров или с использованием процесса Циглера или через оксосинтез . Если производится из олеохимического сырья или процесса Циглера, углеводородная цепь спирта будет линейной. Если получен с использованием оксопроцесса, обычно будет проявляться низкий уровень разветвления с метильной или этильной группой в положении C-2, содержащей четное и нечетное количество алкильных цепей. [3] Эти спирты реагируют с хлорсерной кислотой :
Альтернативно, спирты можно преобразовать в полусульфатные эфиры с использованием триоксида серы : [4]
Специализированные органосульфаты можно получить путем персульфатного окисления фенолов по Элбсу и окисления анилинов по Бойланду-Симсу .

Менее распространенное семейство органосульфатов имеет формулу RO-SO 2 -OR'. Они готовятся из серной кислоты и спирта. Основными примерами являются диэтилсульфат и диметилсульфат , бесцветные жидкости, которые используются в качестве реагентов в органическом синтезе . Эти соединения являются потенциально опасными алкилирующими агентами . Диалкилсульфаты не встречаются в природе. [5]
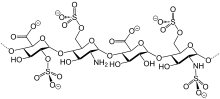
В природе существует несколько классов сульфатных эфиров. Особенно распространены производные сахара, такие как кератансульфат , хондроитинсульфат и антикоагулянт гепарин . [6] Посттрансляционные модификации некоторых белков влекут за собой сульфатирование, часто в фенольной группе остатков тирозина . [7] Стероидный сульфат — это эстрадиолсульфат , латентный предшественник гормона эстрогена.
Основная часть серы в почве находится в форме сульфатных эфиров. [8]
Сульфат является инертным анионом, поэтому природа активирует его путем образования эфирного производного аденозин-5'-фосфосульфата (APS) и 3'-фосфоаденозин-5'-фосфосульфата (PAPS). Многие организмы используют эти реакции для метаболических целей или для биосинтеза соединений серы, необходимых для жизни. [9] Образование и гидролиз природных сульфатных эфиров катализируются сульфатазами (они же сульфогидролазами). [5]
Поскольку они широко используются в коммерческих продуктах, аспекты безопасности органосульфатов тщательно изучаются. [10]
Алкилсульфаты при попадании внутрь хорошо усваиваются и метаболизируются в сульфат C 3 , C 4 или C 5 и дополнительный метаболит. Самым сильным раздражителем из алкилсульфатов является лаурилсульфат натрия, порог раздражения которого составляет 20%. Поверхностно-активные вещества в потребительских товарах обычно смешаны, что снижает вероятность раздражения. Согласно OECD TG 406, в исследованиях на животных алкилсульфаты не оказались сенсибилизаторами кожи. [10] [11]
Лабораторные исследования не выявили генотоксичности , мутагенности или канцерогенности алкилсульфатов . Долгосрочных репродуктивных эффектов не обнаружено. [12]
Первичная утилизация алкилсульфата из использованных коммерческих продуктов — сточные воды. Концентрация алкилсульфатов в сточных водах с очистных сооружений сточных вод (ОССВ) была измерена на уровне 10 микрограммов на литр (5,8 × 10−9 унций /куб. дюйм) и ниже. Алкилсульфаты легко биоразлагаются, даже начиная, вероятно, до попадания на очистные сооружения. Попав на очистные сооружения, они быстро удаляются путем биодеградации . Было обнаружено, что беспозвоночные являются наиболее чувствительной трофической группой к алкилсульфатам. Было обнаружено, что лаурилсульфат натрия, испытанный на Uronema parduczi , простейшем, имеет наименьшее значение эффекта, при этом 20-часовая EC5 составляет 0,75 миллиграмма на литр (2,7 × 10−8 фунтов/куб. дюйм). Тесты на хроническое воздействие C12 – C18 на беспозвоночных Ceriodaphnia dubia показали, что наибольшую токсичность имеет C14 ( NOEC составила 0,045 мг/л).
С точки зрения термической стабильности алкилсульфаты разлагаются задолго до достижения точки кипения из-за низкого давления паров (для C 8-18 от 10-11 до 10-15 гПа). Сорбция почвой пропорциональна длине углеродной цепи, при этом длина 14 и более имеет самую высокую скорость сорбции. Было обнаружено, что концентрации почвы варьируются от 0,0035 до 0,21 миллиграмма на килограмм (от 5,6 × 10 −8 до 3,4 × 10 −6 унций/фунт) сухой массы.