
Грибовидные тела или corpora pedunculata представляют собой пару структур в мозге членистоногих , включая насекомых и ракообразных , [ 2] и некоторых кольчатых червей (в частности, кольчатого червя Platynereis dumerilii ). [3] Известно, что они играют роль в обонятельном обучении и памяти . У большинства насекомых грибовидные тела и боковой рог являются двумя высшими областями мозга, которые получают обонятельную информацию от антеннальной доли через проекционные нейроны. [4] Они были впервые идентифицированы и описаны французским биологом Феликсом Дюжарденом в 1850 году. [5] [6]
Грибовидные тела обычно описываются как нейропили , т. е. как плотные сети нейронных отростков ( дендритов и аксонов ) и глии . Они получили свое название от своей примерно полусферической чашечки , выступа, который соединен с остальной частью мозга центральным нервным трактом или ножкой .
Большая часть наших современных знаний о грибовидных телах получена в результате изучения нескольких видов насекомых, в частности таракана Periplaneta americana , медоносной пчелы Apis mellifera , [7] саранчи и плодовой мухи Drosophila melanogaster . Исследования грибовидных тел плодовых мух были особенно важны для понимания генетической основы функционирования грибовидных тел, поскольку их геном был секвенирован, и существует огромное количество инструментов для управления экспрессией их генов.
В мозге насекомых ножки грибовидных тел простираются через средний мозг . Они в основном состоят из длинных, плотно упакованных нервных волокон клеток Кеньона , внутренних нейронов грибовидных тел. Эти клетки были обнаружены в грибовидных телах всех исследованных видов, хотя их количество варьируется. Например, у плодовых мушек их около 2500, тогда как у тараканов их около 200 000.
Здесь можно увидеть вскрытие мозга саранчи для обнажения центрального мозга и проведения электрофизиологических записей. [8]
Исторически считалось, что грибовидные тела есть только у насекомых, поскольку их нет у крабов и омаров. Однако их открытие у креветок-богомолов в 2017 году привело к более позднему заключению [2] , что грибовидное тело является предковым состоянием всех членистоногих , и что эта особенность была впоследствии утрачена у крабов и омаров. [2]
Грибовидные тела наиболее известны своей ролью в обонятельном ассоциативном обучении. Эти обонятельные сигналы принимаются от дофаминергических , октопаминергических , холинергических , серотонинергических и ГАМКергических нейронов за пределами МБ. [9] Они являются самыми крупными у перепончатокрылых , которые, как известно, имеют особенно сложный контроль над обонятельным поведением. Однако, поскольку грибовидные тела также встречаются у аносмических примитивных насекомых, их роль, вероятно, выходит за рамки обонятельной обработки. Анатомические исследования предполагают роль в обработке зрительного и механосенсорного ввода у некоторых видов. [10] В частности, у перепончатокрылых субрегионы нейропиля грибовидного тела специализированы для получения обонятельного, зрительного или обоих типов сенсорного ввода. [11] У перепончатокрылых обонятельный ввод расположен слоями в чашечке. У муравьев можно выделить несколько слоев, соответствующих различным кластерам клубочков в антеннальных долях , возможно, для обработки различных классов запахов. [4] [12] Существуют две основные группы проекционных нейронов, разделяющих антеннальную долю на две основные области, переднюю и заднюю. Группы проекционных нейронов разделены, иннервируя гломерулярные группы по отдельности и посылая аксоны по отдельным маршрутам, либо через медиально-антенно протоцеребральный тракт (m-APT), либо через латерально-антенно протоцеребральный тракт (l-APT), и соединяясь с двумя слоями в чашечке грибовидных тел. В этих слоях организация двух эфферентных областей антеннальной доли представлена топографически, устанавливая грубую одотопическую карту антеннальной доли в области губы грибовидных тел. [4] [12]
Известно, что грибовидные тела участвуют в обучении и памяти , особенно для обоняния , и, таким образом, являются предметом текущих интенсивных исследований. У более крупных насекомых исследования показывают, что грибовидные тела имеют другие функции обучения и памяти, такие как ассоциативная память , сенсорная фильтрация, двигательный контроль и память места. Исследования предполагают, что грибовидные тела, как правило, действуют как своего рода детектор совпадений , интегрируя мультимодальные входы [ 4] и создавая новые ассоциации, таким образом, предполагая их роль в обучении и памяти. [13] Недавние исследования также показывают доказательства участия грибовидного тела во врожденном обонятельном поведении посредством взаимодействия с боковым рогом, [14] [15], возможно, используя частично стереотипные сенсорные реакции выходных нейронов грибовидного тела (MBON) у разных людей. [16] Хотя связи между проекционными нейронами и клетками Кеньона являются случайными (т.е. не стереотипными у разных людей), [17] стереотипность в ответах MBON становится возможной благодаря плотной конвергенции многих клеток Кеньона на нескольких MBON наряду с другими свойствами сети. [16]
Информация о запахах может быть закодирована в грибном теле с помощью идентификации реагирующих нейронов, а также времени их спайков. [18] Эксперименты на саранче показали, что активность клеток Кеньона синхронизирована с нейронными колебаниями частотой 20 Гц , и они особенно чувствительны к спайкам проекционных нейронов в определенных фазах колебательного цикла. [19]
Нейроны, которые получают сигналы от серотонинергических и ГАМКергических нейронов за пределами МБ, вызывают бодрствование, а экспериментальная стимуляция этих серотонинергических восходящих нейронов вызывает сон. Целевые нейроны в МБ ингибируются серотонином , ГАМК и их комбинацией. С другой стороны, октопамин , по- видимому, не влияет на функцию сна МБ. [9]

Мы знаем, что структуры грибовидного тела важны для обонятельного обучения и памяти у дрозофилы , поскольку их абляция разрушает эту функцию. [21] Грибовидное тело также способно объединять информацию о внутреннем состоянии тела и обонятельный вход для определения врожденного поведения. [22] Точные роли конкретных нейронов, составляющих грибовидные тела, до сих пор неясны. Однако эти структуры широко изучаются, поскольку многое известно об их генетическом составе . Существует три конкретных класса нейронов, которые составляют доли грибовидного тела: нейроны α/β, α'/β' и γ, которые все имеют различную экспрессию генов. Тема текущих исследований - какие из этих подструктур в грибовидном теле участвуют в каждой фазе и процессе обучения и памяти. [23] Грибовидные тела дрозофилы также часто используются для изучения обучения и памяти и подвергаются манипуляциям из-за их относительно дискретной природы. Обычно анализы обонятельного обучения состоят из подвергания мух воздействию двух запахов по отдельности; один из них сопряжен с электрическими импульсами ( условный стимул , или CS+), а второй — нет ( безусловный стимул , или US). После этого периода обучения мухи помещаются в Т-образный лабиринт с двумя запахами, размещенными по отдельности на каждом конце горизонтальных «Т»-рукавов. Подсчитывается процент мух, которые избегают CS+, причем высокий уровень избегания считается свидетельством обучения и памяти. [24]
Недавние исследования, объединяющие обусловливание запаха и клеточную визуализацию, выявили шесть следов памяти, которые совпадают с молекулярными изменениями в обонятельной системе Drosophila . Три из этих следов связаны с ранним формированием поведенческой памяти. Один такой след был визуализирован в антенной доле (AL) с помощью репортерных молекул синапто-pHluorin . Сразу после обусловливания дополнительный набор проекционных нейронов в наборе из восьми клубочков в AL становится синаптически активированным условным запахом и длится всего 7 минут. [25] Второй след обнаруживается по экспрессии GCaMP и, таким образом, по увеличению притока Ca 2+ в аксонах α'/β' нейронов грибовидного тела. [26] Это более длительный след, присутствующий в течение одного часа после обусловливания. Третий след памяти - это снижение активности переднепарного латерального нейрона, который действует как супрессор формирования памяти через один из своих ингибирующих ГАМКергических рецепторов. Снижение кальциевого ответа нейронов APL и последующее снижение высвобождения ГАМК в грибовидные тела сохранялось до 5 минут после обусловливания запахом. [27]
След промежуточной памяти зависит от экспрессии гена amn , расположенного в дорсальных парных медиальных нейронах. Увеличение притока кальция и синаптического высвобождения, которое иннервирует грибовидные тела, становится заметным примерно через 30 минут после сопряжения электрошока с запахом и сохраняется в течение как минимум часа. [28] Оба следа долговременной памяти, которые были картированы, зависят от активности и синтеза белка CREB и CaMKII и существуют только после интервального обусловливания. Первый след обнаруживается в нейронах α/β между 9 и 24 часами после обусловливания и характеризуется увеличением притока кальция в ответ на условный запах. [29] Второй след долговременной памяти формируется в γ-грибовидных телах и обнаруживается увеличением притока кальция между 18 и 24 часами после обусловливания [30]
Циклический аденозинмонофосфат (цАМФ или циклический АМФ) является вторичным посредником, который участвует в облегчении притока кальция в грибовидные нейроны Drosophila melanogaster . Повышение уровня цАМФ вызывает пресинаптическую пластичность у Drosophila. На уровень цАМФ влияют как нейротрансмиттеры , такие как дофамин и октопамин , так и сами запахи. Дофамин и октопамин выделяются интернейронами грибовидных тел , в то время как запахи напрямую активируют нейроны в обонятельном пути, вызывая приток кальция через потенциалзависимые кальциевые каналы . [31]
В классической парадигме обусловливания сопряжение нейронной деполяризации (через применение ацетилхолина для представления запаха или CS ) с последующим применением дофамина (для представления шока или US ) приводит к синергетическому увеличению цАМФ в долях грибовидного тела. [31] Эти результаты показывают, что доли грибовидного тела являются критическим местом интеграции CS/US посредством действия цАМФ. Этот синергетический эффект первоначально наблюдался у Aplysia , где сопряжение притока кальция с активацией сигнализации G-белка серотонином генерирует аналогичное синергетическое увеличение цАМФ. [32]
Кроме того, это синергическое увеличение цАМФ опосредовано и зависит от брюквенной аденилатциклазы (rut AC), которая чувствительна как к кальцию (что является результатом открытия потенциалзависимых кальциевых каналов запахами), так и к стимуляции G-белка (вызванной дофамином). [31] В то время как прямое спаривание нейронной деполяризации и дофамина (ацетилхолин, за которым следует дофамин) приводит к синергетическому увеличению цАМФ, прямое спаривание нейронной деполяризации и октопамина производит субаддитивный эффект на цАМФ. [31] Более конкретно, это означает, что это спаривание производит значительно меньше цАМФ, чем сумма каждого стимула по отдельности в долях. Таким образом, rut AC в нейронах грибовидного тела работает как детектор совпадений с дофамином и октопамином, функционирующими двунаправленно, чтобы влиять на уровни цАМФ. [31]
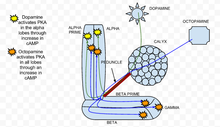
Было обнаружено, что протеинкиназа А (PKA) играет важную роль в обучении и памяти у Drosophila . [33] Когда кальций попадает в клетку и связывается с кальмодулином , он стимулирует аденилатциклазу (AC), которая кодируется геном брюквы ( rut ). [34] Эта активация AC увеличивает концентрацию цАМФ , который активирует PKA. [34] Когда применяется дофамин , аверсивный обонятельный стимулятор, он активирует PKA, особенно в вертикальных долях грибовидного тела. [34] Эта пространственная специфичность регулируется dunce ( dnc ) PDE, цАМФ-специфической фосфодиэстеразой . Если ген dunce отменен, как обнаружено у мутанта dnc , пространственная специфичность не сохраняется. Напротив, аппетитная стимуляция, созданная применением октопамина, увеличивает PKA во всех долях. [34] У мутанта rut , генотипа, в котором брюква отсутствует, реакции как на дофамин, так и на октопамин были значительно снижены и близки к экспериментальному шуму.
Ацетилхолин , который представляет собой условный стимул , приводит к сильному увеличению активации PKA по сравнению со стимуляцией только дофамином или октопамином. [34] Эта реакция отменяется у мутантов rut , что показывает, что PKA необходим для сенсорной интеграции. [34] Специфичность активации альфа-доли в присутствии дофамина сохраняется, когда дофамин находится в сочетании с ацетилхолином. [34] По сути, во время парадигмы кондиционирования, когда условный стимул сочетается с безусловным стимулом, PKA демонстрирует повышенную активацию. Это показывает, что PKA необходим для условного обучения у Drosophila melanogaster .
Стимул → выходные реакции являются продуктом пар возбуждения и торможения . Это та же самая схема организации, что и в мозге млекопитающих . Эти схемы могут, как и у млекопитающих, предшествовать действию. По состоянию на 2021 год [обновлять]это область, которая была недавно разъяснена Звакой и др. 2018, Дьюером и др. 2015 и Паффхаузеном и др. 2020. [7]