Конфокальная микроскопия , чаще всего конфокальная лазерная сканирующая микроскопия ( CLSM ) или лазерная сканирующая конфокальная микроскопия ( LSCM ), представляет собой оптический метод визуализации для повышения оптического разрешения и контрастности микроснимка посредством использования пространственного отверстия для блокировки не сфокусированного света при формировании изображения. [1] Захват нескольких двумерных изображений на разной глубине в образце позволяет реконструировать трехмерные структуры (процесс, известный как оптическое секционирование ) внутри объекта. Этот метод широко используется в научных и промышленных сообществах и типичными приложениями являются науки о жизни , проверка полупроводников и материаловедение .
Свет проходит через образец под обычным микроскопом настолько глубоко, насколько он может проникнуть в образец, в то время как конфокальный микроскоп фокусирует только меньший луч света на одном узком уровне глубины за раз. CLSM достигает контролируемой и строго ограниченной глубины резкости.


Принцип конфокальной визуализации был запатентован в 1957 году Марвином Мински [2] и направлен на преодоление некоторых ограничений традиционных широкопольных флуоресцентных микроскопов . [3] В обычном (т. е. широкопольном) флуоресцентном микроскопе весь образец равномерно освещается светом от источника света. Все части образца могут быть возбуждены одновременно, и результирующая флуоресценция обнаруживается фотодетектором микроскопа или камерой, включая большую несфокусированную фоновую часть. Напротив, конфокальный микроскоп использует точечное освещение (см. Функция рассеяния точки ) и точечное отверстие в оптически сопряженной плоскости перед детектором для устранения сигнала вне фокуса — название «конфокальный» происходит от этой конфигурации. Поскольку может быть обнаружен только свет, создаваемый флуоресценцией очень близко к фокальной плоскости , оптическое разрешение изображения , особенно в направлении глубины образца, намного лучше, чем у широкопольных микроскопов. Однако, поскольку большая часть света от флуоресценции образца блокируется в отверстии, это повышенное разрешение достигается за счет снижения интенсивности сигнала – поэтому часто требуются длительные экспозиции . Чтобы компенсировать это падение сигнала после отверстия , интенсивность света определяется чувствительным детектором, обычно фотоумножительной трубкой (ФЭУ) или лавинным фотодиодом , преобразующим световой сигнал в электрический. [4]
Поскольку в каждый момент времени освещается только одна точка образца, для получения 2D- или 3D-изображений требуется сканирование по регулярному растру (т. е. прямоугольному шаблону параллельных линий сканирования) в образце. Луч сканируется по образцу в горизонтальной плоскости с помощью одного или нескольких ( сервоуправляемых ) колеблющихся зеркал. Этот метод сканирования обычно имеет низкую задержку реакции , а скорость сканирования можно изменять. Более медленное сканирование обеспечивает лучшее соотношение сигнал/шум , что приводит к лучшему контрасту .
Достижимая толщина фокальной плоскости определяется в основном длиной волны используемого света, деленной на числовую апертуру объектива , а также оптическими свойствами образца. Возможность тонкого оптического среза делает эти типы микроскопов особенно хорошими для 3D-визуализации и поверхностного профилирования образцов.
Последовательные срезы составляют «z-стек», который может быть либо обработан для создания трехмерного изображения, либо объединен в двухмерный стек (преимущественно берется максимальная интенсивность пикселей, другие распространенные методы включают использование стандартного отклонения или суммирование пикселей). [1]
Конфокальная микроскопия обеспечивает возможность прямого, неинвазивного, последовательного оптического среза целых, толстых, живых образцов с минимальной подготовкой образца, а также незначительным улучшением латерального разрешения по сравнению с широкопольной микроскопией. [4] Биологические образцы часто обрабатываются флуоресцентными красителями , чтобы сделать выбранные объекты видимыми. Однако фактическая концентрация красителя может быть низкой, чтобы свести к минимуму нарушение биологических систем: некоторые приборы могут отслеживать отдельные флуоресцентные молекулы. Кроме того, трансгенные методы могут создавать организмы, которые производят свои собственные флуоресцентные химерные молекулы (например, слияние GFP, зеленого флуоресцентного белка с интересующим белком). Конфокальные микроскопы работают по принципу точечного возбуждения в образце (пятно, ограниченное дифракцией) и точечного обнаружения полученного флуоресцентного сигнала. Отверстие в детекторе обеспечивает физический барьер, который блокирует флуоресценцию вне фокуса. Регистрируется только фокусное или центральное пятно диска Эйри .
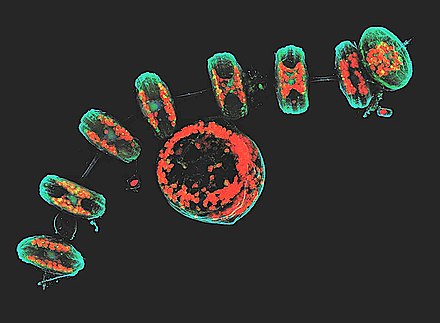
В продаже имеются четыре типа конфокальных микроскопов:
Конфокальные лазерные сканирующие микроскопы используют несколько зеркал (обычно 2 или 3 линейно сканирующих вдоль осей x и y) для сканирования лазером образца и «рассканирования» изображения через фиксированное отверстие и детектор. Этот процесс обычно медленный и не подходит для получения изображений в реальном времени, но может быть полезен для создания репрезентативных изображений высокого разрешения фиксированных образцов.
Конфокальные микроскопы с вращающимся диском ( диск Нипкова ) используют ряд движущихся отверстий на диске для сканирования пятен света. Поскольку ряд отверстий сканирует область параллельно, каждое отверстие может находиться над определенной областью в течение более длительного времени, тем самым уменьшая энергию возбуждения, необходимую для освещения образца по сравнению с лазерными сканирующими микроскопами. Уменьшенная энергия возбуждения уменьшает фототоксичность и фотообесцвечивание образца, что часто делает его предпочтительной системой для визуализации живых клеток или организмов.
Микролинзовые улучшенные или конфокальные микроскопы с двойным вращающимся диском работают по тем же принципам, что и конфокальные микроскопы с вращающимся диском, за исключением того, что второй вращающийся диск, содержащий микролинзы, размещается перед вращающимся диском, содержащим точечные отверстия. Каждое точечное отверстие имеет связанную микролинзу. Микролинзы действуют, чтобы захватывать широкую полосу света и фокусировать ее в каждом точечном отверстии, значительно увеличивая количество света, направленного в каждое точечное отверстие, и уменьшая количество света, блокируемого вращающимся диском. Поэтому микролинзовые улучшенные конфокальные микроскопы значительно более чувствительны, чем стандартные системы с вращающимся диском. Yokogawa Electric изобрела эту технологию в 1992 году. [5]
Микроскопы с программируемой матрицей (PAM) используют управляемый электроникой пространственный модулятор света (SLM), который создает набор движущихся отверстий. SLM — это устройство, содержащее массив пикселей с некоторыми свойствами ( непрозрачность , отражательная способность или оптическое вращение ) отдельных пикселей, которые можно регулировать электронно. SLM содержит микроэлектромеханические зеркала или жидкокристаллические компоненты. Изображение обычно получается с помощью камеры с зарядовой связью (ПЗС).
Каждый из этих классов конфокальных микроскопов имеет свои преимущества и недостатки. Большинство систем оптимизированы либо для скорости записи (то есть видеозахвата), либо для высокого пространственного разрешения. Конфокальные лазерные сканирующие микроскопы могут иметь программируемую плотность выборки и очень высокое разрешение, в то время как Nipkow и PAM используют фиксированную плотность выборки, определяемую разрешением камеры. Частота кадров изображения обычно ниже для одноточечных лазерных сканирующих систем, чем для систем с вращающимся диском или PAM. Коммерческие конфокальные микроскопы с вращающимся диском достигают частоты кадров более 50 в секунду [6] — желательная функция для динамических наблюдений, таких как визуализация живых клеток.
На практике методы Нипкова и PAM позволяют сканировать одну и ту же область с помощью нескольких отверстий параллельно [7], при условии, что отверстия находятся достаточно далеко друг от друга.
Передовая разработка конфокальной лазерной сканирующей микроскопии теперь позволяет получать изображения с более высокой скоростью, чем стандартная (60 кадров в секунду), за счет использования нескольких микроэлектромеханических сканирующих зеркал.
Конфокальная рентгенофлуоресцентная визуализация — это новый метод, позволяющий контролировать глубину, в дополнение к горизонтальному и вертикальному наведению, например, при анализе скрытых слоев в картине. [8]
CLSM — это метод сканирующей визуализации, в котором полученное разрешение лучше всего объясняется путем сравнения его с другим методом сканирования, например, с методом сканирующего электронного микроскопа (SEM). Преимущество CLSM в том, что не требуется подвешивать зонд в нанометрах от поверхности, как, например, в AFM или STM , где изображение получается путем сканирования тонким наконечником по поверхности. Расстояние от объектива до поверхности (называемое рабочим расстоянием ) обычно сопоставимо с расстоянием обычного оптического микроскопа. Оно зависит от оптической конструкции системы, но типичными являются рабочие расстояния от сотен микрометров до нескольких миллиметров.
В CLSM образец освещается точечным лазерным источником, и каждый элемент объема связан с дискретной интенсивностью рассеяния или флуоресценции. Здесь размер сканируемого объема определяется размером пятна (близким к дифракционному пределу) оптической системы, поскольку изображение сканирующего лазера представляет собой не бесконечно малую точку, а трехмерную дифракционную картину. Размер этой дифракционной картины и определяемый ею фокусный объем контролируются числовой апертурой объектива системы и длиной волны используемого лазера. Это можно рассматривать как классический предел разрешения обычных оптических микроскопов, использующих широкопольное освещение. Однако с помощью конфокальной микроскопии можно даже улучшить предел разрешения методов широкопольного освещения, поскольку конфокальную апертуру можно закрыть, чтобы исключить более высокие порядки дифракционной картины [ требуется ссылка ] . Например, если диаметр отверстия установлен на 1 единицу Эйри , то только первый порядок дифракционной картины проходит через апертуру к детектору, в то время как более высокие порядки блокируются, тем самым улучшая разрешение за счет небольшого уменьшения яркости. При флуоресцентных наблюдениях предел разрешения конфокальной микроскопии часто ограничивается отношением сигнал/шум, вызванным небольшим числом фотонов, обычно доступных во флуоресцентной микроскопии. Можно компенсировать этот эффект, используя более чувствительные фотодетекторы или увеличивая интенсивность точечного источника подсветки лазера. Увеличение интенсивности подсветки лазера сопряжено с риском чрезмерного обесцвечивания или другого повреждения интересующего образца, особенно для экспериментов, в которых требуется сравнение яркости флуоресценции. При визуализации тканей, которые являются дифференциально преломляющими, таких как губчатый мезофилл листьев растений или другие ткани, содержащие воздушное пространство, часто ярко выражены сферические аберрации, которые ухудшают качество конфокального изображения. Однако такие аберрации можно значительно уменьшить, поместив образцы в оптически прозрачные, нетоксичные перфторуглероды , такие как перфтордекалин , который легко проникает в ткани и имеет показатель преломления, почти идентичный показателю преломления воды. [9] При визуализации в отражательной геометрии также возможно обнаружить интерференцию отраженного и рассеянного света объекта, например, внутриклеточной органеллы. Интерферометрическая природа сигнала позволяет уменьшить диаметр отверстия до 0,2 единиц Эйри и, следовательно, обеспечивает идеальное повышение разрешения √2 без ущерба для соотношения сигнал/шум, как в конфокальной флуоресцентной микроскопии. [10]
CLSM широко используется в различных биологических научных дисциплинах, от клеточной биологии и генетики до микробиологии и биологии развития . [11] Он также используется в квантовой оптике и визуализации нанокристаллов и спектроскопии.
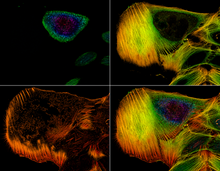
Клинически CLSM используется для оценки различных заболеваний глаз и особенно полезна для визуализации, качественного анализа и количественной оценки эндотелиальных клеток роговицы . [ 12] Она используется для локализации и идентификации наличия нитевидных грибковых элементов в строме роговицы в случаях кератомикоза , что позволяет быстро диагностировать и, таким образом, рано назначать окончательную терапию. Исследования методов CLSM для эндоскопических процедур ( эндомикроскопия ) также показывают многообещающие результаты. [13] В фармацевтической промышленности было рекомендовано следить за процессом производства тонкопленочных фармацевтических форм, чтобы контролировать качество и однородность распределения лекарств. [14] Конфокальная микроскопия также используется для изучения биопленок — сложных пористых структур, которые являются предпочтительной средой обитания микроорганизмов. Некоторые временные и пространственные функции биопленок можно понять, только изучая их структуру в микро- и мезомасштабах. Изучение микромасштаба необходимо для обнаружения активности и организации отдельных микроорганизмов. [15]
CLSM используется в качестве механизма извлечения данных в некоторых системах хранения трехмерных оптических данных и помог определить возраст папируса Магдалины .
Система IRENE использует конфокальную микроскопию для оптического сканирования и восстановления поврежденных исторических аудиозаписей. [16]
Лазерные сканирующие конфокальные микроскопы используются для характеристики поверхности микроструктурированных материалов, таких как кремниевые пластины, используемые в производстве солнечных элементов . На первых этапах обработки пластины подвергаются влажному химическому травлению кислотными или щелочными соединениями, что придает текстуру их поверхности. Затем лазерная конфокальная микроскопия используется для наблюдения за состоянием полученной поверхности на рычаге микрометра. Лазерная конфокальная микроскопия также может использоваться для анализа толщины и высоты металлизированных пальцев, напечатанных на поверхности солнечных элементов.
Функция рассеяния точки отверстия представляет собой эллипсоид, длина которого в несколько раз больше его ширины. Это ограничивает осевое разрешение микроскопа. Одним из методов преодоления этого является 4Pi микроскопия , в которой падающий и/или испускаемый свет могут интерферировать как сверху, так и снизу образца, чтобы уменьшить объем эллипсоида. Альтернативным методом является конфокальная тета-микроскопия . В этом методе конус освещающего света и детектируемый свет находятся под углом друг к другу (наилучшие результаты достигаются, когда они перпендикулярны). Пересечение двух функций рассеяния точки дает гораздо меньший эффективный объем образца. Из этого развился одноплоскостной осветительный микроскоп . Кроме того, деконволюция может быть использована с использованием экспериментально полученной функции рассеяния точки для удаления света вне фокуса, улучшая контрастность как в осевой, так и в боковой плоскостях.
Существуют конфокальные варианты, которые достигают разрешения ниже дифракционного предела, такие как микроскопия с истощением стимулированного излучения (STED). Помимо этой техники, доступно большое разнообразие других (не конфокальных) методов сверхвысокого разрешения, таких как PALM, (d)STORM , SIM и т. д. Все они имеют свои собственные преимущества, такие как простота использования, разрешение и необходимость специального оборудования, буферов или флуорофоров.
Для получения изображений образцов при низких температурах использовались два основных подхода, оба основаны на архитектуре лазерной сканирующей конфокальной микроскопии . Один подход заключается в использовании криостата непрерывного потока : только образец находится при низкой температуре, и он оптически адресуется через прозрачное окно. [17] Другой возможный подход заключается в том, чтобы иметь часть оптики (особенно объектив микроскопа) в криогенном хранилище Дьюара . [18] Этот второй подход, хотя и более громоздкий, гарантирует лучшую механическую стабильность и позволяет избежать потерь из-за окна.
Для изучения молекулярных взаимодействий с помощью CLSM можно использовать резонансный перенос энергии по Фёрстеру (FRET), позволяющий подтвердить, что два белка находятся на определенном расстоянии друг от друга.

В 1940 году Ганс Гольдман, офтальмолог из Берна , Швейцария, разработал систему щелевой лампы для документирования обследований глаз. [19] Эта система рассматривается некоторыми более поздними авторами как первая конфокальная оптическая система. [20] [21]
В 1943 году Зюн Коана опубликовал конфокальную систему. [22] [20]
В 1951 году Хирото Наора, коллега Коаны, описал конфокальный микроскоп в журнале Science for Spectrophotometry . [23]
Первый конфокальный сканирующий микроскоп был построен Марвином Мински в 1955 году, а патент был подан в 1957 году. Сканирование точки освещения в фокальной плоскости достигалось перемещением столика. Не было представлено ни одной научной публикации, и не сохранилось ни одного изображения, сделанного с его помощью. [2] [24]

В 1960-х годах чехословацкий Моймир Петрань с медицинского факультета Карлова университета в Пльзене разработал тандемный сканирующий микроскоп, первый коммерческий конфокальный микроскоп. Он был продан небольшой компанией в Чехословакии и в Соединенных Штатах Tracor-Northern (позже Noran) и использовал вращающийся диск Нипкова для создания множественных возбуждающих и эмиссионных отверстий. [21] [25]
Чехословацкий патент был подан в 1966 году Петранем и Миланом Хадравским, чехословацким коллегой. Первая научная публикация с данными и изображениями, полученными с помощью этого микроскопа, была опубликована в журнале Science в 1967 году под авторством М. Дэвида Эггера из Йельского университета и Петраня. [26] В качестве сноски к этой статье упоминается, что Петран спроектировал микроскоп и руководил его конструкцией, и что он был, отчасти, «научным сотрудником» в Йельском университете. Вторая публикация от 1968 года описывала теорию и технические детали прибора, а Хадравский и Роберт Галамбос , руководитель группы в Йельском университете, были дополнительными авторами. [27] В 1970 году был выдан патент США. Он был подан в 1967 году. [28]
В 1969 и 1971 годах М. Дэвид Эггер и Пол Давидовиц из Йельского университета опубликовали две статьи, описывающие первый конфокальный лазерный сканирующий микроскоп. [29] [30] Это был точечный сканер, то есть создавалось только одно пятно освещения. Он использовал эпи-иллюминационную микроскопию отражения для наблюдения за нервной тканью. Гелий-неоновый лазер мощностью 5 мВт с длиной волны 633 нм отражался полупрозрачным зеркалом в сторону объектива. Объектив представлял собой простую линзу с фокусным расстоянием 8,5 мм. В отличие от всех более ранних и большинства более поздних систем, образец сканировался перемещением этой линзы (сканирование объектива), что приводило к перемещению фокальной точки. Отраженный свет возвращался к полупрозрачному зеркалу, прошедшая часть фокусировалась другой линзой на точечном отверстии обнаружения, за которым располагалась фотоумножительная трубка. Сигнал визуализировался ЭЛТ осциллографа , катодный луч перемещался одновременно с объективом. Специальное устройство позволяло делать фотографии Polaroid , три из которых были показаны в публикации 1971 года.
Авторы рассуждают о флуоресцентных красителях для исследований in vivo . Они ссылаются на патент Мински, благодарят Стива Бэра, в то время аспиранта Медицинской школы Альберта Эйнштейна в Нью-Йорке , где он разработал конфокальный линейный сканирующий микроскоп, [31] за предложение использовать лазер с «микроскопом Мински» и благодарят Галамбоса, Хадравски и Петрана за обсуждения, приведшие к разработке их микроскопа. Мотивацией их разработки было то, что в тандемном сканирующем микроскопе только часть 10−7 света освещения участвует в создании изображения в окуляре. Таким образом, качество изображения было недостаточным для большинства биологических исследований. [20] [32]
В 1977 году Колин Дж. Р. Шеппард и Амарджоти Чоудхури из Оксфорда , Великобритания, опубликовали теоретический анализ конфокальных и лазерных сканирующих микроскопов. [33] Вероятно, это первая публикация, использующая термин «конфокальный микроскоп». [20] [32]
В 1978 году братья Кристоф Кремер и Томас Кремер опубликовали проект конфокального лазерного сканирующего микроскопа, использующего флуоресцентное возбуждение с электронной автофокусировкой. Они также предложили лазерное точечное освещение с использованием "4π-точечной голограммы ". [32] [34] Эта конструкция CLSM впервые объединила метод лазерного сканирования с 3D-обнаружением биологических объектов, помеченных флуоресцентными маркерами .
В 1978 и 1980 годах Оксфордская группа Колина Шеппарда и Тони Уилсона описала конфокальный микроскоп с эпи-лазерным освещением, сканированием столика и фотоумножительными трубками в качестве детекторов. Столик мог двигаться вдоль оптической оси (ось z), позволяя делать оптические серийные срезы. [32]
В 1979 году Фред Бракенхофф и его коллеги продемонстрировали, что теоретические преимущества оптического секционирования и улучшения разрешения действительно достижимы на практике. В 1985 году эта группа стала первой, кто опубликовал убедительные изображения, полученные с помощью конфокального микроскопа, которые смогли ответить на биологические вопросы. [35] Вскоре после этого многие другие группы начали использовать конфокальную микроскопию для ответа на научные вопросы, которые до тех пор оставались загадкой из-за технологических ограничений.
В 1983 году IJ Cox и C. Sheppard из Оксфорда опубликовали первую работу, в которой конфокальный микроскоп управлялся компьютером. Первый коммерческий лазерный сканирующий микроскоп, сценический сканер SOM-25, был предложен Oxford Optoelectronics (после нескольких поглощений, приобретенных BioRad) начиная с 1982 года. Он был основан на конструкции группы из Оксфорда. [21] [36]
В середине 1980-х годов Уильям Брэдшоу Амос и Джон Грэм Уайт с коллегами, работавшими в Лаборатории молекулярной биологии в Кембридже, построили первый конфокальный сканирующий микроскоп. [37] [38] Предметный столик с образцом не двигался, вместо этого двигалось пятно освещения, что позволяло быстрее получать изображения: четыре изображения в секунду по 512 строк каждое. Чрезвычайно увеличенные промежуточные изображения, благодаря длине луча 1–2 метра, позволяли использовать обычную ирисовую диафрагму в качестве «точечного отверстия» с диаметром ~1 мм. Первые микрофотографии были сделаны с длительной экспозицией на пленку, прежде чем была добавлена цифровая камера. Дальнейшее усовершенствование позволило впервые увеличить масштаб препарата. Zeiss , Leitz и Cambridge Instruments не были заинтересованы в коммерческом производстве. [39] Медицинский исследовательский совет (MRC) наконец спонсировал разработку прототипа. Проект был приобретен Bio-Rad , дополнен компьютерным управлением и выпущен в продажу как «MRC 500». Преемник MRC 600 позже стал основой для разработки первого двухфотонно-флуоресцентного микроскопа, разработанного в 1990 году в Корнелльском университете . [35]
Разработки в Королевском технологическом институте KTH в Стокгольме примерно в то же время привели к коммерческому CLSM, распространяемому шведской компанией Sarastro. [40] Предприятие было приобретено в 1990 году компанией Molecular Dynamics, [41] но CLSM в конечном итоге был прекращен. В Германии компания Heidelberg Instruments, основанная в 1984 году, разработала CLSM, который изначально предназначался для промышленных применений, а не для биологии. Этот инструмент был приобретен в 1990 году компанией Leica Lasertechnik . У Zeiss уже был на рынке неконфокальный лазерный сканирующий микроскоп с летающей точкой, который был модернизирован до конфокального. В отчете от 1990 года [42] упоминались некоторые производители конфокальных микроскопов: Sarastro, Technical Instrument, Meridian Instruments, Bio-Rad, Leica, Tracor-Northern и Zeiss. [35]
В 1989 году Фриц Карл Прейкшат вместе со своим сыном Экхардом Прейкшатом изобрели сканирующий лазерный диодный микроскоп для анализа размера частиц. [43] [44] и стали соучредителями Lasentec для его коммерциализации. В 2001 году Lasentec была приобретена Mettler Toledo . [45] Они используются в основном в фармацевтической промышленности для обеспечения контроля на месте процесса кристаллизации в крупных системах очистки.
В стандартных конфокальных приборах вторая или «выходная» пинхол используется для фильтрации испускаемого или рассеянного света. Традиционно эта пинхол является пассивным компонентом, который блокирует свет для оптической фильтрации освещения. Однако в более новых разработках попытались выполнить эту фильтрацию цифровым способом.
Недавние подходы заменили пассивную пинхол-дырку составным элементом детектора. Обычно после цифровой обработки этот подход приводит к лучшему разрешению и бюджету фотонов, поскольку предел разрешения может приближаться к пределу разрешения бесконечно малого пинхола. [46]
Другие исследователи пытались цифровым способом перефокусировать свет от точечного источника возбуждения, используя глубокие сверточные нейронные сети. [47]
{{cite journal}}: Отсутствует или пусто |title=( помощь ) Статья доступна на сайте журнала. PDF-файл с меткой "P359 - 402" имеет размер 19 020 килобайт и также содержит соседние статьи из того же выпуска. На рисунке 1б статьи показана схема конфокального пути трансмиссионного луча.