
Биологический насос ( или океанический углеродный биологический насос или морской биологический углеродный насос ) — это биологически обусловленное океаном поглощение углерода из атмосферы и стока суши во внутренние районы океана и в отложения морского дна . [1] Другими словами, это биологически опосредованный процесс, который приводит к поглощению углерода в глубине океана от атмосферы и суши. Биологический насос — это биологический компонент «морского углеродного насоса», который содержит как физический, так и биологический компонент. Это часть более широкого океанического углеродного цикла, отвечающая за круговорот органического вещества, образованного в основном фитопланктоном во время фотосинтеза (мягкотканный насос), а также круговорот карбоната кальция (CaCO 3 ), образованного в раковинах некоторыми организмами, такими как планктон и моллюски (карбонатный насос). [2]
Расчеты бюджета биологического углеродного насоса основаны на соотношении между седиментацией (экспортом углерода на дно океана) и реминерализацией (выбросом углерода в атмосферу).
Биологический насос — это не столько результат одного процесса, сколько сумма ряда процессов, каждый из которых может влиять на биологическую перекачку. В целом, насос переносит около 10,2 гигатонн углерода каждый год в недра океана и в общей сложности 1300 гигатонн углерода в среднем за 127 лет. [3] Это выводит углерод из контакта с атмосферой на несколько тысяч лет или дольше. Океан без биологического насоса привел бы к повышению уровня углекислого газа в атмосфере примерно на 400 ppm по сравнению с сегодняшним днем.

Элемент углерод играет центральную роль в климате и жизни на Земле. Он способен перемещаться между геосферой , криосферой , атмосферой , биосферой и гидросферой . Этот поток углерода называется углеродным циклом Земли. Он также тесно связан с циклом других элементов и соединений. Океан играет фундаментальную роль в углеродном цикле Земли, помогая регулировать концентрацию CO2 в атмосфере . Биологический насос представляет собой набор процессов, которые переносят органический углерод с поверхности в глубины океана и находится в центре углеродного цикла океана . [5]
Биологический насос зависит от доли первичного органического вещества , которое выживает после деградации в эвфотической зоне и которое экспортируется из поверхностных вод в глубину океана, где оно минерализуется до неорганического углерода , в результате чего углерод переносится против градиента растворенного неорганического углерода (DIC) с поверхности в глубины океана. Этот перенос происходит посредством физического смешивания и переноса растворенного и дисперсного органического углерода (POC), вертикальных миграций организмов ( зоопланктон , рыба ) и посредством гравитационного осаждения дисперсного органического углерода. [6] [7] : 526 [8]
Биологический насос можно разделить на три отдельные фазы, первая из которых — это производство фиксированного углерода планктонными фототрофами в эвфотической (освещенной солнцем) поверхностной области океана. В этих поверхностных водах фитопланктон использует углекислый газ (CO2 ) , азот (N), фосфор (P) и другие микроэлементы ( барий , железо , цинк и т. д.) во время фотосинтеза для производства углеводов , липидов и белков . Некоторые планктонные организмы (например, кокколитофориды и фораминиферы ) объединяют кальций (Ca) и растворенные карбонаты ( угольную кислоту и бикарбонат ), образуя защитное покрытие из карбоната кальция (CaCO3). [ 9]
После того, как этот углерод фиксируется в мягкой или твердой ткани, организмы либо остаются в эвфотической зоне, чтобы быть переработанными в рамках регенеративного цикла питательных веществ , либо после смерти переходят ко второй фазе биологического насоса и начинают погружаться на дно океана. Тонущие частицы часто образуют агрегаты по мере погружения, что значительно увеличивает скорость погружения. Именно эта агрегация дает частицам больше шансов избежать хищничества и разложения в толще воды и в конечном итоге достичь морского дна. [9]
Фиксированный углерод, который разлагается бактериями либо по пути вниз, либо на морском дне, затем попадает в конечную фазу насоса и реминерализуется для повторного использования в первичном производстве . Частицы, которые полностью избегают этих процессов, изолируются в осадке и могут оставаться там миллионы лет. Именно этот изолируемый углерод в конечном итоге отвечает за снижение уровня CO2 в атмосфере . [ 9]

Диаграмма выше иллюстрирует компоненты биологического насоса. Биология, физика и гравитация взаимодействуют, чтобы перекачивать органический углерод в глубокое море. Процессы фиксации неорганического углерода в органическом веществе во время фотосинтеза, его трансформация процессами пищевой цепи (трофодинамика), физическое смешивание, транспортировка и гравитационное осаждение в совокупности называются биологическим насосом. [10]
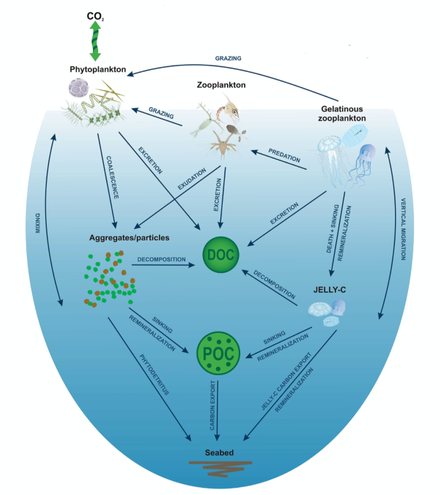
Биологический насос отвечает за преобразование растворенного неорганического углерода (РНУ) в органическую биомассу и закачку ее в виде частиц или растворенной формы в глубины океана. Неорганические питательные вещества и углекислый газ фиксируются во время фотосинтеза фитопланктоном, который выделяет растворенное органическое вещество (РОВ) и потребляется травоядным зоопланктоном. Более крупный зоопланктон, такой как веслоногие рачки , выделяет фекальные гранулы , которые могут быть повторно проглочены и утоплены или собраны с другим органическим детритом в более крупные, более быстро тонущие агрегаты. РОВ частично потребляется бактериями (черные точки) и вдыхается; оставшийся тугоплавкий РОВ адвектируется и смешивается с глубоководными водами. РОВ и агрегаты, экспортируемые в глубинные воды, потребляются и вдыхаются, тем самым возвращая органический углерод в огромный глубоководный резервуар РНУ. Около 1% частиц, покидающих поверхность океана, достигают морского дна и потребляются, вдыхаются или захороняются в отложениях. Там углерод хранится в течение миллионов лет. Чистый эффект этих процессов заключается в удалении углерода в органической форме с поверхности и возвращении его в DIC на больших глубинах, поддерживая градиент DIC от поверхности к глубинам океана. Термохалинная циркуляция возвращает глубоководный DIC в атмосферу в тысячелетних временных масштабах. [10]

Первым шагом в биологическом насосе является синтез как органических, так и неорганических углеродных соединений фитопланктоном в самых верхних, освещенных солнцем слоях океана. [13] Органические соединения в форме сахаров, углеводов, липидов и белков синтезируются в процессе фотосинтеза :
CO2 + H2O + свет → CH2O + O2
Помимо углерода, органическое вещество, обнаруженное в фитопланктоне, состоит из азота, фосфора и различных следовых металлов . Соотношение углерода к азоту и фосфору варьируется от места к месту, [14], но имеет среднее соотношение около 106C:16N:1P, известное как соотношение Редфилда . Следовые металлы, такие как магний, кадмий, железо, кальций, барий и медь, на порядки меньше распространены в органическом материале фитопланктона, но необходимы для определенных метаболических процессов и, следовательно, могут быть ограничивающими питательными веществами в фотосинтезе из-за их более низкого содержания в толще воды. [9]
Первичная продукция океана составляет около половины фиксации углерода, осуществляемой на Земле. Примерно 50–60 Пг углерода фиксируется морским фитопланктоном каждый год, несмотря на то, что на его долю приходится менее 1% от общей фотосинтетической биомассы на Земле. Большая часть этой фиксации углерода (~80%) осуществляется в открытом океане, в то время как оставшееся количество происходит в очень продуктивных регионах апвеллинга океана. Несмотря на то, что эти продуктивные регионы производят в 2–3 раза больше фиксированного углерода на единицу площади, открытый океан составляет более 90% площади океана и, следовательно, вносит больший вклад. [9]

Фитопланктон поддерживает всю жизнь в океане, поскольку он преобразует неорганические соединения в органические компоненты. Эта автотрофно произведенная биомасса представляет собой основу морской пищевой сети. [15] На диаграмме ниже стрелки указывают на различные процессы производства (стрелка указывает в сторону пула РОВ) и удаления РОВ (стрелка указывает в сторону), в то время как пунктирные стрелки представляют собой доминирующие биологические процессы, вовлеченные в перенос РОВ. Из-за этих процессов доля лабильного РОВ быстро уменьшается с глубиной, тогда как рефрактерный характер пула РОВ значительно увеличивается во время его экспорта в глубины океана. РОВ, растворенное органическое вещество. [15] [16]


Морской биологический насос зависит от ряда ключевых пулов, компонентов и процессов, которые влияют на его функционирование. В океане есть четыре основных пула углерода. [5]

Частицы неорганического углерода (PIC) обычно принимают форму карбоната кальция (CaCO 3 ) и играют ключевую роль в океаническом углеродном цикле. [36] Этот биологически фиксированный углерод используется в качестве защитного покрытия для многих планктонных видов (кокколитофориды, фораминиферы), а также более крупных морских организмов (раковины моллюсков). Карбонат кальция также выделяется с высокой скоростью во время осморегуляции рыбой и может образовываться в событиях мерланга . [37] Хотя эта форма углерода напрямую не берется из атмосферного бюджета, она образуется из растворенных форм карбоната, которые находятся в равновесии с CO 2 и затем отвечают за удаление этого углерода посредством секвестрации. [38]
CO 2 + H 2 O → H 2 CO 3 → H + + HCO 3 −
Ca2 + + 2HCO3 − → CaCO3 + CO2 + H2O
Хотя этот процесс действительно позволяет зафиксировать большое количество углерода, на каждую единицу поглощенного углерода приходится две единицы щелочности . [2] [39] Таким образом, образование и погружение CaCO 3 создает градиент щелочности от поверхности к глубине , который повышает pH поверхностных вод, изменяя распределение растворенного углерода для повышения парциального давления растворенного CO 2 в поверхностных водах, что фактически повышает уровень атмосферы. Кроме того, захоронение CaCO 3 в отложениях снижает общую щелочность океана , что приводит к повышению pH и, следовательно, уровня CO 2 в атмосфере , если это не уравновешивается новым поступлением щелочности в результате выветривания. [1] Часть углерода, которая постоянно захоронена на морском дне, становится частью геологической летописи. Карбонат кальция часто образует замечательные отложения, которые затем могут быть подняты на сушу посредством тектонического движения, как в случае с Белыми скалами Дувра в Южной Англии. Эти скалы почти полностью состоят из пластин захороненных кокколитофорид . [40]

Три основных процесса (или насоса), которые составляют морской углеродный цикл, приносят атмосферный углекислый газ (CO 2 ) в недра океана и распределяют его по океанам. Эти три насоса: (1) насос растворимости, (2) карбонатный насос и (3) биологический насос. Общий активный пул углерода на поверхности Земли в течение менее 10 000 лет составляет примерно 40 000 гигатонн C (Гт C, гигатонна равна одному миллиарду тонн, или весу приблизительно 6 миллионов синих китов ), и около 95% (~38 000 Гт C) хранится в океане, в основном в виде растворенного неорганического углерода . [41] [42] Видообразование растворенного неорганического углерода в морском углеродном цикле является основным регулятором кислотно-щелочной химии в океанах.

Биологический насос сопровождается физико-химическим аналогом, известным как насос растворимости . Этот насос переносит значительные объемы углерода в форме растворенного неорганического углерода (DIC) с поверхности океана в его недра. Он включает только физические и химические процессы и не включает биологические процессы. [43]
Насос растворимости приводится в действие совпадением двух процессов в океане:
Поскольку глубокая вода (то есть морская вода в глубине океана) формируется в тех же поверхностных условиях, которые способствуют растворимости углекислого газа, она содержит более высокую концентрацию растворенного неорганического углерода, чем можно было бы ожидать от средних поверхностных концентраций. Следовательно, эти два процесса действуют вместе, перекачивая углерод из атмосферы в глубину океана. Одним из последствий этого является то, что когда глубокая вода поднимается в более теплых экваториальных широтах, она интенсивно выделяет углекислый газ в атмосферу из-за пониженной растворимости газа. [44]
Карбонатный насос иногда называют компонентом «твердой ткани» биологического насоса. [45] Некоторые поверхностные морские организмы, такие как кокколитофориды , производят твердые структуры из карбоната кальция, формы дисперсного неорганического углерода, фиксируя бикарбонат. [46] Эта фиксация DIC является важной частью океанического углеродного цикла.
Са 2+ + 2 HCO 3 − → CaCO 3 + CO 2 + H 2 O
В то время как биологический углеродный насос фиксирует неорганический углерод (CO 2 ) в виде частиц органического углерода в форме сахара (C 6 H 12 O 6 ), карбонатный насос фиксирует неорганический бикарбонат и вызывает чистый выброс CO 2 . [46] Таким образом, карбонатный насос можно назвать карбонатным противонасосом. Он работает в противовес биологическому насосу, противодействуя потоку CO 2 в биологический насос. [47]
Предполагается, что насос континентального шельфа работает в мелководных водах континентальных шельфов как механизм , транспортирующий углерод (растворенный или в виде частиц) из континентальных вод во внутреннюю часть прилегающего глубокого океана. [48] Как первоначально было сформулировано, насос, как полагают, возникает там, где насос растворимости взаимодействует с более холодной и, следовательно, более плотной водой с шельфового дна, которая поступает вниз по континентальному склону в соседний глубокий океан. [48] Мелководность континентального шельфа ограничивает конвекцию охлаждающей воды, поэтому охлаждение может быть больше для вод континентального шельфа, чем для соседних вод открытого океана. Эти более холодные воды способствуют насосу растворимости и приводят к увеличению хранения растворенного неорганического углерода . Это дополнительное хранение углерода дополнительно увеличивается за счет повышенной биологической продуктивности, характерной для шельфов. [49] Плотные, богатые углеродом шельфовые воды затем опускаются на дно шельфа и попадают в подповерхностный слой открытого океана через изопикническое смешивание. [48] Поскольку уровень моря повышается в ответ на глобальное потепление, площадь поверхности шельфовых морей будет расти, и, как следствие, мощность насоса шельфового моря должна возрасти. [50]

На диаграмме справа фитопланктон преобразует CO2 , который растворился из атмосферы в поверхностных океанах (90 Гт год −1 ), в твердый органический углерод (POC) во время первичного производства (~ 50 Гт С год −1 ). Затем фитопланктон потребляется веслоногими рачками , крилем и другими мелкими травоядными зоопланктона, которые, в свою очередь, становятся добычей более высоких трофических уровней . Любой непотребленный фитопланктон образует агрегаты и вместе с фекальными гранулами зоопланктона быстро тонет и выводится из смешанного слоя (< 12 Гт С год −1 14). Криль, веслоногие рачки, зоопланктон и микробы перехватывают фитопланктон на поверхности океана и тонущих детритных частиц на глубине, потребляя и вдыхая этот POC в CO2 ( растворенный неорганический углерод , DIC), так что только небольшая часть углерода, произведенного на поверхности, опускается в глубины океана (т. е. на глубины > 1000 м). По мере того, как криль и более мелкий зоопланктон питаются, они также физически фрагментируют частицы на мелкие, медленно- или нетонущие части (через неаккуратное питание, копрорексию при фрагментации фекалий), [52] замедляя экспорт POC. Это высвобождает растворенный органический углерод (DOC) либо напрямую из клеток, либо косвенно через бактериальную солюбилизацию (желтый круг вокруг DOC). Затем бактерии могут реминерализовать DOC в DIC (CO2 , микробное садоводство). [51]
Биологический углеродный насос является одним из главных факторов, определяющих вертикальное распределение углерода в океанах и, следовательно, поверхностное парциальное давление CO2 , регулирующее обмен CO2 между воздухом и морем . [53] Он включает клетки фитопланктона, их потребителей и бактерии, которые усваивают их отходы, и играет центральную роль в глобальном углеродном цикле, доставляя углерод из атмосферы в глубокое море, где он концентрируется и изолируется на протяжении столетий. [54] Фотосинтез фитопланктоном снижает парциальное давление CO2 в верхних слоях океана, тем самым способствуя поглощению CO2 из атмосферы за счет создания более крутого градиента CO2 . [ 55] Он также приводит к образованию частиц органического углерода (POC) в эвфотическом слое эпипелагической зоны (глубина 0–200 м). РОС перерабатывается микробами, зоопланктоном и их потребителями в фекальные гранулы, органические агрегаты («морской снег») и другие формы, которые затем экспортируются в мезопелагическую (глубина 200–1000 м) и батипелагическую зоны путем погружения и вертикальной миграции зоопланктоном и рыбой. [56] Хотя первичная продукция включает как растворенный , так и дисперсный органический углерод (DOC и POC соответственно), только POC приводит к эффективному экспорту углерода во внутренние районы океана, тогда как фракция DOC в поверхностных водах в основном перерабатывается бактериями. [57] Однако более биологически устойчивая фракция DOC, производимая в эвфотической зоне (составляющая 15–20% чистой продуктивности сообщества), не сразу минерализуется микробами и накапливается на поверхности океана как биологически полулабильный DOC . [58] Этот полулабильный DOC подвергается чистому экспорту в глубины океана, таким образом составляя динамическую часть биологического углеродного насоса. [59] Эффективность производства и экспорта DOC различается в зависимости от океанографических регионов, будучи более заметной в олиготрофных субтропических океанах. [60] Общая эффективность биологического углеродного насоса в основном контролируется экспортом POC. [57] [61]

Большая часть углерода, включенного в органическую и неорганическую биологическую материю, образуется на поверхности моря, где он затем может начать погружаться на дно океана. Глубокий океан получает большую часть своих питательных веществ из более высокого столба воды, когда они опускаются вниз в виде морского снега. Он состоит из мертвых или умирающих животных и микробов, фекалий, песка и других неорганических материалов. [63] Одна клетка фитопланктона имеет скорость погружения около одного метра в день. Учитывая, что средняя глубина океана составляет около четырех километров, этим клеткам может потребоваться более десяти лет, чтобы достичь дна океана. Однако посредством таких процессов, как коагуляция и выталкивание в фекальных гранулах хищников, эти клетки образуют агрегаты. Эти агрегаты, известные как морской снег , имеют скорость погружения на порядки больше, чем отдельные клетки, и завершают свое путешествие на глубину за считанные дни. [9]
На диаграмме справа фитопланктон фиксирует CO2 в эвфотической зоне , используя солнечную энергию, и производит твердый органический углерод (POC). POC, образующийся в эвфотической зоне, перерабатывается микробами, зоопланктоном и их потребителями в органические агрегаты (морской снег), которые затем экспортируются в мезопелагическую (глубина 200–1000 м) и батипелагическую зоны путем погружения и вертикальной миграции зоопланктоном и рыбой. Поток экспорта определяется как седиментация из поверхностного слоя (на глубине примерно 100 м), а поток секвестрации — это седиментация из мезопелагической зоны (на глубине примерно 1000 м). Часть POC выдыхается обратно в CO2 в толще океанической воды на глубине, в основном гетеротрофными микробами и зоопланктоном, тем самым поддерживая вертикальный градиент концентрации растворенного неорганического углерода (DIC). Этот глубоководный DIC возвращается в атмосферу в тысячелетних масштабах времени посредством термохалинной циркуляции . От 1% до 40% первичной продукции экспортируется из эвфотической зоны, которая экспоненциально затухает к основанию мезопелагиали, и только около 1% поверхностной продукции достигает морского дна. [61] [64] [56]
Из 50–60 Пг углерода, фиксируемого ежегодно, примерно 10% покидает поверхностный смешанный слой океанов, в то время как менее 0,5% в конечном итоге достигает морского дна. [9] Большая часть сохраняется в регенерированном производстве в эвфотической зоне, а значительная часть реминерализуется в процессах в средних слоях воды во время погружения частиц. Часть углерода, которая покидает поверхностный смешанный слой океана, иногда считается «секвестрированной» и по существу удаленной от контакта с атмосферой на многие столетия. [64] Однако работа также показывает, что в таких регионах, как Южный океан , большая часть этого углерода может быстро (в течение десятилетий) вернуться в контакт с атмосферой. [65]
Расчеты бюджета биологического углеродного насоса основаны на соотношении между седиментацией (экспортом углерода) и реминерализацией (выбросом в атмосферу). [62] Было подсчитано, что тонущие частицы экспортируют до 25% углерода, захваченного фитопланктоном на поверхности океана, в более глубокие слои воды. [66] Около 20% этого экспорта (5% поверхностных значений) захоронено в океанских отложениях [67], в основном из-за их минерального балласта. [68] Во время процесса погружения эти органические частицы являются горячими точками микробной активности и представляют собой важные локусы для минерализации органического вещества и перераспределения питательных веществ в водной толще. [69] [70] [62]
Наблюдения показали, что потоки балластных минералов (карбонат кальция, опал и литогенный материал) и потоки органического углерода тесно коррелируют в батипелагических зонах океана. [68] Большая часть твердых органических веществ встречается в форме агрегатов морского снега (>0,5 мм), состоящих из фитопланктона, детрита, неорганических минеральных зерен и фекальных гранул в океане. [71] Образование и погружение этих агрегатов запускает биологический углеродный насос посредством экспорта и осаждения органического вещества из поверхностного смешанного слоя в глубокий океан и осадки. Доля органического вещества, которая покидает верхний смешанный слой океана, определяется, среди прочего, скоростью погружения и скоростью микробной реминерализации этих агрегатов. Недавние наблюдения показали, что потоки балластных минералов (карбонат кальция, опал и литогенный материал) и потоки органического углерода тесно коррелируют в батипелагических зонах океана. Это привело к гипотезе, что экспорт органического углерода определяется наличием балластных минералов в оседающих агрегатах. [72] [73] [74] [68]
Минеральный балласт связан примерно с 60% потока органического углерода (POC) в высокоширотной части Северной Атлантики и примерно с 40% потока в Южном океане. [75] Сильные корреляции существуют также в глубоком океане между наличием балластных минералов и потоком POC. Это предполагает, что балластные минералы усиливают поток POC, увеличивая скорость погружения балластных агрегатов. Балластные минералы могут дополнительно обеспечить агрегированному органическому веществу некоторую защиту от деградации. [76]
Было высказано предположение, что органический углерод лучше сохраняется в тонущих частицах из-за повышенной плотности агрегата и скорости погружения, когда присутствуют балластные минералы и/или через защиту органического вещества из-за количественной ассоциации с балластными минералами. [72] [73] [74] В 2002 году Клаас и Арчер наблюдали, что около 83% глобальных потоков органического углерода в виде частиц (POC) были связаны с карбонатом , и предположили, что карбонат был более эффективным балластным минералом по сравнению с опалом и терригенным материалом. Они выдвинули гипотезу, что более высокая плотность карбоната кальция по сравнению с плотностью опала и более высокое содержание карбоната кальция по сравнению с терригенным материалом могут быть причиной эффективного балластирования карбонатом кальция. Однако прямое влияние балластных минералов на скорость погружения и скорости деградации в тонущих агрегатах до сих пор неясно. [74] [68]
Исследование 2008 года продемонстрировало, что фекальные гранулы веслоногих рачков, полученные на диете из диатомовых водорослей или кокколитофорид, демонстрируют более высокую скорость погружения по сравнению с гранулами, полученными на диете из нанофлагеллятов. [77] Однако удельные скорости дыхания углерода в гранулах были схожи и не зависели от содержания минералов. Эти результаты показывают, что различия в минеральном составе не приводят к дифференциальной защите POC от микробной деградации, но повышенные скорости погружения могут привести к 10-кратному повышению сохранения углерода в гранулах, содержащих биогенные минералы , по сравнению с гранулами без биогенных минералов [77] [68]
Минералы, по-видимому, усиливают флокуляцию агрегатов фитопланктона [78] [79] и даже могут выступать в качестве катализатора в образовании агрегатов. [80] Однако также было показано, что включение минералов может привести к фрагментации агрегатов на более мелкие и плотные агрегаты. [81] Это может потенциально снизить скорость погружения агрегированного органического материала из-за уменьшенных размеров агрегатов и, таким образом, снизить общий экспорт органического вещества. И наоборот, если включение минералов увеличивает плотность агрегата, его специфическая для размера скорость погружения также может увеличиться, что может потенциально увеличить экспорт углерода. Поэтому все еще существует необходимость в более качественных количественных исследованиях того, как взаимодействия между минералами и органическими агрегатами влияют на деградацию и скорость погружения агрегатов и, следовательно, на секвестрацию углерода в океане. [81] [68]
Реминерализация относится к распаду или преобразованию органического вещества (молекул, полученных из биологического источника) в его простейшие неорганические формы. Эти преобразования образуют важнейшее звено в экосистемах, поскольку они отвечают за высвобождение энергии, хранящейся в органических молекулах , и переработку вещества в системе для повторного использования в качестве питательных веществ другими организмами . [7] Какая доля избегает реминерализации, зависит от местоположения. Например, в Северном море значения отложения углерода составляют ~1% от первичной продукции [82], тогда как в открытом океане это значение в среднем <0,5%. [83] Таким образом, большая часть питательных веществ остается в толще воды, перерабатываемая биотой . Гетеротрофные организмы будут использовать материалы, произведенные автотрофными (и хемотрофными ) организмами, и посредством дыхания будут реминерализовать соединения из органической формы обратно в неорганическую, делая их снова доступными для первичных производителей.
Для большинства районов океана самые высокие скорости реминерализации углерода происходят на глубинах от 100 до 1200 м (330–3940 футов) в водной толще, снижаясь примерно до 1200 м (3900 футов), где скорости реминерализации остаются довольно постоянными на уровне 0,1 мкмоль кг −1 год −1 . [84] Это обеспечивает наибольшее количество питательных веществ, доступных для первичных продуцентов в фотической зоне, хотя это оставляет верхние поверхностные воды без неорганических питательных веществ. [85] Большая часть реминерализации осуществляется с помощью растворенного органического углерода (РОУ). Исследования показали, что именно более крупные тонущие частицы переносят вещество вниз на морское дно [86], в то время как взвешенные частицы и растворенная органика в основном потребляются реминерализацией. [87] Это происходит отчасти из-за того, что организмы обычно должны потреблять питательные вещества, меньшие, чем они сами, часто на порядки величины. [88] Поскольку микробное сообщество составляет 90% морской биомассы, [89] это частицы, меньшие, чем микробы (порядка 10−6 ), которые будут взяты для реминерализации. [90]
Морской фитопланктон выполняет половину всего фотосинтеза на Земле [91] и напрямую влияет на глобальные биогеохимические циклы и климат, однако неизвестно, как он отреагирует на будущие глобальные изменения. Углекислый газ является одним из основных факторов глобальных изменений и был определен как одна из основных проблем в 21 веке. [92] Углекислый газ (CO2 ) , образующийся в результате антропогенной деятельности, такой как вырубка лесов и сжигание ископаемого топлива для производства энергии, быстро растворяется в поверхностном слое океана и снижает pH морской воды, в то время как CO2, остающийся в атмосфере, повышает глобальную температуру и приводит к увеличению термической стратификации океана . Хотя концентрация CO2 в атмосфере оценивается примерно в 270 ppm до промышленной революции, в настоящее время она увеличилась примерно до 400 ppm [93] и, как ожидается, достигнет 800–1000 ppm к концу этого столетия в соответствии со сценарием выбросов CO2 «бизнес как обычно» . [94] [61]
Морские экосистемы являются основным поглотителем атмосферного CO 2 и поглощают такое же количество CO 2, как и наземные экосистемы, в настоящее время на них приходится удаление почти одной трети антропогенных выбросов CO 2 из атмосферы. [93] [94] Чистый перенос CO 2 из атмосферы в океаны, а затем в отложения , в основном является прямым следствием совместного эффекта растворимости и биологического насоса. [95] В то время как насос растворимости служит для концентрации растворенного неорганического углерода (CO 2 плюс ионы бикарбоната и карбоната) в глубоких океанах, биологический углеродный насос (ключевой естественный процесс и основной компонент глобального углеродного цикла, регулирующий уровни атмосферного CO 2 ) переносит как органический, так и неорганический углерод, зафиксированный первичными продуцентами (фитопланктоном) в эвфотической зоне , во внутреннюю часть океана и затем в нижележащие отложения. [95] [54] Таким образом, биологический насос выводит углерод из контакта с атмосферой на несколько тысяч лет или дольше и поддерживает атмосферный CO2 на значительно более низком уровне, чем если бы его не было. [96] Океан без биологического насоса, который переносит примерно 11 Гт С год −1 во внутренние части океана, привел бы к тому, что уровень CO2 в атмосфере был бы примерно на 400 частей на миллион выше, чем сегодня. [97] [98] [61]
Пассов и Карлсон определили седиментацию из поверхностного слоя (на глубине примерно 100 м) как «поток экспорта», а из мезопелагиали ( на глубине примерно 1000 м) как «поток секвестрации». [64] После того, как углерод переносится ниже мезопелагиали, он остается в глубоком море в течение 100 лет или дольше, отсюда и термин «поток секвестрации». Согласно результатам моделирования Бюсселера и Бойда, от 1% до 40% первичной продукции экспортируется из эвфотической зоны, [99] которая экспоненциально затухает по направлению к основанию мезопелагиали, и только около 1% поверхностной продукции достигает морского дна. [100] Эффективность экспорта органического углерода твердых частиц (POC) показывает региональную изменчивость. Например, в Северной Атлантике более 40% чистой первичной продукции экспортируется из эвфотической зоны по сравнению с всего лишь 10% в Южной части Тихого океана [99] , и это частично обусловлено составом сообщества фитопланктона, включая размер и состав клеток (см. ниже). Экспортируемый органический углерод реминерализуется, то есть выдыхается обратно в CO2 в толще океанической воды на глубине, в основном гетеротрофными микробами и зоопланктоном. Таким образом, биологический углеродный насос поддерживает вертикальный градиент концентрации растворенного неорганического углерода (DIC) с более высокими значениями при увеличении глубины океана. [101] Этот глубоководный DIC возвращается в атмосферу в тысячелетние временные масштабы посредством термохалинной циркуляции . [10] [61]
В 2001 году Хью и др. выразили эффективность биологического насоса как количество углерода, экспортируемого из поверхностного слоя (экспортная продукция), деленное на общее количество, произведенное фотосинтезом (общая продукция). [10] Исследования моделирования, проведенные Бюсселером и Бойдом, показали, что общая эффективность переноса биологического насоса определяется комбинацией факторов: сезонность; [99] состав видов фитопланктона; фрагментация частиц зоопланктоном; и солюбилизация частиц микробами. Кроме того, эффективность биологического насоса также зависит от агрегации и дезагрегации богатых органикой агрегатов и взаимодействия между агрегатами ВОУ и взвешенными «балластными» минералами. [102] Балластные минералы (силикатные и карбонатные биоминералы и пыль) являются основными составляющими частиц, которые покидают поверхность океана путем погружения. Они, как правило, плотнее морской воды и большинства органических веществ, таким образом, обеспечивая большую часть разницы плотности, необходимой для погружения частиц. [72] Агрегация частиц увеличивает вертикальный поток, преобразуя мелкие взвешенные частицы в более крупные, быстро тонущие. Это играет важную роль в осаждении фитодетрита из цветущего фитопланктона поверхностного слоя. [56] Как проиллюстрировал Тернер в 2015 году, вертикальный поток тонущих частиц в основном обусловлен комбинацией фекальных гранул, морского снега и прямого осаждения цветущего фитопланктона, который обычно состоит из диатомовых водорослей, кокколитофорид, динофлагеллят и другого планктона. [56] Морской снег состоит из макроскопических органических агрегатов размером >500 мкм и происходит из комков агрегированного фитопланктона (фитодетрита), выброшенных домиков аппендикулярий, фекалий и других разнообразных детритных частиц. [56] Аппендикулярии выделяют слизистые структуры для питания или «дома», чтобы собирать частицы пищи, выбрасывать и обновлять их до 40 раз в день. [103] Выброшенные дома аппендикулярий очень многочисленны (тысячи на м3 в поверхностных водах) и являются микробными горячими точками с высокой концентрацией бактерий, инфузорий, жгутиконосцев и фитопланктона. Поэтому эти выброшенные дома являются одними из самых важных источников агрегатов, напрямую производимых зоопланктоном с точки зрения потенциала круговорота углерода. [104] [61]

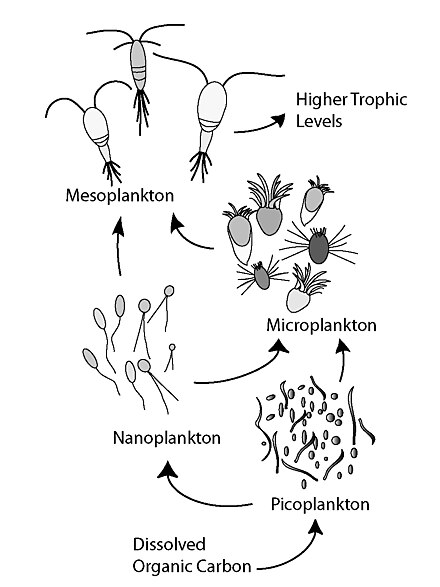
Состав сообщества фитопланктона в эвфотической зоне во многом определяет количество и качество органического вещества, которое погружается на глубину. [100] Основные функциональные группы морского фитопланктона, которые способствуют экспортной продукции, включают азотфиксаторы ( диазотрофные цианобактерии ), силицификаторы (диатомовые водоросли) и кальцификаторы (кокколитофориды). Каждая из этих групп фитопланктона отличается размером и составом своих клеточных стенок и покрытий, которые влияют на скорость их погружения. [105] Например, считается, что автотрофный пикопланктон (0,2–2 мкм в диаметре), включающий такие таксоны, как цианобактерии (например, Prochlorococcus spp. и Synechococcus spp.) и празинофиты (различные роды эукариот <2 мкм), вносит гораздо меньший вклад в экспорт углерода из поверхностных слоев из-за своего небольшого размера, медленной скорости погружения (<0,5 м/день) и быстрого оборота в микробной петле. [105] [106] Напротив, более крупные клетки фитопланктона, такие как диатомовые водоросли (2–500 мкм в диаметре), очень эффективно транспортируют углерод на глубину, образуя быстро тонущие агрегаты. [64] Они уникальны среди фитопланктона, поскольку им требуется Si в форме кремниевой кислоты (Si(OH)4) для роста и производства их панцирей, которые состоят из биогенного кремнезема (bSiO2) и действуют как балласт. [105] [107] Согласно отчетам Миклаша и Денни, [108] скорость погружения диатомовых водорослей может составлять от 0,4 до 35 м/день. [105] [107] [108] Аналогично, кокколитофориды покрыты пластинами карбоната кальция, называемыми «кокколитами», которые играют центральную роль в агрегации и балластировке, создавая скорость погружения около 5 м/день. [64] [105] Хотя предполагалось, что пикофитопланктон , характеризующий обширные олиготрофные области океана, [100] не вносит существенного вклада в поток органического углерода в виде частиц (POC), в 2007 году Ричардсон и Джексон предположили, что весь фитопланктон, включая клетки пикопланктона, в равной степени способствуют экспорту POC. [106] Они предложили альтернативные пути для круговорота углерода пикопланктона, которые основаны на агрегации как механизме как для прямого погружения (экспорт пикопланктона в виде POC), так и для погружения продукции на основе пикопланктона, опосредованного мезозоопланктоном или крупными фильтраторами. [61]

Помимо связывания первичных производителей с более высокими трофическими уровнями в морских пищевых сетях, зоопланктон также играет важную роль в качестве «переработчиков» углерода и других питательных веществ, которые существенно влияют на морские биогеохимические циклы, включая биологический насос. Это особенно касается веслоногих рачков и криля , и особенно важно в олиготрофных водах открытого океана. Через неаккуратное питание, выделение, экскрецию и выщелачивание фекальных гранул зоопланктон выделяет растворенное органическое вещество (РОВ), которое контролирует цикл РОВ и поддерживает микробную петлю. Эффективность поглощения, дыхание и размер добычи еще больше усложняют то, как зоопланктон способен преобразовывать и доставлять углерод в глубины океана. [111]
Экскреция и неаккуратное питание (физическое разрушение источника пищи) составляют 80% и 20% высвобождения РОВ, опосредованного ракообразным зоопланктоном соответственно. [113] В том же исследовании было обнаружено, что выщелачивание фекальных гранул вносит незначительный вклад. У простейших травоядных РОВ высвобождается в основном через экскрецию и испражнение, а студенистый зоопланктон также может высвобождать РОВ посредством выработки слизи. Выщелачивание фекальных гранул может длиться от нескольких часов до нескольких дней после первоначального испражнения, и его последствия могут варьироваться в зависимости от концентрации и качества пищи. [114] [115] Различные факторы могут влиять на то, сколько РОВ высвобождается из особей или популяций зоопланктона.
Фекальные гранулы зоопланктона могут быть важными транспортными средствами для переноса органического углерода в виде частиц (POC) в глубины океана, часто внося большой вклад в секвестрацию углерода. Распределение размеров сообщества веслоногих рачков указывает на то, что большое количество мелких фекальных гранул производится в эпипелагиали . Однако мелкие фекальные гранулы редки в более глубоких слоях, что позволяет предположить, что они не переносятся эффективно на глубину. Это означает, что мелкие фекальные гранулы вносят лишь незначительный вклад в потоки фекальных гранул в мезо- и батипелагиали, особенно с точки зрения углерода. В исследовании, сосредоточенном на море Скотия , которое содержит некоторые из самых продуктивных регионов в Южном океане, доминирующие фекальные гранулы в верхней мезопелагиали были цилиндрическими и эллиптическими, в то время как яйцевидные фекальные гранулы доминировали в батипелагиали . Изменение морфологии фекальных гранул, а также распределение размеров, указывает на переупаковку поверхностных фекальных гранул в мезопелагической и in situ продукции в нижней мезо- и батипелагической, которая может быть усилена поступлением фекальных гранул через вертикальные миграции зоопланктона . Это говорит о том, что поток углерода в более глубокие слои в пределах Южного океана сильно модулируется мезо- и батипелагическим зоопланктоном, что означает, что структура сообщества в этих зонах оказывает большое влияние на эффективность переноса фекальных гранул в глубины океана. [112]
Эффективность поглощения (AE) — это доля пищи, поглощенной планктоном, которая определяет, насколько доступны потребляемые органические материалы для удовлетворения требуемых физиологических потребностей. [111] В зависимости от скорости кормления и состава добычи, изменения в AE могут привести к изменениям в производстве фекальных гранул и, таким образом, регулировать, сколько органического материала возвращается обратно в морскую среду. Низкая скорость кормления обычно приводит к высокой AE и небольшим плотным гранулам, в то время как высокая скорость кормления обычно приводит к низкой AE и более крупным гранулам с большим содержанием органики. Другим фактором, способствующим высвобождению DOM, является скорость дыхания. Физические факторы, такие как доступность кислорода, pH и условия освещенности, могут влиять на общее потребление кислорода и на то, сколько углерода теряется зоопланктоном в виде вдыхаемого CO2 . Относительные размеры зоопланктона и добычи также опосредуют, сколько углерода выделяется при неаккуратном питании. Более мелкая добыча поглощается целиком, тогда как более крупная добыча может питаться более «неаккуратно», то есть больше биоматериала выделяется при неэффективном потреблении. [116] [117] Также имеются данные о том, что состав рациона может влиять на высвобождение питательных веществ, поскольку плотоядные диеты выделяют больше растворенного органического углерода (РОУ) и аммония, чем всеядные диеты. [114]
Микробная петля описывает трофический путь в морской микробной пищевой сети , где растворенный органический углерод (DOC) возвращается на более высокие трофические уровни посредством его включения в бактериальную биомассу, а затем соединяется с классической пищевой цепью, образованной фитопланктоном - зоопланктоном - нектоном . Термин микробная петля был придуман Фаруком Азамом , Томом Фенчелем и др. [118] в 1983 году, чтобы включить роль, которую играют бактерии в циклах углерода и питательных веществ морской среды. В целом, растворенный органический углерод попадает в океанскую среду из-за бактериального лизиса, утечки или экссудации фиксированного углерода из фитопланктона (например, слизистого экзополимера из диатомовых водорослей ), внезапного старения клеток, неаккуратного питания зоопланктоном, выделения отходов водными животными или распада или растворения органических частиц из наземных растений и почв. [119] Бактерии в микробной петле разлагают этот твердый детрит, чтобы использовать этот богатый энергией материал для роста. Поскольку более 95% органического вещества в морских экосистемах состоит из полимерных высокомолекулярных соединений (HMW) (например, белков, полисахаридов, липидов), только небольшая часть общего растворенного органического вещества (DOM) легко утилизируется большинством морских организмов на более высоких трофических уровнях. Это означает, что растворенный органический углерод недоступен напрямую большинству морских организмов; морские бактерии вводят этот органический углерод в пищевую сеть, в результате чего дополнительная энергия становится доступной для более высоких трофических уровней. [120]
До 25% первичной продукции фитопланктона в мировых океанах может быть переработано в микробной петле посредством вирусного шунтирования . [121] Вирусный шунт представляет собой механизм, посредством которого морские вирусы предотвращают миграцию микробных частиц органического вещества (POM) вверх по трофическим уровням , перерабатывая их в растворенное органическое вещество (DOM), которое может быть легко поглощено микроорганизмами. DOM, переработанное путем вирусного шунта, сопоставимо с количеством, вырабатываемым другими основными источниками морского DOM. [122] Вирусы могут легко инфицировать микроорганизмы в микробной петле из-за их относительной распространенности по сравнению с микробами. [123] [124] Смертность прокариот и эукариот способствует переработке углеродных питательных веществ посредством лизиса клеток . Также имеются данные о регенерации азота (в частности, аммония). Эта переработка питательных веществ помогает стимулировать рост микроорганизмов. [125]
Желейные водопады — это морские события круговорота углерода , при которых студенистый зоопланктон , в первую очередь книдарии , опускается на морское дно и усиливает потоки углерода и азота посредством быстро погружающихся частиц органического вещества . [127] Эти события обеспечивают питание для бентосной мегафауны и бактерий . [128] [129] Желейные водопады рассматриваются как основной «студенистый путь» для секвестрации лабильного биогенного углерода через биологический насос. [130] Эти события распространены в охраняемых районах с высоким уровнем первичной продукции и качеством воды, подходящим для поддержки видов книдарий. К таким районам относятся эстуарии , и несколько исследований были проведены во фьордах Норвегии . [129]


Киты и другие морские млекопитающие также повышают первичную продуктивность в своих районах нагула, концентрируя азот вблизи поверхности посредством выброса хлопьевидных фекальных шлейфов. [132] [133] Например, киты и тюлени могут быть ответственны за пополнение большего количества азота в эвфотической зоне залива Мэн, чем поступление всех рек вместе взятых. Этот восходящий насос китов играл гораздо большую роль до того, как промышленное рыболовство опустошило запасы морских млекопитающих, когда рециркуляция азота, вероятно, более чем в три раза превышала поступление атмосферного азота. [132]
Биологический насос опосредует удаление углерода и азота из эвфотической зоны посредством нисходящего потока агрегатов, фекалий и вертикальной миграции беспозвоночных и рыб. [134] Веслоногие рачки и другой зоопланктон производят тонувшие фекальные гранулы и способствуют нисходящему транспорту растворенных и твердых органических веществ путем дыхания и выделения на глубине во время циклов миграции, таким образом, играя важную роль в экспорте питательных веществ (N, P и Fe) из поверхностных вод. [135] [136] [132]
Зоопланктон питается в эвфотической зоне и экспортирует питательные вещества через тонущую фекальную гранулу и вертикальную миграцию. Рыбы обычно выделяют питательные вещества на той же глубине, на которой они питаются. Экскреция морских млекопитающих, привязанных к поверхности для дыхания, как ожидается, будет происходить на меньшей глубине в толще воды, чем там, где они питаются. [132]
Морские млекопитающие обеспечивают важные экосистемные услуги. В глобальном масштабе они могут влиять на климат посредством оплодотворения и экспорта углерода из поверхностных вод в глубокое море через тонущую тушу китов. [137] В прибрежных районах киты локально сохраняют питательные вещества, увеличивая продуктивность экосистемы и, возможно, увеличивая пропускную способность для других морских потребителей, включая коммерческие виды рыб. [132] Было подсчитано, что с точки зрения поглощения углерода один кит эквивалентен тысячам деревьев. [138]
Дневной вертикально мигрирующий криль, сальпы, мелкий зоопланктон и рыба могут активно переносить углерод на глубину, потребляя РОС в поверхностном слое ночью и метаболизируя его в дневное время, на глубинах мезопелагического обитания. В зависимости от жизненного цикла вида активный перенос может происходить и на сезонной основе. [51]
Без вертикальной миграции биологический насос не был бы столь эффективным. Организмы мигрируют наверх, чтобы питаться ночью, поэтому, когда они мигрируют обратно на глубину в течение дня, они испражняются большими тонущими фекальными гранулами. Хотя некоторые более крупные фекальные гранулы могут тонуть довольно быстро, скорость, с которой организмы движутся обратно на глубину, все равно выше. Ночью организмы находятся в верхних 100 метрах водной толщи, но днем они опускаются на глубину от 800 до 1000 метров. Если бы организмы испражнялись на поверхности, фекальным гранулам потребовались бы дни, чтобы достичь глубины, на которую они попадают за считанные часы. Поэтому, выпуская фекальные гранулы на глубине, им нужно преодолеть почти на 1000 метров меньше пути, чтобы попасть в глубокий океан. Это то, что известно как активный транспорт . Организмы играют более активную роль в перемещении органических веществ на глубину. Поскольку большая часть глубоководных районов, особенно морских микробов, зависит от падающих питательных веществ, чем быстрее они смогут достичь дна океана, тем лучше. [63]
Зоопланктон и сальпы играют большую роль в активном транспорте фекальных гранул. По оценкам, 15–50% биомассы зоопланктона мигрирует, что составляет транспорт 5–45% органического азота в виде частиц на глубину. [63] Сальпы — это крупный студенистый планктон, который может вертикально мигрировать на 800 метров и поедать большое количество пищи на поверхности. У них очень долгое время удержания в кишечнике, поэтому фекальные гранулы обычно высвобождаются на максимальной глубине. Сальпы также известны тем, что имеют одни из самых крупных фекальных гранул. Из-за этого они очень быстро тонут, известно, что мелкие частицы детрита собираются на них. Это заставляет их тонуть намного быстрее. Поэтому, хотя в настоящее время все еще проводится много исследований того, почему организмы вертикально мигрируют, ясно, что вертикальная миграция играет большую роль в активном транспорте растворенного органического вещества на глубину. [139]
Липидный насос изолирует углерод с поверхности океана в более глубокие воды с помощью липидов , связанных с зимующим вертикально мигрирующим зоопланктоном . Липиды представляют собой класс богатых углеводородами , дефицитных по азоту и фосфору соединений, необходимых для клеточных структур. Связанный с липидами углерод поступает в глубины океана в виде углекислого газа, образующегося при дыхании липидных запасов, и в виде органического вещества от смертности зоопланктона. По сравнению с более общим биологическим насосом, липидный насос также приводит к липидному шунту, где другие питательные вещества, такие как азот и фосфор, которые потребляются в избытке, должны выводиться обратно в поверхностную среду и, таким образом, не удаляются из поверхностного смешанного слоя океана. [140] Это означает, что углерод, транспортируемый липидным насосом, не ограничивает доступность необходимых питательных веществ на поверхности океана. Таким образом, секвестрация углерода с помощью липидного насоса отделена от удаления питательных веществ, что позволяет продолжать поглощение углерода первичной продукцией океана. В биологическом насосе удаление питательных веществ всегда связано с секвестрацией углерода; Первичная продукция ограничена, поскольку углерод и питательные вещества транспортируются на глубину вместе в форме органического вещества. [140] Вклад липидного насоса в секвестрацию углерода в более глубоких водах океана может быть существенным: углерод, транспортируемый ниже 1000 метров (3300 футов) веслоногими рачками рода Calanus в Северном Ледовитом океане, почти равен углероду, ежегодно транспортируемому ниже той же глубины твердым органическим углеродом (POC) в этом регионе. [141] Значительная часть этого транспортируемого углерода не вернется на поверхность из-за дыхания и смертности. Продолжаются исследования для более точной оценки количества, которое остается на глубине. [140] [141] [142] Скорость экспорта липидного насоса может варьироваться от 1 до 9,3 г С м −2 г −1 в умеренных и субполярных регионах, содержащих сезонно мигрирующий зоопланктон. [142] Роль зоопланктона, и особенно веслоногих рачков, в пищевой сети имеет решающее значение для выживания организмов более высокого трофического уровня , основным источником питания которых являются веслоногие рачки. С потеплением океанов и увеличением таяния ледяных шапок из-за изменения климата, организмы, связанные с липидным насосом, могут быть затронуты, тем самым влияя на выживание многих промысловых рыб и находящихся под угрозой исчезновения морских млекопитающих . [143] [144] [145] Поскольку липидный насос является новым и ранее не количественно определенным компонентом океанического поглощения углерода, дальнейшие исследования липидного насоса могут повысить точность и общее понимание потоков углерода в глобальных океанических системах . [140] [141] [142]

Светящиеся бактерии в симбиозах световых органов последовательно приобретаются хозяином (кальмаром, рыбой) из морской воды, пока они еще молоды, а затем регулярно выпускаются в океан. [146]
На диаграмме справа, в зависимости от положения светового органа, светящиеся бактерии высвобождаются из их кишок в фекальные гранулы или непосредственно в морскую воду (шаг 1). Подвижные светящиеся бактерии колонизируют органическое вещество, погружающееся в толщу воды . Биолюминесцентные бактерии, колонизирующие фекальные гранулы и частицы, влияют на скорость потребления зоопланктона. Такие визуальные маркеры повышают обнаружение («гипотеза приманки»), привлечение и, наконец, хищничество со стороны верхних трофических уровней (шаг 2). В мезопелагиали зоопланктон и его хищники питаются тонущими светящимися частицами и фекальными гранулами, которые образуют либо агрегаты (переупаковку) с более высокой скоростью погружения, либо фрагментируют органическое вещество (из-за неаккуратного питания) с более низкой скоростью погружения (шаг 3). [146]
Фильтраторы также собирают тонущие органические вещества без особого визуального обнаружения и выбора светящихся веществ. Суточные (и сезонные) вертикальные мигранты, питающиеся светящейся пищей, метаболизируют и выделяют светящиеся фекальные гранулы с поверхности в мезопелагическую зону (шаг 4). Это подразумевает распространение биолюминесцентных бактерий в больших пространственных масштабах, для зоопланктона или даже некоторых рыб, активно плавающих на большие расстояния. Светящиеся бактерии, прикрепленные к частицам, опускаются на морское дно, а осадок может быть повторно взвешен океанографическими физическими условиями (шаг 5) и потреблен эпибентосными организмами. Инструменты: (a) планктонная сеть, (b) рыболовная сеть, (c) пробоотборник воды Нискина , (d) батифотометр, (e) ловушки для осадка , (f) автономные подводные аппараты , (g) фотоумножительный модуль, (h) астрофизические оптические модули ANTARES и (i–j) дистанционно управляемые аппараты . [146]

Геологическая составляющая углеродного цикла действует медленно по сравнению с другими частями глобального углеродного цикла. Это один из важнейших факторов, определяющих количество углерода в атмосфере и, следовательно, глобальные температуры. [148]
Поскольку биологический насос играет важную роль в углеродном цикле Земли, значительные усилия тратятся на количественную оценку его мощности. Однако, поскольку они происходят в результате плохо ограниченных экологических взаимодействий, обычно на глубине, процессы, которые формируют биологический насос, трудно измерить. Распространенным методом является оценка первичной продукции, подпитываемой нитратом и аммонием , поскольку эти питательные вещества имеют разные источники, связанные с реминерализацией тонущего материала. Из них можно вывести так называемое f-соотношение , показатель локальной мощности биологического насоса. Применение результатов локальных исследований к глобальному масштабу осложняется ролью, которую циркуляция океана играет в различных океанических регионах. [149]

Изменения в землепользовании, сжигание ископаемого топлива и производство цемента привели к увеличению концентрации CO 2 в атмосфере. В настоящее время около одной трети (примерно 2 Пг C y −1 = 2 × 10 15 граммов углерода в год) [150] [151] [ ненадежный источник? ] антропогенных выбросов CO 2 может поступать в океан, но это довольно неопределенно. [152] Некоторые исследования показывают, что существует связь между повышенным уровнем CO 2 и первичной морской продукцией. [153]


Изменение климата может повлиять на биологический насос в будущем, потеплев и расслоив поверхность океана. Считается, что это может уменьшить подачу питательных веществ в эвфотическую зону, уменьшив там первичное производство. Кроме того, изменения в экологическом успехе кальцифицирующих организмов, вызванные закислением океана, могут повлиять на биологический насос, изменив силу насоса твердых тканей. [156] Это может затем оказать «опосредованное» воздействие на насос мягких тканей, поскольку карбонат кальция действует как балласт, тонущая органическая материя. [157]
Вторая диаграмма справа показывает некоторые возможные эффекты сокращения морского льда и таяния вечной мерзлоты на потоки углерода в Арктике. На суше растения поглощают углерод, а микроорганизмы в почве производят метан и дышат CO2 . Озера являются чистыми источниками метана, а органический и неорганический углерод (растворенный и в виде частиц) поступает в океан через пресноводные системы. В океане метан может выделяться при таянии подводной вечной мерзлоты, а CO2 поглощается из-за недонасыщения CO2 в воде по сравнению с атмосферой. Кроме того, с морским льдом тесно связаны множественные потоки. Текущие наилучшие оценки атмосферных потоков приведены в Tg C год −1 , где это возможно. Обратите внимание, что оценка выбросов для озер относится к области к северу от ~50º с. ш., а не к более узкому определению арктической тундры для других наземных потоков. Когда это возможно, в скобках показаны диапазоны неопределенности. Стрелки не представляют размер каждого потока. [155] [154]
Биологический насос, как полагают, играл значительную роль в колебаниях атмосферного CO2 в течение прошлых ледниковых-межледниковых периодов. Однако пока не ясно, как биологический насос будет реагировать на будущие изменения климата. [56] Чтобы такие прогнозы были обоснованными, важно сначала расшифровать реакцию фитопланктона, одного из ключевых компонентов биологического насоса, на будущие изменения атмосферного CO2 . Из-за своего филогенетического разнообразия различные таксоны фитопланктона, вероятно, будут реагировать на изменение климата по-разному. [105] Например, ожидается снижение численности диатомовых водорослей из-за увеличения стратификации в будущем океане. [158] Диатомовые водоросли очень эффективны в транспортировке углерода на глубину, образуя большие, быстро тонущие агрегаты, и их сокращение может, в свою очередь, привести к снижению экспорта углерода. [64]
Кроме того, снижение pH океана из-за его закисления может помешать способности кокколитофорид образовывать известковые пластины, что может повлиять на биологический насос; [105] однако, по-видимому, некоторые виды более чувствительны, чем другие. [159] Таким образом, будущие изменения относительной численности этих или других таксонов фитопланктона могут оказать заметное влияние на общую продуктивность океана, впоследствии влияя на биогеохимию океана и хранение углерода.
Исследование 2015 года показало, что концентрации кокколитофорид в Северной Атлантике увеличились на порядок с 1960-х годов, и было смоделировано, что наиболее вероятной причиной этого увеличения является увеличение поглощенного CO2 , а также повышение температуры. [160]
В исследовании 2017 года ученые использовали моделирование распределения видов (SDM) для прогнозирования будущего глобального распределения двух видов фитопланктона, важных для биологического насоса: диатомовой водоросли Chaetoceros diadema и кокколитофориды Emiliania huxleyi . [161] Они использовали данные об окружающей среде, описанные в сценарии МГЭИК «Репрезентативные пути концентрации» 8.5 , который предсказывает радиационное воздействие в 2100 году относительно доиндустриальных значений. Результаты их моделирования предсказали, что общая площадь океана, покрытая C. diadema и E. huxleyi, сократится на 8% и 16% соответственно при рассматриваемом климатическом сценарии. Они предсказали, что изменения в ареале и распределении этих двух видов фитопланктона в этих будущих условиях океана, если они будут реализованы, могут привести к снижению вклада в секвестрацию углерода через биологический насос. [61] В 2019 году исследование показало, что при нынешних темпах закисления морской воды мы можем увидеть, как антарктический фитопланктон станет меньше и менее эффективным в хранении углерода к концу столетия. [162]

Мониторинг биологического насоса имеет решающее значение для понимания того, как меняется углеродный цикл Земли. Для мониторинга биологического насоса используются различные методы, которые могут быть развернуты с различных платформ, таких как корабли, автономные транспортные средства и спутники. В настоящее время спутниковое дистанционное зондирование является единственным доступным инструментом для просмотра всей поверхности океана в высоких временных и пространственных масштабах. [5]
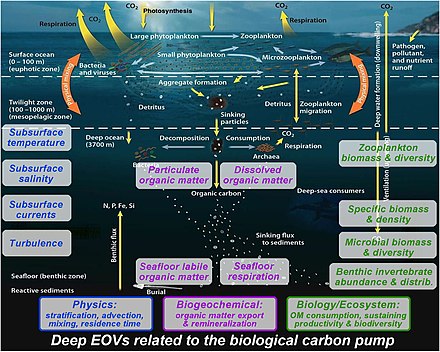
Для правильного понимания биологического насоса все еще необходимы многопрофильные наблюдения в глубоководной толще : [165]
NEP [чистой продукции экосистемы] зависит от границ, определенных для экосистемы. Если рассматривать освещенную солнцем поверхность океана до уровня освещенности 1% («эвфотическая зона») в течение всего года, то NEP эквивалентна
органическому углероду в виде частиц,
погружающемуся в темную внутреннюю часть океана, плюс
растворенный органический углерод,
циркулирующий из эвфотической зоны. В этом случае NEP также часто называют «экспортной продукцией» (или «новой продукцией» (Dugdale & Goering 1967), как обсуждается ниже).
{{cite book}}: CS1 maint: location missing publisher (link){{cite book}}: CS1 maint: multiple names: authors list (link){{cite journal}}: CS1 maint: numeric names: authors list (link){{cite journal}}: Цитировать журнал требует |journal=( помощь ) {{cite web}}: CS1 maint: multiple names: authors list (link){{cite book}}: |journal=проигнорировано ( помощь )CS1 maint: multiple names: authors list (link)