Зеленый флуоресцентный белок ( GFP ) — это белок , который проявляет зеленую флуоресценцию при воздействии света в диапазоне от синего до ультрафиолетового . [2] [3] Название GFP традиционно относится к белку, впервые выделенному из медузы Aequorea victoria , и иногда его называют avGFP . Однако GFP были обнаружены и в других организмах, включая кораллы , морские анемоны , зоанитиды , веслоногие рачки и ланцетники . [4]
GFP из A. victoria имеет основной пик возбуждения на длине волны 395 нм и второстепенный на 475 нм. Его пик испускания находится на 509 нм, что находится в нижней зеленой части видимого спектра . Квантовый выход флуоресценции (QY) GFP составляет 0,79. GFP из морских анютиных глазок ( Renilla reniformis ) имеет один основной пик возбуждения на 498 нм. GFP является превосходным инструментом во многих формах биологии благодаря своей способности образовывать внутренний хромофор без необходимости каких-либо дополнительных кофакторов , генных продуктов или ферментов / субстратов, отличных от молекулярного кислорода. [5]
В клеточной и молекулярной биологии ген GFP часто используется в качестве репортера экспрессии . [6] Он использовался в модифицированных формах для создания биосенсоров , и было создано множество животных, которые экспрессируют GFP, что демонстрирует доказательство концепции , что ген может быть экспрессирован во всем данном организме, в выбранных органах или в интересующих клетках. GFP может быть введен в животных или другие виды с помощью трансгенных технологий и поддерживаться в их геноме и геноме их потомства. GFP был экспрессирован во многих видах, включая бактерии, дрожжи, грибы, рыбу и млекопитающих, в том числе в клетках человека. Ученые Роджер Й. Циен , Осаму Шимомура и Мартин Чалфи были удостоены Нобелевской премии по химии 2008 года 10 октября 2008 года за открытие и разработку зеленого флуоресцентного белка.
Большинство коммерчески доступных генов для GFP и подобных флуоресцентных белков имеют длину около 730 пар оснований. Природный белок состоит из 238 аминокислот. Его молекулярная масса составляет 27 кДа. [7] Таким образом, слияние гена GFP с геном интересующего белка может значительно увеличить размер белка и молекулярную массу, а также может нарушить естественную функцию белка или изменить его местоположение или траекторию транспорта внутри клетки. [8]


В 1960-х и 1970-х годах GFP вместе с отдельным люминесцентным белком экворином ( ферментом , катализирующим распад люциферина , высвобождая свет) был впервые выделен из медузы Aequorea victoria , а его свойства изучал Осаму Шимомура . [9] У A. victoria флуоресценция GFP возникает, когда экворин взаимодействует с ионами Ca2 + , вызывая синее свечение. Часть этой люминесцентной энергии передается GFP, смещая общий цвет в сторону зеленого. [10] Однако его полезность в качестве инструмента для молекулярных биологов начала осознаваться только в 1992 году, когда Дуглас Прашер сообщил о клонировании и нуклеотидной последовательности wtGFP в Gene . [11] Финансирование этого проекта закончилось, поэтому Прашер отправил образцы кДНК в несколько лабораторий. Лаборатория Мартина Чалфи экспрессировала кодирующую последовательность wtGFP, с удаленными первыми несколькими аминокислотами, в гетерологичных клетках E. coli и C. elegans , опубликовав результаты в журнале Science в 1994 году. [12] Лаборатория Фредерика Цуджи независимо сообщила об экспрессии рекомбинантного белка месяц спустя. [13] Примечательно, что молекула GFP сворачивалась и флуоресцировала при комнатной температуре, без необходимости в экзогенных кофакторах, специфичных для медузы. Хотя этот почти wtGFP был флуоресцентным, у него было несколько недостатков, включая двухпиковые спектры возбуждения, чувствительность к pH, чувствительность к хлориду, плохой квантовый выход флуоресценции, плохую фотостабильность и плохое сворачивание при 37 °C (99 °F).
Первая сообщенная кристаллическая структура GFP была мутантом S65T группой Remington в Science в 1996 году . [14] Месяц спустя группа Phillips независимо сообщила о структуре GFP дикого типа в Nature Biotechnology . [15] Эти кристаллические структуры предоставили жизненно важную информацию об образовании хромофора и взаимодействии соседних остатков. Исследователи модифицировали эти остатки с помощью направленного и случайного мутагенеза, чтобы получить широкий спектр производных GFP, используемых сегодня. Дальнейшие исследования GFP показали, что он устойчив к детергентам, протеазам, обработке хлоридом гуанидиния (GdmCl) и резким перепадам температуры. [16]

Из-за возможности широкого использования и меняющихся потребностей исследователей было создано много различных мутантов GFP. [17] [18] Первым крупным улучшением стала одноточечная мутация (S65T), о которой в 1995 году в журнале Nature сообщил Роджер Циен . [19] Эта мутация значительно улучшила спектральные характеристики GFP, что привело к повышению флуоресценции, фотостабильности и смещению основного пика возбуждения до 488 нм, при этом пик испускания сохранился на 509 нм. Это соответствовало спектральным характеристикам общедоступных наборов фильтров FITC , что повысило практичность использования обычным исследователем. Точечный мутант с эффективностью складывания при 37 °C (F64L) для этого каркаса, дающий улучшенный GFP (EGFP), был обнаружен в 1995 году лабораториями Таструпа [20] и Фалькова. [21] EGFP позволил практическое использование GFP в клетках млекопитающих. EGFP имеет коэффициент экстинкции (обозначаемый ε) 55 000 M −1 см −1 . [22] Квантовый выход флуоресценции (QY) EGFP составляет 0,60. Относительная яркость, выраженная как ε•QY, составляет 33 000 M −1 см −1 .
В 2006 году было сообщено о суперскладчатом GFP (sfGFP), серии мутаций, которые позволяют GFP быстро сворачиваться и созревать даже при слиянии с плохо сворачивающимися пептидами. [23]
Было сделано много других мутаций, включая цветовые мутанты; в частности, синий флуоресцентный белок (EBFP, EBFP2, Azurite, mKalama1), голубой флуоресцентный белок (ECFP, Cerulean, CyPet, mTurquoise2) и производные желтого флуоресцентного белка (YFP, Citrine, Venus, YPet). Производные BFP (кроме mKalama1) содержат замену Y66H. Они демонстрируют широкую полосу поглощения в ультрафиолете с центром вблизи 380 нанометров и максимум испускания при 448 нанометрах. Был разработан мутант зеленого флуоресцентного белка (BFPms1), который преимущественно связывает Zn(II) и Cu(II). BFPms1 имеет несколько важных мутаций, включая и хромофор BFP (Y66H), Y145F для более высокого квантового выхода, H148G для создания отверстия в бета-бочонке и несколько других мутаций, которые увеличивают растворимость. Связывание Zn(II) увеличивает интенсивность флуоресценции, тогда как связывание Cu(II) гасит флуоресценцию и сдвигает максимум поглощения с 379 до 444 нм. Поэтому их можно использовать в качестве биосенсора Zn. [24]

Связывание хромофора. Критической мутацией в циановых производных является замена Y66W, которая заставляет хромофор формироваться с индольным, а не фенольным компонентом. Для восстановления яркости этого модифицированного хромофора из-за увеличенного объема индольной группы требуется несколько дополнительных компенсаторных мутаций в окружающем стволе. В ECFP и Cerulean N-концевая половина седьмой нити демонстрирует две конформации. Обе эти конформации имеют сложный набор ван-дер-ваальсовых взаимодействий с хромофором. Мутации Y145A и H148D в Cerulean стабилизируют эти взаимодействия и позволяют хромофору быть более плоским, лучше упакованным и менее склонным к тушению при столкновениях. [25]
Дополнительный сайт-направленный случайный мутагенез в сочетании с флуоресцентным скринингом на основе времени жизни дополнительно стабилизировал седьмую β-цепь, что привело к яркому варианту mTurquoise2 с квантовым выходом (QY) 0,93. [26] Смещенная в красную область длина волны производных YFP достигается мутацией T203Y и обусловлена π-электронными взаимодействиями между замещенным остатком тирозина и хромофором. [3] Эти два класса спектральных вариантов часто используются для экспериментов по резонансному переносу энергии Фёрстера (FRET). Генетически кодируемые репортеры FRET, чувствительные к сигнальным молекулам клетки, таким как кальций или глутамат, состоянию фосфорилирования белка, комплементации белка, димеризации рецептора и другим процессам, обеспечивают высокоспецифичные оптические показания активности клетки в реальном времени.
Полурациональный мутагенез ряда остатков привел к появлению pH-чувствительных мутантов, известных как pHluorins, а позднее и суперэклиптических pHluorins. Используя быстрое изменение pH при слиянии синаптических пузырьков, pHluorins, помеченные синаптобревином, использовались для визуализации синаптической активности в нейронах. [27]
Редокс-чувствительный GFP ( roGFP ) был разработан путем введения цистеинов в структуру бета-бочонка. Редокс- состояние цистеинов определяет флуоресцентные свойства roGFP . [28]
Номенклатура модифицированных GFP часто сбивает с толку из-за перекрывающегося отображения нескольких версий GFP на одно название. Например, mGFP часто относится к GFP с N-концевым пальмитоилированием , которое заставляет GFP связываться с клеточными мембранами . Однако этот же термин также используется для обозначения мономерного GFP, что часто достигается путем нарушения интерфейса димера мутацией A206K. [29] GFP дикого типа имеет слабую тенденцию к димеризации при концентрациях выше 5 мг/мл. mGFP также означает «модифицированный GFP», который был оптимизирован путем обмена аминокислот для стабильной экспрессии в растительных клетках.

Цель как (первичной) биолюминесценции (от действия экворина на люциферин), так и (вторичной) флуоресценции GFP у медуз неизвестна. GFP ко-экспрессируется с экворином в небольших гранулах по краю колокола медузы. Вторичный пик возбуждения (480 нм) GFP поглощает часть синего излучения экворина, придавая биолюминесценции более зеленый оттенок. Остаток серина 65 хромофора GFP отвечает за двухпиковые спектры возбуждения дикого типа GFP. Он сохраняется во всех трех изоформах GFP, первоначально клонированных Прашером. Почти все мутации этого остатка объединяют спектры возбуждения в один пик либо при 395 нм, либо при 480 нм. Точный механизм этой чувствительности сложен, но, по-видимому, включает в себя передачу водорода от серина 65 к глутамату 222, что влияет на ионизацию хромофора. [3] Поскольку одна мутация может значительно усилить пик возбуждения 480 нм, делая GFP гораздо более эффективным партнером экворина, A. victoria , по-видимому, эволюционно предпочитает менее эффективный двухпиковый спектр возбуждения. Роджер Циен предположил, что изменение гидростатического давления с глубиной может повлиять на способность серина 65 отдавать водород хромофору и сместить соотношение двух пиков возбуждения. Таким образом, медуза может менять цвет своей биолюминесценции с глубиной. Однако сокращение популяции медуз в Фрайдей-Харбор , где изначально был обнаружен GFP, затруднило дальнейшее изучение роли GFP в естественной среде обитания медуз.
Известно, что большинство видов ланцетника вырабатывают GFP в различных областях своего тела. [30] В отличие от A. victoria , ланцетники не вырабатывают собственный синий свет, и происхождение их эндогенного GFP до сих пор неизвестно. Некоторые предполагают, что он привлекает планктон ко рту ланцетника, выступая в качестве пассивного механизма охоты. Он также может служить фотозащитным агентом у личинок, предотвращая повреждения, вызванные синим светом высокой интенсивности, путем преобразования его в зеленый свет низкой интенсивности. Однако эти теории не были проверены.
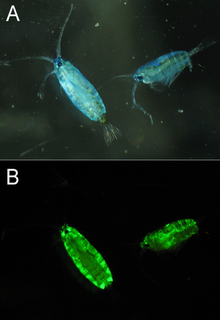
Белки, подобные GFP, были обнаружены у многих видов морских веслоногих рачков , в частности, из семейств Pontellidae и Aetideidae . [31] GFP, выделенный из Pontella mimocerami, показал высокий уровень яркости с квантовым выходом 0,92, что делает его почти в два раза ярче, чем обычно используемый EGFP, выделенный из A. victoria. [32]

Существует много GFP-подобных белков, которые, несмотря на то, что они принадлежат к тому же семейству белков, что и GFP, не получены напрямую из Aequorea victoria . К ним относятся dsRed , eqFP611, Dronpa, TagRFPs, KFP, EosFP/IrisFP, Dendra и т. д. Будучи разработанными из белков в разных организмах, эти белки иногда могут демонстрировать неожиданные подходы к формированию хромофоров. Некоторые из них, такие как KFP, разработаны из естественно нефлуоресцентных или слабофлуоресцентных белков, которые могут быть значительно улучшены путем мутагенеза. [33] Когда используются GFP-подобные стволы с различными характеристиками спектра, спектры возбуждения одного хромофора могут использоваться для питания другого хромофора (FRET), что позволяет преобразовывать длины волн света. [34]
Флуоресцентные белки, связывающие FMN (FbFP), были разработаны в 2007 году и представляют собой класс небольших (11–16 кДа), кислородонезависимых флуоресцентных белков, которые получены из рецепторов синего света. Они предназначены специально для использования в анаэробных или гипоксических условиях, поскольку образование и связывание хромофора Flavin не требует молекулярного кислорода, как это происходит при синтезе хромофора GFP. [35]

Флуоресцентные белки с другими хромофорами, например, UnaG с билирубином, могут демонстрировать уникальные свойства, такие как смещенное в красную область излучение свыше 600 нм или фотоконверсия из состояния зеленого излучения в состояние красного излучения. Они могут иметь длины волн возбуждения и излучения, достаточно далеко расположенные друг от друга, чтобы достичь преобразования между красным и зеленым светом.
Новый класс флуоресцентных белков был получен из фикобилипротеина цианобактерий ( Trichodesmium erythraeum ) , α- аллофикоцианина , и назван малым ультракрасным флуоресцентным белком ( smURFP ) в 2016 году. smURFP автокаталитически самостоятельно включает хромофор биливердин без необходимости во внешнем белке , известном как лиаза . [36] [37] Белки, подобные GFP, полученные из медуз и кораллов, требуют кислорода и производят стехиометрическое количество перекиси водорода при образовании хромофора . [ 38] smURFP не требует кислорода и не производит перекись водорода и использует хромофор биливердин . smURFP имеет большой коэффициент экстинкции (180 000 М −1 см −1 ) и скромный квантовый выход (0,20), что делает его биофизическую яркость сопоставимой с eGFP и примерно в 2 раза ярче большинства красных или дальнекрасных флуоресцентных белков, полученных из кораллов . Спектральные свойства smURFP аналогичны органическому красителю Cy5 . [36] [39]

Обзоры новых классов флуоресцентных белков и их применения можно найти в цитируемых обзорах. [40] [41]
GFP имеет структуру бета-бочонка, состоящую из одиннадцати β-тяжей с гофрированной листовой компоновкой, с альфа-спиралью, содержащей ковалентно связанный хромофор 4-( п -гидроксибензилиден)имидазолидин-5-он (HBI), проходящей через центр. [3] [14] [15] Пять более коротких альфа-спиралей образуют колпачки на концах структуры. Структура бета-бочонка представляет собой почти идеальный цилиндр длиной 42 Å и диаметром 24 Å (некоторые исследования сообщали о диаметре 30 Å [16] ), [14] создавая то, что называется образованием «β-can», которое является уникальным для семейства GFP-подобных белков. [15] HBI, спонтанно модифицированная форма трипептида Ser65–Tyr66–Gly67, не флуоресцентна в отсутствие правильно свернутого каркаса GFP и существует в основном в неионизированной фенольной форме в wtGFP. [42] Обращенные внутрь боковые цепи ствола вызывают специфические реакции циклизации в Ser65–Tyr66–Gly67, которые вызывают ионизацию HBI в фенолятную форму и образование хромофора . Этот процесс посттрансляционной модификации называется созреванием . [43] Сеть водородных связей и взаимодействия электронных укладок с этими боковыми цепями влияют на цвет, интенсивность и фотостабильность GFP и его многочисленных производных. [44] Плотно упакованная природа ствола исключает молекулы растворителя, защищая флуоресценцию хромофора от тушения водой. В дополнение к автоциклизации Ser65-Tyr66-Gly67, реакция 1,2-дегидрирования происходит на остатке Tyr66. [16] Помимо трех остатков, которые образуют хромофор, такие остатки, как Gln94, Arg96, His148, Thr203 и Glu222, действуют как стабилизаторы. Остатки Gln94, Arg96 и His148 способны стабилизироваться путем делокализации заряда хромофора. Arg96 является наиболее важным стабилизирующим остатком из-за того, что он вызывает необходимые структурные перестройки, которые необходимы для кольца HBI. Любая мутация остатка Arg96 приведет к снижению скорости развития хромофора, поскольку будут потеряны надлежащие электростатические и стерические взаимодействия. Tyr66 является получателем водородных связей и не ионизируется для создания благоприятной электростатики. [45]

Механистически процесс включает циклизацию, опосредованную основанием, с последующей дегидратацией и окислением. В реакции 7a-8 происходит образование енамина из имина, тогда как в реакции 7b-9 отщепляется протон. [46] Образованный флуорофор HBI выделен зеленым цветом.
Реакции катализируются остатками Glu222 и Arg96. [46] [47] Аналогичный механизм возможен и с треонином вместо Ser65.
Зеленый флуоресцентный белок может быть использован в качестве репортерного гена . [48] [49]
Например, GFP можно использовать в качестве репортера для уровней токсичности окружающей среды. Было показано, что этот белок является эффективным способом измерения уровней токсичности различных химических веществ, включая этанол, п -формальдегид, фенол, триклозан и парабен. GFP отлично подходит в качестве репортерного белка, поскольку он не оказывает никакого влияния на хозяина при введении в клеточную среду хозяина. Благодаря этой способности не требуется внешнего визуализирующего красителя, АТФ или кофакторов. Что касается уровней загрязняющих веществ, измерялась флуоресценция, чтобы оценить влияние, которое загрязняющие вещества оказывают на клетку-хозяина. Также измерялась клеточная плотность клетки-хозяина. Результаты исследования, проведенного Song, Kim, & Seo (2016), показали, что наблюдалось снижение как флуоресценции, так и клеточной плотности по мере увеличения уровней загрязняющих веществ. Это указывало на тот факт, что клеточная активность снизилась. Дополнительные исследования этого конкретного применения, чтобы определить механизм, с помощью которого GFP действует как маркер загрязняющих веществ. [50] Аналогичные результаты были получены у данио-рерио, поскольку данио-рерио, которым вводили GFP, были примерно в двадцать раз более восприимчивы к распознаванию клеточных стрессов, чем данио-рерио, которым не вводили GFP. [51]
Самым большим преимуществом GFP является то, что он может быть наследуемым, в зависимости от того, как он был введен, что позволяет продолжать изучение клеток и тканей, в которых он экспрессируется. Визуализация GFP неинвазивна, требует только освещения синим светом. GFP сам по себе не мешает биологическим процессам, но при слиянии с интересующими белками требуется тщательная разработка линкеров для поддержания функции интересующего белка. Более того, если он используется с мономером, он способен легко диффундировать по клеткам. [52]

Доступность GFP и его производных полностью изменила флуоресцентную микроскопию и способ ее использования в клеточной биологии и других биологических дисциплинах. [53] В то время как большинство небольших флуоресцентных молекул, таких как FITC (флуоресцеинизотиоцианат), являются сильно фототоксичными при использовании в живых клетках, флуоресцентные белки, такие как GFP, обычно гораздо менее вредны при освещении в живых клетках. Это послужило толчком к разработке высокоавтоматизированных систем флуоресцентной микроскопии живых клеток, которые можно использовать для наблюдения за клетками с течением времени, экспрессирующими один или несколько белков, помеченных флуоресцентными белками.
Существует множество методов использования GFP в эксперименте по визуализации живых клеток. Самый прямой способ использования GFP — это непосредственное присоединение его к интересующему белку. Например, GFP может быть включен в плазмиду, экспрессирующую другие гены, чтобы указать на успешную трансфекцию интересующего гена. Другой метод — использовать GFP, который содержит мутацию, при которой флуоресценция будет меняться с зеленой на желтую с течением времени, что называется флуоресцентным таймером. С помощью флуоресцентного таймера исследователи могут изучать состояние производства белка, например, недавно активированный, непрерывно активированный или недавно деактивированный, на основе цвета, сообщаемого флуоресцентным белком. [54] В еще одном примере ученые модифицировали GFP так, чтобы он становился активным только после воздействия облучения, что дает исследователям инструмент для выборочной активации определенных частей клетки и наблюдения за тем, куда белки, помеченные GFP, перемещаются из исходного положения. [55] Это всего лишь два примера в бурно развивающейся области флуоресцентной микроскопии, а более полный обзор биосенсоров, использующих GFP и другие флуоресцентные белки, можно найти здесь [56]
Например, GFP широко использовался для маркировки сперматозоидов различных организмов в целях идентификации, как в Drosophila melanogaster , где экспрессия GFP может использоваться в качестве маркера для определенной характеристики. GFP также может быть выражен в различных структурах, позволяющих проводить морфологическое различие. В таких случаях ген для производства GFP включается в геном организма в области ДНК, которая кодирует целевые белки и которая контролируется той же регуляторной последовательностью ; то есть регуляторная последовательность гена теперь контролирует производство GFP, в дополнение к меченым белкам. В клетках, где экспрессируется ген и продуцируются меченые белки, GFP продуцируется одновременно. Таким образом, только те клетки, в которых экспрессируется меченый ген или продуцируются целевые белки, будут флуоресцировать при наблюдении под флуоресцентной микроскопией. Анализ таких покадровых фильмов переопределил понимание многих биологических процессов, включая сворачивание белка, транспорт белка и динамику РНК, которые в прошлом изучались с использованием фиксированного (т. е. мертвого) материала. Полученные данные также используются для калибровки математических моделей внутриклеточных систем и оценки скоростей экспрессии генов. [57] Аналогичным образом, GFP может использоваться в качестве индикатора экспрессии белка в гетерологичных системах. В этом сценарии белки слияния, содержащие GFP, вводятся косвенно, с использованием РНК конструкции, или напрямую, с самим меченым белком. Этот метод полезен для изучения структурных и функциональных характеристик меченого белка в макромолекулярном или одномолекулярном масштабе с помощью флуоресцентной микроскопии.
Микроскоп Vertico SMI с технологией SPDM Phymod использует так называемый эффект «обратимого фотообесцвечивания» флуоресцентных красителей, таких как GFP и его производные, для локализации их как отдельных молекул в оптическом разрешении 10 нм. Это также может быть выполнено как колокализация двух производных GFP (2CLM). [58]
Другим мощным применением GFP является экспрессия белка в небольших наборах определенных клеток. Это позволяет исследователям оптически обнаруживать определенные типы клеток in vitro (в чашке Петри) или даже in vivo (в живом организме). [59] Генетическая комбинация нескольких спектральных вариантов GFP является полезным приемом для анализа мозговых схем ( Brainbow ). [60] Другие интересные применения флуоресцентных белков в литературе включают использование FP в качестве датчиков мембранного потенциала нейронов , [61] отслеживание рецепторов AMPA на клеточных мембранах, [62] проникновение вируса и заражение отдельных вирусов гриппа и лентивирусных вирусов, [63] [64] и т. д.
Также было обнаружено, что новые линии трансгенных крыс GFP могут быть актуальны для генной терапии, а также для регенеративной медицины. [65] Используя «высокоэкспрессирующий» GFP, трансгенные крысы демонстрируют высокую экспрессию в большинстве тканей и многих клетках, которые не были охарактеризованы или были плохо охарактеризованы у предыдущих GFP-трансгенных крыс.
GFP показал свою полезность в криобиологии в качестве анализа жизнеспособности . Корреляция жизнеспособности, измеренная с помощью анализов трипанового синего , составила 0,97. [66] Другое применение — использование ко-трансфекции GFP в качестве внутреннего контроля эффективности трансфекции в клетках млекопитающих. [67]
Новое возможное применение GFP включает использование его в качестве чувствительного монитора внутриклеточных процессов через лазерную систему eGFP, изготовленную из линии клеток эмбриональной почки человека. Первый сконструированный живой лазер создан экспрессирующей eGFP клеткой внутри отражающей оптической полости и ударяющей ее импульсами синего света. При определенном пороговом значении импульса оптический выход eGFP становится ярче и полностью однородным по цвету чистого зеленого цвета с длиной волны 516 нм. Перед тем, как испустить лазерный свет, свет отражается вперед и назад внутри полости резонатора и проходит клетку много раз. Изучая изменения оптической активности, исследователи могут лучше понять клеточные процессы. [68] [69]
GFP широко используется в исследованиях рака для маркировки и отслеживания раковых клеток. Раковые клетки, маркированные GFP, использовались для моделирования метастазирования, процесса, посредством которого раковые клетки распространяются на отдаленные органы. [70]
GFP можно использовать для анализа колокализации белков. Это достигается путем «расщепления» белка на два фрагмента, которые способны к самосборке, а затем слияния каждого из них с двумя интересующими белками. По отдельности эти неполные фрагменты GFP не способны флуоресцировать. Однако, если два интересующих белка колокализуются, то два фрагмента GFP собираются вместе, образуя GFP-подобную структуру, которая способна флуоресцировать. Поэтому, измеряя уровень флуоресценции, можно определить, колокализуются ли два интересующих белка. [71]
Биологические процессы макромасштаба, такие как распространение вирусных инфекций, можно отслеживать с помощью маркировки GFP. [72] В прошлом мутагенный ультрафиолетовый свет (УФ) использовался для освещения живых организмов (например, см. [73] ) для обнаружения и фотографирования экспрессии GFP. Недавно была разработана технология с использованием немутагенных светодиодных ламп [74] для макросъемки. [75] В этой технологии используется насадка для эпифлуоресцентной камеры [76], основанная на том же принципе, что и при создании эпифлуоресцентных микроскопов .

Альба , флуоресцентный кролик зеленого цвета, был создан французской лабораторией по заказу Эдуардо Каца с использованием GFP в целях искусства и социальных комментариев. [77] Американская компания Yorktown Technologies продает в аквариумных магазинах флуоресцентных рыбок зебры зеленого цвета ( GloFish ), которые изначально были разработаны для обнаружения загрязнения в водоемах. NeonPets, американская компания, продает флуоресцентных мышей в индустрии домашних животных под названием NeonMice. [78] Флуоресцентные свиньи зеленого цвета, известные как Ноэли, были выведены группой исследователей во главе с У Шинн-Чи на кафедре зоотехники и технологий Национального университета Тайваня . [79] Японо-американская команда создала флуоресцентных кошек зеленого цвета в качестве доказательства концепции, чтобы потенциально использовать их в качестве модельных организмов для заболеваний, в частности ВИЧ . [80] В 2009 году южнокорейская команда из Сеульского национального университета вывела первых трансгенных биглей с фибробластными клетками из морских анемонов. Собаки испускают красный флуоресцентный свет, и они должны позволить ученым изучать гены, вызывающие такие заболевания человека, как нарколепсия и слепота. [81]
Джулиан Фосс-Андреа , художник немецкого происхождения, специализирующийся на «белковых скульптурах», [82] создал скульптуры, основанные на структуре GFP, включая «Зеленый флуоресцентный белок» (2004) высотой 1,70 метра (5 футов 7 дюймов) [83] и «Стальную медузу» (2006) высотой 1,40 метра (4 фута 7 дюймов). Последняя скульптура расположена на месте открытия GFP Шимомуры в 1962 году, в лабораториях Friday Harbor Вашингтонского университета . [ 84]
.jpg/440px-Steel_Jellyfish_(GFP).jpg)