Черная субстанция ( SN ) — это структура базальных ганглиев , расположенная в среднем мозге , которая играет важную роль в вознаграждении и движении . Substantia nigra в переводе с латыни означает «черная субстанция», что отражает тот факт, что части черной субстанции кажутся темнее соседних областей из-за высокого уровня нейромеланина в дофаминергических нейронах . [1] Болезнь Паркинсона характеризуется потерей дофаминергических нейронов в компактной части черной субстанции . [2]
Хотя черная субстанция выглядит как непрерывная полоса в срезах мозга, анатомические исследования показали, что на самом деле она состоит из двух частей с очень разными связями и функциями: pars compacta (SNpc) и pars reticulata (SNpr). Pars compacta служит в основном проекцией на контур базальных ганглиев, снабжая полосатое тело дофамином. Pars reticulata передает сигналы от базальных ганглиев к многочисленным другим структурам мозга. [3]
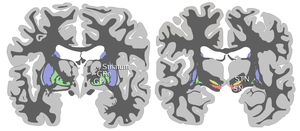


Черная субстанция, наряду с четырьмя другими ядрами, является частью базальных ганглиев . Это самое крупное ядро в среднем мозге, лежащее дорсально по отношению к ножкам мозга . У людей есть две черные субстанции, по одной с каждой стороны от средней линии.
SN делится на две части: pars reticulata (SNpr) и pars compacta (SNpc), которая лежит медиально по отношению к pars reticulata. Иногда упоминается третья область, pars lateralis, хотя обычно ее классифицируют как часть pars reticulata. (SNpr) и внутренний бледный шар (GPi) разделены внутренней капсулой . [4]
Pars reticulata имеет сильное структурное и функциональное сходство с внутренней частью бледного шара. Иногда их считают частями одной и той же структуры, разделенными белым веществом внутренней капсулы. Как и нейроны бледного шара, нейроны pars reticulata в основном ГАМКергические . [5] [6]
Основной вход в SNpr исходит из полосатого тела . Он идет двумя путями, известными как прямой и непрямой пути . Прямой путь состоит из аксонов от средних шипиковых клеток в полосатом теле, которые проецируются непосредственно в ретикулярную часть. Непрямой путь состоит из трех звеньев: проекция от средних шипиковых клеток полосатого тела к внешней части бледного шара ; ГАМКергическая проекция от бледного шара к субталамическому ядру и глутаматергическая проекция от субталамического ядра к ретикулярной части. [6] [7] [ нужен лучший источник ] Таким образом, активность полосатого тела через прямой путь оказывает ингибирующее действие на нейроны в (SNpr), но возбуждающее действие через непрямой путь. Прямые и непрямые пути берут начало в разных подгруппах средних шипиковых клеток полосатого тела: они тесно переплетены, но экспрессируют разные типы дофаминовых рецепторов, а также демонстрируют другие нейрохимические различия.
Значительные проекции происходят в таламусе (вентрально-латеральном и вентрально-переднем ядрах), верхнем холмике и других каудальных ядрах из pars reticulata (нигроталамический путь), [8] , которые используют ГАМК в качестве своего нейротрансмиттера. Кроме того, эти нейроны образуют до пяти коллатералей, которые разветвляются как в пределах pars compacta, так и в пределах pars reticulata, вероятно, модулируя дофаминергическую активность в pars compacta. [9]
Черная субстанция играет важную роль в работе мозга, в частности, в движении глаз , планировании движений , поиске вознаграждения , обучении и зависимости . Многие эффекты черной субстанции опосредуются через полосатое тело . Черный дофаминергический вход в полосатое тело через нигростриарный путь тесно связан с функцией полосатого тела. [10] Созависимость между полосатым телом и черной субстанцией можно увидеть следующим образом: когда черная субстанция подвергается электрической стимуляции, никакого движения не происходит; однако симптомы дегенерации черной субстанции из-за болезни Паркинсона являются ярким примером влияния черной субстанции на движение. В дополнение к функциям, опосредованным полосатым телом, черная субстанция также служит основным источником ГАМКергического торможения различных мозговых мишеней.
Pars reticulata черной субстанции является важным центром обработки в базальных ганглиях. ГАМКергические нейроны в pars reticulata передают окончательно обработанные сигналы базальных ганглиев в таламус и верхний холмик . Кроме того, pars reticulata также подавляет дофаминергическую активность в pars compacta через аксональные коллатерали, хотя функциональная организация этих связей остается неясной.
ГАМКергические нейроны pars reticulata спонтанно генерируют потенциалы действия . У крыс частота потенциалов действия составляет примерно 25 Гц. [11] Целью этих спонтанных потенциалов действия является ингибирование мишеней базальных ганглиев, а снижение ингибирования связано с движением. [12] Субталамическое ядро дает возбуждающий вход, который модулирует скорость активации этих спонтанных потенциалов действия. Однако поражение субталамического ядра приводит лишь к 20%-ному снижению скорости активации pars reticulata, что позволяет предположить, что генерация потенциалов действия в pars reticulata в значительной степени автономна, [13] как показано на примере роли pars reticulata в саккадическом движении глаз . Группа ГАМКергических нейронов из pars reticulata проецируется в верхние холмики, демонстрируя высокий уровень устойчивой ингибирующей активности. [14] Проекции от хвостатого ядра к верхнему холмику также модулируют саккадическое движение глаз. Измененные паттерны срабатывания pars reticulata, такие как одиночные спайки или залпы, обнаруживаются при болезни Паркинсона [15] и эпилепсии . [16]
Наиболее важной функцией pars compacta является двигательный контроль , [17] хотя роль substantia nigra в двигательном контроле является косвенной; электрическая стимуляция substantia nigra не приводит к движению из-за посредничества полосатого тела в нигральном влиянии движения. Pars compacta посылает возбуждающий сигнал в полосатое тело через путь D1, который возбуждает и активирует полосатое тело, что приводит к высвобождению ГАМК на бледный шар для ингибирования его ингибирующего воздействия на таламическое ядро. Это заставляет таламокортикальные пути возбуждаться и передавать сигналы двигательных нейронов в кору головного мозга, позволяя инициировать движение, которое отсутствует при болезни Паркинсона. Однако отсутствие нейронов pars compacta оказывает большое влияние на движение, о чем свидетельствуют симптомы болезни Паркинсона. Двигательная роль pars compacta может включать в себя тонкий двигательный контроль, что было подтверждено на животных моделях с поражениями в этой области. [18]
Компактная часть мозга активно участвует в обученных реакциях на стимулы. У приматов активность дофаминергических нейронов в нигростриарном пути увеличивается при предъявлении нового стимула. [19] Дофаминергическая активность снижается при повторном предъявлении стимула. [19] Однако поведенчески значимое предъявление стимула (т. е. вознаграждения) продолжает активировать дофаминергические нейроны в компактной части черной субстанции. Дофаминергические проекции из вентральной области покрышки (нижняя часть «среднего мозга» или мезэнцефалона) в префронтальную кору (мезокортикальный путь) и в прилежащее ядро (мезолимбический путь – «мезо» относится к «из мезэнцефалона»… в частности, вентральная область покрышки ) участвуют в вознаграждении, удовольствии и аддиктивном поведении. Компактная часть также важна для пространственного обучения, наблюдений за окружающей средой и местоположением в пространстве. Повреждения компактной части приводят к дефициту обучения при повторении идентичных движений, [20] и некоторые исследования указывают на ее участие в дорсальной стриатозависимой, основанной на реакции системе памяти, которая функционирует относительно независимо от гиппокампа , который, как традиционно считается, обслуживает пространственные или эпизодические функции памяти. [21]
Компактная часть также играет роль во временной обработке и активируется во время воспроизведения времени. Повреждения компактной части приводят к временным дефицитам. [22] В последнее время предполагается, что компактная часть участвует в регуляции цикла сна-бодрствования, [23] что согласуется с такими симптомами, как бессонница и нарушения быстрого сна , о которых сообщают пациенты с болезнью Паркинсона . Тем не менее, частичный дефицит дофамина, который не влияет на двигательный контроль, может приводить к нарушениям цикла сна-бодрствования, особенно к паттернам нервной активности, подобным фазе быстрого сна, во время бодрствования, особенно в гиппокампе . [24]
Черная субстанция играет решающую роль в развитии многих заболеваний и синдромов, включая паркинсонизм и болезнь Паркинсона . Существует исследование, показывающее, что высокочастотная стимуляция левой черной субстанции может вызывать транзиторные симптомы острой депрессии. [25]
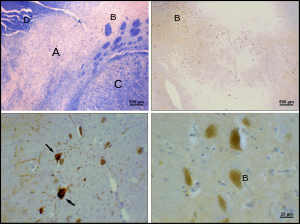
Болезнь Паркинсона — нейродегенеративное заболевание , характеризующееся, в частности, гибелью дофаминергических нейронов в SNpc. Основные симптомы болезни Паркинсона включают тремор , акинезию , брадикинезию и скованность. [26] Другие симптомы включают нарушения осанки, усталость , нарушения сна и подавленное настроение . [27]
Причина смерти дофаминергических нейронов в SNpc неизвестна. Однако были выявлены некоторые факторы, влияющие на уникальную восприимчивость дофаминергических нейронов в pars compacta. Во-первых, дофаминергические нейроны демонстрируют аномалии в митохондриальном комплексе 1 , вызывая агрегацию альфа-синуклеина ; это может привести к аномальной обработке белков и гибели нейронов. [28] Во-вторых, дофаминергические нейроны в pars compacta содержат меньше кальбиндина, чем другие дофаминергические нейроны. [29] Кальбиндин — это белок, участвующий в транспорте ионов кальция внутри клеток, а избыток кальция в клетках токсичен. Теория кальбиндина объяснила бы высокую цитотоксичность болезни Паркинсона в черной субстанции по сравнению с вентральной тегментальной областью. Независимо от причины гибели нейронов, пластичность pars compacta очень надежна; Симптомы болезни Паркинсона обычно не проявляются до тех пор, пока не погибнет по крайней мере 30% дофаминергических нейронов компактной части мозга. [30] Большая часть этой пластичности происходит на нейрохимическом уровне; системы транспорта дофамина замедляются, что позволяет дофамину задерживаться на более длительные периоды времени в химических синапсах полосатого тела. [31]
Менке, Джбабди, Миллер, Мэтьюз и Зари (2010) использовали диффузионную тензорную визуализацию, а также картирование T1 для оценки объемных различий в SNpc и SNpr у участников с болезнью Паркинсона по сравнению со здоровыми людьми. Эти исследователи обнаружили, что у участников с болезнью Паркинсона постоянно наблюдался меньший размер черной субстанции, особенно в SNpr. Поскольку SNpr связан с задним таламусом, вентральным таламусом и, в частности, с моторной корой, и поскольку участники с болезнью Паркинсона сообщают о меньшем размере SNprs (Менке, Джбабди, Миллер, Мэтьюз и Зари, 2010), небольшой объем этой области может быть причиной двигательных нарушений, обнаруженных у пациентов с болезнью Паркинсона. Этот небольшой объем может быть причиной более слабых и/или менее контролируемых двигательных движений, что может приводить к тремору, часто испытываемому людьми с болезнью Паркинсона. [32]
Окислительный стресс и окислительное повреждение в SNpc, вероятно, являются ключевыми факторами этиологии болезни Паркинсона по мере старения людей. [33] Повреждения ДНК, вызванные окислительным стрессом, могут быть восстановлены с помощью процессов, модулируемых альфа-синуклеином . [34] Альфа-синуклеин экспрессируется в черной субстанции, но его функция восстановления ДНК , по-видимому, нарушена в нейронах, содержащих включения телец Леви . [34] Эта потеря может вызвать гибель клеток. [35] [36] [37]
Повышенный уровень дофамина уже давно связывают с развитием шизофрении . [38] Однако до сих пор продолжаются многочисленные споры вокруг этой дофаминовой гипотезы шизофрении . Несмотря на разногласия, антагонисты дофамина остаются стандартным и успешным лечением шизофрении. К этим антагонистам относятся антипсихотики первого поколения (типичные), такие как бутирофеноны , фенотиазины и тиоксантены . Эти препараты в значительной степени были заменены антипсихотиками второго поколения (атипичными), такими как клозапин и палиперидон . В целом, эти препараты действуют не на сами нейроны, продуцирующие дофамин, а на рецепторы на постсинаптическом нейроне.
Другие, нефармакологические доказательства в поддержку гипотезы дофамина, связанной с черной субстанцией, включают структурные изменения в компактной части, такие как уменьшение размера синаптических окончаний. [39] Другие изменения в черной субстанции включают повышенную экспрессию рецепторов NMDA в черной субстанции и сниженную экспрессию дисбиндина . Повышенные рецепторы NMDA могут указывать на участие взаимодействий глутамата и дофамина в шизофрении. Дисбиндин, который (спорно) связан с шизофренией, может регулировать высвобождение дофамина, а низкая экспрессия дисбиндина в черной субстанции может иметь важное значение в этиологии шизофрении. [40] Из-за изменений в черной субстанции в мозге шизофреника, в конечном итоге, может стать возможным использование определенных методов визуализации (таких как нейромеланин-специфическая визуализация) для обнаружения физиологических признаков шизофрении в черной субстанции. [41]
Деревянный сундук , также называемый синдромом ригидности грудной клетки фентанила, является редким побочным эффектом синтетических опиоидов, таких как фентанил , сульфентанил, альфентанил , ремифентанил . Он приводит к общему повышению тонуса скелетных мышц . Считается, что механизм заключается в повышенном высвобождении дофамина и сниженном высвобождении ГАМК в нервах черной субстанции/полосатого тела. Эффект наиболее выражен в мышцах грудной клетки и может привести к нарушению вентиляции. Это состояние чаще всего наблюдается при анестезии, когда внутривенно вводятся быстрые и высокие дозы этих препаратов. [42] [43] [44]
Мультисистемная атрофия, характеризующаяся дегенерацией нейронов в полосатом теле и черной субстанции, ранее называлась стриатонигральной дегенерацией .
Химическая манипуляция и модификация черной субстанции важны в области нейрофармакологии и токсикологии . Различные соединения, такие как леводопа и МФТП, используются в лечении и изучении болезни Паркинсона, а многие другие препараты оказывают воздействие на черную субстанцию.
Исследования показали, что в определенных областях мозга амфетамин и следовые амины увеличивают концентрацию дофамина в синаптической щели , тем самым усиливая реакцию постсинаптического нейрона. [45] Различные механизмы, посредством которых амфетамин и следовые амины влияют на концентрацию дофамина, были тщательно изучены, и известно, что они включают как DAT , так и VMAT2 . [45] [46] [47] Амфетамин похож по структуре на дофамин и следовые амины; как следствие, он может проникать в пресинаптический нейрон через DAT , а также путем диффузии через нервную мембрану напрямую. [45] При проникновении в пресинаптический нейрон амфетамин и следовые амины активируют TAAR1 , который посредством сигнализации протеинкиназы вызывает отток дофамина, зависимую от фосфорилирования интернализацию DAT и неконкурентное обратный захват. [45] [48] Из-за сходства между амфетамином и следовыми аминами он также является субстратом для переносчиков моноаминов; как следствие, он (конкурентно) ингибирует обратный захват дофамина и других моноаминов, также конкурируя с ними за захват. [45]
Кроме того, амфетамин и следовые амины являются субстратами для нейронального везикулярного переносчика моноаминов, везикулярного переносчика моноаминов 2 (VMAT2). [47] Когда амфетамин поглощается VMAT2 , везикула взамен высвобождает (оттекает) молекулы дофамина в цитозоль. [47]
Механизм действия кокаина в мозге человека включает ингибирование обратного захвата дофамина, [49] что объясняет аддиктивные свойства кокаина, поскольку дофамин является критическим нейротрансмиттером для вознаграждения. Однако кокаин более активен в дофаминергических нейронах вентральной области покрышки, чем в черной субстанции. Введение кокаина увеличивает метаболизм в черной субстанции, что может объяснить измененную двигательную функцию, наблюдаемую у субъектов, употребляющих кокаин. [50] Ингибирование обратного захвата дофамина кокаином также ингибирует запуск спонтанных потенциалов действия компактной частью мозга. [51] Механизм, посредством которого кокаин ингибирует обратный захват дофамина, включает его связывание с белком -транспортером дофамина . Однако исследования показывают, что кокаин также может вызывать снижение уровней мРНК DAT , [52] скорее всего, из-за того, что кокаин блокирует рецепторы дофамина, а не из-за прямого вмешательства в транскрипционные или трансляционные пути. [52]
Инактивация черной субстанции может оказаться возможным методом лечения кокаиновой зависимости. В исследовании на крысах, зависимых от кокаина, инактивация черной субстанции с помощью имплантированных канюль значительно снизила рецидивы кокаиновой зависимости. [53]
Черная субстанция является целью химических терапевтических средств для лечения болезни Паркинсона. Леводопа (обычно называемая L-ДОФА), предшественник дофамина, является наиболее часто назначаемым лекарством от болезни Паркинсона, несмотря на споры относительно нейротоксичности дофамина и L-ДОФА. [54] Препарат особенно эффективен при лечении пациентов на ранних стадиях болезни Паркинсона, хотя со временем он теряет свою эффективность. [55] Леводопа может пересекать гематоэнцефалический барьер и повышать уровень дофамина в черной субстанции, тем самым облегчая симптомы болезни Паркинсона. Недостатком лечения леводопой является то, что она лечит симптомы болезни Паркинсона (низкий уровень дофамина), а не причину (гибель дофаминергических нейронов в черной субстанции).
MPTP — это нейротоксин , специфичный для дофаминергических клеток мозга, в частности, в черной субстанции. MPTP оказался в центре внимания в 1982 году, когда у потребителей героина в Калифорнии проявились симптомы, похожие на болезнь Паркинсона, после использования MPPP, загрязненного MPTP. Пациенты, которые были ригидными и почти полностью неподвижными, отреагировали на лечение леводопой. Ремиссии симптомов, похожих на болезнь Паркинсона, не сообщалось, что предполагает необратимую гибель дофаминергических нейронов. [56] Предложенный механизм MPTP включает нарушение функции митохондрий , включая нарушение метаболизма и создание свободных радикалов . [57]
Вскоре после этого MPTP был протестирован на животных моделях на предмет его эффективности в индуцировании болезни Паркинсона (с успехом). MPTP вызывал акинезию, ригидность и тремор у приматов, и было обнаружено, что его нейротоксичность очень специфична для substantia nigra pars compacta. [58] У других животных, таких как грызуны, индуцирование болезни Паркинсона MPTP является неполным или требует гораздо более высоких и частых доз, чем у приматов. Сегодня MPTP остается наиболее предпочтительным методом для индуцирования болезни Паркинсона на животных моделях . [57] [59]
Черная субстанция была открыта в 1784 году Феликсом Вик-д'Азиром [60] , а Самуэль Томас фон Зёммеринг упомянул об этой структуре в 1791 году. [61] Дифференциация между сетчатой частью и компактной частью черной субстанции была впервые предложена Сано в 1910 году. [62] В 1963 году Олег Хорникевич сделал вывод из своего наблюдения, что «потеря клеток в черной субстанции (у пациентов с болезнью Паркинсона) вполне может быть причиной дефицита дофамина в полосатом теле». [63]
{{cite book}}: |journal=проигнорировано ( помощь )