Legionella pneumophila — аэробная , плеоморфная, жгутиконосная , не образующая спор, грамотрицательная бактерия. [1] [2] Существует четырнадцать серогрупп L. pneumophila. L. pneumophila — факультативный внутриклеточный паразит, который заражает почвенных амеб и пресноводных амебофлагеллятов для репликации. [3] [4] Таким образом, этот патоген обычно встречается вблизи пресноводных сред [5] и проникает в одноклеточную жизнь , используя их для выполнения метаболических функций. [6] Благодаря способности L. pneumophila процветать в воде, она может расти в системах фильтрации воды, попадая в краны, душевые и другие приспособления, а затем распространяться через аэрозольные капли воды. [6]
L. pneumophila также является возбудителем болезни легионеров , также известной как легионеллез. [4] Благодаря природе репликации бактерий, они способны свободно размножаться в макрофагах человека. [4] После заражения эта бактерия может вызвать пневмонию с такими симптомами, как лихорадка, делирий, диарея и снижение функции печени и почек. [7] Инфекции L. pneumophila можно диагностировать с помощью анализа мочи на антиген. [8] [9] Инфекции, вызванные бактериями, можно лечить фторхинолонами и антибиотиками азитромицином . [8]
L. pneumophila — коккобацилла . [10] Это грамотрицательная аэробная бактерия, неспособная гидролизовать желатин или вырабатывать уреазу . Она также не ферментирует . L. pneumophila не пигментирована и не автофлуоресцирует . Она оксидаза- и каталаза -положительна и вырабатывает бета-лактамазу . [11] Морфология колонии L. pneumophila серо-белая с текстурированным, похожим на граненое стекло внешним видом; для ее роста также требуются цистеин и железо . [12] Она растет на буферном агаре с древесно-угольным дрожжевым экстрактом , а также во влажных средах, таких как водопроводная вода, в «опалоподобных» колониях. [12]
Бактерия является факультативной и способна сохраняться в различных средах. Благодаря специализированной характеристике бактерия может жить внутри- или внеклеточно. Это объясняет, почему L. pneumophila присутствует во многих пресноводных средах, а также в альвеолярных макрофагах в легких человека. Это достигается посредством ее двух форм: трансмиссивной и репликативной. Переход между ними происходит на протяжении всего ее жизненного цикла; она активируется путем изменения доступности метаболических/питательных ресурсов в ее среде. Чтобы заразить своих хозяев, бактерии используют свою трансмиссивную форму. Затем следует репликативная форма для осуществления пролиферации. [13]
L. pneumophila — грамотрицательный организм, структура которого основана на клеточной мембране, состоящей из двух мембран, разделенных периплазматическим пространством . Его уникальная внешняя мембрана, состоящая из липопротеинов , фосфолипидов и других белков, является отличительной чертой Legionella spp . Как и большинство грамотрицательных бактерий, L. pneumophila имеет трехкомпонентный липополисахарид . Legionella spp. обладают уникальными липополисахаридами (ЛПС), простирающимися от наружного мембранного листка внешней клеточной мембраны, которые играют роль в патогенности и адгезии к клетке-хозяину. Липополисахариды являются ведущим поверхностным антигеном всех видов Legionella , включая L. pneumophila . [14]
Основы соматической антигенной специфичности этого организма расположены на боковых цепях его клеточной стенки. Химический состав этих боковых цепей ЛПС как в отношении компонентов, так и расположения различных сахаров определяет природу соматических или О- антигенных детерминант , которые являются важными средствами серологической классификации многих грамотрицательных бактерий. L. pneumophila проявляет отличительные химические характеристики в своей структуре ЛПС, которые отличают ее от других грамотрицательных бактерий. [15] Уникальные атрибуты являются ключевыми факторами ее серологической идентичности и биологической функции. [15]

L. pneumophila процветает в широком диапазоне условий окружающей среды, выдерживая температуры от 0°C до 63 °C, диапазон pH от 5,0 до 8,5 и концентрацию растворенного кислорода от 0,2 до 15,0 мг/л. Однако она размножается в более узком диапазоне температур от 25 °C до 42 °C [5] .
Широкая температурная толерантность организма позволяет ему выживать в пресноводных средах с широким диапазоном температур. L. pneumophila особенно устойчива к производным хлора, которые обычно используются для борьбы с патогенами, передающимися через воду. Эта устойчивость позволяет проникать и сохраняться в водных системах даже при использовании стандартных процессов дезинфекции [6] . Водопроводные сети являются основным источником заражения L. pneumophila , что позволяет ей расти и размножаться в таких местах, как градирни, системы водоснабжения больниц, отелей и круизных судов [16]. Эта бактерия может образовывать и находиться в биопленках внутри труб систем водоснабжения, что позволяет ей распыляться через такие приспособления, как краны, душевые и разбрызгиватели. Воздействие этих аэрозолей может привести к инфицированию восприимчивых людей [17] .
Как факультативный внутриклеточный паразит , L. pneumophila может проникать и размножаться внутри простейших в окружающей среде, особенно внутри видов родов Acanthamoeba и Naegleria , которые, таким образом, могут служить резервуаром для L. pneumophila. Эти хозяева обеспечат защиту от неблагоприятных физических и химических условий, таких как хлорирование [6] .
Биопленки — это специализированные сообщества, прикрепленные к поверхности, которые могут состоять из одного микроба или нескольких разных микробов, начиная от бактерий , водорослей и простейших . [5] Эти защитные матрицы позволяют микробам жить в течение длительных периодов времени в средах с низким содержанием питательных веществ. [11] Основная цель гена bffA — регулировать образование биопленки. [18] Биопленки на водопроводных системах и в системах распределения воды — это то место, где может выживать множество L. pneumophila . [5] В период с 2009 по 2010 год L. pneumophila способствовала 58% от общего числа вспышек заболеваний, связанных с питьевой водой в Соединенных Штатах, что привело к увеличению исследований, посвященных биопленкам L. pneumophila и ее пролиферации. [19] Материал также играет роль в пролиферации биопленки. В водопроводных трубах L. pneumophila чаще обнаруживалась в пластиковых трубах при температуре 40 °C, а не в медных трубах, которые фактически подавляли рост. [5]
Legionella — это род, который, как известно, заражает и размножается внутри видов экологических простейших. Мы знаем по крайней мере о 20 различных видах простейших, которые поддерживают внутриклеточную репликацию L. pneumophila. [20] Эта бактерия может заражать и выживать внутри родов простейших, таких как Acanthamoeba , Vermamoeba и Naegleria . Бактерии окружены устойчивой цистой, находясь внутри клетки-хозяина, что позволяет им выживать в суровых условиях окружающей среды, таких как хлор, который обычно используется в системах очистки воды. [21]
Хотя известно, что простейшие играют важную роль в экологии L. pneumophila , мало данных о том, как эти организмы взаимодействуют с другими микробами в окружающей среде, и как это влияет на L. pneumophila в целом. [20]
L. pneumophila является основным возбудителем легионеллеза , ответственным за более чем 90% случаев в Соединенных Штатах. [22] Примерно 2 из 100 000 человек заражаются каждый год в Европейском союзе (ЕС), при этом уровень инфицирования составляет приблизительно 5 на 100 000 в Италии. [23] Наибольшее количество зарегистрированных случаев в США, ЕС и Италии было среди мужчин старше 50 лет. [23] [22] L. pneumophila часто заражает людей через некачественные источники воды. Примерно 20% зарегистрированных случаев легионеллеза происходят из медицинских учреждений, домов престарелых или туристических учреждений, которые подвергались воздействию воды, загрязненной L. pneumophila. [22] Также может быть повышен риск заражения L. pneumophila из частных колодцев, поскольку они часто не регулируются и не так тщательно дезинфицируются, как муниципальные системы водоснабжения. [24] Несколько крупных вспышек болезни легионеров произошли в общественных джакузи, поскольку температурный диапазон воды идеально подходит для роста легионеллы . [25] [26]
Болезнь легионеров получила мировое признание после вспышки в 1976 году в отеле в Филадельфии, штат Пенсильвания. Возбудителем вспышки была L. pneumophila , которая загрязнила систему кондиционирования воздуха отеля, что позволило микробу распространиться в окружающей среде отеля. Основным способом передачи заболевания является вдыхание загрязненных водных аэрозолей. [22] В результате вспышки было зарегистрировано в общей сложности 182 случая и 29 смертей. [23] Этот инцидент положил начало исследованию бактерий, вызывающих заболевание, а также профилактических подходов к загрязнению. [22]

.jpg/440px-Legionella_pneumonia_(3785990105).jpg)
Естественным хозяином L. pneumophila являются пресноводные простейшие, но бактерии способны проникать и размножаться в человеческих альвеолярных макрофагах . [28] Интернализация бактерий может быть усилена присутствием антител и комплемента , но не является абсолютно необходимой. [29] Интернализация бактерий, по-видимому, происходит посредством фагоцитоза или спирального фагоцитоза и зависит от системы секреции Dot/Icm типа 4B ( T4BSS ). [28] После интернализации система Dot/Icm начинает секретировать бактериальные эффекторные белки , которые привлекают факторы хозяина в вакуоль, содержащую легионеллу (LCV). Этот процесс предотвращает слияние LCV с лизосомами , которые в противном случае разлагали бы бактерии. Везикулы шероховатого эндоплазматического ретикулума клетки-хозяина притягиваются к LCV, и эти вакуоли снабжают LCV необходимыми липидами и белками. [28] Целостность мембраны LCV требует постоянного снабжения липидов хозяина, таких как клеточный холестерин и цис-мононенасыщенная жирная кислота, пальмитолеиновая кислота. [30] [31] Репликация L. pneumophila происходит внутри LCV. После того, как питательные вещества истощаются, бактерии приобретают жгутики и цитотоксичность. Чтобы выйти из клетки-хозяина, L. pneumophila лизирует LCV и находится в цитоплазме. В цитоплазме L. pneumophila подавляет органеллы и функцию и структуру плазматической мембраны, что в конечном итоге приводит к осмотическому лизису клетки-хозяина. [32]
L. pneumophila демонстрирует уникальную липополисахаридную (ЛПС) структуру, которая является высокогидрофобной из-за ее плотной упаковки разветвленными жирными кислотами и повышенного уровня O -ацетил и N -ацетил групп. [33] Эта структура помогает предотвратить взаимодействие с общим корецептором иммунной системы ЛПС, CD14. [33] Существует также корреляция между ЛПС с высокой молекулярной массой и ингибированием слияния фагосомы и лизосомы. [33] L. pneumophila производит пили различной длины. Два белка пили: PilE и препилинпептидаза (PilD) отвечают за производство пили типа IV и последующую внутриклеточную пролиферацию. [34] L. pneumophila обладает единственным полярным жгутиком , который используется для подвижности клеток, адгезии, вторжения в хозяина и образования биопленки. [33] Те же регуляторы, которые контролируют жгутикование, также контролируют избегание лизосом и цитотоксичность . [33] Потенциатор инфекционности макрофагов является еще одним ключевым компонентом вторжения в клетку хозяина и внутриклеточной репликации. MIP проявляет активность пептидил-пролил цис/транс -изомеразы (PPIase), которая имеет решающее значение для выживания внутри макрофага, а также для трансмиграции через эпителиальный барьер легких. [33] [34]
Другим ключевым фактором вирулентности L. pneumophila является получение железа, микроб имеет два метода поглощения железа, которые он использует. Двухвалентное железо собирается с помощью транспортной системы, включающей белок внутренней мембраны, известный как белок FeoB. Оптимальное внутриклеточное инфицирование достигается в амебах и макрофагах с помощью этой транспортной системы. Вторая форма поглощения, включающая трехвалентное железо, достигается с помощью хелатора железа, известного как легиобактин. Он секретируется L. pneumophila, когда микробы выращиваются в химически разработанной среде с низким содержанием железа. [35]
Бактерии используют систему секреции типа IVB, известную как Dot/Icm, для инъекции эффекторных белков в хозяина. Эти эффекторы участвуют в повышении способности бактерий выживать внутри клетки хозяина. L. pneumophila кодирует более 330 «эффекторных» белков, [36] которые секретируются системой транслокации Dot/Icm для вмешательства в процессы клетки хозяина с целью содействия выживанию бактерий. Было предсказано, что род Legionella кодирует более 10 000 и, возможно, до ~18 000 эффекторов, которые с высокой вероятностью будут секретированы в клетки хозяина. [37] [38]
Одним из основных способов, которым L. pneumophila использует свои эффекторные белки, является вмешательство в слияние вакуоли, содержащей Legionella, с эндосомами хозяина и, таким образом, защита от лизиса. [39] Исследования нокаутов транслоцированных эффекторов Dot/Icm показывают, что они жизненно важны для внутриклеточного выживания бактерии, но многие отдельные эффекторные белки, как полагают, функционируют избыточно, поскольку нокауты одного эффектора редко препятствуют внутриклеточному выживанию. Такое большое количество транслоцированных эффекторных белков и их избыточность, вероятно, являются результатом того, что бактерия эволюционировала во многих различных простейших хозяевах. [40]
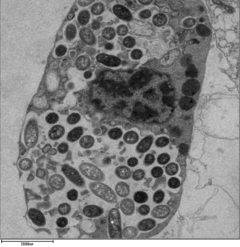
Для того чтобы легионелла выжила в макрофагах и простейших, она должна создать специализированный отсек, известный как вакуоль, содержащая легионеллу (LCV). [41] Благодаря действию системы секреции Dot/Icm бактерии способны предотвратить деградацию по нормальному пути эндосомального транспорта и вместо этого размножаться. Вскоре после интернализации бактерии специфически рекрутируют везикулы и митохондрии, полученные из эндоплазматического ретикулума , в LCV, предотвращая при этом рекрутирование эндосомальных маркеров, таких как Rab5a и Rab7a . Формирование и поддержание вакуолей имеют решающее значение для патогенеза; бактерии, лишенные системы секреции Dot/Icm, не являются патогенными и не могут размножаться внутри клеток, в то время как удаление эффектора Dot/Icm SdhA приводит к дестабилизации вакуолярной мембраны и отсутствию бактериальной репликации. [42] [43]
L. pneumophila использует гликолиз , путь Энтнера-Дудорова (ED), пентозофосфатный путь (PP) и цикл лимонной кислоты (TCA). [44] Хотя L. pneumophila также может осуществлять глюконеогенез , у нее нет генов для кодирования 1,6-бифосфатаз. Поэтому для завершения глюконеогенеза используются другие ферменты. Вместо этого используется фруктозо-6-фосфатальдолаза. [44] Эта тенденция также присутствует, когда речь идет о пути PP, который может происходить без субстратов, таких как 6-фосфоглюконатдегидрогеназа. [44] Пути ED и PP являются основными путями метаболизма глюкозы в этом организме. Наряду с этими путями было обнаружено, что серин является основным питательным веществом из-за его способности превращаться в пируват, который является важным промежуточным продуктом в метаболических путях у L. pneumophila . [44]
Хотя метаболизм глюкозы используется, он не является одним из основных путей синтеза в организме. При использовании среды, содержащей глюкозу, рост L. pneumophila не увеличивался, а углеводы не считались важным источником углерода в L. pneumophila. Глюкоза может выступать в качестве косубстрата только при определенных условиях, так как этот микроб использует аминокислоты чаще и эффективнее. [44]
Legionella является ауксотрофной по семи аминокислотам: цистеину, лейцину, метионину, валину, треонину, изолейцину и аргинину. Оказавшись внутри клетки-хозяина, Legionella нуждается в питательных веществах для роста и размножения. Внутри вакуоли доступность питательных веществ низкая; высокая потребность в аминокислотах не покрывается транспортом свободных аминокислот, обнаруженных в цитоплазме хозяина . Чтобы улучшить доступность аминокислот, паразит стимулирует механизмы хозяина протеасомной деградации. Этот процесс в L. pneumophila включает в себя убиквитинлигазу SCF1 и эффектор AnkB F-Box , который фарнезилируется активностью трех ферментов хозяина, локализованных в мембране LCV: фарнезилтрансферазы , протеазы Ras-конвертирующего фермента-1 и ICMT . Фарнезилирование позволяет AnkB закрепиться на цитоплазматической стороне вакуоли. SCF1 и AnkB взаимодействуют друг с другом, разрушая полиубиквитинированные белки, связанные с Lys. [45] Это приводит к образованию избытка свободных аминокислот в цитоплазме клеток, инфицированных L. pneumophila , которые могут использоваться для внутривакуолярной пролиферации паразита.
Полиубиквитинирование, связанное с K48, является маркером протеасомной деградации, которая высвобождает пептиды длиной от 2 до 24 аминокислот, которые быстро расщепляются до аминокислот различными олигопептидазами и аминопептидазами, присутствующими в цитоплазме. Аминокислоты импортируются в LCV через различные транспортеры аминокислот, такие как нейтральный транспортер аминокислот B(0) . [45]
Аминокислоты являются основным источником углерода и энергии L. pneumophila , которые имеют почти 12 классов ABC-транспортеров , пермеаз аминокислот и много протеаз , чтобы эксплуатировать его. Импортируемые аминокислоты используются L. pneumophila для получения энергии через цикл TCA (цикл Кребса) и в качестве источников углерода и азота. Поскольку деградация аминокислот действует как основной источник углерода для L. pneumophila, этот микроб не так сильно зависит от глюкозы. Несмотря на это, L. pneumophila содержит несколько амилаз, таких как LamB, которая гидролизует полисахариды в мономеры глюкозы для метаболизма. Потеря LamB может привести к серьезным проблемам роста для L. pneumophila. [46]
Однако содействие протеасомной деградации для получения аминокислот и гидролиза полисахаридов может быть не единственной стратегией вирулентности для получения источников углерода и энергии от хозяина. Секретируемые деградирующие ферменты типа II могут обеспечить дополнительную стратегию для генерации источников углерода и энергии. [47] L. pneumophila является единственным известным внутриклеточным патогеном, имеющим систему секреции типа II (секретом). При секреции типа II белки сначала транслоцируются через внутреннюю мембрану в периплазматическое пространство. Этот процесс опосредуется либо путем Sec, либо путем Tat. Вскоре после этого те же белки затем транспортируются через определенную пору во внешней мембране к внешней стороне клетки. Считается, что этот секретом имеет до 60 белков, включенных в систему. [47]
Существует 14 известных серогрупп L. pneumophila, но серогруппа 1 чаще всего является возбудителем болезни легионеров. [48] Три штамма, L. pneumophila Philadelphia , L. pneumophila Paris и L. pneumophila Lens, были выделены в 2004 году, что проложило путь к пониманию молекулярной биологии бактерий . [49] Подвиды, которые обычно определяются географическим положением, разделяют около 80% своего генома с вариациями между штаммами, которые объясняют разницу в вирулентности между подвидами. [49] Геном относительно большой, около 3,5 мегапар оснований (мбп), что отражает большее количество генов, что соответствует способности легионеллы адаптироваться к различным хозяевам и средам. [49] Существует относительно высокое содержание эукариотических белков (ELP). ELP полезны для имитации эукариотических хозяев бактерий для патогенности. [49] Другие гены L. pneumophila кодируют специфичные для Legionella вакуоли, транспортеры эффлюкса, белки анкиринового повтора и многие другие характеристики, связанные с вирулентностью. [49] Углубленный сравнительный геномный анализ с использованием ДНК-массивов для изучения генного состава 180 штаммов Legionella выявил высокую геномную пластичность и частые события горизонтального переноса генов . [49] Горизонтальный перенос генов позволяет L. pneumophila быстро эволюционировать и обычно связан с устойчивостью к лекарственным препаратам. [50]
Трансформация — это бактериальная адаптация, включающая перенос ДНК от одной бактерии к другой через окружающую жидкую среду. Трансформация — это бактериальная форма полового размножения . [51] Для того чтобы бактерия могла связать, принять и рекомбинировать экзогенную ДНК в свою хромосому, она должна войти в особое физиологическое состояние, называемое « компетентностью ».
Чтобы определить, какие молекулы могут индуцировать компетентность у L. pneumophila , были протестированы 64 токсичные молекулы. [52] Только шесть из этих молекул, все повреждающие ДНК агенты, вызвали сильную индукцию компетентности. Это были митомицин С (который вводит межцепочечные сшивки ДНК), норфлоксацин , офлоксацин и налидиксовая кислота (ингибиторы ДНК-гиразы , которые вызывают двухцепочечные разрывы), бицикломицин (вызывает двухцепочечные разрывы) и гидроксимочевина (вызывает окисление оснований ДНК). Эти результаты предполагают, что компетентность к трансформации у L. pneumophila развилась в ответ на повреждение ДНК . [52] Возможно, индукция компетентности обеспечивает преимущество выживания у естественного хозяина, как это происходит с другими патогенными бактериями. [51]
Несколько ферментов в бактериях были предложены в качестве предварительных целей для лекарств. Например, ферменты в пути поглощения железа были предложены в качестве важных целей для лекарств. [35] Кроме того, класс cN-II специфической 5´-нуклеотидазы IMP/GMP , которая была подробно охарактеризована кинетически. Тетрамерный фермент демонстрирует аспекты положительной гомотропной кооперативности , активации субстрата и представляет собой уникальный аллостерический сайт , который может быть направлен для разработки эффективных лекарств против фермента и, таким образом, организма. Более того, фермент отличается от своего человеческого аналога, что делает его привлекательной целью для разработки лекарств.
Антисыворотки использовались как для исследований агглютинации на слайдах , так и для прямого обнаружения бактерий в тканях с помощью иммунофлуоресценции с помощью флуоресцентно -меченых антител . Специфические антитела у пациентов можно определить с помощью непрямого теста флуоресцентных антител. Также успешно применялись ИФА и микроагглютинационные тесты. [9] Последовательным методом, который использовался для обнаружения заболевания, является тест на антиген в моче. [8]
Эффективное лечение антибиотиками пневмонии, вызванной легионеллой , включает фторхинолоны ( левофлоксацин или моксифлоксацин ) или, в качестве альтернативы, азитромицин . [8] Не было обнаружено существенной разницы между использованием фторхинолона или азитромицина для лечения пневмонии, вызванной легионеллой . [8] Комбинированное лечение с рифампицином тестируется в качестве ответа на устойчивость к антибиотикам во время монотерапии, хотя его эффективность остается неопределенной. [8]
Эти антибиотики работают лучше всего, потому что L. pneumophila является внутриклеточным патогеном . [53] Левофлоксацин и азитромицин обладают большой внутриклеточной активностью и способны проникать в клетки, инфицированные Legionella . Американское общество инфекционных заболеваний рекомендует 5–10 дней лечения левофлоксацином или 3–5 дней лечения азитромицином; однако пациентам с ослабленным иммунитетом или тяжелым заболеванием может потребоваться более длительный курс лечения. [53]