Почечно-клеточная карцинома ( ПКР ) — это рак почки , который возникает в слизистой оболочке проксимальных извитых канальцев , части очень маленьких трубочек в почках, по которым транспортируется первичная моча. ПКР — наиболее распространенный тип рака почки у взрослых, на него приходится примерно 90–95% случаев. [1] Чаще встречается у мужчин (соотношение мужчин и женщин до 2:1). [2] Чаще всего диагностируется у пожилых людей (особенно у людей старше 75 лет). [3]
Первоначальное лечение чаще всего заключается в частичном или полном удалении пораженной почки. [4] Если рак не метастазировал (не распространился на другие органы) и не проник глубже в ткани почек, пятилетняя выживаемость составляет 65–90%, [5] но она значительно снижается, когда рак распространился .
Организм удивительно хорошо скрывает симптомы, и в результате у людей с ПКР к моменту его обнаружения заболевание часто уже находится на поздней стадии. [6] Первоначальные симптомы ПКР часто включают кровь в моче (встречающуюся у 40% больных в момент первого обращения за медицинской помощью), боль в боку (40%), образование в животе или боку (25%). , потеря веса (33%), лихорадка (20%), высокое кровяное давление (20%), ночная потливость и общее плохое самочувствие . [1] Метастазы ПКР чаще всего распространяются в лимфатические узлы , легкие , печень , надпочечники , мозг или кости. [7] Иммунотерапия и таргетная терапия улучшили прогноз метастатического ПКР. [8] [9]
ПКР также связан с рядом паранеопластических синдромов (ПНС), которые представляют собой состояния, вызванные либо гормонами, продуцируемыми опухолью, либо атакой организма на опухоль и присутствуют примерно у 20% пациентов с ПКР. [1] Эти синдромы чаще всего поражают ткани, не пораженные раком. [1] Наиболее распространенными нарушениями ПНС, наблюдаемыми у людей с ПКР, являются: высокий уровень кальция в крови , высокое количество эритроцитов , высокое количество тромбоцитов и вторичный амилоидоз . [7]
Исторически сложилось так, что практикующие врачи ожидали, что человек представит три вывода. Это классическая триада [10] : 1: гематурия , когда в моче присутствует кровь, 2: боль в боку, то есть боль на боковой стороне тела между бедром и ребрами, и 3: образование в брюшной полости, подобное к вздутию живота, но больше. Сейчас известно, что эта классическая триада симптомов встречается только в 10–15% случаев и обычно указывает на то, что почечно-клеточный рак (ПКР) находится на поздней стадии. [10] Сегодня ПКР часто протекает бессимптомно (что означает отсутствие симптомов или отсутствие симптомов) и обычно выявляется случайно, когда человека обследуют на наличие других заболеваний. [11]
Другие признаки и симптомы могут включать гематурию ; [10] боль в пояснице; [10] брюшная масса; [11] недомогание , представляющее собой общее плохое самочувствие; [11] потеря веса и/или потеря аппетита; [12] анемия , возникающая в результате депрессии эритропоэтина ; [10] эритроцитоз (повышенное производство эритроцитов ) из-за повышенной секреции эритропоэтина; [10] варикоцеле , которое проявляется у мужчин как расширение гроздьевидного сплетения вен, дренирующих яичко (чаще левое яичко) [11] гипертония (высокое кровяное давление), возникающая в результате секреции ренина опухолью; [13] гиперкальциемия , то есть повышение уровня кальция в крови; [14] нарушение сна или ночная потливость; [12] рецидивирующая лихорадка ; [12] и хроническая усталость. [15]
Наибольшие факторы риска ПКР связаны с образом жизни; По оценкам , курение, ожирение и гипертония (высокое кровяное давление) являются причиной до 50% случаев. [16] Профессиональное воздействие некоторых химических веществ, таких как асбест, кадмий, свинец, хлорированные растворители, нефтехимические продукты и ПАУ ( полициклические ароматические углеводороды ), изучалось в ходе многочисленных исследований с неубедительными результатами. [17] [18] [19] Другим предполагаемым фактором риска является длительное использование нестероидных противовоспалительных препаратов (НПВП). [20]
Наконец, исследования показали, что у женщин, перенесших гистерэктомию, риск развития ПКР более чем в два раза выше, чем у тех, кто этого не делал. [21] С другой стороны, было доказано, что умеренное употребление алкоголя оказывает защитный эффект. [22]
Наследственные факторы оказывают незначительное влияние на индивидуальную восприимчивость: у ближайших родственников людей с ПКР риск развития этого заболевания увеличивается в два-четыре раза. [23] Другие генетически связанные состояния также увеличивают риск ПКР, включая наследственный папиллярный рак почки, наследственный лейомиоматоз , синдром Бирта-Хогга-Дюбе , синдром гиперпаратиреоза-опухоли челюсти, семейный папиллярный рак щитовидной железы , болезнь фон Гиппеля-Линдау [24] и серповидно-клеточная анемия . [25]
Однако наиболее значимое заболевание, влияющее на риск, не связано генетически: у пациентов с приобретенными кистозными заболеваниями почек, нуждающихся в диализе, вероятность развития ПКР в 30 раз выше, чем у населения в целом. [26]
Опухоль возникает из клеток проксимального эпителия почечных канальцев . [1] Считается аденокарциномой . [7] Существует два подтипа: спорадический (то есть ненаследственный) и наследственный. [1] Оба таких подтипа связаны с мутациями в коротком плече хромосомы 3 , причем вовлеченные гены представляют собой либо гены-супрессоры опухолей ( VHL и TSC ), либо онкогены (например, c-Met ). [1]
Первыми шагами, предпринимаемыми для диагностики этого состояния, являются рассмотрение признаков и симптомов, а также сбор анамнеза (подробный медицинский анализ прошлого состояния здоровья) для оценки любых факторов риска. На основании представленных симптомов ряд биохимических тестов (с использованием образцов крови и/или мочи) также можно рассматривать как часть процесса скрининга, чтобы обеспечить достаточный количественный анализ любых различий в электролитах , функции почек и печени, а также времени свертывания крови. . [25] При физическом осмотре и пальпации живота может быть выявлено наличие новообразования или увеличения органа. [27]
Хотя это заболевание не имеет характеристики на ранних стадиях развития опухоли, важны соображения, основанные на разнообразных клинических проявлениях, а также устойчивости к лучевой и химиотерапии . Основными диагностическими методами выявления почечно-клеточного рака являются УЗИ , компьютерная томография (КТ) и магнитно-резонансная томография (МРТ) почек. [28]
Почечно-клеточная карцинома (ПКР) — это не единое образование, а скорее совокупность различных типов опухолей , каждая из которых происходит из различных частей нефрона ( эпителия или почечных канальцев ) и обладает различными генетическими характеристиками, гистологическими особенностями и, в некоторых случаях, степень, клинические фенотипы. [25]
Кариотипирование на основе массивов можно использовать для выявления характерных хромосомных аберраций в опухолях почек со сложной морфологией. [34] [35] Кариотипирование на основе массивов хорошо работает при опухолях, залитых парафином [36] и подходит для рутинного клинического использования. См. также раздел «Виртуальное кариотипирование» для сертифицированных CLIA лабораторий, предлагающих кариотипирование солидных опухолей на основе массивов.
Классификация опухолей мочеполовой системы Всемирной организации здравоохранения (ВОЗ) 2004 года выделяет более 40 подтипов новообразований почек . С момента публикации последней версии классификации ВОЗ в 2004 г. было описано несколько новых подтипов опухолей почек: [37]
Лабораторные тесты обычно проводятся, когда у пациента появляются признаки и симптомы, которые могут быть характерны для почечной недостаточности. Они не используются в первую очередь для диагностики рака почки из-за его бессимптомного характера и обычно обнаруживаются случайно во время обследований на другие заболевания, такие как заболевания желчного пузыря . [39] Другими словами, эти виды рака обычно не выявляются, поскольку при обнаружении они не вызывают боли или дискомфорта. Лабораторный анализ может дать оценку общего состояния здоровья пациента и предоставить информацию для определения стадии и степени метастазирования в другие части тела (если выявлено поражение почек) до начала лечения. [ нужна цитата ]
Наличие крови в моче является частым предположительным признаком почечно-клеточного рака. Гемоглобин крови придает моче ржавый, коричневый или красный цвет. Альтернативно, анализ мочи может выявить сахар , белок и бактерии , которые также могут служить индикаторами рака . Полный анализ клеток крови также может предоставить дополнительную информацию о тяжести и распространении рака. [40]
Общий анализ крови обеспечивает количественную оценку различных клеток в образце цельной крови пациента. К таким клеткам, которые проверяются в этом тесте, относятся эритроциты ( эритроциты ), лейкоциты ( лейкоциты ) и тромбоциты ( тромбоциты ). Распространенным признаком почечно-клеточного рака является анемия , при которой у пациента наблюдается дефицит эритроцитов. [41] Анализы крови жизненно важны как инструмент скрининга для проверки состояния здоровья пациента перед операцией. Несоответствие количества тромбоцитов также часто встречается среди этих онкологических больных, и следует рассмотреть возможность проведения дополнительных тестов на коагуляцию, включая скорость оседания эритроцитов (СОЭ), протромбиновое время (ПВ), активированное частичное тромбопластиновое время (АЧТВ). [ нужна цитата ]
Биохимические анализы крови проводятся при подозрении на почечно-клеточный рак, поскольку рак может повышать уровни определенных химических веществ в крови. Например, обнаружено, что ферменты печени , такие как аспартатаминотрансфераза (АСТ) и аланинаминотрансфераза (АЛТ), находятся на аномально высоком уровне. [42] Стадию рака также можно определить по аномально повышенному уровню кальция, что позволяет предположить, что рак мог метастазировать в кости. [43] В этом случае врачу следует назначить компьютерную томографию. Биохимические анализы крови также оценивают общую функцию почек и могут позволить врачу принять решение о дальнейших радиологических исследованиях. [ нужна цитата ]
Характерным проявлением почечно-клеточного рака (ПКР) является солидное поражение почки, нарушающее контур почки. Он часто имеет неправильный или дольчатый край и может выглядеть как шишка в нижней части таза или в области живота. Традиционно от 85 до 90% твердых образований почек оказываются ПКР, но кистозные образования почек также могут быть следствием ПКР. [44] Однако развитие диагностических методов позволяет случайно диагностировать у значительной части пациентов поражения почек, которые могут показаться небольшими по размеру и доброкачественными. Десять процентов ПКР будут содержать кальцинаты , а некоторые содержат макроскопический жир (вероятно, из-за инвазии и образования околопочечной жировой оболочки). [45]
Решение о доброкачественной или злокачественной природе почечной массы на основании ее локализованного размера является проблемой, поскольку почечно-клеточная карцинома также может быть кистозной. Поскольку существует несколько доброкачественных кистозных поражений почек (простая киста почки, геморрагическая киста почки, многокамерная кистозная нефрома , поликистоз почек ), рентгенологу иногда может быть трудно отличить доброкачественное кистозное поражение от злокачественного. [46] Система классификации кистозных поражений почек Босняка делит их на группы доброкачественных и требующих хирургической резекции на основе конкретных особенностей визуализации. [47]
Основными визуализирующими тестами, выполняемыми для выявления почечно-клеточного рака, являются КТ органов малого таза и брюшной полости, ультразвуковое исследование почек (ультрасонография), МРТ, внутривенная пиелограмма (ВВП) или почечная ангиография. [48] Среди этих основных диагностических тестов другие радиологические тесты, такие как экскреторная урография , позитронно-эмиссионная томография (ПЭТ), ультрасонография , артериография , венография и сканирование костей, также могут использоваться для помощи в оценке стадии новообразования почек и отличать доброкачественные опухоли от злокачественных. [ нужна цитата ]
Компьютерная томография (КТ) с контрастным усилением обычно используется для определения стадии почечно-клеточного рака в брюшной и тазовой областях. КТ позволяет отличить солидные образования от кистозных и может предоставить информацию о локализации, стадии или распространении рака на другие органы пациента. Ключевые части человеческого тела, которые исследуются на предмет метастатического поражения почечно-клеточного рака, могут включать почечную вену , лимфатический узел и поражение нижней полой вены . [49] Согласно исследованию, проведенному Сауком и др., характеристики мультидетекторной компьютерной томографии могут применяться при диагностике пациентов с ясной почечно-клеточной карциномой путем отображения различий этих клеток на цитогенном уровне. [50]
Ультрасонографическое исследование может быть полезно при оценке сомнительных бессимптомных опухолей почек и кистозных поражений почек , если компьютерная томография не дает результатов. Эта безопасная и неинвазивная радиологическая процедура использует высокочастотные звуковые волны для создания внутреннего изображения тела на мониторе компьютера. Изображение, создаваемое ультразвуком, может помочь диагностировать почечно-клеточный рак на основе различий в отражениях звука на поверхности органов и аномальных тканевых образованиях. По сути, ультразвуковые исследования могут определить, является ли почечная масса преимущественно твердой или заполнена жидкостью. [48]
Чрескожная биопсия может быть выполнена радиологом с использованием ультразвука или компьютерной томографии для отбора проб опухоли с целью диагностики патологии . Однако это не выполняется регулярно, поскольку при наличии типичных визуализирующих особенностей почечно-клеточного рака возможность ошибочно отрицательного результата вместе с риском медицинских осложнений для пациента может сделать его неблагоприятным с точки зрения соотношения риска и пользы. [51] Тем не менее, исследовательский интерес представляют биопсийные тесты для молекулярного анализа, позволяющие отличить доброкачественные опухоли почек от злокачественных. [51]
Магнитно-резонансная томография (МРТ) позволяет получить изображение мягких тканей тела с помощью радиоволн и сильных магнитов. МРТ можно использовать вместо КТ, если у пациента наблюдается аллергия на контрастное вещество, введенное для исследования. [52] [53] Иногда перед МРТ проводится внутривенная инъекция контрастного вещества, называемого гадолинием, для получения более детального изображения. Пациентам, находящимся на диализе, или людям с почечной недостаточностью следует избегать применения этого контрастного вещества, поскольку оно может вызвать редкий, но серьезный побочный эффект, известный как нефрогенный системный фиброз. [54] Сканирование костей или визуализация головного мозга обычно не проводятся, если только признаки или симптомы не указывают на потенциальное метастатическое поражение этих областей. Следует также рассмотреть возможность МРТ-сканирования для оценки распространения опухоли , которая разрослась в основные кровеносные сосуды, включая полую вену , в брюшной полости. МРТ можно использовать для наблюдения за возможным распространением рака на головной или спинной мозг , если у пациента появляются симптомы, указывающие на это. [ нужна цитата ]
Внутривенная пиелограмма (ВВП) – полезная процедура для выявления наличия аномальной почечной массы в мочевыводящих путях . Эта процедура включает введение контрастного красителя в руку пациента. Краситель попадает из кровотока в почки, которые со временем попадают в почки и мочевой пузырь. В этом тесте нет необходимости, если проводилась КТ или МРТ. [55]
Почечная ангиография использует тот же принцип, что и IVP, поскольку в этом типе рентгена также используется контрастный краситель. Этот радиологический тест важен для диагностики почечно-клеточного рака, поскольку помогает исследовать кровеносные сосуды почек. В основе этого диагностического теста лежит контрастное вещество, которое вводится в почечную артерию для поглощения раковыми клетками. [56] Контрастный краситель обеспечивает более четкий контур аномально ориентированных кровеносных сосудов, предположительно вовлеченных в опухоль. Это крайне важно для хирургов, поскольку позволяет составить карту кровеносных сосудов пациента до операции. [49]
Стадирование почечно-клеточного рака является наиболее важным фактором в прогнозировании его прогноза . [57] Стадирование может соответствовать системе стадирования TNM , где размер и распространенность опухоли (T), поражение лимфатических узлов (N) и метастазы (M) классифицируются отдельно. Кроме того, он может использовать общую группировку стадий на стадии I–IV в соответствии с версией AJCC 1997 года, описанной ниже: [57]
На момент постановки диагноза 30% почечно-клеточных карцином распространяются на ипсилатеральную почечную вену, а 5–10% - в нижнюю полую вену. [58]
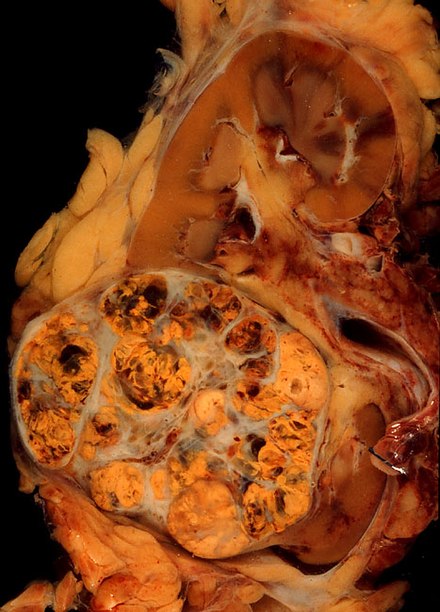
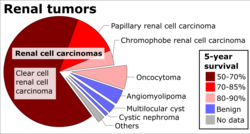

Макроскопические и микроскопические проявления почечно-клеточного рака весьма разнообразны. Почечно-клеточная карцинома может представлять собой покрасневшие участки кровоточащих кровеносных сосудов и кисты, содержащие водянистую жидкость. [59] В теле опухоли видны крупные кровеносные сосуды, стенки которых состоят из раковых клеток.При общем осмотре часто выявляется желтоватая многодольчатая опухоль в корковом веществе почки , которая часто содержит зоны некроза , кровоизлияний и рубцов . С микроскопической точки зрения выделяют четыре основных гистологических подтипа почечно-клеточного рака: светлоклеточный (обычный ПКР, 75%), папиллярный (15%), хромофобный (5%) и собирательный проток (2%). Саркоматоидные изменения (морфология и характер ИГХ, имитирующие саркому, веретенообразные клетки) могут наблюдаться при любом подтипе ПКР и связаны с более агрессивным клиническим течением и худшим прогнозом. Под световой микроскопией эти опухолевые клетки могут иметь сосочки , канальцы или гнезда, они довольно большие, атипичные и многоугольные. [ нужна цитата ]
Недавние исследования привлекли внимание к тесной связи типа раковых клеток с агрессивностью заболевания. Некоторые исследования показывают, что эти раковые клетки накапливают гликоген и липиды, их цитоплазма выглядит «чистой», ядра остаются в середине клеток, а клеточная мембрана очевидна. [60] Некоторые клетки могут быть меньшего размера, с эозинофильной цитоплазмой, напоминающей нормальные тубулярные клетки. Строма редуцирована, но хорошо васкуляризирована. Опухоль сдавливает окружающую паренхиму , образуя псевдокапсулу. [61]
Наиболее распространенным типом клеток, встречающимся при почечно-клеточном раке, являются светлые клетки , получившие свое название из-за растворения в цитоплазме клеток с высоким содержанием липидов. Считается, что прозрачные клетки менее склонны к распространению и обычно более благоприятно реагируют на лечение. Однако большинство опухолей содержат смесь клеток. Считается, что наиболее агрессивной стадией рака почки является та, при которой опухоль смешанная, содержащая как светлые, так и зернистые клетки. [62]
Рекомендуемой схемой гистологической классификации ПКР является система Фурмана (1982), которая представляет собой оценку, основанную на микроскопической морфологии новообразования с помощью гематоксилина и эозина (окрашивание H&E). Эта система классифицирует почечно-клеточный рак на 1, 2, 3, 4 степени на основе ядерных характеристик. Подробности системы оценок Фурмана для RCC показаны ниже: [63]
Считается, что ядерная степень является одним из наиболее важных прогностических факторов у пациентов с почечно-клеточным раком. [25] Однако исследование Delahunt et al. (2007) показали, что классификация Фурмана идеальна для светлоклеточного рака, но может не подходить для хромофобных почечно-клеточных карцином, и что определение стадии рака (определяемое с помощью компьютерной томографии) является более благоприятным предиктором прогноза этого заболевания. [64] Что касается стадирования рака почки, Гейдельбергская система классификации опухолей почки была введена в 1976 году как средство более полной корреляции гистопатологических особенностей с выявленными генетическими дефектами. [65]
Риск почечно-клеточного рака можно снизить, поддерживая нормальный вес тела. [66]

Тип лечения зависит от множества факторов и индивидуальных особенностей, некоторые из которых включают стадию почечно-клеточного рака (пораженные/непораженные органы и части тела), тип почечно-клеточного рака, ранее существовавшие или сопутствующие заболевания, а также общее состояние здоровья и возраст человека. [10] [67] Каждая форма лечения имеет как риски, так и преимущества; Медицинский работник предложит лучшие варианты, соответствующие индивидуальным обстоятельствам.
Если он распространился за пределы почек, часто в лимфатические узлы , легкие или главную вену почки, применяются различные методы лечения, включая хирургическое вмешательство и медикаментозное лечение. ПКР в большинстве случаев устойчив к химиотерапии и лучевой терапии, но хорошо реагирует на иммунотерапию интерлейкином-2 или интерфероном-альфа, биологическую или таргетную терапию. На ранних стадиях предпочтительными вариантами являются криотерапия и хирургическое вмешательство.
Активное наблюдение или «бдительное ожидание» становится все более распространенным при обнаружении небольших образований или опухолей почек, а также у пожилых людей, когда хирургическое вмешательство не всегда подходит. [68] Активное наблюдение включает выполнение различных диагностических процедур, тестов и визуализации для мониторинга прогрессирования ПКР, прежде чем приступать к варианту лечения более высокого риска, например хирургическому вмешательству. [68] Это особенно полезно для пожилых людей, пациентов с сопутствующими заболеваниями и для неподходящих кандидатов на хирургическое вмешательство.
В зависимости от обстоятельств могут оказаться наиболее подходящими различные процедуры.
Рекомендуемым лечением почечно-клеточного рака может быть нефрэктомия или частичная нефрэктомия , хирургическое удаление всей или части почки. [4] Это может включать некоторые окружающие органы или ткани или лимфатические узлы. Если рак встречается только в почках, что составляет около 60% случаев, примерно в 90% случаев его можно вылечить хирургическим путем .
Небольшие опухоли почек (< 4 см) по возможности все чаще лечат методом частичной нефрэктомии. [69] [70] [71] Большинство этих небольших почечных образований проявляют вялое биологическое поведение с отличным прогнозом. [72] Нефронсохраняющая частичная нефрэктомия используется, когда опухоль небольшая (менее 4 см в диаметре) или когда у пациента есть другие медицинские проблемы, такие как диабет или гипертония . [10] Частичная нефрэктомия включает удаление только пораженной ткани, сохраняя остальную часть почки, фасцию Героты и регионарные лимфатические узлы. Это позволяет лучше сохранить почку по сравнению с радикальной нефрэктомией и может иметь положительные долгосрочные преимущества для здоровья. [73] Более крупные и сложные опухоли также можно лечить с помощью частичной нефрэктомии хирургами с большим опытом хирургии почек. [74]
Хирургическая нефрэктомия может быть «радикальной», если в ходе процедуры одновременно удаляется вся пораженная почка, включая фасцию Героты , надпочечник , расположенный на той же стороне, что и пораженная почка, и регионарные забрюшинные лимфатические узлы. [10] Этот метод, хотя и суров, но эффективен. Но это не всегда целесообразно, поскольку это серьезная операция, которая сопряжена с риском осложнений как во время, так и после операции и может иметь более длительный период восстановления. [75] Важно отметить, что другая почка должна быть полностью функциональной, и этот метод чаще всего используется, когда большая опухоль присутствует только в одной почке.

В случаях, когда опухоль распространилась на почечную вену, нижнюю полую вену и, возможно, правое предсердие, эту часть опухоли также можно удалить хирургическим путем. Если опухоль затронула нижнюю полую вену, важно классифицировать, какие части полой вены поражены, и соответствующим образом спланировать операцию, поскольку иногда полная резекция предполагает разрез грудной клетки, что приводит к увеличению осложнений. По этой причине доктор Гаэтано Чианчио адаптировал методы мобилизации печени при трансплантации печени для лечения ретропеченочного или даже надпеченочного тромба нижней полой вены, связанного с опухолями почек. [76] С помощью этой техники можно мобилизовать всю нижнюю полую вену брюшной полости. Это облегчает удаление опухоли ниже основных печеночных вен пальцами хирурга, минуя необходимость торакоабдоминального разреза или искусственного кровообращения . [77] В случаях известных метастазов хирургическая резекция почки («циторедуктивная нефрэктомия») может улучшить выживаемость [78] , а также резекция одиночного метастатического поражения. Почки иногда эмболизируют перед операцией, чтобы минимизировать кровопотерю. [79]
Хирургическое вмешательство все чаще выполняется лапароскопическими методами. Обычно называемая хирургией замочной скважины, эта операция не предполагает больших разрезов, наблюдаемых при классической радикальной или частичной нефрэктомии, но при этом успешно удаляет всю почку или ее часть. Лапароскопическая хирургия связана с более коротким пребыванием в больнице и более быстрым периодом восстановления, но все же существуют риски, связанные с хирургической процедурой. Их преимущество заключается в том, что они менее обременительны для пациента, а выживаемость без признаков заболевания сравнима с таковой при открытой хирургии. [4] При небольших экзофитных поражениях, не затрагивающих крупные сосуды или мочевыводящую систему, может быть выполнена частичная нефрэктомия (также называемая «нефронсберегающей операцией»). Это может включать временную остановку притока крови к почке на время удаления массы, а также охлаждение почки ледяной слякотью. Маннитол также можно назначать, чтобы ограничить повреждение почек. Обычно это делается через открытый разрез, хотя небольшие повреждения можно выполнить лапароскопически с помощью робота или без него.
Лапароскопическая криотерапия также может проводиться при небольших поражениях. Обычно биопсию берут во время лечения. Интраоперационное ультразвуковое исследование может использоваться для определения расположения замораживающих зондов. Затем выполняются два цикла замораживания/оттаивания, чтобы уничтожить опухолевые клетки. Поскольку опухоль не удаляется, последующее наблюдение становится более сложным (см. ниже), а общие показатели отсутствия заболеваний не так хороши, как при хирургическом удалении.
Хирургическое вмешательство при метастатическом заболевании: если есть метастатическое заболевание, хирургическое лечение все еще может быть жизнеспособным вариантом. Радикальная и частичная нефрэктомия все еще может быть выполнена, а в некоторых случаях, если метастаз небольшой, его также можно удалить хирургическим путем. [10] Это зависит от того, на какой стадии роста и насколько далеко распространилось заболевание.
При чрескожной абляции рентгенологи используют визуализацию для лечения локализованных опухолей, если хирургическая процедура не является подходящим вариантом. Хотя использование лапароскопических хирургических методов для полной нефрэктомии снизило некоторые риски, связанные с хирургическим вмешательством, [80] любое хирургическое вмешательство в некоторых случаях по-прежнему будет неосуществимо. Например, пожилым людям, людям с тяжелой почечной дисфункцией или людям с несколькими сопутствующими заболеваниями любое хирургическое вмешательство не требуется. [81]
Зонд вводится через кожу в опухоль с использованием визуализации кончика зонда и опухоли в реальном времени с помощью компьютерной томографии , ультразвука или даже магнитно-резонансной томографии , а затем опухоль разрушается с помощью тепла ( радиочастотная абляция ) или холода. ( криотерапия ). Эти методы имеют недостаток по сравнению с традиционной хирургией, поскольку патологическое подтверждение полного разрушения опухоли невозможно. Таким образом, долгосрочное наблюдение имеет решающее значение для оценки полноты абляции опухоли. [82] [83] В идеале чрескожная абляция ограничивается опухолями размером менее 3,5 см и используется для контроля лечения. Однако в некоторых случаях абляцию можно использовать при опухолях большего размера. [81]
Двумя основными методами абляции, которые используются при почечно-клеточном раке, являются радиочастотная абляция и криоабляция . [81]
Радиочастотная абляция использует электрод-зонд, который вводится в пораженную ткань и посылает в ткань радиочастоты для выработки тепла за счет трения молекул воды. Тепло разрушает опухолевую ткань. [10] Гибель клеток обычно происходит в течение нескольких минут после воздействия температуры выше 50 °C.
Криоабляция также предполагает введение зонда в пораженный участок [10] , однако для уничтожения опухоли вместо тепла используется холод. Зонд охлаждается очень холодными химическими жидкостями. Низкие температуры вызывают гибель опухолевых клеток, вызывая осмотическую дегидратацию , которая вытягивает воду из клетки, разрушая фермент , органеллы , клеточную мембрану и замораживая цитоплазму . [81]
Рак часто растет необузданно, потому что он способен уклоняться от иммунной системы. [9] Иммунотерапия — это метод, который активирует иммунную систему человека и использует ее в своих целях. [9] Он был разработан после наблюдения того, что в некоторых случаях наблюдался спонтанный регресс. [84] Иммунотерапия использует это явление и направлена на создание иммунного ответа человека на раковые клетки. [84]
Другие препараты таргетной терапии ингибируют факторы роста, которые, как было показано, способствуют росту и распространению опухолей. [85] [86] Большинство этих лекарств были одобрены в течение последних десяти лет. [87] Эти методы лечения: [88]
У пациентов с метастатическим раком сунитиниб, вероятно, приводит к большему прогрессированию рака, чем пембролизумаб, акситиниб и авелумаб. [94] По сравнению с пембролизумабом и акситинибом он, вероятно, приводит к большему количеству смертей, но может немного уменьшить серьезные нежелательные эффекты. [94] По сравнению с комбинациями иммунотерапии (ниволумаб и ипилимумаб) сунитиниб может приводить к большему прогрессированию и серьезным последствиям. [94] Между пазопанибом и сунитибом разница в прогрессировании, выживаемости и серьезных последствиях может быть незначительной или отсутствовать. [94]
Также сообщалось об активности ипилимумаба [95] , но он не одобрен для лечения рака почки. [96]
Ожидается, что в ближайшем будущем появится больше лекарств, поскольку в настоящее время проводится несколько клинических исследований новых таргетных методов лечения, [97] в том числе: атезолизумаб , варлилумаб , дурвалумаб , авелумаб , LAG525 , MBG453, TRC105 и саволитиниб .
Химиотерапия и лучевая терапия не столь эффективны в случае ПКР. В большинстве случаев ПКР устойчив, но вероятность успеха составляет около 4–5%, но это часто недолговечно, и позже развиваются новые опухоли и новообразования. [10]
Адъювантная терапия , то есть терапия, назначаемая после первичной операции, в течение длительного времени не показала эффективности при почечно-клеточном раке. [98] Однако в 2021 году пембролизумаб был одобрен для адъювантного лечения после того, как было продемонстрировано многообещающее улучшение безрецидивной выживаемости. [99]
И наоборот, неоадъювантную терапию назначают перед предполагаемым основным или основным лечением. Было показано, что в некоторых случаях неоадъювантная терапия уменьшает размер и стадию ПКР, что позволяет затем удалить его хирургическим путем. [86] Это новая форма лечения, и эффективность этого подхода все еще оценивается в клинических испытаниях .
Метастатический почечно-клеточный рак (мПКР) – это распространение первичного почечно-клеточного рака из почки в другие органы. Примерно у 25–30% людей к моменту постановки диагноза почечно-клеточного рака наблюдается такое метастатическое распространение . [100] Столь высокая доля объясняется тем, что клинические признаки, как правило, легкие, пока заболевание не перейдет в более тяжелое состояние. [101] Наиболее распространенными местами метастазирования являются лимфатические узлы, легкие, кости, печень и мозг. [11] Как это распространение влияет на стадию заболевания и, следовательно, на прогноз, обсуждается в разделах «Диагноз» и «Прогноз».
MRCC имеет плохой прогноз по сравнению с другими видами рака, хотя средняя продолжительность выживаемости увеличилась за последние несколько лет благодаря достижениям в лечении. Среднее время выживания в 2008 году при метастатической форме заболевания составляло менее года [102] , а к 2013 году оно улучшилось в среднем до 22 месяцев. [103] Несмотря на это улучшение, пятилетняя выживаемость при мПКР остается ниже 10% [104] , а 20–25% пациентов остаются невосприимчивыми к любому лечению, и в этих случаях заболевание быстро прогрессирует. [103]
The available treatments for RCC discussed in the "Treatment" section are also relevant for the metastatic form of the disease. Options include interleukin-2, which is a standard therapy for advanced renal cell carcinoma.[98] From 2007 to 2013, seven new treatments have been approved specifically for mRCC (sunitinib, temsirolimus, bevacizumab, sorafenib, everolimus, pazopanib and axitinib).[8] These new treatments are based on the fact that renal cell carcinomas are very vascular tumours – they contain a large number of blood vessels. The drugs aim to inhibit the growth of new blood vessels in the tumours, hence slowing growth and in some cases, reducing the size of the tumours.[105]Side effects unfortunately are quite common with these treatments and include:[106]
Radiotherapy and chemotherapy are more commonly used in the metastatic form of RCC to target the secondary tumours in the bones, liver, brain and other organs. While not curative, these treatments do provide relief for symptoms associated with the spread of tumours.[103]
The prognosis is influenced by several factors, including tumour size, degree of invasion and metastasis, histologic type, and nuclear grade.[25] Staging is the most important factor in the outcome of renal cell cancer. The following numbers are based on patients first diagnosed in 2001 and 2002 by the National Cancer Data Base:[107]
Корейское исследование показало, что общая пятилетняя выживаемость при конкретном заболевании составляет 85%. [108] В целом, если заболевание ограничивается почками, только у 20–30% после нефрэктомии развиваются метастазы. [109] Более конкретные подгруппы показывают пятилетнюю выживаемость около 90–95% для опухолей размером менее 4 см. Для более крупных опухолей, ограниченных почками без венозной инвазии, выживаемость все еще относительно хорошая и составляет 80–85%. [ нужна цитата ] Для опухолей, которые распространяются через капсулу почки и за пределы местных фасциальных вложений, выживаемость снижается почти до 60%. [ нужна цитата ] Такие факторы, как общее состояние здоровья и физическая форма или тяжесть их симптомов, влияют на выживаемость. Например, у молодых людей (20–40 лет) исход лучше, несмотря на большее количество симптомов на момент обращения, возможно, из-за более низкой скорости распространения рака на лимфатические узлы (стадия III).
Гистологическая степень связана с агрессивностью рака и подразделяется на 4 степени: 1 имеет лучший прогноз (пятилетняя выживаемость более 89%), а 4 — худший прогноз (46% пятилетней выживаемости). .
У некоторых людей почечно-клеточный рак обнаруживается до того, как у них появляются симптомы (случайно) благодаря компьютерной томографии (компьютерной томографии) или ультразвуку . Случайно диагностированный почечно-клеточный рак (без симптомов) отличается по прогнозу от тех, которые диагностируются после появления симптомов почечно-клеточного рака или метастазов. Пятилетняя выживаемость была выше для случайных, чем для симптоматических опухолей: 85,3% против 62,5%. Случайные поражения имели значительно более низкую стадию, чем те, которые вызывают симптомы, поскольку у 62,1% пациентов со случайным почечно-клеточным раком наблюдались поражения I стадии, против 23% - с симптоматическим почечно-клеточным раком. [110]
Если он метастазировал в лимфатические узлы, пятилетняя выживаемость составляет от 5% до 15%. При метастатическом почечно-клеточном раке факторы, которые могут представлять плохой прогноз, включают низкую оценку работоспособности Карновского (стандартный способ измерения функциональных нарушений у больных раком), низкий уровень гемоглобина , высокий уровень лактатдегидрогеназы в сыворотке и высокий корригированный уровень сывороточного кальция. [111] [112] В неметастатических случаях алгоритм оценки Лейбовича может использоваться для прогнозирования послеоперационного прогрессирования заболевания. [113]
Почечно-клеточная карцинома является одним из видов рака, наиболее тесно связанных с паранеопластическим синдромом , чаще всего обусловленным эктопической выработкой гормонов опухолью. Лечение этих осложнений ПКР обычно ограничивается лечением основного рака.
Заболеваемость варьирует в зависимости от географических, демографических и, в меньшей степени, наследственных факторов. Существуют некоторые известные факторы риска, однако значимость других потенциальных факторов риска остается более спорной. Заболеваемость раком увеличивалась во всем мире со скоростью примерно 2–3% за десятилетие [102] до тех пор, пока в последние несколько лет число новых случаев не стабилизировалось. [17]
Заболеваемость ПКР варьируется в зависимости от пола, возраста, расы и географического положения по всему миру. У мужчин заболеваемость выше, чем у женщин (приблизительно 1,6:1) [98] , и у подавляющего большинства диагноз диагностируется после 65 лет. [98] Сообщается, что у азиатов значительно более низкая заболеваемость ПКР, чем у белых, и хотя в африканских странах зарегистрирована самая низкая заболеваемость, у афроамериканцев самая высокая заболеваемость среди населения в Соединенных Штатах. [17] В развитых странах заболеваемость выше, чем в развивающихся, причем самые высокие показатели наблюдаются в Северной Америке, Европе и Австралии/Новой Зеландии. [114]
Даниэль Сеннерт сделал первое упоминание об опухоли , возникающей в почках , в своем тексте Practicae Medicinae , впервые опубликованном в 1613 году. [115]
Мириль опубликовал самый ранний однозначный случай рака почки в 1810 году. [116] Он описал случай Франсуазы Левелли, 35-летней женщины, которая поступила в Брестскую гражданскую больницу 6 апреля 1809 года, предположительно на поздних стадиях беременности. . [115]
Кениг опубликовал первую классификацию опухолей почек, основанную на макроскопической морфологии, в 1826 году. Кениг разделил опухоли на скиррозную, стеатоматозную, грибковую и медуллярную формы. [117]
После классификации опухоли исследователи попытались определить ткань, из которой произошел рак почки.
Патогенез опухолей почечного эпителия обсуждался на протяжении десятилетий. Дебаты были инициированы Полом Гравицем , когда в 1883 году он опубликовал свои наблюдения о морфологии небольших желтых опухолей почек . Гравитц пришел к выводу, что только альвеолярные опухоли имеют надпочечниковое происхождение, тогда как папиллярные опухоли происходят из почечной ткани. [115]
В 1893 году Пауль Судек бросил вызов теории, постулированной Гравицем, опубликовав описания опухолей почек, в которых он определил атипичные особенности внутри почечных канальцев и отметил градацию этих атипичных особенностей между канальцами и соседней злокачественной опухолью . В 1894 году Отто Любарш , который поддержал теорию, постулированную Гравитцем, ввёл термин « гипернефроидная опухоль» , который Феликсом Виктором Бирч-Хиршфельдом был дополнен термином « гипернефрома» для описания этих опухолей. [118]
Резкую критику Гравица высказал Оскар Стерк в 1908 г., который считал надпочечниковое происхождение опухолей почек недоказанным. Несмотря на убедительные аргументы против теории, выдвинутой Гравицем, термин «гипернефрома» с ассоциированным с ним надпочечниковым оттенком сохранился в литературе. [115]
Фут и Хамфрис, а также Фут и др. ввели термин « почечно-клеточная карцинома» , чтобы подчеркнуть канальцевое происхождение этих опухолей . Их обозначение было немного изменено Феттером и теперь стало широко распространенным термином « почечно-клеточная карцинома» . [119]
Убедительные доказательства для разрешения спора были предложены Oberling et al. в 1959 году изучил ультраструктуру светлых клеток восьми карцином почек . Они обнаружили, что цитоплазма опухолевых клеток содержит многочисленные митохондрии и отложения гликогена и жира. Они идентифицировали цитоплазматические мембраны , прикрепленные перпендикулярно к базальной мембране , со случайными клетками, содержащими микроворсинки вдоль свободных границ. Они пришли к выводу, что эти особенности указывают на то, что опухоли возникают из эпителиальных клеток извитых канальцев почек , тем самым окончательно решая один из наиболее обсуждаемых вопросов опухолевой патологии. [115] [120]
{{cite web}}: CS1 maint: архивная копия в заголовке ( ссылка )