Ретикулярная формация представляет собой набор взаимосвязанных ядер в стволе мозга , который простирается от нижнего конца продолговатого мозга до верхнего конца среднего мозга . [2] Нейроны ретикулярной формации составляют сложный набор нейронных сетей в ядре ствола мозга. [3] Ретикулярная формация состоит из диффузного сетчатого образования ретикулярных ядер , которое не имеет четкого определения. [4] Ее можно рассматривать как состоящую из всех рассеянных клеток в стволе мозга между более компактными и названными структурами. [4]
Ретикулярная формация функционально разделена на восходящую ретикулярную активирующую систему ( ARAS ), восходящие пути к коре головного мозга , и нисходящую ретикулярную систему , нисходящие пути ( ретикулоспинальные тракты ) к спинному мозгу . [5] [6] [7] [8] Из-за своей протяженности вдоль ствола мозга ее можно разделить на различные области, такие как ретикулярная формация среднего мозга, центральная мезэнцефальная ретикулярная формация, ретикулярная формация моста, парамедианная ретикулярная формация моста, дорсолатеральная ретикулярная формация моста и ретикулярная формация продолговатого мозга. [9]
Нейроны ARAS в основном действуют как переключатель «вкл/выкл» для коры головного мозга и, следовательно, играют решающую роль в регуляции бодрствования ; поведенческое возбуждение и сознание функционально связаны в ретикулярной формации с использованием ряда систем нейротрансмиттерного возбуждения. Общие функции ретикулярной формации являются модуляторными и премоторными, [A] включая соматический двигательный контроль, сердечно-сосудистый контроль, модуляцию боли, сон и сознание, а также привыкание. [10] Модуляторные функции в основном обнаруживаются в ростральном секторе ретикулярной формации, а премоторные функции локализованы в нейронах в более каудальных областях.
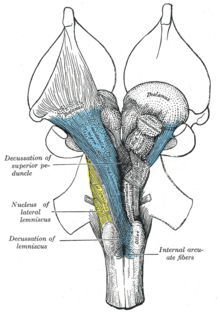
Ретикулярная формация делится на три столба: ядра шва (медианная), гигантоклеточные ретикулярные ядра (медиальная зона) и мелкоклеточные ретикулярные ядра (латеральная зона). Ядра шва являются местом синтеза нейромедиатора серотонина , который играет важную роль в регуляции настроения. Гигантоклеточные ядра участвуют в координации движений. Мелкоклеточные ядра регулируют выдох . [11]
Ретикулярная формация необходима для управления некоторыми из основных функций высших организмов. Она филогенетически старая и встречается у низших позвоночных . [2]

Ретикулярная формация человека состоит из почти 100 ядер и содержит множество проекций в передний мозг , ствол мозга и мозжечок , среди других областей. [6] Она включает ретикулярные ядра , ретикулоталамические проекционные волокна, диффузные таламокортикальные проекции , восходящие холинергические проекции , нисходящие нехолинергические проекции и нисходящие ретикулоспинальные проекции. [7] Ретикулярная формация также содержит две основные нейронные подсистемы , восходящую ретикулярную активирующую систему и нисходящие ретикулоспинальные тракты, которые опосредуют различные когнитивные и физиологические процессы. [6] [7] Она была функционально расщеплена как сагиттально , так и коронарно .
Традиционно ретикулярные ядра делятся на три колонки: [ необходима ссылка ]
Первоначальной функциональной дифференциацией было разделение на каудальную и ростральную части . Это было основано на наблюдении, что поражение ростральной ретикулярной формации вызывает гиперсомнию в мозге кошки. Напротив, поражение более каудальной части ретикулярной формации вызывает бессонницу у кошек. Это исследование привело к идее, что каудальная часть подавляет ростральную часть ретикулярной формации. [ необходима цитата ]
Сагиттальное деление выявляет больше морфологических различий. Ядра шва образуют гребень в середине ретикулярной формации, а непосредственно на ее периферии находится раздел, называемый медиальной ретикулярной формацией. Медиальная РФ большая и имеет длинные восходящие и нисходящие волокна, и окружена латеральной ретикулярной формацией. Латеральная РФ находится близко к двигательным ядрам черепных нервов и в основном опосредует их функцию. [ необходима цитата ]
Медиальная ретикулярная формация и латеральная ретикулярная формация — это два столба ядер с плохо определенными границами, которые посылают проекции через продолговатый мозг в средний мозг . Ядра можно дифференцировать по функции, типу клеток и проекциям эфферентных или афферентных нервов. Двигаясь каудально от ростральной части среднего мозга , в месте рострального моста и среднего мозга, медиальная РФ становится менее выраженной, а латеральная РФ становится более выраженной. [ необходима цитата ]
По бокам медиальной ретикулярной формации находится ее латеральный кузен, который особенно выражен в ростральном продолговатом мозге и каудальном мосту. Из этой области выходят черепные нервы, включая очень важный блуждающий нерв . [ необходимо уточнение ] Латеральная РФ известна своими ганглиями и областями интернейронов вокруг черепных нервов , которые служат для опосредования их характерных рефлексов и функций.
Подсистемами ретикулярной формации являются восходящая ретикулярная активирующая система и нисходящая ретикулярная система. [7]
Восходящая ретикулярная активирующая система (ARAS), также известная как экстраталамическая контрольно-модуляторная система или просто ретикулярная активирующая система (RAS), представляет собой набор связанных ядер в мозге позвоночных, которые отвечают за регулирование бодрствования и переходов сна и бодрствования . ARAS находится в ретикулярной формации среднего мозга. [12] Она в основном состоит из различных ядер в таламусе / гипоталамусе и ряда дофаминергических , норадренергических , серотонинергических , гистаминергических , холинергических и глутаматергических ядер мозга. [6] [13] [14] [15]
ARAS состоит из нескольких нейронных цепей, соединяющих дорсальную часть задней части среднего мозга и вентральную часть моста с корой головного мозга через различные пути, которые проецируются через таламус и гипоталамус . [6] [14] [15] ARAS представляет собой совокупность различных ядер — более 20 с каждой стороны в верхней части ствола мозга, мосту, продолговатом мозге и заднем гипоталамусе. [12] Нейротрансмиттеры, которые выделяют эти нейроны, включают дофамин , норадреналин , серотонин , гистамин , ацетилхолин и глутамат . [6] [13] [14] [15] Они оказывают кортикальное влияние через прямые аксональные проекции и косвенные проекции через таламические реле. [14] [15] [12]
Таламический путь состоит в основном из холинергических нейронов в покрышке моста , тогда как гипоталамический путь состоит в основном из нейронов, которые выделяют моноаминовые нейротрансмиттеры , а именно дофамин, норадреналин, серотонин и гистамин. [6] [13] Глутамат- высвобождающие нейроны в ARAS были идентифицированы гораздо позже по сравнению с моноаминергическими и холинергическими ядрами; [16] глутаматергический компонент ARAS включает одно ядро в гипоталамусе и различные ядра ствола мозга. [14] [16] [17] Орексиновые нейроны латерального гипоталамуса иннервируют каждый компонент восходящей ретикулярной активирующей системы и координируют активность внутри всей системы. [15] [18] [19]
ARAS состоит из эволюционно древних областей мозга, которые имеют решающее значение для выживания животного и защищены в неблагоприятные периоды, такие как периоды торможения гипноза животных, также известные как рефлекс Тоттелла . [23] Восходящая ретикулярная активирующая система, которая посылает нейромодуляторные проекции в кору, в основном соединяется с префронтальной корой . [24] Кажется, что существует низкая связь с двигательными областями коры. [24]
Восходящая ретикулярная активирующая система является важным фактором, обеспечивающим состояние сознания . [12] Считается, что восходящая система способствует бодрствованию, которое характеризуется корковым и поведенческим возбуждением. [8]
Основная функция ARAS заключается в изменении и потенцировании таламической и корковой функции, в результате чего наступает десинхронизация электроэнцефалограммы (ЭЭГ). [B] [26] [27] Существуют четкие различия в электрической активности мозга во время периодов бодрствования и сна: быстрые всплески мозговых волн низкого напряжения (десинхронизация ЭЭГ) связаны с бодрствованием и быстрым сном (которые электрофизиологически схожи); медленные волны высокого напряжения обнаруживаются во время не быстрого сна. Вообще говоря, когда релейные нейроны таламуса находятся в режиме всплесков , ЭЭГ синхронизируется, а когда они находятся в тоническом режиме, она десинхронизируется. [27] Стимуляция ARAS вызывает десинхронизацию ЭЭГ путем подавления медленных корковых волн (0,3–1 Гц), дельта-волн (1–4 Гц) и колебаний веретенных волн (11–14 Гц), а также путем стимулирования колебаний гамма-диапазона (20–40 Гц). [18]
Физиологическое изменение от состояния глубокого сна к бодрствованию обратимо и опосредовано ARAS. [28] Вентролатеральное преоптическое ядро (VLPO) гипоталамуса подавляет нейронные цепи, ответственные за состояние бодрствования, а активация VLPO способствует наступлению сна. [29] Во время сна нейроны в ARAS будут иметь гораздо более низкую частоту импульсации; наоборот, они будут иметь более высокий уровень активности во время бодрствования. [30] Для того чтобы мозг мог спать, должно быть снижение восходящей афферентной активности, достигающей коры, путем подавления ARAS. [28] Дисфункция паравентрикулярного ядра гипоталамуса может привести к сонливости до 20 часов в день. [31]
ARAS также помогает опосредовать переходы от расслабленного бодрствования к периодам повышенного внимания . [22] Наблюдается увеличение регионального кровотока (предположительно, указывающее на повышенную меру нейронной активности) в ретикулярной формации среднего мозга (MRF) и интраламинарных ядрах таламуса во время задач, требующих повышенной бдительности и внимания. [ необходима цитата ]
Массовые поражения ядер ARAS могут вызвать потерю сознания. [12] [32] Двустороннее повреждение ядер ARAS может привести к коме или смерти. [33]
Прямая электрическая стимуляция ARAS вызывает болевые реакции у кошек и словесные сообщения о боли у людей. [ требуется ссылка ] Восходящая ретикулярная активация у кошек может вызывать мидриаз , [34] который может быть результатом длительной боли. Эти результаты предполагают некоторую связь между цепями ARAS и физиологическими болевыми путями. [34]
Некоторые патологии ARAS могут быть связаны со старением , поскольку, по-видимому, наблюдается общее снижение реактивности ARAS с возрастом. [35] Было высказано предположение, что изменения в электрической связи [C] объясняют некоторые изменения в активности ARAS: если бы связь была подавлена , то произошло бы соответствующее снижение высокочастотной синхронизации (гамма-диапазон). И наоборот, повышенная электрическая связь увеличила бы синхронизацию быстрых ритмов, что могло бы привести к повышенному возбуждению и влечению ко сну с быстрыми движениями глаз. [37] В частности, нарушение ARAS было связано со следующими расстройствами:
Существует несколько потенциальных факторов, которые могут неблагоприятно повлиять на развитие восходящей ретикулярной активирующей системы:
Ретикулоспинальные тракты — это экстрапирамидные двигательные тракты, которые спускаются из ретикулярной формации [42] в два тракта, чтобы воздействовать на двигательные нейроны, снабжающие туловище и проксимальные сгибатели и разгибатели конечностей. Ретикулоспинальные тракты в основном участвуют в локомоции и контроле позы, хотя у них есть и другие функции. [43] Нисходящие ретикулоспинальные тракты являются одними из четырех основных корковых путей к спинному мозгу для мышечно-скелетной активности. Ретикулоспинальные тракты работают с другими тремя путями, обеспечивая скоординированный контроль движения, включая тонкие манипуляции. [42] Четыре пути можно сгруппировать в два основных системных пути — медиальную систему и латеральную систему. Медиальная система включает ретикулоспинальный тракт и вестибулоспинальный тракт и обеспечивает контроль позы. Корково -спинномозговой тракт и руброспинальный тракт относятся к латеральной системе, которая обеспечивает тонкий контроль движений. [42]

Ретикулоспинальные тракты — это медиальный ретикулоспинальный тракт и латеральный ретикулоспинальный тракт. [ необходима цитата ]
Восходящий сенсорный тракт, передающий информацию в противоположном направлении, называется спиноретикулярным трактом .
Ретикулоспинальные пути обеспечивают путь, по которому гипоталамус может контролировать симпатический грудопоясничный и парасимпатический крестцовый отток. [ необходима цитата ]
Две основные нисходящие системы, передающие сигналы от ствола мозга и мозжечка к спинному мозгу, могут запускать автоматическую постуральную реакцию для равновесия и ориентации: вестибулоспинальные тракты от вестибулярных ядер и ретикулоспинальные тракты от моста и продолговатого мозга. Повреждения этих трактов приводят к глубокой атаксии и постуральной неустойчивости . [45]
Физическое или сосудистое повреждение ствола мозга, разъединяющее красное ядро (средний мозг) и вестибулярные ядра (варолиевый мост), может вызвать децеребрационную ригидность , которая имеет неврологический признак повышенного мышечного тонуса и гиперактивных рефлексов растяжения . В ответ на пугающий или болевой стимул обе руки и ноги вытягиваются и поворачиваются внутрь. Причиной является тоническая активность боковых вестибулоспинальных и ретикулоспинальных трактов, стимулирующих разгибательные мотонейроны без торможения со стороны руброспинального тракта . [46]
Повреждение ствола мозга выше уровня красного ядра может вызвать декортикационную ригидность . В ответ на пугающий или болевой стимул руки сгибаются, а ноги разгибаются. Причиной является то, что красное ядро через руброспинальный тракт противодействует возбуждению двигательного нейрона разгибателя от латерального вестибулоспинального и ретикулоспинального трактов. Поскольку руброспинальный тракт распространяется только на шейный отдел спинного мозга, он в основном действует на руки, возбуждая мышцы-сгибатели и подавляя мышцы-разгибатели, а не на ноги. [46]
Повреждение продолговатого мозга ниже вестибулярных ядер может вызвать вялый паралич , гипотонию , потерю дыхательного драйва и квадриплегию . Рефлексы, напоминающие ранние стадии спинального шока , отсутствуют из-за полной потери активности в двигательных нейронах, поскольку больше нет никакой тонической активности, возникающей из латеральных вестибулоспинальных и ретикулоспинальных трактов. [46]
Термин «ретикулярная формация» был придуман в конце 19 века Отто Дейтерсом , совпав с нейронной доктриной Рамона-и-Кахаля . Аллан Хобсон утверждает в своей книге «Возвращение к ретикулярной формации » , что это название является этимологическим пережитком ушедшей эпохи теории совокупного поля в нейронных науках. Термин «ретикулум» означает «сетчатая структура», что и напоминает ретикулярную формацию на первый взгляд. Ее описывали либо как слишком сложную для изучения, либо как недифференцированную часть мозга без какой-либо организации вообще. Эрик Кандель описывает ретикулярную формацию как организованную аналогично промежуточному серому веществу спинного мозга. Эта хаотичная, рыхлая и сложная форма организации — то, что оттолкнуло многих исследователей от дальнейшего изучения этой конкретной области мозга. [ необходима цитата ] У клеток нет четких ганглиозных границ, но они имеют четкую функциональную организацию и различные типы клеток. Термин «ретикулярная формация» теперь используется редко, за исключением общих фраз. Современные ученые обычно ссылаются на отдельные ядра, составляющие ретикулярную формацию. [ необходима цитата ]
Моруцци и Магун впервые исследовали нейронные компоненты, регулирующие механизмы сна-бодрствования мозга, в 1949 году. Физиологи предположили, что некая структура глубоко внутри мозга контролирует умственное бодрствование и бдительность. [26] Считалось, что бодрствование зависит только от прямого приема афферентных (сенсорных) стимулов в коре головного мозга . [ необходима цитата ]
Поскольку прямая электрическая стимуляция мозга могла имитировать электрокортикальные реле, Магун использовал этот принцип, чтобы продемонстрировать на двух отдельных участках ствола мозга кошки, как вызвать бодрствование из сна. Сначала он стимулировал восходящие соматические и слуховые пути; во-вторых, серию «восходящих реле от ретикулярной формации нижнего ствола мозга через покрышку среднего мозга , субталамус и гипоталамус к внутренней капсуле ». [47] Последнее представляло особый интерес, поскольку эта серия реле не соответствовала ни одному известному анатомическому пути для передачи сигнала бодрствования и была названа восходящей ретикулярной активирующей системой (ARAS). [ необходима цитата ]
Затем значение этой недавно идентифицированной релейной системы оценивалось путем размещения поражений в медиальной и латеральной частях передней части среднего мозга . Кошки с мезэнцефальными прерываниями ARAS впадали в глубокий сон и демонстрировали соответствующие мозговые волны. В альтернативном варианте кошки с аналогичными прерываниями восходящих слуховых и соматических путей демонстрировали нормальный сон и бодрствование и могли быть разбужены физическими стимулами. Поскольку эти внешние стимулы блокировались на пути к коре прерываниями, это указывало на то, что восходящая передача должна проходить через недавно обнаруженную ARAS. [ необходима цитата ]
Наконец, Магун записал потенциалы в медиальной части ствола мозга и обнаружил, что слуховые стимулы напрямую активируют части ретикулярной активирующей системы. Кроме того, однократная стимуляция седалищного нерва также активировала медиальную ретикулярную формацию, гипоталамус и таламус . Возбуждение ARAS не зависело от дальнейшего распространения сигнала через мозжечковые контуры, поскольку те же результаты были получены после децеребелляции и декортикации. Исследователи предположили, что столб клеток, окружающих ретикулярную формацию среднего мозга, получал входные данные от всех восходящих путей ствола мозга и передавал эти афференты в кору и, таким образом, регулировал бодрствование. [47] [28]
Восходящая ретикулярная активирующая система (ARAS) отвечает за устойчивое состояние бодрствования. Она получает информацию от сенсорных рецепторов различных модальностей, передаваемую через спиноретикулярные пути и черепно-мозговые нервы (тройничный нерв — полимодальные пути, обонятельный нерв, зрительный нерв и вестибулокохлеарный нерв — мономодальные пути). Эти пути достигают таламуса напрямую или косвенно через медиальный столб ядер ретикулярной формации (крупноклеточные ядра и ретикулярные ядра мостовой покрышки). Ретикулярная активирующая система начинается в дорсальной части заднего среднего мозга и переднего моста, продолжается в промежуточный мозг, а затем делится на две части, достигающие таламуса и гипоталамуса, которые затем проецируются в кору головного мозга (рис. 1). В таламической проекции доминируют холинергические нейроны, происходящие из педункулопонтийного ядра покрышки моста и среднего мозга (PPT) и латеродорсального ядра покрышки моста и среднего мозга (LDT) [17, 18]. Гипоталамическая проекция включает норадренергические нейроны голубого пятна (LC) и серотонинергические нейроны дорсального и срединного ядер шва (DR), которые проходят через латеральный гипоталамус и достигают аксонов гистаминергического туберомамиллярного ядра (TMN), вместе образуя путь, простирающийся в передний мозг, кору и гиппокамп. Корковое возбуждение также использует дофаминергические нейроны черной субстанции (SN), вентральной области покрышки (VTA) и околоводопроводной серой области (PAG). Меньшее количество холинергических нейронов моста и среднего мозга посылают проекции в передний мозг по вентральному пути, минуя таламус [19, 20].
RAS представляет собой сложную структуру, состоящую из нескольких различных цепей, включая четыре моноаминергических пути... Норадреналиновый путь берет начало из голубого пятна (LC) и связанных с ним ядер ствола мозга; серотонинергические нейроны также берут начало из ядер шва в стволе мозга; дофаминергические нейроны берут начало в вентральной области покрышки (VTA); а гистаминергический путь берет начало из нейронов в туберомаммиллярном ядре (TMN) заднего гипоталамуса. Как обсуждалось в Главе 6, эти нейроны широко проецируются по всему мозгу из ограниченных скоплений клеточных тел. Норадреналин, серотонин, дофамин и гистамин имеют сложные модуляторные функции и, в целом, способствуют бодрствованию. PT в стволе мозга также является важным компонентом ARAS. Активность PT холинергических нейронов (клеток REM-on) способствует быстрому сну. Во время бодрствования клетки фазы быстрого сна ингибируются подгруппой норадреналиновых и серотониновых нейронов ARAS, называемых клетками фазы быстрого сна.
Понимание функций ARAS по пробуждению и поддержанию бодрствования еще больше усложнилось нейрохимическими открытиями многочисленных групп нейронов с восходящими путями, берущими начало в ретикулярном ядре ствола мозга, включая понтомезэнцефальные ядра, которые синтезируют различные трансмиттеры и высвобождают их в обширных областях мозга и во всем неокортексе (для обзора см. Jones 2003; Lin et al. 2011). Они включали глутаматергическую, холинергическую, норадренергическую, дофаминергическую, серотонинергическую, гистаминергическую и орексинергическую системы (для обзора см. Lin et al. 2011). ... ARAS представляет собой диффузные, неспецифические пути, которые, работая через срединные и интраламинарные таламические ядра, могут изменять активность всего неокортекса, и, таким образом, эта система изначально была предложена как общая система возбуждения на естественные стимулы и критическая система, лежащая в основе бодрствования (Moruzzi и Magoun 1949; Lindsley и др. 1949; Starzl и др. 1951, см. пунктирную область на рис. 1). ... В недавнем исследовании на крысах было обнаружено, что состояние бодрствования в основном поддерживается восходящей глутаматергической проекцией из парабрахиального ядра и преголубых областей в базальные отделы переднего мозга, а затем передается в кору головного мозга (Fuller и др. 2011). ... Анатомические исследования выявили два основных пути, участвующих в возбуждении и начинающихся в областях с группами холинергических клеток: один через таламус, а другой, проходящий вентрально через гипоталамус и преоптическую область и реципрокно связанный с лимбической системой (Nauta и Kuypers 1958; Siegel 2004). ... Как подсчитано в холинергических связях с ретикулярным ядром таламуса ...
Эта восходящая ретикулярная активирующая система (ARAS) состоит из холинергической латеродорсальной и ножко-понтинной покрышки (LDT/PPT), норадренергического голубого пятна (LC), серотонинергических (5-HT) ядер шва и дофаминергической вентральной области покрышки (VTA), черной субстанции (SN) и периакведуктальных серых проекций, которые стимулируют кору напрямую и косвенно через таламус, гипоталамус и BF.
6, 12-18
Эти аминергические и катехоламинергические популяции имеют многочисленные взаимосвязи и параллельные проекции, которые, вероятно, придают системе функциональную избыточность и устойчивость.
6, 13, 19
... Совсем недавно медуллярная парафациальная зона (PZ), прилегающая к лицевому нерву, была идентифицирована как центр, способствующий сну, на основе анатомических, электрофизиологических, хемо- и оптогенетических исследований.
23, 24
ГАМКергические нейроны PZ ингибируют глутаматергические парабрахиальные (PB) нейроны, которые проецируются в BF,
25
тем самым способствуя NREM-сну за счет бодрствования и REM-сна. ... Нейроны Hcrt широко проецируются по всему головному и спинному мозгу92
, 96, 99, 100,
включая основные проекции на группы клеток, способствующих бодрствованию, такие как клетки HA TM,
101
клетки 5-HT дорсальных ядер шва (DRN),
101
норадренергические клетки LC,
102
и холинергические клетки в LDT, PPT и BF.
101, 103
... Hcrt напрямую возбуждает клеточные системы, участвующие в бодрствовании и возбуждении, включая LC,
102, 106, 107
DRN,
108, 109
TM,
110-112
LDT,
113, 114
холинергические BF,
115
и как дофаминовые (DA), так и не-DA нейроны в VTA.
116, 117
Парабрахиальная и педункулопонтийная глутаматергическая система возбуждения
Ретроградные трассеры из BF последовательно идентифицировали один участок ствола мозга, который не является частью классической моноаминергической восходящей системы возбуждения: глутаматергические нейроны в парабрахиальном и педункулопонтийном ядре... Юкстацеллюлярные записи от педункулопонтийных нейронов показали, что почти все холинергические нейроны в этой области, а также многие глутаматергические и ГАМКергические нейроны наиболее активны во время бодрствования и быстрого сна [25], хотя некоторые из последних нейронов были максимально активны либо во время бодрствования, либо во время быстрого сна, но не в обоих случаях. ... [Парабрахиальные и педункулопонтийные глутаматергические нейроны] обеспечивают интенсивную иннервацию латерального гипоталамуса, центрального ядра миндалевидного тела и BF
Основные и клинические наблюдения показывают, что каудальный гипоталамус представляет собой ключевой узел восходящей системы возбуждения, но типы клеток, лежащие в основе этого, до конца не изучены. В данной работе мы сообщаем, что нейроны супрамамиллярной области, высвобождающие глутамат (SuMvglut2), при хемогенетический активации вызывают устойчивое поведенческое и ЭЭГ-возбуждение.
Орексиновые нейроны расположены в латеральном гипоталамусе. Они организованы в широко проецирующемся порядке, подобно моноаминам (глава 6), и иннервируют все компоненты ARAS. Они возбуждают моноаминергические нейроны REM-off во время бодрствования и PT-холинергические нейроны во время REM-сна. Они ингибируются нейронами VLPO во время NREM-сна.
Регуляция сна и бодрствования затрагивает многие регионы и клеточные подтипы мозга. Действительно, восходящая система возбуждения способствует бодрствованию через сеть, состоящую из моноаминергических нейронов в голубом пятне (LC), гистаминергических нейронов в туберомаммиллярном ядре (TMN), глутаматергических нейронов в парабрахиальном ядре (PB) ...
Это соответствует центро-медианным и центральным латеральным ядрам внутриламинарной группы.
{{cite book}}: |work=проигнорировано ( помощь )