Африканский трипаносомоз — это паразитарная инфекция человека и других животных, переносимая насекомыми . [3]
Человеческий африканский трипаносомоз (HAT), также известный как африканская сонная болезнь или просто сонная болезнь , вызывается видом Trypanosoma brucei . [3] Люди заражаются двумя типами: Trypanosoma brucei gambiense (TbG) и Trypanosoma brucei rhodesiense (TbR). [3] TbG вызывает более 92% зарегистрированных случаев. [1] Оба обычно передаются через укус инфицированной мухи цеце и наиболее распространены в сельской местности. [3]
Первоначально первая стадия заболевания характеризуется лихорадкой, головными болями, зудом и болями в суставах, начинающимися через одну-три недели после укуса. [1] [2] Спустя несколько недель или месяцев вторая стадия начинается со спутанности сознания, плохой координации, онемения и проблем со сном. [2] Диагноз ставится путем обнаружения паразита в мазке крови или в жидкости лимфатического узла. [2] Для различения первой и второй стадии заболевания часто требуется люмбальная пункция . [2] Если заболевание не лечить быстро, оно может привести к смерти.
Профилактика тяжелого заболевания включает скрининг населения, находящегося в группе риска, с помощью анализов крови на TbG. [3] Лечение легче, когда заболевание выявляется на ранней стадии и до появления неврологических симптомов. [3] Лечение первой стадии проводилось с помощью препаратов пентамидина или сурамина . [3] Лечение второй стадии включало эфлорнитин или комбинацию нифуртимокса и эфлорнитина для TbG. [2] [3] Фексинидазол — более современное лечение, которое можно принимать внутрь для любой стадии TbG. [3] Хотя меларсопрол эффективен для обоих типов, обычно он используется только для TbR из-за серьезных побочных эффектов. [3] Без лечения сонная болезнь обычно приводит к смерти. [3]
Заболевание регулярно встречается в некоторых регионах Африки к югу от Сахары, при этом численность населения, подверженного риску, составляет около 70 миллионов человек в 36 странах. [5] По оценкам, в настоящее время инфицировано 11 000 человек, в 2015 году было зарегистрировано 2800 новых случаев заражения . [6] [1] В 2018 году было зарегистрировано 977 новых случаев заболевания. [3] В 2015 году оно вызвало около 3500 смертей, что меньше, чем 34 000 в 1990 году. [4] [7] Более 80% этих случаев приходится на Демократическую Республику Конго . [1] В недавней истории произошло три крупных вспышки: одна с 1896 по 1906 год, в основном в Уганде и бассейне реки Конго , и две в 1920 и 1970 годах в нескольких африканских странах. [1] Оно классифицируется как забытое тропическое заболевание . [8] Другие животные, такие как коровы, могут переносить болезнь и заражаться ею, в этом случае она известна как нагана или трипаносомоз животных . [1]
Симптомы африканского трипаносомоза проявляются в две стадии: гемолимфатическую стадию и неврологическую стадию (последняя характеризуется паразитарной инвазией центральной нервной системы). [9] [10] Неврологические симптомы проявляются в дополнение к начальным признакам, и эти две стадии может быть трудно различить только на основании клинических признаков. [10]
Сообщалось, что заболевание проявляется атипичными симптомами у инфицированных лиц, которые происходят из неэндемичных районов (например, путешественников). Причины этого неясны и могут быть генетическими. Небольшое количество таких случаев также может иметь искаженные результаты. У таких лиц инфекция, как говорят, проявляется в основном как лихорадка с желудочно-кишечными симптомами (например, диарея и желтуха), при этом лимфаденопатия развивается лишь изредка. [11]
Системное заболевание иногда предвещается трипаносомной язвой, развивающейся в месте укуса инфекционной мухи в течение 2 дней после заражения. Язва чаще всего наблюдается при заражении T. b. rhodesiense и лишь изредка при заражении T. b. gambiense (однако при заражении T. b. gambiense язвы чаще встречаются у лиц из неэндемичных районов). [10]
Инкубационный период составляет 1–3 недели для T. b. rhodesiense и дольше (но менее точно охарактеризован) при инфекции T. b. gambiense . Первая/начальная стадия, известная как гемолимфатическая фаза, характеризуется неспецифическими, генерализованными симптомами [10], такими как: лихорадка (перемежающаяся) , головные боли (сильные), [12] боли в суставах , зуд , [9] [10] слабость, недомогание, утомляемость, потеря веса, лимфаденопатия и гепатоспленомегалия . [10]
Диагностика может быть отложена из-за неясности начальных симптомов. Болезнь также может быть ошибочно принята за малярию (которая на самом деле может протекать как сопутствующая инфекция). [11]
Лихорадка носит прерывистый характер, приступы длятся от одного дня до недели, разделенные интервалами от нескольких дней до месяца или дольше. [9] [10] Эпизоды лихорадки становятся менее частыми в течение болезни. [10]
Вторжение паразита в кровеносную и лимфатическую системы связано с сильным отеком лимфатических узлов , часто до огромных размеров. [9] Чаще всего поражаются задние шейные лимфатические узлы, однако также могут поражаться подмышечные, паховые и эпитрохлеарные лимфатические узлы. [10] Может появиться симптом Уинтерботтома — характерное увеличение лимфатических узлов вдоль задней поверхности шеи. [9] Симптом Уинтерботтома часто встречается при заражении T. b. gambiense . [10]
У пострадавших могут также наблюдаться: кожная сыпь, [12] гемолитическая анемия, гепатомегалия и нарушение функции печени, спленомегалия, эндокринные нарушения, поражение сердца (например, перикардит и застойная сердечная недостаточность) и поражение глаз. [11]
Вторая фаза заболевания, неврологическая фаза (также называемая менингоэнцефалической стадией [10] ), начинается, когда паразит проникает в центральную нервную систему , проходя через гематоэнцефалический барьер . [9] Прогрессирование в неврологическую фазу происходит примерно через 21–60 дней в случае заражения T. b. rhodesiens e и через 300–500 дней в случае заражения T. b. gambiense . [10]
В действительности эти две фазы перекрываются и их трудно различить только на основании клинических признаков; определение фактической стадии заболевания достигается путем исследования спинномозговой жидкости на наличие паразита. [10]
Нарушения сна и бодрствования являются ведущим признаком неврологической стадии [9] [15] и дают заболеванию его общее название «сонная болезнь». [9] [10] [15] Инфицированные люди испытывают дезорганизованный и фрагментированный цикл сна и бодрствования. [9] У пораженных людей наблюдается инверсия сна , что приводит к дневному сну [9] и сонливости, [10] а также ночным периодам бодрствования [9] и бессоннице. [10] Кроме того, у пораженных людей также наблюдаются эпизоды внезапной сонливости. [10]
Неврологические симптомы включают: тремор , общую мышечную слабость, гемипарез , паралич конечности, [16] ненормальный мышечный тонус, нарушение походки, атаксию, нарушения речи, парестезию, гиперестезию, анестезию, нарушение зрения, ненормальные рефлексы, судороги и кому. [10] Паркинсоноподобные движения могут возникать из-за неспецифических двигательных расстройств и нарушений речи. [16]
У людей могут проявляться психиатрические симптомы, которые иногда могут доминировать над клиническим диагнозом и могут включать агрессивность, апатию , [10] [16] раздражительность, психотические реакции [16] и галлюцинации , беспокойство , эмоциональную лабильность , спутанность сознания , манию , дефицит внимания и делирий . [10]
Без лечения болезнь неизменно фатальна, с прогрессирующим ухудшением психики, приводящим к коме, системной недостаточности органов и смерти. Нелеченая инфекция T. b. rhodesiense приведет к смерти в течение нескольких месяцев [17] , тогда как нелеченая инфекция T. b. gambiense приведет к смерти через несколько лет. [18] Повреждения, нанесенные в неврологической фазе, необратимы. [19]
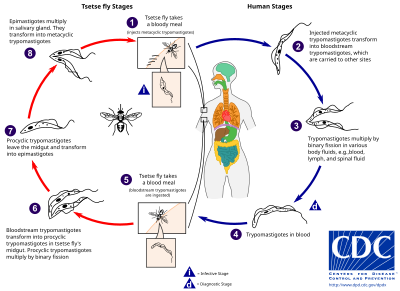
Trypanosoma brucei gambiense является причиной большинства случаев африканского трипаносомоза, причем основным резервуаром, необходимым для передачи, являются люди, в то время как Trypanosoma brucei rhodesiense в основном является зоонозным, со случайным инфицированием людей. [20] Эпидемиология африканского трипаносомоза зависит от взаимодействия между паразитом (трипаносомой), переносчиком ( мухой цеце ) и хозяином. [20]
Существует два подвида паразита, которые вызывают заболевание у людей. Trypanosoma brucei gambiense вызывает заболевание в Западной и Центральной Африке , тогда как Trypanosoma brucei rhodesiense имеет ограниченный географический ареал и вызывает заболевание в Восточной и Южной Африке. Кроме того, третий подвид паразита, известный как Trypanosoma brucei brucei, поражает животных, но не людей. [16]
Люди являются основным резервуаром T. b. gambiense , но этот вид также может быть обнаружен у свиней и других животных. Дикие животные и крупный рогатый скот являются основным резервуаром T. b. rhodesiense . Эти паразиты в первую очередь заражают людей в странах Африки к югу от Сахары, поскольку именно там находится переносчик (муха цеце). Две человеческие формы заболевания также сильно различаются по интенсивности. T. b. gambiense вызывает хроническое состояние , которое может оставаться в пассивной фазе в течение месяцев или лет, прежде чем проявятся симптомы, а инфекция может длиться около трех лет, прежде чем наступит смерть. [16]
T. b. rhodesiense — острая форма заболевания, и смерть может наступить в течение месяцев, так как симптомы проявляются в течение недель, и он более вирулентный и развивается быстрее, чем T. b. gambiense . Кроме того, трипаносомы окружены оболочкой, которая состоит из вариантных поверхностных гликопротеинов (VSG). Эти белки защищают паразита от любых литических факторов, которые присутствуют в плазме человека. Иммунная система хозяина распознает гликопротеины, присутствующие на оболочке паразита, что приводит к выработке различных антител (IgM и IgG). [16]
Эти антитела затем будут действовать, чтобы уничтожить паразитов, циркулирующих в крови. Однако из нескольких паразитов, присутствующих в плазме, небольшое количество из них испытает изменения в своих поверхностных оболочках, что приведет к образованию новых VSG. Таким образом, антитела, вырабатываемые иммунной системой, больше не будут распознавать паразита, что приведет к пролиферации, пока не будут созданы новые антитела для борьбы с новыми VSG. В конце концов, иммунная система больше не сможет бороться с паразитом из-за постоянных изменений в VSG, и возникнет инфекция. [16]

Муха цеце (род Glossina ) — крупная, коричневая, кусающаяся муха, которая служит как хозяином, так и переносчиком для паразитов трипаносом . При заборе крови у млекопитающего-хозяина инфицированная муха цеце впрыскивает метациклические трипомастиготы в кожную ткань. После укуса паразиты сначала попадают в лимфатическую систему, а затем в кровоток. Внутри млекопитающего-хозяина они трансформируются в трипомастиготы кровотока и переносятся в другие места по всему телу, достигают других жидкостей организма (например, лимфы, спинномозговой жидкости) и продолжают размножаться путем бинарного деления . [21] [22]
Весь жизненный цикл африканских трипаносом представлен внеклеточными стадиями. Муха цеце заражается трипомастиготами кровотока при питании кровью инфицированного млекопитающего. В средней кишке мухи паразиты трансформируются в проциклические трипомастиготы, размножаются бинарным делением, покидают среднюю кишку и трансформируются в эпимастиготы. Эпимастиготы достигают слюнных желез мухи и продолжают размножаться бинарным делением. [23]
Весь жизненный цикл мухи занимает около трех недель. Помимо укуса мухи цеце , болезнь может передаваться:
Слепни ( Tabanidae ) и мухи-охвостни ( Muscidae ), возможно, играют роль в передаче наганы (животной формы сонной болезни) и человеческой формы заболевания. [26]
Триптофол — это химическое соединение, вырабатываемое трипаносомным паразитом при сонной болезни, которое вызывает сон у людей. [27]

Золотым стандартом диагностики является идентификация трипаносом в образце с помощью микроскопического исследования. Образцы, которые могут быть использованы для диагностики, включают язвенную жидкость, аспираты лимфатических узлов, кровь, костный мозг и, на неврологической стадии, спинномозговую жидкость . Обнаружение антител, специфичных к трипаносомам, может быть использовано для диагностики, но чувствительность и специфичность этих методов слишком изменчивы, чтобы их можно было использовать отдельно для клинической диагностики. Кроме того, сероконверсия происходит после появления клинических симптомов во время инфекции T. b. rhodesiense , поэтому имеет ограниченное диагностическое применение. [ необходима цитата ]
Трипаносомы можно обнаружить в образцах с помощью двух различных препаратов. Влажный препарат можно использовать для поиска подвижных трипаносом. В качестве альтернативы фиксированный (высушенный) мазок можно окрасить с помощью техники Гимзы или Филда и исследовать под микроскопом. Часто паразит находится в образце в относительно небольшом количестве, поэтому перед микроскопическим исследованием можно использовать методы концентрирования паразитов. Для образцов крови они включают центрифугирование с последующим исследованием лейкоцитарнои пленки ; мини-анионообмен/центрифугирование; и метод количественной лейкоцитарнои пленки (QBC). Для других образцов, таких как спинномозговая жидкость, методы концентрирования включают центрифугирование с последующим исследованием осадка. [ необходима цитата ]
Для обнаружения паразита также доступны три серологических теста: микро-CATT (реакция агглютинации карточек на трипаносомоз), wb-CATT и wb-LATEX. Первый использует сухую кровь, а два других используют образцы цельной крови. Исследование 2002 года показало, что wb-CATT является наиболее эффективным для диагностики, в то время как wb-LATEX является лучшим тестом для ситуаций, где требуется большая чувствительность. [28]

В настоящее время существует мало медицинских вариантов профилактики африканского трипаносомоза (т. е. не существует вакцины для иммунитета). Хотя риск заражения от укуса мухи цеце незначителен (по оценкам, менее 0,1%), использование репеллентов от насекомых, ношение одежды с длинными рукавами, избегание мест, где много мухи цеце, применение методов расчистки кустарников и отстрел дичи являются наилучшими вариантами, доступными для местных жителей пострадавших районов, чтобы избежать заражения. [16]
В июле 2000 года была принята резолюция о создании Панафриканской кампании по искоренению мухи цеце и трипаносомоза (PATTEC). Кампания направлена на искоренение популяции переносчиков мухи цеце и, соответственно, простейших заболеваний путем использования пропитанных инсектицидами целей, ловушек для мух, обработанного инсектицидами скота, сверхнизкодозного распыления с воздуха/на земле (SAT) мест отдыха мухи цеце и метода стерильных насекомых (SIT). [30] Использование SIT в Занзибаре оказалось эффективным в уничтожении всей популяции мухи цеце, но было дорогим и относительно непрактичным для использования во многих эндемичных странах, пораженных африканским трипаносомозом. [31]
Пилотная программа в Сенегале сократила популяцию мухи цеце на 99% за счет внедрения самцов мух, стерилизованных путем воздействия гамма-лучей . [32] [33]
Регулярное активное наблюдение, включающее обнаружение и быстрое лечение новых случаев заражения, а также контроль мухи цеце, является основой стратегии, используемой для контроля сонной болезни. Систематический скрининг сообществ, подверженных риску, является наилучшим подходом, поскольку индивидуальный скрининг нецелесообразен в эндемичных регионах. Систематический скрининг может осуществляться в форме мобильных клиник или стационарных скрининговых центров, где группы ежедневно выезжают в районы с высоким уровнем заражения. Такие усилия по скринингу важны, поскольку ранние симптомы не являются очевидными или достаточно серьезными, чтобы заставить людей с болезнью гамбиенс обратиться за медицинской помощью, особенно в очень отдаленных районах. Кроме того, диагностика заболевания затруднена, и работники здравоохранения могут не связывать такие общие симптомы с трипаносомозом. Систематический скрининг позволяет обнаружить заболевание на ранней стадии и лечить его до того, как оно прогрессирует, и устраняет потенциальный человеческий резервуар. [34] Сообщалось об одном случае передачи западноафриканской сонной болезни половым путем. [25]
Лечение зависит от того, на первой или второй стадии заболевания обнаружено заболевание. Требованием для лечения второй стадии является прохождение препарата через гематоэнцефалический барьер .
Лечение первой стадии заболевания — фексинидазол внутрь или пентамидин в виде инъекций для T. b. gambiense . [3] Сурамин в виде инъекций используется для T. b. rhodesiense . [3]
Фексинидазол может использоваться на второй стадии TbG, если заболевание не тяжелое. [35] [3] В противном случае схема, включающая комбинацию нифуртимокса и эфлорнитина , комбинированное лечение нифуртимоксом-эфлорнитином (NECT) или только эфлорнитин, по-видимому, более эффективны и приводят к меньшему количеству побочных эффектов. [36] Эти методы лечения могут заменить меларсопрол , если они доступны. [36] [2] NECT имеет преимущество в том, что требует меньше инъекций эфлорнитина. [36]
Внутривенное введение меларсопрола ранее было стандартным методом лечения второй стадии заболевания (неврологическая фаза) и эффективно для обоих типов. [2] Меларсопрол является единственным методом лечения второй стадии T. b. rhodesiense ; однако он приводит к смерти у 5% людей, которые его принимают. [2] Может возникнуть резистентность к меларсопролу. [2]
Проекты по разработке лекарств . Основной проблемой было найти лекарства, которые легко преодолевают гематоэнцефалический барьер. Последним препаратом, который вошел в клиническую практику, является фексинидазол, но многообещающие результаты были также получены с препаратом бензоксаборола акозиборолом (SCYX-7158). Этот препарат в настоящее время проходит оценку в качестве однократного перорального лечения, что является большим преимуществом по сравнению с используемыми в настоящее время препаратами. Еще одной областью исследований, которая была широко изучена на Trypanosoma brucei , является нацеливание на его метаболизм нуклеотидов. [37] Исследования метаболизма нуклеотидов привели как к разработке аналогов аденозина, выглядящих многообещающими в исследованиях на животных, так и к выводу, что подавление транспортера аденозина P2 является распространенным способом приобретения частичной лекарственной устойчивости против семейств меламинофенилмышьяка и диамидина (содержащих меларсопрол и пентамидин соответственно). [37] Поглощение и деградация лекарств являются двумя основными проблемами, которые следует учитывать, чтобы избежать развития лекарственной устойчивости. В случае аналогов нуклеозидов они должны быть захвачены транспортером нуклеозидов P1 (вместо P2), и они также должны быть устойчивы к расщеплению паразитом. [38] [39]
При отсутствии лечения T. b. gambiense почти всегда приводит к смерти, и только несколько человек, как было показано в долгосрочном 15-летнем наблюдении, выжили после отказа от лечения. T. b. rhodesiense , будучи более острой и тяжелой формой заболевания, неизменно приводит к летальному исходу, если ее не лечить. [2]
Прогрессирование заболевания сильно различается в зависимости от формы заболевания. Для людей, инфицированных T. b. gambiense , на долю которого приходится 92% всех зарегистрированных случаев, человек может быть инфицирован в течение месяцев или даже лет без признаков или симптомов до поздней стадии заболевания, когда уже слишком поздно проводить успешное лечение. Для людей, пораженных T. b. rhodesiense , на долю которого приходится 2% всех зарегистрированных случаев, симптомы проявляются в течение недель или месяцев после заражения. Прогрессирование заболевания происходит быстро и поражает центральную нервную систему, вызывая смерть в течение короткого периода времени. [40]

В 2010 году он стал причиной около 9000 смертей, что ниже 34000 в 1990 году. [7] По состоянию на 2000 год, количество лет жизни с поправкой на инвалидность (от 9 до 10 лет), потерянных из-за сонной болезни, составляет 2,0 миллиона. [42] С 2010 по 2014 год, по оценкам, 55 миллионов человек подвергались риску африканского трипаносомоза gambiense и более 6 миллионов человек подвергались риску африканского трипаносомоза rhodesiense . [43] В 2014 году Всемирная организация здравоохранения сообщила о 3797 случаях африканского трипаносомоза человека, тогда как прогнозируемое число случаев должно было составить 5000. Общее число зарегистрированных случаев в 2014 году на 86% меньше общего числа случаев, зарегистрированных в 2000 году. [43]
Заболевание зарегистрировано в 37 странах, все в Африке к югу от Сахары. Оно регулярно встречается на юго-востоке Уганды и западе Кении и убило более 48 000 африканцев в 2008 году. [19] Демократическая Республика Конго является наиболее пострадавшей страной в мире, на которую приходится 75% случаев Trypanosoma brucei gambiense . [20] Население, подвергающееся риску, составляет около 69 миллионов человек, причем треть из этого числа находится в группе риска от «очень высокого» до «умеренного», а оставшиеся две трети — в группе риска от «низкого» до «очень низкого». [5] Число людей, пораженных этой болезнью, сократилось. При таких темпах ликвидация сонной болезни является возможной. Всемирная организация здравоохранения планирует искоренить сонную болезнь к 2030 году. [43] [44]

Это состояние существовало в Африке на протяжении тысяч лет. [46] Из-за отсутствия поездок между коренными народами сонная болезнь у людей была ограничена изолированными очагами. Это изменилось после того, как арабские работорговцы проникли в Центральную Африку с востока, следуя по реке Конго , и принесли с собой паразитов. Гамбийская сонная болезнь распространилась вверх по реке Конго, а затем дальше на восток. [47]
Арабский писатель XIV века оставил следующее описание в случае султана королевства Мали: «Его кончина была настигнута сонной болезнью ( illat an-nawm ), которая является болезнью, часто поражающей жителей этих стран, особенно их вождей. Сон настигает одного из них таким образом, что его едва ли возможно разбудить». [47]
Британский военно-морской хирург Джон Аткинс описал болезнь по возвращении из Западной Африки в 1734 году: [47]
Сонная болезнь (распространенная среди негров) не дает никаких других предварительных уведомлений, кроме отсутствия аппетита за 2 или 3 дня до этого; их сон крепкий, а чувства и ощущения очень слабые; поскольку дерганье, побои или порка едва ли пробудят чувства и силы, достаточные для движения; и в тот момент, когда вы прекращаете бить, боль забывается, и они снова впадают в состояние бесчувственности, постоянно истекая изо рта, как при обильном слюноотделении; дышат медленно, но не неравномерно, и не хрюкают. Молодые люди более подвержены этому, чем старые; и приговор, как правило, выносится - смерть, Prognostik редко ошибается. Если время от времени кто-то из них выздоравливает, он, безусловно, теряет тот небольшой разум, который у него был, и становится идеотом...
Французский военно-морской хирург Мари-Теофиль Гриффон дю Белле лечил и описывал случаи, находясь на борту госпитального судна «Караван» в Габоне в конце 1860-х годов. [48]
В 1901 году в Уганде разразилась разрушительная эпидемия , в результате которой погибло более 250 000 человек, [49] включая около двух третей населения в пострадавших прибрежных районах. Согласно «Кембриджской истории Африки» , «было подсчитано, что до половины людей умерло от сонной болезни и оспы в землях по обоим берегам нижней реки Конго ». [50]
Возбудитель и переносчик были идентифицированы в 1903 году Дэвидом Брюсом , а подвиды простейших были дифференцированы в 1910 году. Ранее Брюс показал, что T. brucei является причиной похожего заболевания у лошадей и крупного рогатого скота, которое передавалось мухой цеце ( Glossina morsitans ). [47]
Первое эффективное лечение — атоксил , препарат на основе мышьяка , разработанный Полом Эрлихом и Киёси Шигой , — было введено в 1910 году, но серьезным побочным эффектом была слепота.
Сурамин был впервые синтезирован Оскаром Дресселем и Ричардом Коте в 1916 году для Bayer . Он был представлен в 1920 году для лечения первой стадии заболевания. К 1922 году сурамин обычно сочетался с трипарсамидом (еще одним пятивалентным мышьякорганическим препаратом), первым препаратом, который проник в нервную систему и был полезен при лечении второй стадии формы gambiense. Трипарсамид был анонсирован в Journal of Experimental Medicine в 1919 году и испытан в Бельгийском Конго Луизой Пирс из Института Рокфеллера в 1920 году. Он использовался во время грандиозной эпидемии в Западной и Центральной Африке на миллионах людей и был основой терапии до 1960-х годов. [51] Американский врач-миссионер Артур Льюис Пайпер активно использовал трипарсамид для лечения сонной болезни в Бельгийском Конго в 1925 году. [52]
Пентамидин , высокоэффективный препарат для первой стадии заболевания, использовался с 1937 года. [53] В 1950-х годах он широко использовался в качестве профилактического средства в Западной Африке, что привело к резкому снижению уровня инфицирования. В то время считалось, что искоренение болезни уже близко. [ необходима цитата ] [51]
Мышьякорганический меларсопрол (Арсобал), разработанный в 1940-х годах, эффективен для людей со второй стадией сонной болезни. Однако у 3–10% тех, кому он был введен, развивается реактивная энцефалопатия (судороги, прогрессирующая кома или психотические реакции), и в 10–70% таких случаев наступает смерть; он может вызвать повреждение мозга у тех, кто пережил энцефалопатию. Однако из-за своей эффективности меларсопрол используется и сегодня. Устойчивость к меларсопролу растет, и в настоящее время изучаются комбинированные терапии с нифуртимоксом. [ необходима цитата ]
Эфлорнитин (дифторметилорнитин или DFMO), самое современное лечение, было разработано в 1970-х годах Альбертом Сьёрдсмой и прошло клинические испытания в 1980-х годах. Препарат был одобрен Управлением по контролю за продуктами и лекарствами США в 1990 году. [54] Aventis , компания, ответственная за его производство, остановила производство в 1999 году. В 2001 году Aventis совместно с организацией «Врачи без границ» и Всемирной организацией здравоохранения подписали долгосрочное соглашение о производстве и пожертвовании препарата. [ необходима цитата ]
Помимо сонной болезни, предыдущие названия включали негритянскую летаргию, maladie du sommeil (фр.), Schlafkrankheit (нем.), африканскую летаргию [55] и конголезский трипаносомоз. [55] [56]
Геном паразита был секвенирован , и несколько белков были идентифицированы как потенциальные цели для лечения лекарствами. Анализ генома также выявил причину, по которой создание вакцины от этой болезни было таким сложным. У T. brucei более 800 генов, которые заставляют паразита «смешивать и подбирать» белки, чтобы избежать обнаружения иммунной системой. [57]
Использование генетически модифицированной формы бактерии, которая естественным образом встречается в кишечнике переносчиков, изучается как метод контроля заболевания. [58]
Недавние открытия показывают, что паразит не способен выживать в кровотоке без своего жгутика . Это понимание дает исследователям новый угол, с которого можно атаковать паразита. [59]
Вакцины против трипаносомоза находятся на стадии исследований.
Кроме того, Инициатива по лекарственным препаратам для забытых болезней внесла свой вклад в исследование африканской сонной болезни, разработав соединение под названием фексинидазол . Этот проект был первоначально начат в апреле 2007 года и охватил 749 человек в ДРК и Центральноафриканской Республике . Результаты показали эффективность и безопасность на обеих стадиях заболевания, как у взрослых, так и у детей в возрасте ≥ 6 лет и весом ≥ 20 кг. [60] Европейское агентство по лекарственным средствам одобрило его для первой и второй стадии заболевания за пределами Европы в ноябре 2018 года. [61] Лечение было одобрено в ДРК в декабре 2018 года. [62]
Для текущей статистики финансирования африканский трипаносомоз человека сгруппирован с кинетопластидными инфекциями. Кинетопластиды относятся к группе жгутиконосных простейших. [63] Кинетопластидные инфекции включают африканскую сонную болезнь, болезнь Шагаса и лейшманиоз. В общей сложности эти три заболевания стали причиной 4,4 млн лет жизни с поправкой на инвалидность (DALY) и дополнительно 70 075 зарегистрированных смертей в год. [63] Для кинетопластидных инфекций общее глобальное финансирование исследований и разработок составило приблизительно 136,3 млн долларов США в 2012 году. Каждое из трех заболеваний, африканская сонная болезнь, болезнь Шагаса и лейшманиоз, получило приблизительно треть финансирования, что составило около 36,8 млн долларов США, 38,7 млн долларов США и 31,7 млн долларов США соответственно. [63]
Для сонной болезни финансирование было разделено на фундаментальные исследования, разработку лекарств, вакцины и диагностику. Наибольший объем финансирования был направлен на фундаментальные исследования болезни; на эти усилия было направлено около 21,6 млн долларов США. Что касается терапевтических разработок, было инвестировано около 10,9 млн долларов США. [63]
Основным источником финансирования исследований и разработок в области кинетопластидных инфекций являются государственные источники. Около 62% финансирования поступает из стран с высоким уровнем дохода, а 9% — из стран с низким и средним уровнем дохода. Государственное финансирование стран с высоким уровнем дохода является крупнейшим источником финансирования исследований забытых болезней. Однако в последние годы финансирование из стран с высоким уровнем дохода неуклонно сокращается: в 2007 году страны с высоким уровнем дохода предоставили 67,5% от общего финансирования, тогда как в 2012 году государственные средства стран с высоким уровнем дохода предоставили только 60% от общего финансирования кинетопластидных инфекций. Эта тенденция к снижению оставляет пробел для других источников финансирования, таких как благотворительные фонды и частные фармацевтические компании, которые должны его заполнить. [63]
Большая часть прогресса, достигнутого в исследовании африканской сонной болезни и забытых болезней в целом, является результатом других негосударственных спонсоров. Одним из этих основных источников финансирования стали фонды, которые все больше и больше привержены открытию лекарств от забытых болезней в 21 веке. В 2012 году филантропические источники предоставили 15,9% от общего финансирования. [63] Фонд Билла и Мелинды Гейтс был лидером в предоставлении финансирования для разработки лекарств от забытых болезней . Они выделили 444,1 млн долларов США на исследования забытых болезней в 2012 году. На сегодняшний день они пожертвовали более 1,02 млрд долларов США на усилия по открытию забытых болезней. [64]
В частности, для кинетопластидных инфекций они жертвовали в среднем 28,15 млн долларов США в год в период с 2007 по 2011 год. [63] Они назвали человеческий африканский трипаносомоз перспективной целью, то есть это болезнь, которая представляет наибольшую возможность для контроля, устранения и искоренения посредством разработки новых лекарств, вакцин, программ общественного здравоохранения и диагностики. Они являются вторым по величине источником финансирования для забытых болезней, сразу после Национальных институтов здравоохранения США. [63] В то время, когда государственное финансирование сокращается, а правительственные гранты на научные исследования становится все труднее получить, филантропический мир вмешался, чтобы продвинуть исследования вперед. [ необходима цитата ]
Другой важный компонент возросшего интереса и финансирования пришел из промышленности. В 2012 году они внесли 13,1% в общей сложности в исследования и разработки кинетопластида и дополнительно сыграли важную роль, внося вклад в государственно-частное партнерство (ГЧП), а также партнерство по разработке продукта (ПРП). [63] Государственно-частное партнерство - это соглашение между одним или несколькими государственными субъектами и одним или несколькими частными субъектами, которое существует для достижения определенного результата в области здравоохранения или для производства продукта для здоровья. Партнерство может существовать различными способами; они могут делиться и обмениваться средствами, имуществом, оборудованием, человеческими ресурсами и интеллектуальной собственностью. Эти государственно-частные партнерства и партнерства по разработке продукта были созданы для решения проблем в фармацевтической промышленности, особенно связанных с исследованиями забытых заболеваний. Эти партнерства могут помочь увеличить масштаб усилий по разработке терапевтических средств за счет использования различных знаний, навыков и опыта из разных источников. Было показано, что эти типы партнерств более эффективны, чем промышленные или государственные группы, работающие независимо. [65]
Trypanosoma как rhodesiense , так и gambiense может поражать других животных, таких как крупный рогатый скот и диких животных. [1] Африканский трипаносомоз обычно считался антропонозным заболеванием, и поэтому программа его контроля была в основном сосредоточена на прекращении передачи путем лечения случаев заболевания людей и устранения переносчика. Однако сообщалось, что резервуары животных, возможно, играют важную роль в эндемичной природе африканского трипаносомоза и в его возрождении в исторических очагах Западной и Центральной Африки. [66] [67]
{{cite journal}}: Цитировать журнал требует |journal=( помощь ). стр. 154–5