
Нейротоксины — это токсины , которые разрушают нервную ткань (вызывая нейротоксичность ). [3] Нейротоксины — это обширный класс экзогенных химических неврологических поражений [4] , которые могут отрицательно влиять на функцию как развивающейся, так и зрелой нервной ткани. [5] Этот термин также может использоваться для классификации эндогенных соединений, которые при ненормальном контакте могут оказаться неврологически токсичными. [4] Хотя нейротоксины часто оказываются неврологически разрушительными, их способность специфически воздействовать на нейронные компоненты важна при изучении нервной системы. [6] Распространенными примерами нейротоксинов являются свинец , [7] этанол (питьевой алкоголь), [8] глутамат , [9] оксид азота , [10] ботулинический токсин (например, ботокс), [11] столбнячный токсин , [12] и тетродотоксин . [6] Некоторые вещества, такие как оксид азота и глутамат, на самом деле необходимы для правильного функционирования организма и оказывают нейротоксическое действие только при чрезмерных концентрациях.
Нейротоксины подавляют контроль нейронов над концентрациями ионов через клеточную мембрану [6] или связь между нейронами через синапс . [13] Локальная патология воздействия нейротоксинов часто включает в себя нейронную эксайтотоксичность или апоптоз [14] , но также может включать повреждение глиальных клеток . [15] Макроскопические проявления воздействия нейротоксинов могут включать в себя широко распространенное повреждение центральной нервной системы , такое как умственная отсталость , [5] стойкие нарушения памяти , [16] эпилепсия и деменция . [17] Кроме того, распространено повреждение периферической нервной системы, опосредованное нейротоксинами , такое как невропатия или миопатия . Была показана поддержка ряда методов лечения, направленных на смягчение повреждения, опосредованного нейротоксинами, таких как введение антиоксидантов [8] и антитоксинов [18] .
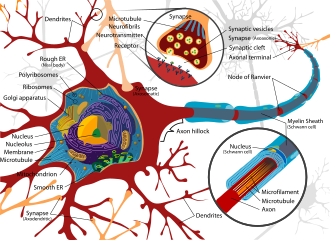
Воздействие нейротоксинов в обществе не является чем-то новым, [19] поскольку цивилизации подвергались воздействию неврологически разрушительных соединений на протяжении тысяч лет. Одним из примечательных примеров является возможное значительное воздействие свинца во времена Римской империи в результате развития обширных водопроводных сетей и привычки кипятить уксусное вино в свинцовых кастрюлях для его подслащивания, в результате чего получался ацетат свинца, известный как «свинцовый сахар». [20] Отчасти нейротоксины были частью человеческой истории из-за хрупкой и восприимчивой природы нервной системы, что делало ее весьма склонной к нарушениям.
Нервная ткань, обнаруженная в головном мозге , спинном мозге и периферии, представляет собой чрезвычайно сложную биологическую систему, которая в значительной степени определяет многие уникальные черты личности. Однако, как и в случае с любой очень сложной системой, даже небольшие возмущения в ее среде могут привести к значительным функциональным нарушениям. Свойства, приводящие к восприимчивости нервной ткани, включают большую площадь поверхности нейронов, высокое содержание липидов , которые удерживают липофильные токсины, высокий приток крови к мозгу, вызывающий повышенное эффективное воздействие токсинов, и сохранение нейронов в течение жизни человека, что приводит к усугублению повреждений. [21] В результате нервная система имеет ряд механизмов, предназначенных для ее защиты от внутренних и внешних атак, включая гематоэнцефалический барьер.
Гематоэнцефалический барьер (ГЭБ) является одним из важнейших примеров защиты, которая предотвращает попадание токсинов и других неблагоприятных соединений в мозг. [22] Поскольку мозгу требуется поступление питательных веществ и удаление отходов, он снабжается кровотоком. Однако кровь может переносить ряд поглощенных токсинов, которые могут вызвать значительную гибель нейронов, если достигнут нервной ткани. Таким образом, защитные клетки, называемые астроцитами, окружают капилляры в мозге и поглощают питательные вещества из крови, а затем транспортируют их к нейронам, эффективно изолируя мозг от ряда потенциальных химических поражений. [22]

Этот барьер создает плотный гидрофобный слой вокруг капилляров в мозге, препятствуя транспорту крупных или гидрофильных соединений. В дополнение к ГЭБ, сосудистое сплетение обеспечивает слой защиты от всасывания токсинов в мозге. Сосудистые сплетения представляют собой васкуляризированные слои ткани, обнаруженные в третьем, четвертом и боковых желудочках мозга , которые посредством функции своих эпендимальных клеток отвечают за синтез спинномозговой жидкости (СМЖ). [23] Важно, что посредством избирательного прохождения ионов и питательных веществ и улавливания тяжелых металлов, таких как свинец, сосудистые сплетения поддерживают строго регулируемую среду, которая содержит головной и спинной мозг. [22] [23]

Будучи гидрофобными и небольшими или ингибируя функцию астроцитов, некоторые соединения, включая определенные нейротоксины, способны проникать в мозг и вызывать значительные повреждения. В наше время ученые и врачи столкнулись с проблемой идентификации и лечения нейротоксинов, что привело к росту интереса как к исследованиям нейротоксикологии, так и к клиническим исследованиям. [24] Хотя клиническая нейротоксикология является в значительной степени развивающейся областью, были достигнуты значительные успехи в идентификации многих экологических нейротоксинов, что привело к классификации от 750 до 1000 известных потенциально нейротоксичных соединений. [21] В связи с критической важностью обнаружения нейротоксинов в обычных средах Агентством по охране окружающей среды США (EPA) были разработаны специальные протоколы для тестирования и определения нейротоксических эффектов соединений (USEPA 1998). Кроме того, системы in vitro стали использоваться чаще, поскольку они обеспечивают значительные улучшения по сравнению с более распространенными системами in vivo прошлого. Примерами улучшений являются управляемые, однородные среды и устранение загрязняющих эффектов системного метаболизма. [24] Однако системы in vitro представляют проблемы, поскольку было трудно должным образом воспроизвести сложности нервной системы, такие как взаимодействия между поддерживающими астроцитами и нейронами при создании ГЭБ. [25] Чтобы еще больше усложнить процесс определения нейротоксинов при тестировании in vitro, нейротоксичность и цитотоксичность могут быть трудноразличимы, поскольку непосредственное воздействие соединений на нейроны может быть невозможно in vivo, как это происходит in vitro. Кроме того, реакция клеток на химические вещества может не точно передавать различие между нейротоксинами и цитотоксинами, поскольку симптомы, такие как окислительный стресс или изменения скелета , могут возникать в ответ на любой из них. [26]
В попытке решить эту проблему недавно были предложены отростки нейритов (аксональные или дендритные) в ответ на применяемые соединения в качестве более точного различия между истинными нейротоксинами и цитотоксинами в среде тестирования in vitro. Однако из-за значительных неточностей, связанных с этим процессом, он медленно получал широкую поддержку. [27] Кроме того, биохимические механизмы стали более широко использоваться в тестировании нейротоксинов, так что соединения можно проверять на предмет достаточности для индуцирования вмешательства в клеточный механизм, например, ингибирования ацетилхолинэстеразной способности органофосфатов (включая паратион и газ зарин ). [28] Хотя методы определения нейротоксичности все еще требуют значительной разработки, идентификация вредных соединений и симптомов воздействия токсинов претерпела значительные улучшения.
Несмотря на разнообразие химических свойств и функций, нейротоксины обладают общим свойством, заключающимся в том, что они действуют посредством некоторого механизма, приводящего либо к нарушению, либо к разрушению необходимых компонентов нервной системы . Однако нейротоксины по своей природе могут быть очень полезны в области нейронауки . Поскольку нервная система большинства организмов является одновременно и очень сложной, и необходимой для выживания, она естественным образом стала мишенью для атак как хищников, так и добычи. Поскольку ядовитые организмы часто используют свои нейротоксины для очень быстрого подчинения хищника или добычи, токсины эволюционировали, чтобы стать высокоспецифичными к своим целевым каналам, так что токсин нелегко связывается с другими целями [29] (см. Токсины ионных каналов ). Таким образом, нейротоксины представляют собой эффективное средство, с помощью которого определенные элементы нервной системы могут быть точно и эффективно нацелены. Ранний пример нацеливания на основе нейротоксинов использовал радиоактивно меченый тетродотоксин для анализа натриевых каналов и получения точных измерений их концентрации вдоль нервных мембран . [29] Аналогичным образом, посредством изоляции определенных видов активности каналов, нейротоксины предоставили возможность улучшить исходную модель нейрона Ходжкина-Хаксли , в которой предполагалось, что отдельные общие натриевые и калиевые каналы могут отвечать за большую часть функций нервной ткани. [29] Исходя из этого базового понимания, использование общих соединений, таких как тетродотоксин, тетраэтиламмоний и бунгаротоксины, привело к гораздо более глубокому пониманию различных способов, которыми могут вести себя отдельные нейроны.
Поскольку нейротоксины являются соединениями, которые отрицательно влияют на нервную систему, ряд механизмов, посредством которых они функционируют, заключается в ингибировании клеточных процессов нейронов. Эти ингибированные процессы могут варьироваться от механизмов деполяризации мембраны до межнейронной коммуникации . Ингибируя способность нейронов выполнять ожидаемые внутриклеточные функции или передавать сигнал соседней клетке, нейротоксины могут вызывать остановку системной нервной системы, как в случае с ботулиническим токсином , [13] или даже гибель нервной ткани. [30] Время, необходимое для появления симптомов при воздействии нейротоксина, может варьироваться в зависимости от разных токсинов, составляя порядка часов для ботулинического токсина [18] и лет для свинца. [31]

Тетродотоксин (TTX) — яд, вырабатываемый организмами, принадлежащими к отряду Tetraodontiformes , в который входят рыба-собака , океаническая рыба-солнце и рыба-дикобраз . [55] В рыбе-собаке TTX содержится в печени , гонадах , кишечнике и коже . [6] [56] TTX может быть смертельным при употреблении и стал распространенной формой отравления во многих странах. Общие симптомы потребления TTX включают парестезию (часто ограниченную ртом и конечностями ) , мышечную слабость, тошноту и рвоту [55] и часто проявляются в течение 30 минут после приема . [57] Основной механизм, посредством которого TTX является токсичным, заключается в ингибировании функции натриевых каналов, что снижает функциональную способность нейронной коммуникации. Это ингибирование в значительной степени влияет на восприимчивую подгруппу натриевых каналов, известных как TTX-чувствительные (TTX-s), которые также в значительной степени отвечают за натриевый ток, который управляет фазой деполяризации потенциалов действия нейронов . [6]

TTX-резистентный (TTX-r) — это еще одна форма натриевого канала, которая имеет ограниченную чувствительность к TTX и в основном встречается в аксонах малого диаметра, таких как те, что встречаются в ноцицептивных нейронах . [6] При попадании значительного количества TTX он связывает натриевые каналы нейронов и снижает их мембранную проницаемость для натрия. Это приводит к повышению эффективного порога требуемых возбуждающих сигналов для того, чтобы вызвать потенциал действия в постсинаптическом нейроне. [6] Эффект этого повышенного порога сигнализации заключается в снижении возбудимости постсинаптических нейронов и последующей потере двигательной и сенсорной функции, что может привести к параличу и смерти. Хотя вспомогательная вентиляция легких может повысить шансы на выживание после воздействия TTX, в настоящее время не существует антитоксина. Однако использование ингибитора ацетилхолинэстеразы неостигмина или мускаринового антагониста ацетилхолина атропина (который будет подавлять парасимпатическую активность) может повысить активность симпатического нерва в достаточной степени, чтобы повысить шансы на выживание после воздействия TTX. [55]
Тетраэтиламмоний (TEA) — это соединение, которое, как и ряд нейротоксинов, было впервые идентифицировано по его разрушительному воздействию на нервную систему и, как было показано, обладает способностью подавлять функцию двигательных нервов и, таким образом, сокращение мускулатуры способом , аналогичным действию кураре. [58] Кроме того, при хроническом введении TEA может быть вызвана мышечная атрофия. [58] Позднее было установлено, что TEA функционирует in vivo в первую очередь за счет своей способности подавлять как калиевые каналы, ответственные за замедленное выпрямление, наблюдаемое в потенциале действия , так и некоторую популяцию кальций-зависимых калиевых каналов. [32] Именно эта способность подавлять поток калия в нейронах сделала TEA одним из важнейших инструментов в нейронауке. Было высказано предположение, что способность TEA ингибировать калиевые каналы обусловлена его структурой, заполняющей пространство, схожей с ионами калия. [58] Что делает TEA очень полезным для нейробиологов, так это его специфическая способность устранять активность калиевых каналов, тем самым позволяя изучать вклад нейронных реакций других ионных каналов, таких как потенциалзависимые натриевые каналы. [59] В дополнение к его многочисленным применениям в нейробиологических исследованиях, было показано, что TEA является эффективным средством лечения болезни Паркинсона благодаря своей способности ограничивать прогрессирование заболевания. [60]
Хлоротоксин (Cltx) — это активное соединение, обнаруженное в яде скорпиона , и оно в первую очередь токсично из-за своей способности подавлять проводимость хлоридных каналов . [33] Прием смертельных объемов Cltx приводит к параличу из-за нарушения этого ионного канала. Было показано, что Cltx, подобно ботулиническому токсину, обладает значительной терапевтической ценностью. Доказательства показали, что Cltx может подавлять способность глиом проникать в здоровую нервную ткань мозга, значительно снижая потенциальный инвазивный вред, наносимый опухолями. [61] [62]
Конотоксины представляют собой категорию ядов, вырабатываемых морской улиткой-конусом, и способны подавлять активность ряда ионных каналов, таких как кальциевые, натриевые или калиевые каналы. [63] [64] Во многих случаях токсины, выделяемые различными типами улиток-конусов , включают ряд различных типов конотоксинов, которые могут быть специфичны для различных ионных каналов, создавая, таким образом, яд, способный вызывать широкомасштабное нарушение нервной функции. [63] Одна из уникальных форм конотоксинов, ω-конотоксин ( ω-CgTx ), высокоспецифичен для каналов Ca2+ и показал свою полезность в их изоляции от системы. [65] Поскольку поток кальция необходим для надлежащей возбудимости клетки, любое значительное ингибирование может предотвратить большую часть функциональности. Примечательно, что ω-CgTx способен к долгосрочному связыванию и ингибированию потенциал-зависимых кальциевых каналов, расположенных в мембранах нейронов, но не мышечных клеток. [66]

Ботулинический токсин (БТХ) представляет собой группу нейротоксинов, состоящую из восьми различных соединений, называемых БТХ-A, B, C, D, E, F, G, H, которые вырабатываются бактерией Clostridium botulinum и приводят к мышечному параличу . [67] Особенно уникальной особенностью БТХ является его относительно распространенное терапевтическое применение при лечении дистонии и спастичности , [67] , а также при индукции мышечной атрофии [11], несмотря на то, что это самое ядовитое из известных веществ. [18] БТХ действует периферически, ингибируя высвобождение ацетилхолина (АХ) в нервно-мышечном соединении посредством деградации белков SNARE, необходимых для слияния везикул-мембран АХ . [35] Поскольку токсин обладает высокой биологической активностью, расчетной дозы 1 мкг/кг веса тела достаточно, чтобы вызвать недостаточный дыхательный объем и, как следствие, смерть от асфиксии . [13] Из-за своей высокой токсичности антитоксины BTX стали активной областью исследований. Было показано, что капсаицин (активное соединение, ответственное за остроту перца чили ) может связывать рецептор TRPV1, экспрессируемый на холинергических нейронах , и ингибировать токсические эффекты BTX. [18]
Нейротоксин столбняка (TeNT) — это соединение, которое функционально снижает тормозные передачи в нервной системе, что приводит к мышечной тетании. TeNT похож на BTX и на самом деле очень похож по структуре и происхождению; оба принадлежат к одной и той же категории клостридиальных нейротоксинов . [12] Как и BTX, TeNT подавляет межнейронную связь посредством высвобождения везикулярного нейротрансмиттера (NT). [36] Одно заметное различие между двумя соединениями заключается в том, что в то время как BTX подавляет мышечные сокращения , TeNT их вызывает. Хотя оба токсина подавляют высвобождение везикул в синапсах нейронов, причина этого различного проявления заключается в том, что BTX функционирует в основном в периферической нервной системе (ПНС), тогда как TeNT в значительной степени активен в центральной нервной системе (ЦНС). [68] Это является результатом миграции TeNT через двигательные нейроны к тормозным нейронам спинного мозга после проникновения через эндоцитоз . [69] Это приводит к потере функции тормозных нейронов в ЦНС, что приводит к системным мышечным сокращениям . Подобно прогнозу смертельной дозы BTX, TeNT приводит к параличу и последующему удушью . [69]
Известно, что нейротоксическое поведение алюминия проявляется при попадании в кровеносную систему , откуда он может мигрировать в мозг и подавлять некоторые из важнейших функций гематоэнцефалического барьера (ГЭБ). [37] Потеря функции ГЭБ может привести к значительному повреждению нейронов в ЦНС, поскольку барьер, защищающий мозг от других токсинов, обнаруженных в крови, больше не будет способен к такому действию. Хотя известно, что металл нейротоксичен, его воздействие обычно ограничивается пациентами , неспособными удалять избыток ионов из крови, например, страдающими почечной недостаточностью . [70] Пациенты, испытывающие токсичность алюминия, могут проявлять такие симптомы , как нарушение обучения и снижение координации движений . [71] Кроме того, известно, что системные уровни алюминия увеличиваются с возрастом и, как было показано, коррелируют с болезнью Альцгеймера , что подразумевает его как нейротоксичное причинное соединение этого заболевания. [72] Несмотря на известную токсичность в ионной форме, исследования разделились относительно потенциальной токсичности использования алюминия в упаковке и кухонных приборах.
Ртуть способна вызывать повреждение ЦНС, проникая в мозг через ГЭБ. [38] Ртуть существует в виде ряда различных соединений, хотя метилртуть (MeHg + ), диметилртуть и диэтилртуть являются единственными значительно нейротоксичными формами. Диэтилртуть и диметилртуть считаются одними из самых мощных нейротоксинов, когда-либо обнаруженных. [38] MeHg + обычно приобретается при употреблении морепродуктов , поскольку он имеет тенденцию концентрироваться в организмах, находящихся высоко в пищевой цепи. [73] Известно, что ион ртути ингибирует транспорт аминокислот (AA) и глутамата (Glu), что потенциально приводит к эксайтотоксическим эффектам. [74]
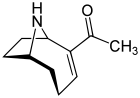
Исследования анатоксина -a , также известного как «фактор очень быстрой смерти», начались в 1961 году после гибели коров, которые пили воду из озера, содержащего цветущие водоросли в Саскачеване, Канада. [41] [42] Это цианотоксин, вырабатываемый по крайней мере четырьмя различными родами цианобактерий , и был зарегистрирован в Северной Америке, Европе, Африке, Азии и Новой Зеландии. [75]
Токсические эффекты анатоксина- а развиваются очень быстро, поскольку он действует непосредственно на нервные клетки ( нейроны ). Прогрессирующими симптомами воздействия анатоксина- а являются потеря координации, подергивание , судороги и быстрая смерть от паралича дыхания . Нервные ткани, которые взаимодействуют с мышцами, содержат рецептор, называемый никотиновым ацетилхолиновым рецептором . Стимуляция этих рецепторов вызывает мышечное сокращение . Молекула анатоксина- а имеет такую форму, которая подходит этому рецептору, и таким образом имитирует естественный нейротрансмиттер, обычно используемый рецептором, ацетилхолин . После того, как он вызвал сокращение, анатоксин- а не позволяет нейронам вернуться в состояние покоя, поскольку он не разрушается холинэстеразой , которая обычно выполняет эту функцию. В результате мышечные клетки постоянно сокращаются, связь между мозгом и мышцами нарушается, и дыхание останавливается. [76] [77]
Когда он был впервые обнаружен, токсин был назван Очень быстрым фактором смерти (VFDF), потому что при введении в полость тела мышей он вызывал тремор, паралич и смерть в течение нескольких минут. В 1977 году структура VFDF была определена как вторичный бициклический аминный алкалоид , и он был переименован в анатоксин -a . [78] [79] По своей структуре он похож на кокаин. [80] Анатоксин -a продолжает вызывать интерес из-за опасностей, которые он представляет для рекреационных и питьевых вод, а также потому, что это особенно полезная молекула для исследования ацетилхолиновых рецепторов в нервной системе. [81] Смертоносность токсина означает, что он имеет высокий военный потенциал как токсинное оружие. [82]
Бунгаротоксин — это соединение, известное взаимодействием с никотиновыми ацетилхолиновыми рецепторами (nAChR), которые представляют собой семейство ионных каналов , активность которых запускается связыванием нейротрансмиттера. [83] Бунгаротоксин вырабатывается в нескольких различных формах, хотя одной из наиболее часто используемых форм является длинноцепочечная альфа-форма, α-бунгаротоксин , которая выделяется из полосатой змеи крайта . [39] Хотя α-бунгаротоксин чрезвычайно токсичен при попадании внутрь, он продемонстрировал обширную полезность в нейронауке, поскольку он особенно эффективен при выделении nAChR из-за своего высокого сродства к рецепторам. [39] Поскольку существует множество форм бунгаротоксина, существуют различные формы nAChR, с которыми он будет связываться, и α-бунгаротоксин особенно специфичен для α7-nAChR . [84] Этот α7-nAChR функционирует, чтобы обеспечить приток ионов кальция в клетки, и, таким образом, при блокировке принятым бунгаротоксином будет производиться разрушительный эффект, поскольку сигнализация ACh будет подавлена. [84] Аналогично, использование α-бунгаротоксина может быть очень полезным в нейронауке, если желательно заблокировать поток кальция, чтобы изолировать эффекты других каналов. Кроме того, различные формы бунгаротоксина могут быть полезны для изучения ингибированных nAChR и их результирующего потока ионов кальция в различных системах организма. Например, α-бунгаротоксин специфичен для nAChR, обнаруженных в мускулатуре, а κ-бунгаротоксин специфичен для nAChR, обнаруженных в нейронах. [85]
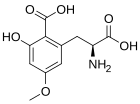
Карамбосин (CBX) — токсин, содержащийся в карамболе ( Averrhoa carambola) . Люди с некоторыми типами заболеваний почек подвержены неблагоприятным неврологическим эффектам, включая интоксикацию, судороги и даже смерть после употребления карамболы или сока из этого фрукта. Карамбосин — это новый непептидный аминокислотный токсин, который стимулирует глутаматные рецепторы в нейронах. Карамбосин является агонистом как NMDA , так и AMPA глутаматергических ионотропных рецепторов с мощными возбуждающими, судорожными и нейродегенеративными свойствами. [43]
Термин « кураре » неоднозначен, поскольку он использовался для описания ряда ядов, которые на момент наименования понимались иначе, чем в настоящее время. В прошлом эта характеристика подразумевала яды, используемые южноамериканскими племенами для стрел или дротиков , хотя она созрела для указания конкретной категории ядов, которые действуют на нервно-мышечное соединение , чтобы подавлять сигнализацию и, таким образом, вызывать мышечную релаксацию. [86] Категория нейротоксинов содержит ряд различных ядов, хотя все они изначально были очищены из растений, происходящих из Южной Америки. [86] Эффект, с которым обычно связывают инъекционный яд кураре, — это мышечный паралич и последующая смерть. [87] Кураре в частности действует на ингибирование никотиновых ацетилхолиновых рецепторов в нервно-мышечном соединении . Обычно эти рецепторные каналы позволяют ионам натрия в мышечных клетках инициировать потенциал действия, который приводит к сокращению мышц. Блокируя рецепторы, нейротоксин способен значительно снижать передачу сигналов в нервно-мышечном соединении, что привело к его использованию анестезиологами для достижения мышечной релаксации. [88]

Токсичность аммиака часто наблюдается двумя путями введения: либо через потребление, либо через эндогенные заболевания, такие как печеночная недостаточность . [89] [90] Один из примечательных случаев, когда токсичность аммиака является распространенной, - это реакция на цирроз печени , которая приводит к печеночной энцефалопатии и может привести к отеку мозга (Haussinger 2006). Этот отек мозга может быть результатом ремоделирования нервных клеток. Было показано, что вследствие повышенных концентраций активность аммиака in vivo вызывает отек астроцитов в мозге за счет увеличения продукции цГМФ (циклического гуанозинмонофосфата) внутри клеток, что приводит к цитоскелетным модификациям, опосредованным протеинкиназой G (PKG). [46] Результирующим эффектом этой токсичности может быть снижение энергетического метаболизма и функции мозга. Важно отметить, что токсическое воздействие аммиака на ремоделирование астроцитов можно уменьшить путем введения L-карнитина . [89] Это ремоделирование астроцитов, по-видимому, опосредовано аммиачным индуцированным переходом митохондриальной проницаемости. Этот митохондриальный переход является прямым результатом активности глутамина — соединения, которое образуется из аммиака in vivo. [91] Введение антиоксидантов или ингибиторов глутаминазы может уменьшить этот митохондриальный переход и, возможно, также ремоделирование астроцитов. [91]
Мышьяк — нейротоксин, обычно концентрирующийся в районах, подверженных воздействию сельскохозяйственных стоков , горнодобывающих и плавильных участков (Martinez-Finley 2011). Одним из последствий приема мышьяка во время развития нервной системы является ингибирование роста нейритов [92], которое может происходить как в ПНС, так и в ЦНС. [93] Это ингибирование роста нейритов часто может приводить к дефектам миграции нейронов и значительным морфологическим изменениям нейронов во время развития , [94] ), часто приводящим к дефектам нервной трубки у новорожденных . [95] Как метаболит мышьяка, арсенит образуется после приема мышьяка и показал значительную токсичность для нейронов в течение примерно 24 часов после воздействия. Механизм этой цитотоксичности функционирует через вызванное арсенитом повышение внутриклеточного уровня ионов кальция в нейронах, что может впоследствии снизить митохондриальный трансмембранный потенциал, который активирует каспазы , вызывая гибель клеток. [94] Другая известная функция арсенита - его разрушительная природа по отношению к цитоскелету через ингибирование транспорта нейрофиламентов . [47] Это особенно разрушительно, поскольку нейрофиламенты используются в базовой структуре и поддержке клеток. Однако введение лития показало многообещающие результаты в восстановлении некоторой части утраченной подвижности нейрофиламентов. [96] Кроме того, подобно другим методам лечения нейротоксинами, введение определенных антиоксидантов показало некоторые перспективы в снижении нейротоксичности потребляемого мышьяка. [94]

Свинец является мощным нейротоксином, токсичность которого известна уже не менее тысяч лет. [97] Хотя нейротоксические эффекты свинца наблюдаются как у взрослых , так и у маленьких детей , развивающийся мозг особенно восприимчив к вреду, вызванному свинцом, эффекты которого могут включать апоптоз и эксайтотоксичность. [97] Основной механизм, посредством которого свинец способен причинять вред, заключается в его способности транспортироваться насосами кальциевой АТФазы через ГЭБ, что обеспечивает прямой контакт с хрупкими клетками центральной нервной системы. [98] Нейротоксичность является результатом способности свинца действовать аналогично ионам кальция, поскольку концентрированный свинец приводит к клеточному поглощению кальция, что нарушает клеточный гомеостаз и вызывает апоптоз. [48] Именно это внутриклеточное увеличение кальция активирует протеинкиназу С (PKC), что проявляется в виде дефицита обучения у детей в результате раннего воздействия свинца. [48] Помимо индукции апоптоза, свинец подавляет передачу сигналов между нейронами посредством нарушения высвобождения нейротрансмиттеров, опосредованного кальцием. [99]

Как нейротоксин, этанол , как было показано, вызывает повреждение нервной системы и влияет на организм различными способами. Среди известных эффектов воздействия этанола есть как временные, так и долгосрочные последствия. Некоторые из долгосрочных эффектов включают долгосрочное снижение нейрогенеза в гиппокампе , [100] [101] широко распространенную атрофию мозга, [102] и вызванное воспаление в мозге. [103] Следует отметить, что хроническое употребление этанола, как было дополнительно показано, вызывает реорганизацию компонентов клеточной мембраны, что приводит к образованию липидного бислоя, отмеченного повышенными концентрациями холестерина и насыщенных жиров в мембране . [50] Это важно, поскольку транспорт нейротрансмиттеров может быть нарушен из-за ингибирования везикулярного транспорта, что приводит к снижению функции нейронной сети. Одним из важных примеров снижения межнейронной коммуникации является способность этанола ингибировать рецепторы NMDA в гиппокампе, что приводит к снижению долгосрочного потенцирования (LTP) и приобретению памяти. [49] Было показано, что NMDA играет важную роль в LTP и, следовательно, в формировании памяти. [104] Однако при хроническом потреблении этанола восприимчивость этих рецепторов NMDA к индукции LTP увеличивается в мезолимбических дофаминовых нейронах в зависимости от инозитол 1,4,5-трифосфата (IP3). [105] Эта реорганизация может привести к нейрональной цитотоксичности как через гиперактивацию постсинаптических нейронов, так и через вызванную зависимость от постоянного потребления этанола. Кроме того, было показано, что этанол напрямую снижает внутриклеточное накопление ионов кальция через ингибированную активность рецепторов NMDA и, таким образом, снижает способность к возникновению LTP. [106]
В дополнение к нейротоксическим эффектам этанола в зрелых организмах, хроническое употребление может вызывать серьезные дефекты развития. Впервые в 1973 году были получены доказательства связи между хроническим потреблением этанола матерями и дефектами у их потомства. [107] Эта работа была ответственна за создание классификации фетального алкогольного синдрома , заболевания, характеризующегося общими аберрациями морфогенеза , такими как дефекты краниофациального формирования, развития конечностей и формирования сердечно-сосудистой системы . Было показано, что величина нейротоксичности этанола у плодов, приводящая к фетальному алкогольному синдрому, зависит от уровней антиоксидантов в мозге, таких как витамин E. [ 108] Поскольку мозг плода относительно хрупок и восприимчив к индуцированным стрессам, серьезные пагубные эффекты воздействия алкоголя можно наблюдать в таких важных областях, как гиппокамп и мозжечок . Тяжесть этих эффектов напрямую зависит от количества и частоты потребления этанола матерью, а также от стадии развития плода. [109] Известно, что воздействие этанола приводит к снижению уровня антиоксидантов, дисфункции митохондрий (Chu 2007) и последующей гибели нейронов, по-видимому, в результате увеличения образования реактивных окислительных видов (ROS). [30] Это вероятный механизм, поскольку в мозге плода наблюдается снижение количества антиоксидантных ферментов, таких как каталаза и пероксидаза . [110] В поддержку этого механизма, введение высоких уровней диетического витамина E приводит к снижению или устранению нейротоксических эффектов, вызванных этанолом, у плода. [8]
н- гексан — нейротоксин, который в последние годы стал причиной отравления нескольких рабочих на китайских заводах по производству электроники. [111] [112] [113] [51]
MPP + , токсичный метаболит MPTP, является селективным нейротоксином, который препятствует окислительному фосфорилированию в митохондриях, ингибируя комплекс I , что приводит к истощению АТФ и последующей гибели клеток. Это происходит почти исключительно в дофаминергических нейронах черной субстанции , что приводит к проявлению постоянного паркинсонизма у подвергшихся воздействию субъектов через 2–3 дня после введения.
В отличие от большинства распространенных источников нейротоксинов, которые попадают в организм через пищеварительный тракт, эндогенные нейротоксины как возникают, так и оказывают свое действие in vivo . Кроме того, хотя большинство ядов и экзогенных нейротоксинов редко обладают полезными возможностями in vivo, эндогенные нейротоксины обычно используются организмом полезными и здоровыми способами, например, как оксид азота, который используется в клеточной коммуникации. [114] Часто только тогда, когда эти эндогенные соединения становятся высококонцентрированными, они приводят к опасным эффектам. [9]
Хотя оксид азота (NO) обычно используется нервной системой в межнейронной коммуникации и передаче сигналов, он может быть активен в механизмах, приводящих к ишемии в головном мозге (Iadecola 1998). Нейротоксичность NO основана на его важности в эксайтотоксичности глутамата, поскольку NO генерируется зависимым от кальция образом в ответ на активацию NMDA, опосредованную глутаматом, которая происходит с повышенной скоростью при эксайтотоксичности глутамата. [52] Хотя NO способствует увеличению притока крови к потенциально ишемическим областям мозга, он также способен усиливать окислительный стресс , [115] вызывая повреждение ДНК и апоптоз. [116] Таким образом, повышенное присутствие NO в ишемической области ЦНС может вызывать значительные токсические эффекты.
Глутамат , как и оксид азота, является эндогенно вырабатываемым соединением, используемым нейронами для нормальной работы, присутствующим в небольших концентрациях по всему серому веществу ЦНС. [9] Одним из наиболее заметных применений эндогенного глутамата является его функциональность в качестве возбуждающего нейротрансмиттера. [53] Однако при концентрации глутамат становится токсичным для окружающих нейронов. Эта токсичность может быть как результатом прямого летального действия глутамата на нейроны, так и результатом индуцированного потока кальция в нейроны, приводящего к отеку и некрозу. [53] Было показано, что эти механизмы играют важную роль в таких заболеваниях и осложнениях, как болезнь Хантингтона , эпилепсия и инсульт . [9]
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка )