
В органической химии алкен или олефин — это углеводород , содержащий двойную связь углерод - углерод . [1] Двойная связь может быть внутренней или в терминальном положении. Терминальные алкены также известны как α-олефины .
Международный союз теоретической и прикладной химии (ИЮПАК) рекомендует использовать название «алкен» только для ациклических углеводородов с одной двойной связью; алкадиен , алкатриен и т. д. или полиен для ациклических углеводородов с двумя или более двойными связями; циклоалкен , циклоалкадиен и т. д. для циклических ; и «олефин» для общего класса — циклических или ациклических, с одной или более двойными связями. [2] [3] [4]
Ациклические алкены, имеющие только одну двойную связь и не имеющие других функциональных групп (также известные как моноены ), образуют гомологический ряд углеводородов с общей формулой C n H 2 n , где n является натуральным числом > 1 (что на два атома водорода меньше, чем у соответствующего алкана ). Когда n равно четырем или более, возможны изомеры , различающиеся положением и конформацией двойной связи.
Алкены, как правило , бесцветные неполярные соединения, несколько похожие на алканы, но более реакционноспособные . Первые несколько членов ряда являются газами или жидкостями при комнатной температуре. Простейший алкен, этилен ( C2H4 ) (или «этен» в номенклатуре ИЮПАК ) — это органическое соединение, производимое в промышленных масштабах в наибольшем количестве. [5]
Ароматические соединения часто изображаются как циклические алкены, однако их структура и свойства достаточно различны, чтобы их можно было классифицировать как алкены или олефины. [3] Углеводороды с двумя перекрывающимися двойными связями ( C=C=C ) называются алленами — простейшее такое соединение само по себе называется алленом — а те, у которых есть три или более перекрывающихся связей ( C=C=C=C , C=C=C=C=C и т. д.), называются кумуленами .
Алкены, имеющие четыре или более атомов углерода , могут образовывать разнообразные структурные изомеры . Большинство алкенов также являются изомерами циклоалканов . Ациклические структурные изомеры алкенов с одной двойной связью следующие: [6]
Многие из этих молекул демонстрируют цис - транс -изомерию . Также могут быть хиральные атомы углерода, особенно внутри более крупных молекул (от C5 ). Число потенциальных изомеров быстро увеличивается с дополнительными атомами углерода.

Двойная связь углерод-углерод состоит из сигма-связи и пи-связи . Эта двойная связь прочнее одинарной ковалентной связи (611 кДж / моль для C=C против 347 кДж/моль для C–C), [1] , но не в два раза прочнее. Двойные связи короче одинарных, средняя длина связи составляет 1,33 Å (133 пм ) против 1,53 Å для типичной одинарной связи CC. [7]
Каждый атом углерода двойной связи использует свои три гибридные sp 2 орбитали для образования сигма-связей с тремя атомами (другим атомом углерода и двумя атомами водорода). Негибридизованные атомные орбитали 2p, которые лежат перпендикулярно плоскости, созданной осями трех гибридных sp 2 орбиталей, объединяются, образуя пи-связь. Эта связь лежит вне главной оси C–C, причем половина связи находится на одной стороне молекулы, а половина — на другой. При прочности 65 ккал/моль пи-связь значительно слабее сигма-связи.
Вращение вокруг двойной связи углерод-углерод ограничено, поскольку для нарушения выравнивания p-орбиталей на двух атомах углерода требуются энергетические затраты. Следовательно, цис- или транс- изомеры взаимопревращаются настолько медленно, что с ними можно свободно обращаться в условиях окружающей среды без изомеризации. Более сложные алкены могут быть названы с помощью обозначения E – Z для молекул с тремя или четырьмя различными заместителями (боковыми группами). Например, из изомеров бутена две метильные группы ( Z )-бут-2 -ена (он же цис -2-бутен) появляются на одной стороне двойной связи, а в ( E )-бут-2-ене (он же транс -2-бутен) метильные группы появляются на противоположных сторонах. Эти два изомера бутена обладают различными свойствами.
Как предсказывает модель отталкивания электронных пар VSEPR , молекулярная геометрия алкенов включает углы связи вокруг каждого атома углерода в двойной связи около 120°. Угол может меняться из-за стерического напряжения , вызванного не связанными взаимодействиями между функциональными группами, присоединенными к атомам углерода двойной связи. Например, угол связи C–C–C в пропилене составляет 123,9°.
Для мостиковых алкенов правило Бредта гласит, что двойная связь не может возникнуть в головной части мостиковой кольцевой системы, если кольца не достаточно велики. [8] Следуя Фосетту и определяя S как общее число атомов, не являющихся головными частями в кольцах, [9] бициклические системы требуют S ≥ 7 для стабильности [8] , а трициклические системы требуют S ≥ 11. [10]
В органической химии префиксы цис- и транс- используются для описания положений функциональных групп, присоединенных к атомам углерода, соединенным двойной связью. На латыни цис и транс означают «по эту сторону» и «по другую сторону» соответственно. Поэтому, если функциональные группы находятся по одну сторону углеродной цепи, говорят, что связь имеет цис- конфигурацию, в противном случае (т. е. функциональные группы находятся по другую сторону углеродной цепи), говорят, что связь имеет транс- конфигурацию.
Для того чтобы были цис- и транс-конфигурации, должна быть углеродная цепь, или по крайней мере одна функциональная группа, присоединенная к каждому углероду, одинакова для обоих. E- и Z-конфигурации могут использоваться вместо этого в более общем случае, когда все четыре функциональные группы, присоединенные к атомам углерода в двойной связи, различны. E- и Z- являются сокращениями немецких слов zusammen (вместе) и entgegen (напротив). В E- и Z-изомерии каждой функциональной группе назначается приоритет на основе правил приоритета Кана-Ингольда-Прелога . Если две группы с более высоким приоритетом находятся по одну сторону двойной связи, связи назначается Z- конфигурация, в противном случае (т. е. две группы с более высоким приоритетом находятся по противоположную сторону двойной связи), связи назначается E- конфигурация. Цис- и транс-конфигурации не имеют фиксированной связи с E- и Z -конфигурациями.
Многие физические свойства алкенов и алканов схожи: они бесцветны, неполярны и горючи. Физическое состояние зависит от молекулярной массы : подобно соответствующим насыщенным углеводородам, простейшие алкены ( этилен , пропилен и бутен ) являются газами при комнатной температуре. Линейные алкены, содержащие приблизительно от пяти до шестнадцати атомов углерода, являются жидкостями, а высшие алкены — восковыми твердыми веществами. Температура плавления твердых веществ также увеличивается с увеличением молекулярной массы.
Алкены обычно имеют более сильный запах, чем соответствующие им алканы. У этилена сладкий и затхлый запах. Известно, что напряженные алкены, в частности, такие как норборнен и транс -циклооктен, имеют сильный, неприятный запах, что согласуется с более сильными π-комплексами, которые они образуют с ионами металлов, включая медь. [11]
Ниже приведен список температур кипения и плавления различных алкенов с соответствующими аналогами алканов и алкинов. [12] [13]
Растяжение связи C=C даст пик поглощения ИК-излучения при 1670–1600 см −1 , тогда как изгиб связи C=C поглощает длину волны от 1000 до 650 см −1 .
В спектроскопии ЯМР 1 H водород, связанный с углеродом, соседствующим с двойными связями, даст δ H 4,5–6,5 ppm . Двойная связь также деэкранирует водород, присоединенный к углеродам, соседствующим с sp 2 углеродами, и это генерирует пики δ H =1,6–2. ppm. [14] Цис/транс изомеры различимы из-за различного эффекта J-связывания . Цис- вицинальные водороды будут иметь константы связи в диапазоне 6–14 Гц , тогда как транс будет иметь константы связи 11–18 Гц. [15]
В спектрах ЯМР 13 C алкенов двойные связи также деэкранируют углероды, что приводит к низкому сдвигу поля. Двойные связи C=C обычно имеют химический сдвиг около 100–170 ppm. [15]
Как и большинство других углеводородов , алкены сгорают с образованием углекислого газа и воды.
Сгорание алкенов выделяет меньше энергии, чем сгорание той же молярности насыщенных с тем же числом атомов углерода. Эта тенденция хорошо прослеживается в списке стандартных энтальпий сгорания углеводородов. [16]
Алкены являются относительно стабильными соединениями, но более реакционноспособны, чем алканы . Большинство реакций алкенов включают присоединения к этой пи-связи, образуя новые одинарные связи . Алкены служат сырьем для нефтехимической промышленности , поскольку они могут участвовать в самых разных реакциях, в частности, в полимеризации и алкилировании. За исключением этилена, алкены имеют два центра реакционной способности: углерод-углеродную пи-связь и наличие аллильных CH-центров. Первый доминирует, но аллильные центры также важны.

Гидрирование включает добавление H 2 , что приводит к образованию алкана. Уравнение гидрирования этилена с образованием этана :
Реакции гидрирования обычно требуют катализаторов для увеличения скорости реакции . Общее количество водородов, которые могут быть добавлены к ненасыщенному углеводороду, зависит от степени его ненасыщенности .
Подобно водороду, галогены присоединяются к двойным связям.
Ионы галония являются промежуточными продуктами. Эти реакции не требуют катализаторов.

Бромный тест используется для проверки насыщенности углеводородов. [17] Бромный тест также может использоваться в качестве показателя степени ненасыщенности ненасыщенных углеводородов. Бромное число определяется как грамм брома, способный реагировать со 100 г продукта. [18] Подобно гидрированию, галогенирование брома также зависит от числа π-связей. Более высокое бромное число указывает на более высокую степень ненасыщенности.
π-связи алкеновых углеводородов также подвержены гидратации . Реакция обычно включает сильную кислоту в качестве катализатора . [19] Первый шаг гидратации часто включает образование карбокатиона . Конечным результатом реакции будет спирт . Уравнение реакции гидратации этилена:
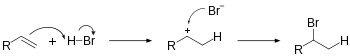
Гидрогалогенирование включает присоединение H−X к ненасыщенным углеводородам. В результате этой реакции образуются новые σ-связи C−H и C−X. Образование промежуточного карбокатиона селективно и подчиняется правилу Марковникова . Гидрогалогенирование алкена приведет к образованию галогеналкана . Уравнение реакции присоединения HBr к этилену:
![Генерация синглетного кислорода и его [4+2]-циклоприсоединение с циклопентадиеном](http://upload.wikimedia.org/wikipedia/commons/thumb/1/12/4%2B2_cycloaddition_cyclopentadiene_O2.svg/350px-4%2B2_cycloaddition_cyclopentadiene_O2.svg.png)
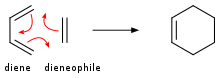
Алкены присоединяются к диенам, образуя циклогексены . Это превращение является примером реакции Дильса-Альдера . Такая реакция протекает с сохранением стереохимии. Скорости чувствительны к электроноакцепторным или электронодонорным заместителям. При облучении УФ-светом алкены димеризуются, образуя циклобутаны . [20] Другим примером является реакция Шенкена , в которой синглетный кислород реагирует с аллильной структурой, образуя транспонированную аллильную перекись :

Алкены реагируют с перкарбоновыми кислотами и даже перекисью водорода с образованием эпоксидов :
Эпоксидирование этилена осуществляется в очень больших промышленных масштабах с использованием кислорода в присутствии катализаторов на основе серебра:
Алкены реагируют с озоном, что приводит к разрыву двойной связи. Этот процесс называется озонолизом . Часто в процедуру реакции входит мягкий восстановитель, такой как диметилсульфид ( SMe 2 ):
При обработке горячим концентрированным подкисленным раствором KMnO 4 алкены расщепляются с образованием кетонов и/или карбоновых кислот . Стехиометрия реакции чувствительна к условиям. Эту реакцию и озонолиз можно использовать для определения положения двойной связи в неизвестном алкене.
Окисление можно остановить на уровне вицинального диола, а не путем полного расщепления алкена, используя тетроксид осмия или другие окислители:
Эта реакция называется дигидроксилированием .
В присутствии соответствующего фотосенсибилизатора , такого как метиленовый синий , и света, алкены могут вступать в реакцию с активными формами кислорода, генерируемыми фотосенсибилизатором, такими как гидроксильные радикалы , синглетный кислород или супероксидный ион. Реакции возбужденного сенсибилизатора могут включать перенос электронов или водорода, обычно с восстанавливающим субстратом (реакция типа I) или взаимодействие с кислородом (реакция типа II). [21] Эти различные альтернативные процессы и реакции можно контролировать выбором определенных условий реакции, что приводит к широкому спектру продуктов. Распространенным примером является [4+2]-циклоприсоединение синглетного кислорода с диеном, таким как циклопентадиен, с получением эндопероксида :
Терминальные алкены являются предшественниками полимеров через процессы, называемые полимеризацией . Некоторые полимеризации имеют большое экономическое значение, так как они производят пластмассы полиэтилен и полипропилен . Полимеры из алкена обычно называют полиолефинами, хотя они не содержат олефинов. Полимеризация может протекать по различным механизмам. Сопряженные диены , такие как бута-1,3-диен и изопрен (2-метилбута-1,3-диен), также производят полимеры, одним из примеров которых является натуральный каучук.
Наличие связи C=C π в ненасыщенных углеводородах ослабляет энергию диссоциации аллильных связей C−H. Таким образом, эти группировки восприимчивы к свободнорадикальному замещению на этих участках CH, а также к реакциям присоединения на участке C=C. В присутствии радикальных инициаторов аллильные связи CH могут быть галогенированы. [22] Наличие двух связей C=C, фланкирующих одну метиленовую, т. е. дважды аллильных, приводит к особенно слабым связям HC-H. Высокая реакционная способность этих ситуаций является основой для определенных свободнорадикальных реакций, проявляющихся в химии высыхающих масел .
Алкены подвергаются метатезису олефинов , который расщепляет и меняет местами заместители алкена. Связанная реакция — этенолиз : [23]


В комплексах переходных металлов с алкенами алкены служат лигандами для металлов. [24] В этом случае π-электронная плотность отдается [ требуется разъяснение ] на d-орбитали металла. Чем сильнее отдача, тем сильнее обратная связь от d-орбитали металла к π*-антисвязывающей орбитали алкена. Этот эффект снижает порядок связи алкена и увеличивает длину связи CC . Одним из примеров является комплекс PtCl 3 (C 2 H 4 )] − . Эти комплексы связаны с механизмами катализируемых металлами реакций ненасыщенных углеводородов. [23]
Алкены производятся путем крекинга углеводородов. В США и на Ближнем Востоке сырьем в основном являются компоненты конденсата природного газа (главным образом этан и пропан), а в Европе и Азии — нафта . Алканы расщепляются при высоких температурах, часто в присутствии цеолитного катализатора, для получения смеси в основном алифатических алкенов и алканов с более низкой молекулярной массой. Смесь зависит от сырья и температуры и разделяется фракционной перегонкой. Это в основном используется для производства малых алкенов (до шести атомов углерода). [25]

С этим связана каталитическая дегидрогенизация , при которой алкан теряет водород при высоких температурах, образуя соответствующий алкен. [1] Это процесс, обратный каталитическому гидрированию алкенов.

Этот процесс также известен как риформинг . Оба процесса являются эндотермическими и при высоких температурах движутся к алкену под действием энтропии .
Каталитический синтез высших α-алкенов (типа RCH=CH 2 ) может быть также достигнут путем реакции этилена с металлоорганическим соединением триэтилалюминием в присутствии никеля , кобальта или платины .
Одним из основных методов синтеза алкенов в лабораторных условиях является реакция элиминирования алкилгалогенидов, спиртов и подобных соединений. Наиболее распространенным является β-элиминирование по механизму E2 или E1. [26] Коммерчески значимым примером является производство винилхлорида .
Механизм E2 обеспечивает более надежный метод β-элиминирования, чем E1, для большинства синтезов алкенов. Большинство элиминирований E2 начинаются с алкилгалогенида или алкилсульфонатного эфира (например, тозилата или трифлата ). Когда используется алкилгалогенид, реакция называется дегидрогалогенированием . Для несимметричных продуктов более замещенные алкены (те, у которых меньше водородов, присоединенных к C=C), как правило, преобладают (см. правило Зайцева ). Два распространенных метода реакций элиминирования — это дегидрогалогенирование алкилгалогенидов и дегидратация спиртов. Типичный пример показан ниже; обратите внимание, что, если возможно, H находится в анти-положении к уходящей группе, даже если это приводит к менее стабильному Z -изомеру. [27]

Алкены могут быть синтезированы из спиртов путем дегидратации , в этом случае вода теряется по механизму E1. Например, дегидратация этанола дает этилен:
Спирт также может быть преобразован в лучшую уходящую группу (например, ксантогенат ), чтобы обеспечить более мягкое син -элиминирование, такое как элиминирование Чугаева и элиминирование Грико . Связанные реакции включают элиминирование β-галогенэфирами ( синтез олефинов по Бурду ) и эфирами ( пиролиз эфиров ). Тиокетон и фосфитный эфир в сочетании ( олефинирование по Кори-Уинтеру ) или тетраиодид дифосфора дезоксигенируют гликоли до алкенов.
Алкены могут быть получены косвенно из алкиламинов . Амин или аммиак не являются подходящей уходящей группой, поэтому амин сначала либо алкилируется (как в элиминировании Хофмана ), либо окисляется до оксида амина ( реакция Копа ), чтобы сделать возможным плавное элиминирование. Реакция Копа представляет собой син -элиминирование, которое происходит при температуре 150 °C или ниже, например: [28]

Элиминирование Хофмана необычно тем, что основным продуктом обычно является менее замещенный (не зайцевский ) алкен.
Алкены образуются из α-галогенсульфонов в реакции Рамберга-Бэклунда через промежуточный сульфон с трехчленным кольцом.
Другой важный класс методов синтеза алкенов включает построение новой двойной связи углерод-углерод путем связывания или конденсации карбонильного соединения (например, альдегида или кетона ) с карбанионом или его эквивалентом. Преобладающей является альдольная конденсация . Конденсации Кнёвенагеля представляют собой родственный класс реакций, которые превращают карбонилы в алкены. Хорошо известные методы называются олефинированиями . Реакция Виттига является иллюстративной, но известны и другие родственные методы, включая реакцию Хорнера-Уодсворта-Эммонса .
The Wittig reaction involves reaction of an aldehyde or ketone with a Wittig reagent (or phosphorane) of the type Ph3P=CHR to produce an alkene and Ph3P=O. The Wittig reagent is itself prepared easily from triphenylphosphine and an alkyl halide.[29]

Related to the Wittig reaction is the Peterson olefination, which uses silicon-based reagents in place of the phosphorane. This reaction allows for the selection of E- or Z-products. If an E-product is desired, another alternative is the Julia olefination, which uses the carbanion generated from a phenyl sulfone. The Takai olefination based on an organochromium intermediate also delivers E-products. A titanium compound, Tebbe's reagent, is useful for the synthesis of methylene compounds; in this case, even esters and amides react.
A pair of ketones or aldehydes can be deoxygenated to generate an alkene. Symmetrical alkenes can be prepared from a single aldehyde or ketone coupling with itself, using titanium metal reduction (the McMurry reaction). If different ketones are to be coupled, a more complicated method is required, such as the Barton–Kellogg reaction.
A single ketone can also be converted to the corresponding alkene via its tosylhydrazone, using sodium methoxide (the Bamford–Stevens reaction) or an alkyllithium (the Shapiro reaction).
The formation of longer alkenes via the step-wise polymerisation of smaller ones is appealing, as ethylene (the smallest alkene) is both inexpensive and readily available, with hundreds of millions of tonnes produced annually. The Ziegler–Natta process allows for the formation of very long chains, for instance those used for polyethylene. Where shorter chains are wanted, as they for the production of surfactants, then processes incorporating a olefin metathesis step, such as the Shell higher olefin process are important.
Olefin metathesis is also used commercially for the interconversion of ethylene and 2-butene to propylene. Rhenium- and molybdenum-containing heterogeneous catalysis are used in this process:[30]
Transition metal catalyzed hydrovinylation is another important alkene synthesis process starting from alkene itself.[31] It involves the addition of a hydrogen and a vinyl group (or an alkenyl group) across a double bond.
Reduction of alkynes is a useful method for the stereoselective synthesis of disubstituted alkenes. If the cis-alkene is desired, hydrogenation in the presence of Lindlar's catalyst (a heterogeneous catalyst that consists of palladium deposited on calcium carbonate and treated with various forms of lead) is commonly used, though hydroboration followed by hydrolysis provides an alternative approach. Reduction of the alkyne by sodium metal in liquid ammonia gives the trans-alkene.[32]

For the preparation multisubstituted alkenes, carbometalation of alkynes can give rise to a large variety of alkene derivatives.
Alkenes can be synthesized from other alkenes via rearrangement reactions. Besides olefin metathesis (described above), many pericyclic reactions can be used such as the ene reaction and the Cope rearrangement.

In the Diels–Alder reaction, a cyclohexene derivative is prepared from a diene and a reactive or electron-deficient alkene.
Unsaturated hydrocarbons are widely used to produce plastics, medicines, and other useful materials.
Alkenes are prevalent in nature. Plants are the main natural source of alkenes in the form of terpenes.[33] Many of the most vivid natural pigments are terpenes; e.g. lycopene (red in tomatoes), carotene (orange in carrots), and xanthophylls (yellow in egg yolk). The simplest of all alkenes, ethylene is a signaling molecule that influences the ripening of plants.
Although the nomenclature is not followed widely, according to IUPAC, an alkene is an acyclic hydrocarbon with just one double bond between carbon atoms.[2] Olefins comprise a larger collection of cyclic and acyclic alkenes as well as dienes and polyenes.[3]
To form the root of the IUPAC names for straight-chain alkenes, change the -an- infix of the parent to -en-. For example, CH3-CH3 is the alkane ethANe. The name of CH2=CH2 is therefore ethENe.
For straight-chain alkenes with 4 or more carbon atoms, that name does not completely identify the compound. For those cases, and for branched acyclic alkenes, the following rules apply:
The position of the double bond is often inserted before the name of the chain (e.g. "2-pentene"), rather than before the suffix ("pent-2-ene").
The positions need not be indicated if they are unique. Note that the double bond may imply a different chain numbering than that used for the corresponding alkane: (H
3C)
3C–CH
2–CH
3 is "2,2-dimethyl pentane", whereas (H
3C)
3C–CH=CH
2 is "3,3-dimethyl 1-pentene".
More complex rules apply for polyenes and cycloalkenes.[4]

If the double bond of an acyclic mono-ene is not the first bond of the chain, the name as constructed above still does not completely identify the compound, because of cis–trans isomerism. Then one must specify whether the two single C–C bonds adjacent to the double bond are on the same side of its plane, or on opposite sides. For monoalkenes, the configuration is often indicated by the prefixes cis- (from Latin "on this side of") or trans- ("across", "on the other side of") before the name, respectively; as in cis-2-pentene or trans-2-butene.

More generally, cis–trans isomerism will exist if each of the two carbons of in the double bond has two different atoms or groups attached to it. Accounting for these cases, the IUPAC recommends the more general E–Z notation, instead of the cis and trans prefixes. This notation considers the group with highest CIP priority in each of the two carbons. If these two groups are on opposite sides of the double bond's plane, the configuration is labeled E (from the German entgegen meaning "opposite"); if they are on the same side, it is labeled Z (from German zusammen, "together"). This labeling may be taught with mnemonic "Z means 'on ze zame zide'".[34]

IUPAC recognizes two names for hydrocarbon groups containing carbon–carbon double bonds, the vinyl group and the allyl group.[4]
