Артемизинин ( / ˌ ɑːr t ɪ ˈ m iː s ɪ n ɪ n / ) и его полусинтетические производные представляют собой группу препаратов, используемых для лечения малярии, вызванной Plasmodium falciparum . [1] Он был открыт в 1972 году Ту Юю , которая разделила Нобелевскую премию по физиологии и медицине 2015 года за свое открытие. [2] Комбинированная терапия на основе артемизинина (АКТ) в настоящее время является стандартным лечением во всем мире для малярии, вызванной P. falciparum , а также для малярии, вызванной другими видами плазмодиев . [3] Артемизинин извлекается из растения Artemisia annua (сладкая полынь), травы, используемой в китайской традиционной медицине . Соединение-предшественник может быть получено с использованием генетически модифицированных дрожжей , что намного эффективнее, чем использование растения. [4]
Артемизинин и его производные — это все сесквитерпеновые лактоны , содержащие необычный пероксидный мостик. Это эндопероксидное 1,2,4-триоксановое кольцо отвечает за их противомалярийные свойства. Известно немного других природных соединений с таким пероксидным мостиком. [5]
Артемизинин и его производные использовались для лечения малярийных и паразитарных червей (гельминтов) . Преимущества таких методов лечения по сравнению с другими противопаразитарными средствами включают более быстрое устранение паразитов и более широкую эффективность на протяжении всего жизненного цикла паразита; недостатки включают их низкую биодоступность , плохие фармакокинетические свойства и высокую стоимость. [6] [7] Более того, использование препарата в качестве монотерапии явно не рекомендуется Всемирной организацией здравоохранения , [8] поскольку были признаки того, что малярийные паразиты развивают устойчивость к препарату. [9] Комбинированная терапия , включающая артемизинин или его производные вместе с некоторыми другими противомалярийными препаратами, представляет собой современный стандартный режим лечения малярии. [10]
Всемирная организация здравоохранения (ВОЗ) рекомендует артемизинин или одно из его производных — обычно в сочетании с более продолжительным партнерским препаратом — в качестве терапии первой линии для всех случаев малярии. [3] Для неосложненной малярии ВОЗ рекомендует три дня перорального лечения любым из пяти комбинированных препаратов на основе артемизинина (АКТ): артеметер/люмефантрин , артесунат/амодиахин (ASAQ), артесунат/мефлохин , дигидроартемизинин/пиперахин или артесунат/сульфадоксин/пириметамин . [3] В каждой из этих комбинаций производное артемизинина быстро убивает паразитов, но само быстро выводится из организма. [11] Более продолжительный партнерский препарат убивает оставшихся паразитов и обеспечивает некоторую длительную защиту от повторного заражения. [12]
При тяжелой малярии ВОЗ рекомендует внутривенное или внутримышечное лечение производным артемизинина артесунатом в течение как минимум 24 часов. [13] Лечение артесунатом продолжается до тех пор, пока пациент не почувствует себя достаточно хорошо, чтобы принимать пероральные препараты. Затем ему назначают трехдневный курс АКТ при неосложненной малярии. [13] Если артесунат недоступен, ВОЗ рекомендует внутримышечную инъекцию менее сильнодействующего производного артемизинина артеметера . [14] Для детей младше шести лет, если инъекционный артесунат недоступен, ВОЗ рекомендует ректальное введение артесуната с последующим направлением в учреждение с ресурсами для дальнейшего ухода. [13]
Артемизинины не используются для профилактики малярии из-за чрезвычайно короткой активности ( периода полураспада ) препарата. Чтобы быть эффективным, его нужно вводить несколько раз в день. [ необходима цитата ]
ВОЗ рекомендует избегать АКТ женщинам в первом триместре беременности из-за отсутствия исследований безопасности артемизинина на ранних сроках беременности. Вместо этого ВОЗ рекомендует семидневный курс клиндамицина и хинина . [15] Для беременных женщин во втором или третьем триместрах ВОЗ рекомендует обычный курс лечения АКТ. [16] Для некоторых других групп определенные АКТ избегаются из-за побочных эффектов партнерского препарата: сульфадоксин-пириметамин избегают в течение первых нескольких недель жизни, так как он мешает действию билирубина и может ухудшить неонатальную желтуху . [17] У ВИЧ-положительных людей комбинация триметоприма/сульфаметоксазола , антиретровирусных препаратов, содержащих зидовудин , и ASAQ связана с нейтропенией . Комбинация препарата для лечения ВИЧ эфавиренз и ASAQ связана с гепатотоксичностью. [18]
Артемизинины, как правило, хорошо переносятся в дозах, используемых для лечения малярии. [19] Побочные эффекты от препаратов класса артемизинина похожи на симптомы малярии: тошнота , рвота , потеря аппетита и головокружение . Также были отмечены легкие нарушения крови. Редким, но серьезным побочным эффектом является аллергическая реакция . [19] [20] Сообщалось об одном случае значительного воспаления печени в связи с длительным применением относительно высокой дозы артемизинина по неясной причине (у пациента не было малярии). [21] Препараты, используемые в комбинированной терапии, могут способствовать возникновению побочных эффектов у тех, кто проходит лечение. Побочные эффекты у пациентов с острой малярией P. falciparum , лечившихся производными артемизинина, как правило, выше. [22]
Необычным компонентом молекул артемизинина является эндопероксидное 1,2,4-триоксановое кольцо. Это главный противомалярийный центр молекулы. [23] Модификации в положении углерода 10 (C10) приводят к появлению множества производных, которые более мощны, чем исходное соединение. [24] Поскольку физические свойства самого артемизинина, такие как плохая биодоступность, ограничивают его эффективность, были разработаны полусинтетические производные артемизинина. Производные дигидроартемизинина производятся с 1976 года. Артесунат, артеэтер и артеметер были впервые синтезированы в 1986 году. Было получено много производных, из которых артелиновая кислота , артемотил , артемизон, SM735, SM905, SM933, SM934 и SM1044 являются одними из самых мощных соединений. [25] [26] Существуют также упрощенные аналоги, находящиеся на стадии доклинической разработки . [27] Было подготовлено более 120 других производных, но клинические испытания не были возможны из-за отсутствия финансовой поддержки. [23]
Артемизинин плохо растворяется в маслах и воде. Поэтому его обычно вводят через пищеварительный тракт, либо перорально, либо ректально. Однако артесунат можно вводить внутривенно и внутримышечно, а также перорально и ректально. [28] Синтетическое соединение с похожей триоксолановой структурой (кольцо, содержащее три атома кислорода) под названием RBx-11160 [29] показало многообещающие результаты в испытаниях in vitro . Испытания фазы II на пациентах с малярией оказались не такими успешными, как ожидалось, но производитель все равно решил начать испытания фазы III. [30]
По состоянию на 2018 год точный механизм действия артемизининов полностью не выяснен. [31] Сам артемизинин является пролекарством биологически активного дигидроартемизинина . Этот метаболит подвергается расщеплению своего эндопероксидного кольца внутри эритроцитов . Когда молекулы препарата вступают в контакт с гемом ( связанным с гемоглобином эритроцитов ), оксид железа (II) разрушает эндопероксидное кольцо. [32] Этот процесс производит свободные радикалы, которые, в свою очередь, повреждают восприимчивые белки, что приводит к гибели паразита. [33] [34] В 2016 году было показано, что артемизинин связывается с большим количеством мишеней, что позволяет предположить, что он действует беспорядочно. Однако эндопероксидная часть артемизинина менее чувствительна к свободному оксиду железа (II) и, следовательно, более активна на внутриэритроцитарных стадиях P. falciparum . [35] Напротив, клиническая практика показывает, что в отличие от других противомалярийных препаратов, артемизинин активен на всех стадиях жизненного цикла паразита. [36]
Клинические доказательства устойчивости к препарату артемизинин в Юго-Восточной Азии были впервые зарегистрированы в 2008 году [37] и впоследствии были подтверждены подробным исследованием из Западной Камбоджи . [38] [39] Устойчивость в соседнем Таиланде была зарегистрирована в 2012 году [40] , а в Северной Камбодже, Вьетнаме и Восточной Мьянме — в 2014 году. [41] [42] Возникающая устойчивость была зарегистрирована в Южном Лаосе , Центральной Мьянме и Северо-Восточной Камбодже в 2014 году. [41] [42] Ген паразита kelch на хромосоме 13, по-видимому, является надежным молекулярным маркером клинической устойчивости в Юго-Восточной Азии. [43]
В 2011 году ВОЗ заявила, что устойчивость к самому эффективному противомалярийному препарату, артемизинину, может подорвать национальные индийские программы по борьбе с малярией, которые достигли значительного прогресса за последнее десятилетие. ВОЗ выступает за рациональное использование противомалярийных препаратов и признает решающую роль работников здравоохранения в снижении заболеваемости малярией в регионе. [44]
Артемизинины можно использовать отдельно, но это приводит к высокому уровню возврата паразитов , и требуются другие препараты для очистки организма от всех паразитов и предотвращения рецидива. ВОЗ оказывает давление на производителей, чтобы они прекратили делать некомпаундированные препараты доступными для медицинского сообщества в целом, осознавая катастрофу, которая может возникнуть, если малярийный паразит разовьет устойчивость к артемизининам. [45]
Два основных механизма резистентности приводят к резистентности плазмодия к противомалярийным препаратам. Первый — это отток препарата от места его действия из-за мутаций в различных генах-транспортерах (например, pfcrt при резистентности к хлорохину ) или увеличенное число копий гена (например, число копий pfmdr1 при резистентности к мефлохину ). Второй — это изменение мишени паразита из-за мутаций в соответствующих генах (например, на уровне цитозоля, dhfr и dhps при резистентности к сульфадоксину - пириметамину или, на уровне митохондрий, цитохром b при резистентности к атовакуону ). Устойчивость P. falciparum к новым соединениям артемизинина включает новый механизм, соответствующий феномену покоя. [46]
С 2020 года [обновлять]будущие исследования устойчивости будут использовать трансгенных мышей для обнаружения соответствующих молекулярных маркеров . [47]
Биосинтез артемизинина, как полагают, включает мевалонатный путь (MVA) и циклизацию фарнезилдифосфата (FDP). Неясно, может ли не-мевалонатный путь также вносить вклад в 5-углеродные предшественники ( IPP или DMAPP ), как это происходит в других системах биосинтеза сесквитерпенов. Пути от артемизинового спирта до артемизинина остаются спорными, и они отличаются в основном тем, когда происходит стадия восстановления. Оба пути предполагают дигидроартемизиновую кислоту в качестве конечного предшественника артемизинина. Затем дигидроартемизиновая кислота подвергается фотоокислению с образованием гидропероксида дигидроартемизиновой кислоты. [48] Расширение кольца путем расщепления гидропероксида и второе гидропероксидирование, опосредованное кислородом, завершают биосинтез артемизинина. [49] [50]
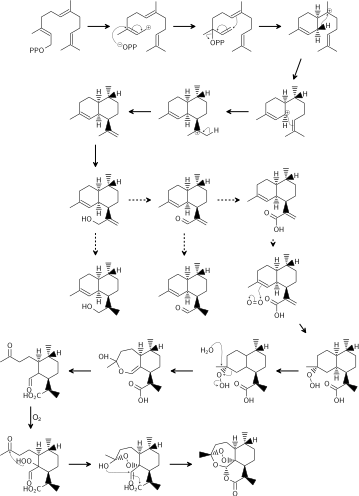
Полный синтез артемизинина был выполнен из доступных органических исходных материалов с использованием основных органических реагентов много раз. Первые два полных синтеза были стереоселективным синтезом Шмида и Хофхайнца в Hoffmann-La Roche в Базеле, начиная с (−)- изопулегола (13 шагов, ~5% общего выхода), и параллельным синтезом Чжоу и его коллег в Шанхайском институте органической химии из ( R )-(+)- цитронеллаля (20 шагов, ~0,3% общего выхода). [51] Ключевые шаги подхода Шмида–Хофхайнца включали начальное стереоселективное гидроборирование/окисление Орлоффа для установления «внекольцевого» метильного стереоцентра на боковой цепи пропена; два последовательных алкилирования с участием литиевого реагента, которые вводили все необходимые атомы углерода и которые были вместе высоко диастереоселективными; и дальнейшие шаги восстановления, окисления и десилилирования, выполняемые на этом монокарбоциклическом промежуточном соединении, включая конечную фотооксигенацию с использованием синглетного кислорода и реакцию ена , которая после кислотной обработки замыкает три оставшихся оксациклических кольца желаемого продукта, артемизинина, за один шаг. [51] [52] [53] (По сути, конечная операция окислительного замыкания кольца в этих синтезах завершает три замыкающих биосинтетических шага, показанных выше.)
Продолжается изучение широкого спектра дальнейших путей, с самых ранних дней и до сегодняшнего дня, включая пути полного синтеза из ( R )-(+)-пулегона, изоментена , [51] и даже 2-циклогексен-1-она , [54], а также пути, которые лучше описать как частичные или полусинтезы из более распространенного биосинтетического предшественника, артемизиновой кислоты — в последнем случае, включая некоторые очень короткие и очень высокопродуктивные примеры биомиметического синтеза (Рота и Эктона, и Хейнса и др., 3 этапа, выход 30%), которые снова характеризуются химией синглетного кислорода ена. [55] [51] [56] [57]
Партнерство по разработке полусинтетического артемизинина возглавлялось программой разработки лекарств PATH (через аффилированность с OneWorld Health) при финансировании со стороны Фонда Билла и Мелинды Гейтс . Проект начался в 2004 году, и первоначальными партнерами проекта были Калифорнийский университет в Беркли (который предоставил технологию, на которой был основан проект – процесс, в ходе которого генетически изменялись дрожжи для производства артемизиновой кислоты) [58] и Amyris (биотехнологическая фирма в Калифорнии, которая усовершенствовала процесс для обеспечения крупномасштабного производства и разработала масштабируемые процессы для передачи промышленному партнеру).
В 2006 году группа ученых из Калифорнийского университета в Беркли сообщила, что им удалось спроектировать дрожжи Saccharomyces cerevisiae для производства небольшого количества предшественника артемизиновой кислоты. Синтезированная артемизиновая кислота затем может быть транспортирована, очищена и химически преобразована в артемизинин, который, как они утверждают, будет стоить примерно 0,25 доллара США за дозу. В этом усилии синтетической биологии был использован модифицированный мевалонатный путь, а дрожжевые клетки были сконструированы для экспрессии фермента аморфадиенсинтазы и цитохрома P450 монооксигеназы (CYP71AV1), оба из Artemisia annua . Трехэтапное окисление аморфа-4,11-диена дает в результате артемизиновую кислоту. [59]
Метод UC Berkeley был расширен с использованием технологий из различных других организаций. Окончательная успешная технология основана на изобретениях, лицензированных UC Berkeley и Национальным исследовательским советом (NRC) Института биотехнологии растений Канады. [ необходима цитата ]
Коммерческое производство полусинтетического артемизинина в настоящее время ведется на площадке Sanofi в Гарессио, Италия. Этот второй источник артемизинина готов обеспечить более стабильный поток основных противомалярийных препаратов для тех, кто в них больше всего нуждается. [60] Цель производства установлена на уровне 35 тонн на 2013 год. Ожидается, что он увеличится до 50–60 тонн в год в 2014 году, что обеспечит примерно одну треть мировой годовой потребности в артемизинине. [ необходима цитата ]
В 2013 году Программа ВОЗ по предварительной квалификации лекарственных средств объявила о приемлемости полусинтетического артемизинина для использования в производстве активных фармацевтических ингредиентов, представленных в ВОЗ для предварительной квалификации или уже прошедших квалификацию ВОЗ. [61] Активный фармацевтический ингредиент (АФИ) компании Sanofi, произведенный из полусинтетического артемизинина (артезуната), также прошел предварительную квалификацию ВОЗ 8 мая 2013 года, что сделало его первым полусинтетическим производным артемизинина, прошедшим предварительную квалификацию. [ необходима цитата ]
В 2010 году группа ученых из Университета Вагенингена и Научно-исследовательского центра сообщила, что им удалось создать близкого родственника табака, Nicotiana benthamiana , который также может производить прекурсор — артемизиновую кислоту. [62]
Китай и Вьетнам поставляют 70%, а Восточная Африка — 20% растительного сырья. [63] Саженцы выращивают в питомниках, а затем пересаживают на поля. Им требуется около 8 месяцев, чтобы достичь полного размера. Растения собирают, листья сушат и отправляют на объекты, где артемизинин извлекают с помощью растворителя, как правило, гексана . Были предложены альтернативные методы экстракции. [64] Рыночная цена на артемизинин сильно колебалась: от 120 до 1200 долларов США за килограмм с 2005 по 2008 год. [65]
Китайская компания Artepharm создала комбинированный препарат артемизинина и пиперахина, продаваемый под названием Artequick. В дополнение к клиническим исследованиям, проведенным в Китае и Юго-Восточной Азии, Artequick использовался в крупномасштабных усилиях по искоренению малярии на Коморских островах . Эти усилия, проведенные в 2007, 2012 и 2013–2014 годах, привели к сокращению числа случаев малярии на Коморских островах на 95–97%. [66]
После переговоров с ВОЗ компании Novartis и Sanofi предоставляют препараты АКТ по себестоимости на некоммерческой основе; однако эти препараты по-прежнему дороже других средств лечения малярии. [67] Инъекции артезуната для лечения тяжелой формы малярии производятся на фармацевтическом заводе Guilin Pharmaceutical в Китае, где производство получило предварительную квалификацию ВОЗ. [68] Высокоурожайные сорта полыни производятся Центром новых сельскохозяйственных продуктов при Йоркском университете с использованием методов молекулярной селекции. [65]
Используя семена, предоставленные Action for Natural Medicine (ANAMED), Всемирный центр агролесоводства (ICRAF) разработал гибрид, названный A3, который может вырасти до высоты 3 метров и производить в 20 раз больше артемизинина, чем дикие сорта. На северо-западе Мозамбика ICRAF работает вместе с медицинской организацией Médecins Sans Frontières , ANAMED и Министерством сельского хозяйства и развития сельских районов, чтобы обучить фермеров выращиванию кустарника из черенков, а также сбору и сушке листьев для приготовления чая из полыни. Однако ВОЗ не рекомендует использовать растительные материалы A. annua , включая чай, для профилактики и лечения малярии. [69]
В 2013 году компания Sanofi объявила о запуске [60] производственного предприятия в Гарессио, Италия, для производства противоплазмодийного препарата в больших масштабах. Партнерство по созданию нового фармацевтического производственного процесса возглавлялось программой разработки лекарств PATH (через аффилированное лицо с OneWorld Health) при финансировании Фонда Билла и Мелинды Гейтс и основывалось на модифицированном биосинтетическом процессе артемизиновой кислоты, первоначально разработанном Джеем Кислингом в Калифорнийском университете в Беркли и оптимизированном компанией Amyris . За реакцией следует фотохимический процесс, создающий синглетный кислород для получения конечного продукта. Sanofi рассчитывает произвести 25 тонн артемизинина в 2013 году, увеличив производство до 55–60 тонн в 2014 году. Цена за килограмм составит 350–400 долларов США, что примерно соответствует цене за ботанический источник. [70] Несмотря на опасения, что этот эквивалентный источник приведет к краху компаний, которые производят это вещество традиционным способом путем извлечения биомассы A. annua , увеличение поставок этого препарата, вероятно, приведет к снижению цен и, следовательно, повышению доступности для лечения ACT. В 2014 году компания Sanofi объявила о выпуске первой партии полусинтетического артемизинина. 1,7 миллиона доз ASAQ компании Sanofi , комбинированной терапии на основе артемизинина с фиксированной дозой, будут отправлены в полдюжины африканских стран в течение следующих нескольких месяцев. [71]
Систематический обзор четырех исследований из Восточной Африки, проведенный в 2016 году, пришел к выводу, что субсидирование АКТ в частном розничном секторе в сочетании с обучением и маркетингом привело к повышению доступности АКТ в магазинах, увеличению использования АКТ для лихорадящих детей в возрасте до пяти лет и снижению использования старых, менее эффективных противомалярийных препаратов среди детей в возрасте до пяти лет. Базовые исследования не определяли, были ли у детей малярия, и не определяли, были ли преимущества для здоровья. [72]
После приема внутрь или инъекции артемизинин и его производные (артеэтер, артеметер и артесунат) быстро преобразуются в кровотоке в дигидроартемизинин (ДГК), который обладает в 5–10 раз большей противомалярийной активностью, чем артемизинин. [73] ДГК в конечном итоге преобразуется в печени в метаболиты, такие как дезоксиартемизинин, дезоксидигидроартемизинин и 9,10-дигидродезоксиартемизинин. Эти реакции катализируются ферментами CYP2A6 , CYP3A4 и CYP3A5 , которые относятся к группе цитохрома P450 , присутствующей в гладком эндоплазматическом ретикулуме . Эти метаболиты лишены противомалярийных свойств из-за потери эндопероксидной группы (дезоксиартемизинин, однако, обладает противовоспалительными и противоязвенными свойствами. [74] ) Все эти метаболиты подвергаются глюкуронированию , после чего выводятся с мочой или калом. За этот процесс отвечают глюкуронозилтрансферазы , в частности UGT1A9 и UGT2B7 . DHA также выводится с желчью в виде второстепенных глюкуронидов . Благодаря быстрому метаболизму артемизинин и его производные являются относительно безопасными препаратами с относительно высоким терапевтическим индексом . [6]
Артемизинин — это противомалярийный лактон, полученный из цинхао (青蒿, Artemisia annua или сладкая полынь). В 1596 году Ли Шичжэнь рекомендовал чай, приготовленный из цинхао, специально для лечения симптомов малярии в своем «Своде лекарственных веществ» . Название рода происходит от греческой богини Артемиды и, более конкретно, возможно, было названо в честь королевы Артемисии II из Карии , ботаника и медицинского исследователя в четвертом веке до нашей эры. [75]

Artemisia annua – распространенная трава , встречающаяся во многих частях мира. В 1967 году Народно-освободительная армия организовала программу исследований по скринингу растений в рамках секретной военной программы под кодовым названием « Проект 523 », чтобы найти адекватное лечение малярии; программа и ранние клинические работы были заказаны Мао Цзэдуном по просьбе лидеров Северного Вьетнама, чтобы оказать помощь их армии, охваченной малярией. [76] В ходе этого исследования в 1972 году Ту Юю обнаружила артемизинин в листьях Artemisia annua . [77]
Названный цинхаосу ( китайский :青蒿素; букв. «соединение зелено-голубой полыни»), [77] [78] он был одним из многих кандидатов, испытанных в качестве возможных методов лечения малярии китайскими учеными, из списка почти 2000 традиционных китайских лекарств . [79] Ту Юю также обнаружила, что процесс низкотемпературной экстракции может быть использован для выделения эффективного противомалярийного вещества из растения. Ту говорит, что на нее повлиял источник традиционной китайской травяной медицины «Справочник рецептов для экстренного лечения», написанный в 340 году н. э. Ге Хуном, в котором говорилось, что эту траву следует замачивать в холодной воде. [80] В этой книге содержалась полезная ссылка на траву: «Горсть цинхао, погруженная в два литра воды, отожмите сок и выпейте его весь».
Команда Ту впоследствии выделила экстракт . [77] Результаты были опубликованы в Chinese Medical Journal в 1979 году. [77] [81] [5] Извлеченное вещество, однажды подвергнутое очистке, оказалось полезной отправной точкой для получения очищенного артемизинина. [77] Обзор 2012 года сообщил, что терапии на основе артемизинина были наиболее эффективными препаратами для лечения малярии в то время; [82] также сообщалось, что он очищал организм пациентов от малярийных паразитов быстрее, чем другие препараты. В дополнение к артемизинину, Проект 523 разработал ряд продуктов, которые можно использовать в сочетании с артемизинином, включая люмефантрин , пиперахин и пиронаридин . [77]
В конце 1990-х годов компания Novartis подала новый китайский патент на комбинированное лечение с использованием артеметера/люмефантрина, предоставив ВОЗ первую комбинированную терапию на основе артемизинина (Коартем) по сниженным ценам. [83] В 2006 году, после того как артемизинин стал предпочтительным средством лечения малярии, ВОЗ призвала к немедленному отказу от монопрепаратов артемизинина в пользу комбинаций артемизинина с другим противомалярийным препаратом, чтобы снизить риск развития резистентности у паразитов. [84]
В 2011 году Ту Юю была награждена премией Lasker-Debakey Clinical Medical Research Award за ее роль в открытии и разработке артемизинина. [77] [85] 5 октября 2015 года ей была присуждена половина Нобелевской премии по физиологии и медицине 2015 года за открытие артемизинина, «препарата, который значительно снизил уровень смертности пациентов, страдающих малярией». [2] Другая половина премии была присуждена совместно Уильяму К. Кэмпбеллу и Сатоши Омуре за открытие авермектина , «производные которого радикально снизили заболеваемость речной слепотой и лимфатическим филяриатозом , а также продемонстрировали эффективность против растущего числа других паразитарных заболеваний». [2]
ВОЗ отмечает четыре дополнительных АКТ, которые находятся на стадии предварительных клинических испытаний или используются на региональном уровне, для которых нет доказательств, позволяющих рекомендовать их широкое применение: артесунат/пиронаридин , артеролан - пиперахин , основание артемизинина-пиперахина и артемизинин/нафтохин. [86]
В начале 1980-х годов в Китае при поиске новых антигельминтных средств от шистосомоза было сделано счастливое открытие : артемизинин эффективен против шистосом [87] [88] — человеческих кровяных сосальщиков , которые являются вторыми по распространенности паразитарными инфекциями после малярии. Артемизинин и его производные являются мощными антигельминтными средствами [89] . Позднее было обнаружено, что артемизинины обладают широким спектром действия против широкого спектра трематод , включая Schistosoma japonicum , S. mansoni , S. haematobium , Clonorchis sinensis , Fasciola hepatica и Opisthorchis viverrini [90] [91] .
Артемизинин и его производные находятся на стадии лабораторных исследований на предмет их потенциального противоракового действия. [1] [92] По состоянию на 2018 год были проведены только предварительные клинические исследования с использованием производных артемизинина при различных видах рака, без одобренных клинических применений. [93]
Производные артемизинина могут подавлять иммунные реакции, такие как воспаление. Одно производное, SM934, было одобрено в 2015 году Национальным управлением по контролю за лекарственными средствами Китая для клинического испытания в качестве препарата для лечения системной красной волчанки . [94]
Артемизинин может быть потенциально полезен для лечения симптомов синдрома поликистозных яичников (СПКЯ). [95]
{{cite journal}}: CS1 maint: DOI неактивен по состоянию на март 2024 г. ( ссылка )素:...5. 带有根本性质的物质 'вещество с фундаментальными свойствами'