Внеклеточные полимерные вещества ( ЭПС ) — это природные полимеры с высокой молекулярной массой , выделяемые микроорганизмами в окружающую среду. [1] ЭПС обеспечивают функциональную и структурную целостность биопленок и считаются основным компонентом, определяющим физико-химические свойства биопленки. [2] ЭПС в матрице биопленок обеспечивают композиционную поддержку и защиту микробных сообществ от суровых условий. [3] Компоненты ЭПС могут относиться к различным классам полисахаридов, липидов, нуклеиновых кислот, белков, липополисахаридов и минералов.
EPS в основном состоят из полисахаридов (экзополисахаридов) и белков , но включают и другие макромолекулы , такие как ДНК , липиды и гуминовые вещества. EPS являются строительным материалом бактериальных поселений и либо остаются прикрепленными к внешней поверхности клетки, либо секретируются в ее питательную среду . Эти соединения важны для формирования биопленки и прикрепления клеток к поверхностям. EPS составляют от 50% до 90% от общего органического вещества биопленки . [2] [4] [5]
Экзополисахариды (иногда также сокращенно EPS ; далее EPS-сахара ) являются сахарными частями EPS. Микроорганизмы синтезируют широкий спектр многофункциональных полисахаридов , включая внутриклеточные полисахариды, структурные полисахариды и внеклеточные полисахариды или экзополисахариды. [6] Экзополисахариды обычно состоят из моносахаридов и некоторых неуглеводных заместителей (таких как ацетат , пируват , сукцинат и фосфат ).
Экзополисахариды выделяются микроорганизмами, включая микроводоросли , в окружающую среду во время их роста или размножения. [7] Они могут быть либо слабо прикреплены к клеточной стенке , либо выделяться в окружающую среду. [8] [9] Многие микроводоросли, особенно различные красные водоросли и цианобактерии , являются производителями структурно разнообразных экзополисахаридов. Кроме того, экзополисахариды участвуют во взаимодействиях между клетками, адгезии и образовании биопленки . [10] [11]
Экзополисахариды широко используются в пищевой промышленности в качестве загустителей и желирующих добавок, которые улучшают качество и текстуру продуктов питания. [12] В настоящее время экзополисахаридам уделяется большое внимание из-за их антибактериальных , антиоксидантных и противораковых свойств, что приводит к разработке перспективных фармацевтических кандидатов. [13] [14] Поскольку экзополисахариды высвобождаются в культуральную среду, их можно легко извлечь и очистить. [15] Различные стратегии, используемые для экономичной экстракции и другой последующей обработки, обсуждались в главе указанной книги. [16]
Минералы, являющиеся результатом процессов биоминерализации , регулируемых окружающей средой или бактериями, также являются важными компонентами экзополисахаридов. Они обеспечивают структурную целостность матрицы биопленки и действуют как каркас для защиты бактериальных клеток от сдвигающих сил и антимикробных химикатов. [17] Было обнаружено, что минералы в EPS способствуют морфогенезу бактерий и структурной целостности матрицы. Например, в биопленках Bacillus subtilis , Mycobacterium smegmatis и Pseudomonas aeruginosa кальцит ( CaCO3 ) способствует целостности матрицы. Минералы также связаны с медицинскими состояниями. В биопленках Proteus mirabilis , Proteus vulgaris и Providencia rettgeri минералы кальций и магний вызывают инкрустацию катетера. [18]
Обзор 2013 года описывает сульфатированные полисахариды, синтезируемые 120 морскими микроводорослями, большинство из которых являются EPS. Эти гетерополимеры в основном состоят из галактозы , глюкозы и ксилозы в разных пропорциях, за исключением тех, что у Gyrodinium impudicum , которые являются гомополимерами. [19] Большинство EPS из цианобактерий также являются сложными анионными гетерополимерами, содержащими от шести до десяти различных моносахаридов, одну или несколько уроновых кислот и различные функциональные заместители, такие как метил, ацетат, пируват, сульфатные группы и белки. [20] Например, EPS из Arthrospira platensis являются гетерополимерами с белковыми (55%) фрагментами и сложным полисахаридным составом, содержащим семь нейтральных сахаров: глюкозу, рамнозу, фруктозу, галактозу, ксилозу, арабинозу и маннозу, а также две уроновые кислоты, галактуроновую кислоту и глюкуроновую кислоту. [21]
Dunaliella salina — одноклеточная зеленая водоросль с выдающейся галотолерантностью . [22] Солевой стресс вызывает секрецию внеклеточных полимерных веществ у D. salina . Предполагается, что высвобождение сложных смесей макромолекулярных полиэлектролитов с высоким содержанием полисахаридов способствует стратегии выживания D. salina при различных концентрациях соли. Четыре моносахарида (галактоза, глюкоза, ксилоза и фруктоза) были обнаружены в гидролизате EPS из D. salina при солевом стрессе. [23] [24] Напротив, водорастворимые полисахариды, выделяемые Chlorella pyrenoidosa, содержат галактозу, арабинозу , маннозу , рибозу , ксилозу, фукозу и рамнозу ; их высвобождение зависит от фотосинтетической активности клетки и репродуктивного состояния. [25]
Хотя EPS из микроводорослей имеют множество потенциальных применений, их низкий выход является одним из основных ограничений для масштабирования в промышленности. Тип и количество EPS, получаемых из определенной культуры микроводорослей, зависят от нескольких факторов, таких как конструкция системы культивирования, условия питания и культивирования, а также процесс восстановления и очистки. Поэтому конфигурация и оптимизация производственных систем имеют решающее значение для дальнейшего развития приложений.
Примеры успешного увеличения доходности EPS включают:
Было высказано предположение, что совместное культивирование микроводорослей и других микроорганизмов может быть более универсально использовано в качестве технологии для увеличения производства EPS, поскольку микроорганизмы могут реагировать на партнеров по взаимодействию, секретируя EPS в качестве стратегии при неблагоприятных условиях. [29] [30]

Экзоферменты — это ферменты, выделяемые микроорганизмами, такими как бактерии и грибы , для функционирования вне их клеток. Эти ферменты имеют решающее значение для расщепления крупных молекул в окружающей среде на более мелкие, которые микроорганизмы могут поглощать (транспортировать в свои клетки) и использовать для роста и получения энергии.
Несколько исследований продемонстрировали, что активность внеклеточных ферментов в экологии водных микроорганизмов имеет водорослевое происхождение. [31] [32] Эти экзоферменты, высвобождаемые из микроводорослей, включают щелочные фосфатазы , хитиназы , β-d-глюкозидазы , протеазы и т. д. и могут влиять на рост микроорганизмов, химическую сигнализацию и биогеохимический цикл в экосистемах. [33] Изучение этих экзоферментов может помочь оптимизировать стратегию добавления питательных веществ в аквакультуру. Тем не менее, только несколько ферментов были выделены и очищены. Отдельные известные классы ферментов выделены в цитируемой литературе. [34]
Было обнаружено, что зеленые микроводоросли Chlamydomonas coccoides и Dunaliella sp. [35] и chlorella sphaerkii (одноклеточный морской хлорофит) продуцируют внеклеточные протеазы. [35] Диатомовая водоросль Chaetoceros didymus выделяет в среду значительное количество протеаз, это производство вызвано присутствием литической бактерии Kordia algicida и связано с устойчивостью этой водоросли к воздействию этой бактерии. [36] Некоторые протеазы имеют функциональное значение в жизненных циклах вирусов, поэтому являются привлекательными целями для разработки лекарственных препаратов . [37]
Фикобилипротеины — это водорастворимые белки, улавливающие свет, вырабатываемые цианобактериями и несколькими водорослями. Эти пигменты были исследованы в качестве флуоресцентных меток, пищевых красителей, косметики и иммунологических диагностических агентов. Большинство этих пигментов синтезируются и накапливаются внутриклеточно. В качестве исключения цианобактерии Oscillatoria и Scytonema sp. выделяют внеклеточный фикоэритрин-подобный белок 250 кДа. Этот пигмент подавляет рост зеленых водорослей Chlorella fusca и Chlamydomonas и может потенциально использоваться в качестве альгицида. [38]
Фенолы являются важной группой экотоксинов из-за их токсичности и стойкости. [39] Многие микроорганизмы могут разлагать ароматические загрязнители и использовать их в качестве источника энергии, [40] и способность микроводорослей разлагать множество ароматических соединений, включая фенольные соединения, все больше признается. Некоторые микроводоросли, включая Chlamydomonas sp., Chlorella sp., Scenedesmus sp. и Anabaena sp. способны разлагать различные фенолы, такие как пентахлорфенол, п -нитрофенол и нафталинсульфоновые кислоты. [41] [42] Хотя пути метаболической деградации не полностью изучены, ферменты, включая фенолоксидазу лакказу (EC 1.10.3.2) и лакказоподобные ферменты, участвуют в окислении ароматических субстратов. [40] [43] [44] Эти экзоферменты потенциально могут применяться в экологической деградации фенольных загрязнителей.
Ингибиторы протеазы — это класс соединений, которые подавляют активность протеаз (ферментов, ответственных за расщепление пептидных связей в белках ). Эти ингибиторы играют решающую роль в различных биологических процессах и терапевтических применениях, поскольку протеазы играют ключевую роль во многих физиологических функциях, включая пищеварение, иммунный ответ, свертывание крови и клеточную сигнализацию.
Ингибитор внеклеточной цистеиновой протеазы, ECPI-2, был очищен из культуральной среды Chlorella sp. Ингибитор оказывал ингибирующее действие на протеолитическую активность папаина , фицина и химопапаина . ECPI-2 содержит 33,6% углеводных остатков, которые могут отвечать за стабильность фермента в нейтральных или кислых условиях. Эти ингибиторные белки из Chlorella могут быть синтезированы для защиты клеток от атак, например, вирусов или травоядных животных. [45] По сравнению с органическими соединениями, пептидные препараты имеют относительно низкую токсичность для человеческого организма. Таким образом, разработка пептидных ингибиторов в качестве лекарств является привлекательной темой для исследований в современной медицинской химии. [46] Ингибиторы протеазы являются привлекательными агентами при лечении определенных заболеваний; например, эластаза имеет решающее значение при таких заболеваниях, как эмфизема легких , что мотивирует дальнейшее исследование ингибиторов протеазы микроводорослей как ценных ведущих структур в фармацевтической разработке. [47]
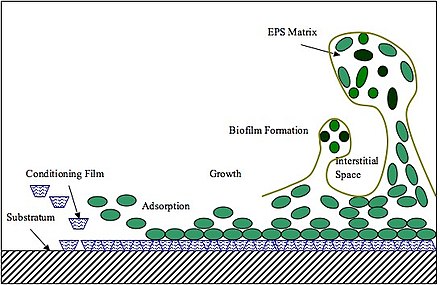
Первым шагом в формировании биопленок является адгезия. Первоначальная бактериальная адгезия к поверхностям включает взаимодействия адгезин-рецептор. Определенные полисахариды, липиды и белки в матрице функционируют как адгезивные агенты. EPS также способствует межклеточной когезии (включая межвидовое распознавание), способствуя микробной агрегации и образованию биопленки. [48] В целом, матрица на основе EPS опосредует сборку биопленки следующим образом. Во-первых, формирование EPS происходит в месте адгезии, он будет либо вырабатываться на бактериальных поверхностях, либо секретироваться на поверхности прикрепления и образовывать начальную полимерную матрицу, способствующую микробной колонизации и кластеризации клеток. Затем непрерывное производство EPS дополнительно расширяет матрицу в трех измерениях, одновременно формируя ядро бактериальных клеток. Бактериальное ядро обеспечивает поддерживающий каркас и облегчает развитие трехмерных кластеров и агрегацию микроколоний. [49] Исследования P. aeruginosa , B. subtilis , V. cholerae и S. mutans показали, что переход от первоначального скопления клеток к микроколонии, по-видимому, сохраняется среди различных модельных организмов, образующих биопленку. [49] Например, S. mutans вырабатывает экзоферменты, называемые глюкозилтрансферазами (Gtfs), которые синтезируют глюканы in situ , используя сахара рациона хозяина в качестве субстратов. Gtfs даже связываются с бактериями, которые не синтезируют Gtfs, и, следовательно, способствуют межвидовой и межцарственной коадгезии. [50]
Впоследствии, по мере того, как биопленка закрепляется, EPS обеспечивает физическую стабильность и устойчивость к механическому удалению, противомикробным препаратам и иммунитету хозяина. Экзополисахариды и ДНК окружающей среды (eDNA) способствуют вязкоупругости зрелых биопленок, так что отсоединение биопленки от субстрата будет сложным даже при постоянном напряжении сдвига жидкости или высоком механическом давлении. [51] В дополнение к механической устойчивости EPS также способствует защите от противомикробных препаратов и повышению переносимости лекарств. [52] Антимикробные препараты не могут диффундировать через барьер EPS, что приводит к ограничению доступа лекарств в более глубокие слои биопленки. [53] Более того, положительно заряженные агенты будут связываться с отрицательно заряженными EPS, способствуя противомикробной переносимости биопленок и обеспечивая инактивацию или деградацию противомикробных препаратов ферментами, присутствующими в матрице биопленки. EPS также функционирует как локальный резервуар питательных веществ различных биомолекул, таких как ферментируемые полисахариды. [54] Исследование V. cholerae , проведенное в 2017 году, показало, что из-за разницы осмотического давления в биопленках V. cholerae микробные колонии физически разбухают, тем самым увеличивая свой контакт с питательными поверхностями и, следовательно, поглощение питательных веществ. [55]
EPS обнаружен в матрице других микробных биопленок, таких как биопленки микроводорослей . Формирование биопленки и структура EPS имеют много общего с бактериальными. Формирование биопленки начинается с обратимой абсорбции плавающих клеток на поверхности. После образования EPS адсорбция станет необратимой. EPS будет колонизировать клетки на поверхности с помощью водородных связей. Репликация ранних колонизаторов будет облегчаться наличием органических молекул в матрице, которые будут обеспечивать питательные вещества для клеток водорослей. По мере размножения колонизаторов биопленка растет и становится трехмерной структурой. [56] Биопленки микроводорослей состоят на 90% из EPS и на 10% из клеток водорослей. EPS водорослей имеет схожие компоненты с бактериальными; он состоит из белков, фосфолипидов, полисахаридов, нуклеиновых кислот, гуминовых веществ, уроновых кислот и некоторых функциональных групп, таких как фосфорные, карбоксильные, гидроксильные и аминогруппы. Клетки водорослей потребляют EPS в качестве источника энергии и углерода. [57] Кроме того, EPS защищает их от обезвоживания и усиливает адгезию клеток к поверхности. В биопленках водорослей EPS имеет две подкатегории: растворимый EPS (sEPS) и связанный EPS (bEPS), причем первый распределен в среде, а второй прикреплен к клеткам водорослей. [58] Связанный EPS можно далее подразделить на прочно связанный EPS (TB-EPS) и слабо связанный EPS (LB-EPS). На состав EPS влияют несколько факторов, включая вид, тип субстрата, доступность питательных веществ, температуру, pH и интенсивность света. [59]
Экзополисахариды могут способствовать прикреплению азотфиксирующих бактерий к корням растений и частицам почвы, что опосредует симбиотические отношения. [60] Это важно для колонизации корней и ризосферы , которая является ключевым компонентом пищевых сетей почвы и круговорота питательных веществ в экосистемах . Это также позволяет успешно проникать в растение-хозяина и заражать его . [60] Бактериальные внеклеточные полимерные вещества могут помочь в биоремедиации тяжелых металлов , поскольку они обладают способностью адсорбировать катионы металлов, среди других растворенных веществ. [61] Это может быть полезно при очистке сточных вод , поскольку биопленки способны связывать и удалять такие металлы, как медь , свинец , никель и кадмий . [61] Сродство связывания и специфичность к металлу EPS варьируются в зависимости от состава полимера, а также таких факторов, как концентрация и pH . [61] В геомикробиологическом контексте было замечено, что EPS влияют на осаждение минералов, особенно карбонатов . [62] EPS также может связываться с частицами в суспензиях биопленки и захватывать их, что может ограничивать дисперсию и круговорот элементов. [62] Устойчивость осадка может быть повышена EPS, поскольку он влияет на сцепление , проницаемость и эрозию осадка. [62 ] Имеются данные о том, что адгезия и способность EPS связывать металлы влияют на скорость выщелачивания минералов как в экологическом, так и в промышленном контексте. [62] Эти взаимодействия между EPS и абиотической средой позволяют EPS оказывать большое влияние на биогеохимический круговорот . Взаимодействия хищник-жертва между биопленками и бактериофагами , такими как почвенная нематода Caenorhabditis elegans , были тщательно изучены. Благодаря образованию липкой матрицы и образованию агрегатов биопленки Yersinia pestis могут препятствовать питанию, закупоривая рот C. elegans . [63] Более того, биопленки Pseudomonas aeruginosa могут препятствовать скользящей подвижности C. elegans , что называется « фенотипом болота », что приводит к застреванию C. elegans в биопленках и препятствует исследованию нематодами восприимчивых биопленок с целью их питания. [64] Это значительно снижает способность хищников питаться и размножаться, тем самым способствуя выживанию биопленок.
Капсульные экзополисахариды могут защищать патогенные бактерии от высыхания и хищничества , а также способствовать их патогенности . [60] Сидячие бактерии, фиксированные и агрегированные в биопленках , менее уязвимы по сравнению с дрейфующими планктонными бактериями, поскольку матрица EPS способна действовать как защитный диффузионный барьер. [65] Физические и химические характеристики бактериальных клеток могут зависеть от состава EPS, влияющего на такие факторы, как клеточное распознавание, агрегация и адгезия в их естественной среде. [65]
До сих пор производство промышленных микроводорослей на основе биомассы широко применялось в различных областях: от производства продуктов питания и кормов до производства ценных химикатов для фармацевтических и экологических целей. [66] [67] [68]
Хотя коммерческое выращивание микроводорослей становится все более популярным, только биомасса водорослей перерабатывается в текущие продукты, в то время как огромные объемы среды, свободной от водорослей, остаются неиспользованными в проточных культурах и после сбора биомассы из партий культур. Переработка среды для экономии затрат на культивирование сопряжена с большим риском ингибирования роста. Большие объемы отработанной среды приводят к загрязнению окружающей среды и расходам на воду и питание при выращивании, когда среда выбрасывается непосредственно в окружающую среду. Поэтому применение методов переработки, мотивированных одновременным получением высокоценных продуктов из отработанной среды, несет потенциал в коммерческих и экологических перспективах. [29]
В нутрицевтической промышленности Arthrospira ( Spirulina ) и Chlorella являются наиболее важными видами в коммерциализации в качестве здоровой пищи и пищевых добавок с различными преимуществами для здоровья, включая повышение активности иммунной системы, противоопухолевые эффекты и стимуляцию роста животных, благодаря их обильным белкам, витаминам, активным полисахаридам и другим важным соединениям. [69] Каротиноиды микроводорослей с β-каротином из Dunaliella и астаксантином из Haematococcus производятся в коммерческих целях в крупномасштабных процессах. Продукты, полученные из микроводорослей, в настоящее время успешно разрабатываются для использования в косметике и фармацевтических продуктах. [70] [71] Примерами являются полисахариды из цианобактерий, используемые в средствах личной гигиены, и экстракты Chlorella sp., которые содержат олигопептиды, которые могут способствовать упругости кожи. [72] В фармацевтической промышленности были выявлены кандидаты на лекарственные препараты с противовоспалительной, противораковой и противоинфекционной активностью. [73] Например, аденозин из Phaeodactylum tricornutum может действовать как антиаритмическое средство для лечения тахикардии, а метаболит зеленых водорослей каулерпин фигурирует в исследованиях его противотуберкулезной активности. [74] [75]
Более того, некоторые внеклеточные полисахариды из микроводорослей обладают различной биологической активностью, включая противоопухолевую, противовоспалительную и противовирусную активность, что открывает многообещающие перспективы для фармацевтического применения. [76]
Микроводоросли, такие как Isochrysis galbana, Nannochlor opsisoculata , Chaetoceros muelleri , Chaetoceros gracilis и P. tricornutum, давно используются в аквакультуре в качестве прямых или косвенных источников корма в инкубаторах для обеспечения отличных условий питания для ранней молоди выращиваемых рыб, моллюсков и креветок. [77] [78]
Кроме того, слой EPS действует как ловушка для питательных веществ, способствуя росту бактерий . [65] Экзополисахариды некоторых штаммов молочнокислых бактерий , например, Lactococcus lactis subsp. cremoris , придают студенистую текстуру ферментированным молочным продуктам (например, Viili ), и эти полисахариды также легко усваиваются. [79] [80] Примером промышленного использования экзополисахаридов является применение декстрана в панеттоне и других видах хлеба в хлебопекарной промышленности. [81]
B. subtilis привлекла внимание своими пробиотическими свойствами благодаря своей биопленке, которая позволяет ей эффективно поддерживать благоприятную микросреду в желудочно-кишечном тракте. Чтобы выжить при прохождении через верхний отдел желудочно-кишечного тракта, B. subtilis вырабатывает внеклеточный матрикс, который защищает ее от стрессовых сред, таких как сильнокислая среда в желудке. [82]
Производство маслянистых микроводорослей становится привлекательным в качестве альтернативных источников биотоплива с потенциалом удовлетворения мирового спроса на возобновляемую биоэнергию. [83] Повышение нефтеотдачи (EOR) с использованием внеклеточных биополимеров из микроводорослей может стать будущей областью применения. [84]
В последние годы было обнаружено, что EPS-сахара из морских бактерий ускоряет очистку нефтяных разливов. [85] Во время разлива нефти Deepwater Horizon в 2010 году эти EPS-продуцирующие бактерии смогли быстро расти и размножаться. [85] Позже было обнаружено, что их EPS-сахара растворяли нефть и образовывали нефтяные агрегаты на поверхности океана, что ускоряло процесс очистки. [85] Эти нефтяные агрегаты также являлись ценным источником питательных веществ для других морских микробных сообществ. Это позволило ученым модифицировать и оптимизировать использование EPS-сахаров для очистки нефтяных разливов . [85]
В процессе роста микроводоросли производят и выделяют в среду метаболиты, такие как ацетат или глицерин. [86] Внеклеточные метаболиты (ЭМ) микроводорослей имеют важное экологическое значение. Например, морские микроводоросли выделяют большое количество растворенных органических веществ (РОВ), которые служат источниками энергии для гетеротрофов в симбиотических взаимодействиях водорослей и бактерий. [87] Выделения в околоклеточное пространство в значительной степени определяют ход аллелопатических взаимодействий между микроводорослями и другими микроорганизмами. [88] Некоторые аллелопатические соединения микроводорослей реализуются как экологически чистые гербициды или агенты биологического контроля с прямыми перспективами их биотехнологического использования. [89]
В B. subtilis было показано, что компонент белковой матрицы, TasA, и экзополисахарид необходимы для эффективной колонизации корней растений Arabidopsis и томатов. [52] Также было высказано предположение, что TasA играет важную роль в посредничестве в межвидовой агрегации со стрептококками. [90]
В связи с растущей потребностью в поиске более эффективной и экологически чистой альтернативы традиционным методам удаления отходов, промышленные предприятия уделяют все больше внимания функции бактерий и их EPS-сахаров в биоремедиации . [91]
Исследователи обнаружили, что добавление EPS-сахаров из цианобактерий в сточные воды удаляет тяжелые металлы, такие как медь , кадмий и свинец . [91] EPS-сахара сами по себе могут физически взаимодействовать с этими тяжелыми металлами и поглощать их посредством биосорбции . [ 91] Эффективность удаления можно оптимизировать, обрабатывая EPS-сахара различными кислотами или основаниями перед добавлением их в сточные воды. [91] Некоторые загрязненные почвы содержат высокие уровни полициклических ароматических углеводородов (ПАУ); EPS из бактерии Zoogloea sp . и грибка Aspergillus niger эффективны в удалении этих токсичных соединений. [92] EPS содержат ферменты , такие как оксидоредуктаза и гидролаза , которые способны разлагать ПАУ. [92] Степень разложения ПАУ зависит от концентрации EPS, добавленных в почву. Этот метод оказывается недорогим и высокоэффективным. [92]
Применение наночастиц (NP) является одним из новых многообещающих методов воздействия на биопленки из-за их высокого отношения площади поверхности к объему, их способности проникать в более глубокие слои биопленок и способности высвобождать антимикробные агенты контролируемым образом. Изучение взаимодействий NP-EPS может обеспечить более глубокое понимание того, как разрабатывать более эффективные наночастицы. [3] Наноносители «умного высвобождения», которые могут проникать в биопленки и активироваться патогенной микросредой для доставки лекарств или многофункциональных соединений, таких как каталитические наночастицы к аптамерам, дендримерам и биоактивным пептидам), были разработаны для нарушения EPS и жизнеспособности или метаболической активности внедренных бактерий. Некоторые факторы, которые могли бы изменить потенциал NP для транспортировки антимикробных агентов в биопленку, включают физико-химические взаимодействия NP с компонентами EPS, характеристики водных пространств (пор) внутри матрицы EPS и вязкость матрицы EPS. [93] Размер и поверхностные свойства (заряд и функциональные группы) NP являются основными детерминантами проникновения и взаимодействия с EPS. [3] Другая потенциальная стратегия борьбы с биопленкой — фаговая терапия. Бактериофаги, вирусы, которые проникают в определенные бактериальные клетки-хозяева, были предложены в качестве эффективных агентов для проникновения в биопленки. [18] Для того чтобы достичь максимальной эффективности в уничтожении биопленок, терапевтические стратегии должны быть нацелены как на компоненты матрицы биопленки, так и на внедренные микроорганизмы, чтобы нацеливаться на сложную микросреду биопленки. [18]
В данной статье использован текст Лу Лю, Георга Понерта и Дун Вэя, доступный по лицензии CC BY 4.0.